β-catenin、GS及GPC3在肝细胞癌组织的表达及意义
2018-06-25王淑妍张士岭王素英张慧芝黄春鑫
王淑妍 张士岭 李 璐 王素英 张慧芝 黄春鑫
肝细胞癌(hepatocellular carcinoma,HCC,以下简称肝癌),在我国的发病率为25.7/10万,居全球之首,5年以上生存率仅为10%左右[1]。准确诊断HCC是临床制定治疗方案的前提,但在实际病理工作中却面临许多困难,早期HCC肿瘤异型性小,结构异常也不明显,容易与肝硬化及腺瘤等良性疾病混淆;分化较差时,又与胆管细胞癌形态有很大重叠,仅凭形态准确区分两者有时十分困难。因此,寻找特异性强的手段准确识别HCC是十分必要的。Wnt/β-连环蛋白(β-catenin)途径作为一条控制胚胎发育且参与多种人类肿瘤发生的重要信号途径,其异常激活与肝癌关系密切,β-catenin是该信号传导途径中的关键调控因子,在细胞增殖及分化上起重要作用,磷脂酰肌醇蛋白聚糖 3(glypican-3,GPC3)参与 Wnt通路的信号转导,且与肝癌的发生、发展密切相关[2]。本研究利用免疫组化方法对β-catenin、谷氨酰胺合成酶(glutamine synthetase,GS)及GPC3在 HCC组织的表达进行观察与分析,探讨这三项指标在HCC的诊断、鉴别诊断价值及在HCC发生、发展中的作用价值。
1 材料与方法
1.1 临床资料 收集浙江省宁波市临床病理诊断中心组织病理科2016年1月—2017年8月行手术治疗的HCC组织标本87例,病理诊断标准依据WHO(2010)消化系统肿瘤分类和原发性肝癌规范化病理诊断指南(2015)[3],均为原发性肝癌患者。其中男68例,女 19例,男:女为 3.58:1,年龄 31~78岁,中位年龄60岁,平均年龄58.63岁。87例肝细胞肝癌中肿块大小<3.0cm者28例,肿块≥3.0且≤5.0cm者29例,>5.0cm者30例;高分化15例,中分化53例,低分化 19例;肝癌(tumor node metastasis,TNM)分期[3]Ⅰ期59例,Ⅱ期23例,Ⅲ期4例,Ⅳ期1例。取癌旁1cm及1cm以外肝组织,行微血管侵犯(microvascular invasion,MVI)风险分级[3],其中 M0:63 例,M1:16例,M2:8例。取相应的癌旁组织70例及肝内胆管细胞癌 (intrahepatic cholangiocarcinoma,ICC)40 例作为对照。癌旁组织组70例中男53例,女17例,男:女为3.12:1,年龄35~78岁,中位年龄61岁,平均年龄56.50岁;ICC组40例中男31例,女9例,男:女为3.44:1,年龄33~72岁,中位年龄58岁,平均年龄52.50岁。各组间性别、年龄差异无统计学意义(P>0.05)。
1.2 方 法 所有标本均经10%中性福尔马林液固定,常规脱水,石蜡包埋,连续切片厚3~5μm,常规HE染色及免疫组化染色。免疫组化采用EnVision二步法,用Ventana Benchmark XT全自动免疫组化仪(Roche Ventana公司)染色,操作按说明书进行。一抗 β-catenin(DAK-calret)、GPC3(IG12)及 GS(GS-6)均购自罗氏诊断产品(上海)有限公司。以TBS替代一抗作阴性对照。
1.3 结果判定 由两位病理医师采用双盲法对免疫组化结果进行半定量评估。β-catenin主要表达于细胞膜,染色结果判读标准[4]:正常表达为细胞膜阳性表达>70%;表达缺失为细胞膜阳性表达<70%;异位表达为胞质或胞核阳性表达,即细胞质或细胞核阳性表达>10%。胞膜表达缺失、异位表达统称为异常表达。GS在正常肝组织内及癌旁表达于终末肝静脉周围的肝细胞,异常表达判断标准为:GS主要定位于细胞浆,在肿瘤细胞中呈弥漫性表达,且>10%的肿瘤细胞呈阳性,至少为中度染色;GPC3主要定位于细胞浆及细胞膜,其阳性判断标准:至少5% 的细胞呈阳性,不论染色程度;GPC3阴性:低于5%的细胞呈阳性,不论染色程度。
1.4 统计学方法 使用SPSS22.0软件进行统计分析,三种抗体在不同实验组中的阳性率比较采用χ2检验,并采用Spearman相关性检验在HCC组织表达的相关性,以P<0.05为差异有统计学意义。
2 结果
2.1 各组β-catenin、GS及GPC3表达量比较 βcatenin蛋白正常弱表达于癌旁肝细胞的细胞膜,在原发性肝癌中呈不同程度的异位表达(封三图1),主要为胞浆异位表达且染色强度中度及以上。βcatenin在HCC、ICC及癌旁组织的异常表达率分别为72.41%、70.0%及15.71%,肝癌组织中的异常表达率显著高于癌旁组织(P<0.05);HCC与ICC之间差异无统计学意义(χ2=0.079,P>0.05);HCC、ICC 与癌旁组织之间差异均有统计学意义(χ2=50.046,χ2=27.513,P均<0.05)。由于GS在正常肝组织内及癌旁表达于终末肝静脉周围的肝细胞(封三图2),在癌组织中GS阳性率及阳性范围明显增强(封三图3)。因此,对GS免疫组化结果的判读既要观察染色面积,也要兼顾染色强度,同时还要排除组织中血管因素的影响。GS在HCC、ICC及癌旁组织的异常表达率分别为87.36%、40.0%及5.71%,在HCC与ICC表达率差异有统计学意义(χ2=30.781,P<0.05),HCC、ICC与癌旁组织之间差异均有统计学意义(χ2=103.458,χ2=20.114,P<0.05)。GPC3(封三图 4)在 HCC、ICC 及癌旁组织的异常表达率分别为73.56%、2.50%及2.86%,GPC3在HCC与ICC表达率差异有统计学意义(χ2=55.382,P<0.05),HCC 与癌旁组织表达率差异有统计学意义(χ2=79.588,P<0.05),ICC 与癌旁组织之间表达差异无统计学意义(χ2=0.012,P>0.05),见表1。
2.2 β-catenin、GS及GPC3表达和HCC临床病理特征的关系 HCC组织β-catenin及GS异常率在不同年龄、肿瘤直径、分化程度、临床分期(TNM)及MVI风险分级差异均无统计学意义(P>0.05);GPC3阳性率在不同性别、年龄、肿瘤直径、临床分期(TNM)及MVI风险分级差异均无统计学意义(P>0.05),而在不同病理分化程度有统计学意义(P<0.01),见表2。

表1 各组β-catenin、GS及GPC3表达情况(例)

表2 β-catenin、GS及GPC3表达和HCC临床病理特征的关系(例)
2.3 β-catenin、GS及GPC3在HCC组织表达的相关性 经Spearman相关性检验表明,HCC组织βcatenin及GPC3蛋白表达呈正相关(rs=0.229,P<0.05)。β-catenin与 GS蛋白表达无相关性(rs=0.164,P=0.129),GS与GPC3蛋白表达无相关性(rs=0.153,P=0.160)。
3 讨论
β-catenin是1980年由德国科学家首先发现的一个定位于胞质的可溶性蛋白,人类β-catenin又叫CTNNB1基因,是果蝇Armadillo基因产物在哺乳类动物的同源类似物[5]。CTNNB1基因编码的β-catenin蛋白是一种多功能蛋白,一方面参与细胞间的黏附,另一方面是经典Wnt信号通路中重要的转录激活因子,是Wnt/β-catenin蛋白通路的决定性组成部分[6]。
正常的肝组织β-catenin表达于细胞膜,在细胞质内弱表达,核内无表达,而HCC组织存在多种机制导致β-catenin核内的异常积聚,造成β-catenin在胞质积聚和/或核转位[7-9]。Zulehner等[10]研究了133例HCC患者,发现58.6%具有β-catenin在细胞质和核内积聚现象,而且这些患者的肿瘤中有血管侵袭与转移,生存时间明显缩短,表明β-catenin的核内聚集与与肝细胞的去分化及增加恶性程度密切相关。本实验发现,β-catenin在主要在胞质的异常积聚,但未发现在核上表达及细胞膜失表达,推测可能与实验室抗体差异有关;β-catenin在HCC、ICC及癌旁组织的异常表达率分别为72.41%、70.0%及15.71%,且与年龄、肿瘤直径、分化程度、临床分期(TNM)及 MVI风险分级差异等均无关(P>0.05),但在癌组织与癌旁正常组织表达差异有统计学意义(P<0.05),这表明β-catenin蛋白异常表达可能在原发性肝癌的发生中发挥重要作用,对于HCC的诊断具有一定意义,但在HCC、ICC组织二者无明显差异(P>0.05),因此不能对鉴别提供帮助。
GS是催化谷氨酸与氨合成谷氨酰胺的酶家族成员之一,在肝脏氨解毒、氮平衡及pH值调节功能中起重要作用。但已有研究[11]表明:人肝癌组织中的GSmRNA、GS蛋白活性较非肝癌组织显著升高,HCC癌组织中GS的过表达可成为HCC早期诊断与预后判断的生物标记。Chayanupatkul等[12]研究认为,HCC患者的血清GS分泌水平及肝组织GS蛋白表达水平均较非肝癌患者明显升高,与甲胎蛋白(AFP)水平呈正相关,认为其可能成为HCC诊断的新标记物。GS正常表达于癌旁及正常肝组织终末肝静脉周围的肝细胞,本实验中GS在HCC中弥漫/片状阳性表达,与癌旁正常组织表达模式具有显著不同,在HCC、ICC及癌旁组织的异常表达率分别为87.36%、40.0%及5.71%,各组间差异有统计学意义(P<0.05),对于HCC诊断以及HCC与ICC鉴别诊断有重要价值。
磷脂酰肌醇蛋白聚糖 3(Glypican3,GPC-3)属于glypican家族,其基因定位于人染色体Xq261,是一种对分子量为66Kda的分泌性细胞外糖蛋白,可以依靠磷脂酰肌醇锚定在细胞膜上[13];通过结合细胞外基质、GF和蛋白酶等影响信号传递,在调控细胞生长和分化方面起重要作用。GPC-3的基因在胎儿高表达,而成人肝脏中表达关闭,因而在成人正常组织不表达或低水平表达。最近研究发现,GPC-3在肝细胞肝癌中异常表达,与原发性肝癌的发生、发展密切相关,在肿瘤细胞增殖、分化、黏附和转移过程中发挥着重要的调节作用[14],可作为诊断HCC的特异性和灵敏性肿瘤标志物[15]。本研究发现,GPC-3在HCC与癌旁组织表达率为73.56%与2.86%,在ICC组织表达率为2.5%,不仅与癌旁组织差异有统计学意义(P<0.05),且在与ICC的鉴别诊断中具有重要价值。另外,GPC3的表达情况与患者临床分期及预后判断也密切相关。Chen等[16]研究发现GPC3阳性的肝癌患者5年生存率显著低于GPC3阴性表达的患者(27%vs62%,P=0.0036),认为GPC3表达情况与肝癌患者预后密切相关;Xue等[17]发现,肝癌组织GPC3表达与其肿瘤分级、临床病理分期及血管侵犯相关,是一种可用于预测肿瘤复发或转移、侵袭及生存期的潜在肿瘤血清标志物[18]。本组资料GPC3在不同病理分化程度HCC组织表达差异有统计学意义(P<0.05),与上述研究的结果一致。
Wnt/β-cateninn通路信号传导通路在细胞正常发育过程和肿瘤发生发展具有重要作用。尹寿新等[19]研究证明,HepG2细胞在过度活化时可以诱导Wnt经典靶基因的表达,抑制Wnt/β-cateninn通路可以起到抗肿瘤的效果[20]。目前已发现多种分泌蛋白在调控Wnt/β-cateninn通路上发挥重要作用,GPC3就是其中之一。本实验也发现β-catenin及GPC3蛋白表达呈正相关,推测GPC3在Wnt/β-cateninn通路上发挥重要作用。但β-catenin及GPC3与GS表达均未见明显相关性(P>0.05)。

图1 β-catenin癌旁肝组织包膜弱阳性,癌组织膜浆同时阳性(EnVision两步法 ×10)
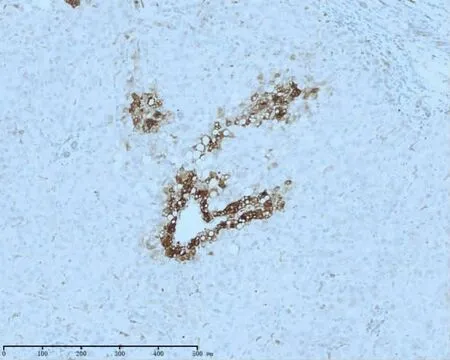
图2 GS在正常肝组织内及癌旁表达于终末肝静脉周围的肝细胞(EnVision两步法 ×10)

图3 GS在肝癌中弥漫成片表达(EnVision两步法×20)
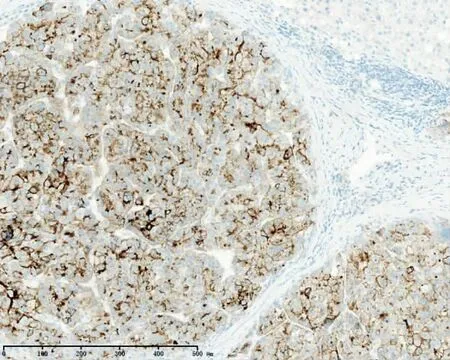
图4 GPC3在肝癌中的表达,周围癌旁组织未见阳性表达(EnVision两步法 ×20)
[1] Della CC,Colombo M.Surveillance for hepatocellular carcinoma[J].Semin Oncol,2012,39(4):384-398.
[2] Gao W,Kim H,Feng M,et al.Inactivation of Wnt signaling by a human antibody that recognizes the heparan sulfate chains of glypican-3 for liver cancer therapy[J].Hepatology,2014,60(2):576-587.
[3]中国抗癌协会肝癌专业委员会,中华医学会肝病学分会肝癌学组,中国抗癌协会病理专业委员会,等.原发性肝癌规范化病理诊断指南(2015版)[J].中华肝胆外科杂志,2015,21(3):145-151.
[4] Peker K,Baso lu M,Gürsan N.Relationship between β -catenin expression and prognostic parameters of colorectal carcinomas[J].Turk Patoloji Derg,2013,29(2):87-93.
[5] Aktary Z,Alaee M,Pasdar M.Beyond cell-cell adhesion:Plakoglobin and the regulation of tumorigenesis and metastasis[J].Oncotarget,2017,8(19):32270-32291.
[6] Marsden AN,Derry SW,Schneider I,et al.The Nkd EF-hand domain modulates divergent wnt signaling outputs in zebrafish[J].Dev Biol,2018,434(1):63-73.
[7] Bi L,Liu X,Wang C,et al.Wnt5a involved in regulation of the biological behavior of hepatocellular carcinoma[J].Int J Clin Exp Pathol,2014,7(3):987-995.
[8]Ohrnberger S,Thavamani A,Braeuning A,et al.Dysregulated serum response factor triggers formation of hepatocellular carcinoma[J].Hepatology,2015,61(3):979-989.
[9] Kuwata K,Inoue K,Ichimura R,et al.β-catenin Mutations Are Not Involved in Early-stage Hepatocarcinogenesis Induced by Protoporphyrinogen Oxidase Inhibitors in Mice[J].Toxicol Pathol,2017,45(4):493-505.
[10] Zulehner G,Mikula M,Schneller D,et al.Nuclear betacatenin Induces an early Liver progenitor phenotype in hepatocellular carcinoma and promotes tumor recurrence[J].Am J Pathol,2010,176(1):472-481.
[11]Vasuri F,Malvi D,Bonora S,et al.From large to small:the immunohistochemical panel in the diagnosis of early hepatocellular carcinoma[J].Histopathology,2018,72(3):414-422.
[12] Chayanupatkul M,Omino R,Mittal S,et al.Hepatocellular carcinoma in the absence of cirrhosis in patients with chronic hepatitis B virus infection[J].J Hepatol,2017,66(2):355-362.
[13]Das Bhowmik A,Dalal A.Whole exome sequencing identifies a novel frameshift mutation in GPC3 gene in a patient with overgrowth syndrome[J].Gene,2015,572(2):303-306.
[14] Schmidt J,Hollstein R,Kaiser FJ,et al.Molecular analysis of a novel intragenic deletion in GPC3 in three cousins with Simpson-Golabi-Behmel syndrome[J].Am J Med Genet A,2017,173(5):1400-1405.
[15] Liu JW,Zuo XL,Wang S.Diagnosis accuracy of serum glypican-3 level in patients with hepatocellular carcinoma and liver cirrhosis:a meta-analysis[J].Eur Rev Med Pharmacol Sci 2015,19(19):3655-3673.
[16] Chen IP,Ariizumi S,Nakano M,et al.Positive glypican-3 expression in early hepatocellular carcinoma predictsrecurrence after hepatectomy[J].J Gastroenterol,2014,49(1):117-125.
[17]Xue R,Feng J,Meng Q,et al.The significance of glypican-3 expression profiling in the tumor cellular origin theoretical system for hepatocellular carcinoma progression[J].J Gastroenterol Hepatol,2017,32(8):1503-1511.
[18] Liu X,Wang SK,Zhang K,et al.Expression of glypican 3 enriches hepatocellular carcinoma developmentrelated genes and associates with carcinogenesis in cirrhotic livers[J].Carcinogenesis,2015,36(2):232-242.
[19]尹寿新,马美雪,周震,等.GPC3通过活化Wnt/β-catenin通路促进HepG2生长[J].胃肠病学和肝病学杂志,2015,11(24):1357-1360.
[20]张世苹,张旭.Wnt信号通路在肿瘤调控方面的研究进展[J].中国药理学通报,2017,33(1):14-18.
