天麻种质资源的SSR指纹图谱研究
2018-06-23周天华丁家玺
周天华,丁家玺,徐 皓,陈 琛,2
(1 陕西理工大学 生物科学与工程学院,陕西汉中 723001;2 陕西省天麻山茱萸工程技术研究中心,陕西汉中 723000)
天麻(GastrodiaelataBl.)属兰科天麻亚族天麻属(GastrodiaR. Br.)多年生草本植物,又名赤箭、独摇芝、离母、定风草、白龙皮等。分布于吉林、辽宁、内蒙古、河北、山西、陕西、甘肃、江苏、安徽、浙江、江西、台湾、河南、湖北、湖南、四川、贵州、云南和西藏。生于海拔400~3 200 m 的疏林下、林中空地、林缘及灌丛边缘,生长过程中必须先后与小菇属和蜜环菌属2类真菌建立共生关系。植株高30~200 cm。茎直立,无绿叶,下部被数枚膜质鞘。根状茎肥厚,块茎状,椭圆形至近哑铃形,具较密的节[1]。天麻块茎入药为中药天麻(GASTRODIAE RHIZOMA),是中国名贵中药材,性甘、平,归肝经,主治功能有息风止痉,平抑肝阳,祛风通络,可用于小儿惊风,头痛眩晕,肢体麻木等症状[2]。
天麻属下共有13个种,而药用植物天麻(G.elata)种下又可分为5个变型(form),分别是红天麻(G.elataBl. f.elata)、绿天麻(G.elataBl. f.viridisMakino)、乌天麻(G.elataBl. f.glaucaS. Chow)、黄天麻(G.elataBl. f.flavidaS. Chow)与松天麻(G.elataBl. f.albaS. Chow)[1]。这5个变型分布于全国各地,均有驯化栽培。研究表明,天麻的块茎中存在着多种化学成分,如酚类、有机酸类、多糖类和甾体类等,其中天麻素(对-羟甲基苯-β-D-吡喃葡萄糖)是公认的主要药用活性成分[3],天麻素的含量也成为了评定天麻质量的重要指标。然而,现有研究发现天麻不同产地、不同变型间的天麻素含量存在着较大差异[4-5]。
天麻的市场需求量日益上涨,野生天麻已经不能满足市场的需求,虽然大范围的人工栽培在一定程度上解决了野生天麻稀缺的问题,但也导致了市场上的天麻的种质混乱。不同变型间的天麻块茎在形态上几乎没有区别,而天麻素的量却有着较大的差异,导致药材品质良莠不齐,且混伪品泛滥,给天麻的种植栽培和临床用药安全带来了极大的困难。因此,亟需利用DNA分子鉴定的方法,为该药材良种选用及用药安全提供重要技术支撑。
微卫星DNA(microsatellite DNA)也称为简单重复序列(simple sequence repeats, SSRs),是由1~6 bp的重复单元串联而成一段DNA,并且广泛分布于核基因组与叶绿体基因中[6]。随着分子生物学的快速发展,SSR技术已经普遍运用于植物遗传学的研究中,用来揭示植物样本间或居群间的遗传变异或评估种间的遗传关系。与其他分子标记技术相比,由于微卫星位点上碱基数目是可变的并且呈高度的多态性,以及可以做共显性的等位基因分析,因此被广泛应用于药用植物的遗传背景分析、种质资源鉴定和混伪品鉴定[7-9]。尽管药材在干燥过程中DNA有所降解,但干品仍然带有足够多的DNA信息特别是稳定的小分子带,可供鉴别药材使用。因此,不论新鲜药材还是干品饮片,或是不同药用部位,通过DNA分子技术皆能准确予以鉴别。
本研究利用已开发的SSR引物对天麻的3种变型进行了群体遗传分析,并构建了天麻种质资源的SSR指纹图谱,为中国传统中药材天麻变型间区分提供了可靠的分子依据。
1 材料和方法
1.1 材 料
本研究所用120份样本采自于陕西省汉中市、贵州省毕节市、云南省昭通市和湖北省宜昌市。每个地区采集茎秆颜色分明的乌天麻、红天麻和黄天麻各10个样本,将块茎清洗,切片存于-80 ℃超低温冰箱中保存备用。所有样品的标本凭证保存于陕西理工大学生物科学与工程学院植物分子生物学实验室。
1.2 方 法
1.2.1天麻DNA提取采用改良2×CTAB法提取天麻4个栽培居群120个样本的基因组DNA,溶解在100 μL 0.1%TE缓冲液中,0 ℃保存备用。应用紫外分光光度计(NanoDrop 2000)检测其纯度,记录DNA浓度和A260/A280吸光比值。各取10 μL 基因组DNA用浓度为1%琼脂糖凝胶检测其完整性。
1.2.2天麻的PCR扩增与聚丙烯酰氨凝胶电泳检测从本实验室开发的20对天麻SSR引物[10]中选取条带清晰,多态性高的7对引物(表1)对4个居群120个样本进行PCR扩增和聚丙烯酰胺凝胶电泳检测。
PCR扩增反应体系为20 μL,包括DNA模板50 ng,2×Mix(天根生物科技)10 μL,正反引物各50 ng,加ddH2O至20 μL。PCR反应在PCR扩增仪(Bio-Rad S1000TM)上按以下程序运行:首先94 ℃预变性3 min;94 ℃变性30 s,退火温度下45 s,72 ℃下延伸45 s,35个循环;最后72 ℃延伸7 min,4 ℃保存。
完成PCR循环48 h内,取2 μL PCR产物在8%非变性聚丙烯酰胺凝胶上恒电压160V电泳14h。用NaOH银染方法进行染色显影。显影完成之后,用凝胶成像系统(Bio-Rad GEL DOCTM XR+)采集图像并进行数据统计分析。
1.2.3数据统计与软件分析将银染过的聚丙烯酰凝胶拍照,使用Bio-Rad Quantity软件对电泳图进行条带统计,采用人工读带的方式记录主要带型,忽略弱杂带,在Excel 2016中构建天麻SSR条带数据库。应用POPGENE Version1.32[11]计算各引物的等位基因数目(Na)、期望杂合度(He)、观测杂合度(Ho)、多态性信息含量[12](PIC)等参数,计算天麻变型和种群的遗传多样性,统计平均等位基因数目(A)、Nei’s基因多样性指数(H)和Shannon多样性指数(I)。使用GenALEX 6.1统计所有样本的基因型组成,并计算所有个体的Simpson指数(D),计算公式为:D=1-∑[ni(ni-1)/N(N-1)],其中ni是指具有第i个基因型的个数。Simpson指数是测定种群克隆多样性的重要指标,数值越高说明种群克隆多样性越好。在本研究中借用Simpson指数来说明所有样本中个体基因型的多样性,如果群体中所有个体基因的基因型各不相同,则Simpson指数最大,即D=1;如果所有个体基因型都相同,则Simpson指数最小,即D=0。
此外,为了分析天麻种质资源样本的遗传关系,应用Structrue V2.3.4[13]软件来确定所有样本的聚类分组,并构建了各样本的遗传关系图[14],使用GenALEX6.1对所有样本进行主相关性(The Principal Coordinates Analysis, PCoA)分析,使用软件ARLQEQUIN 3.0进行分子方差分析(analysis of molecular variance, AMOVA), 计算天麻物种及变型遗传分化。
2 结果与分析
2.1 引物扩增多态性与区分效率
本研究所提取的天麻样本基因组DNA检测结果显示,天麻 DNA浓度均在45~360 ng/μL之间,A260/A280吸光比值均在1.6~2.0之间。琼脂糖凝胶电泳显示,天麻 DNA长度均大于20 000 bp。提取到的天麻样本总DNA纯度和完整度高,能够用于PCR扩增。
本研究所采用的7对天麻SSR引物均能对120份样品进行扩增,效果良好(图1)。表1显示,SSR引物的等位基因数在5~7之间,共计45个;每个位点的等位基因数(Na)平均为6.428 6个,具有较好的多态性和通用性;期望杂合度(He)范围为0.325 0~0.741 7,平均值为0.540 5;观测杂合度(Ho)范围为0.325 0~0.741 7,平均值为0.540 5(表1)。多态信息含量(PIC)范围为0.626 2~0.823 5,平均值为0.759 5,而PIC值能够反映引物对材料的区分能力,说明引物对材料具有较好的鉴别能力。

M.PUC-18 DNA marker; 1~10.YCB居群的10个个体M. PUC-18 DNA marker; 1-10. 10 samples of population YCB
表1本研究所用SSR引物的遗传多样性
Table 1 The genetic diversity of 7 SSR primer pairs used in this study

引物Primer等位基因数Number of alleles(Na)观测杂合度Observed heterozygosity(Ho)期望杂合度Expected heterozygosity(He)多态信息量Polymorphism information content(PIC)GEBL0370.700 00.810 10.782 5GEBL0750.533 30.679 80.626 2GEBL1470.500 00.846 80.823 5GEBL2070.575 00.831 90.805 3GEBL2770.741 70.767 40.732 1GEBL2860.408 30.679 80.745 5GEBL3160.325 00.825 70.801 2平均 Mean6.428 60.540 50.792 30.759 5
2.2 天麻变型的遗传多样性与遗传分化
对天麻各变型及种群的群体遗传分析发现,天麻在物种水平和变型水平有较高的遗传多样性(物种水平:A=6.428 6,H=0.789 0,I=1.682 9; 变型水平:A=2.666 6,H=0.523 9,I=0.812 3),其中红天麻遗传多样性明显高于乌天麻与绿天麻(表2)。
分子方差分析(AMOVA)结果(表3)显示,38.18%的变异来自于变型间,17.68%的变异来自于变型内种群间,而种群内的变异占44.14%。这说明天麻种群间遗传分化强烈(Fst=0.558 6),天麻变型间也存在明显的遗传分化(Fct=0.381 8)。

表2 天麻种群的采样地与遗传多样性Table 2 The sample locations and genetic diversities of G. elata populations
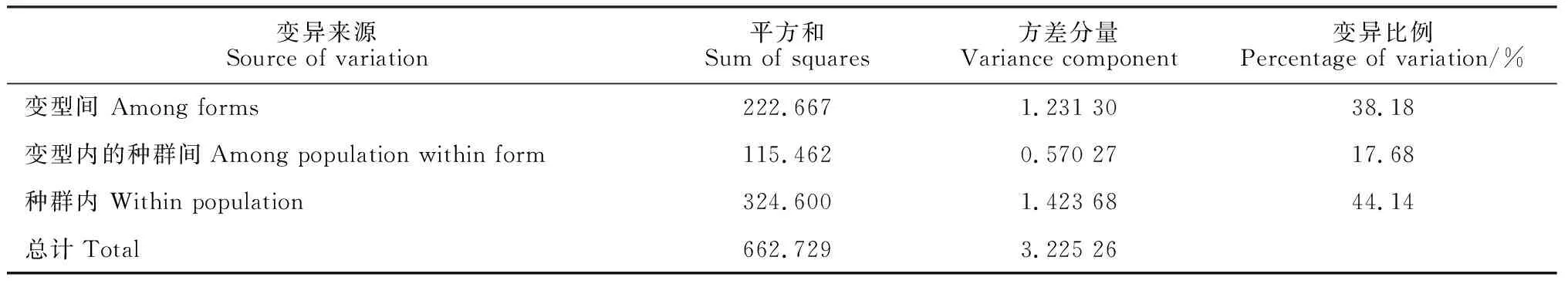
表3 天麻样本的分子方差分析Table 3 Analysis of molecular variance (AMOVA) of G. elata
2.3 天麻变型间SSR指纹图谱的构建与鉴定
利用7对天麻SSR引物构建天麻SSR指纹图谱(表4)并对指纹图谱进行分析。在120份样本中有106份样本的基因型,绝大多数个体具有特有的基因型。仅有个别个体存在共享基因组型的情况,例如YLG10与YLG01共享一个基因型,ZTG10、ZTG09和ZTG08共享一个基因型,但这种共享基因型的情况仅仅发生在相同种群内,变型间和种群间没有共享基因型的情况。这表明本研究所用的7对天麻SSR引物在个体水平有着极高的鉴定效率。

表4 天麻样本的SSR指纹图谱Table 4 The SSR fingerprinting for G. elata samples

续表4 Continued Table 4

续表4 Continued Table 4

此图为K=3时STRUCTURE 分组结果条形图,图中同一颜色表示同一变型Bar plots showing assignment probabilities from STRUCTURE analyses when K = 3, the same color in the figure represents the same variant
利用Structure软件对120份样本进行贝叶斯聚类分析结果表明,当K=3时,ΔK出现最大峰值,此时聚类图将不同地域的相同天麻变型聚为一类,不同变型之间基因渗透现象较少(图2)。此外,使用GenAlEx 6.1 软件对样本进行居群主相关性分析(图3),得到的结果与上述结果完全一致。这说明天麻不同变型在遗传上的差异较为稳定,本研究的结果和基于花葶颜色对不同变型进行分类的结果完全一致。这也表明,本研究所用的天麻SSR引物在变型水平也具有非常良好的鉴定效果,能有效区分天麻的不同变型。
3 讨 论
目前许多中药材均存在同名异物和同物异名的现象,而解决这类问题的方法则是进行有效准确的物种鉴定。目前常用的鉴定方法如形态学鉴定、显微鉴定、理化鉴定等都无法准确地对同属同种等亲缘关系较近的物种进行有效的鉴别。对于天麻而言,药用部位为块茎,更无法从形态学上进行准确的鉴定,而SSR分子标记技术有着信息量高、重复性好、呈共显性遗传等特点[15]成为天麻种质资源鉴定的首选技术。本研究选用了7对天麻SSR引物对3种变型、12个种群共计120个样本进行了检测分析,并构建了天麻变型间SSR指纹图谱。

图3 基于遗传距离的天麻样本主相关性分析Fig.3 The Principal Coordinates Analysis (PCoA) dendrogram for G. elata samples based on genetic distance
本研对120份样品进行群体遗传分析结果显示,7对引物的平均观测杂合度(Ho)为0.540 5,平均期望杂合度(He)为0.792 3。7对天麻SSR引物共获得45个变异位点,平均每对引物6.43个,说明SSR引物变异丰富。并且7对天麻SSR引物多态性信息含量(PIC)较高,平均为0.759 7,表现出较高的鉴别材料样本的能力,表明本研究所选用的7对SSR引物可用于天麻的种质资源鉴定。
天麻为中国二级保护植物,野生资源资源稀少,亟需保护。本研究对所有样本进行遗传多样性分析结果表明,天麻在物种水平上和变型水平上均有较高的遗传多样性(物种水平:A= 6.428 6,I= 1.682 9,H= 0.789 0;变型水平:A= 2.666 6,I= 0.523 9,H= 0.812 6),进化潜能丰富。同时AMOVA分析表明,在所有天麻样本中,主要遗传变异(44.14%)来自于各个种群之内,其次38.18%的遗传变异来自于变型之间,并且变型间遗传分化强烈(Fct=0.381 8)。随着天麻产业的快速发展,天麻的供需矛盾也日渐突出,尽管在全国范围内均有人工栽培,但野生天麻种质资源依旧遭到严重破环,对天麻野生种质资源的保护已刻不容缓。天麻在物种水平上具有高度遗传多样性,且遗传分化强烈,因此首先应该对现有野生天麻种群进行就地保护。其次,应对野生天麻种质资源进行广泛的收集与保存,建立天麻种质资源库,确保收集天麻种质资源中保留有该物种绝大部分的遗传信息。
Structure聚类表明,当K=3时,ΔK出现最大峰值,此时聚类图将不同地域的相同天麻变型聚为一类,同一个产区内不同变型间基因渗透现象较少,这是由于在不同海拔上各个变型的分布比例不同,花期也存在一定差异,基因交流主要存在于同一变型间[16]。本研究对120份样本进行居群主相关性分析(PCoA),其结果与Structure聚类结果一致。最终根据PCoA图以及Structure聚类显示7对引物可以完全区分所有供试天麻变型材料,7对引物在变型水平上具有较高的鉴别能力,能用于今后对天麻种质资源的分析与评价。
通过计算得出Simpson指数(D)为0.998,表明所有天麻样本的基因型丰富度较高,在120个样本中共检测出了106个样本的基因型组成不同,其余14个个体仅共享6个基因型,且共享基因型的个体均在相同的种群中。结果表明本研究所选用的7对SSR引物在个体水平有着较高的鉴定效率。
本研究运用现代分子生物学研究手段,利用开发的引物对天麻进行群体遗传分析,并且建立适合天麻的种质资源鉴定体系。研究结果可为后期天麻的良种选育与质量控制提供技术方法与重要的科学依据。本研究结果表明,天麻不同变型遗传差异较大,因此根据天麻的花葶的颜色进行变型的分类是完全可靠的。本研究的结果也为天麻变型的分类提供了重要理论支撑。
参考文献:
[1] 陈心启, 吉占和, 郎楷永, 等. 中国植物志(第18卷)[M]. 北京: 科学出版社, 1999: 29-33.
[2] 国家药典委员会. 中华人民共和国药典(一部)[S]. 北京: 中国医药科技出版社, 2015: 58-59.
[3] 周慧君. 天麻有效成分的药理作用与临床应用研究进展[J]. 中医临床研究, 2016,8(22): 56-58.
ZHOU H J. A review on pharmacological action of active principle inGastrodiaelataand the clinical application[J].ClinicalJournalofChineseMedicine, 2016,8(22): 56-58.
[4] 李德勋, 陈 桂, 李辅碧, 等. 天麻不同变异类型药材中天麻素含量比较[J]. 现代中药研究与实践, 2007,22(3): 23-24.
LI D X, CHEN G, LI F B,etal. Comparison ofGastrodiafrom different variation types ofGastrodiaelata[J].ResearchandPracticeonChineseMedicines. 2007,22(3): 23-24.
[5] 梁纪军, 田大丰, 王中彦, 等. HPLC法测定不同产地天麻中天麻素的含量[J]. 沈阳药科大学学报, 2006,23(1): 26-27.
LIANG J J, TIAN D F, WANG Z Y,etal. Determination of the contents ofGastrodiain Rhizoma Gastrodiae from different regions by HPLC[J].JournalofShenyangPharmaceuticalUniversity, 2006,23(1): 26-27.
[6] GUICHOUX E, LAGACHE L, WAGNER S,etal. Current trends in microsatellite genotyping[J].MolecularEcologyResources, 2011,11(4): 591-611.
[7] KAUR K, SHARMA V, SINGH V,etal. Development of novel SSR markers for evaluation of genetic diversity and population structure inTribulusterrestrisL. (Zygophyllaceae)[J].Biotech, 2016,6(2): 156.
[8] ZHAO B, DU Y Q, LI J J,etal. Development of 18 novel microsatellite primers forBegoniafimbristipula(Begoniaceae), an endangered medicinal plant in China [J].ApplicationsinPlantSciences, 2016,4(7): 1600004.
[9] TIAN H Z, GUI F Z,etal. Characterization of EST-derived microsatellite loci inSarumahenryiOliv., an endangered Chinese endemic herb[J].ConservationGenetResource, 2009, 1: 67-70.
[10] 周天华, 丁家玺, 田 伟, 等. 天麻基因组微卫星特征分析与分子标记开发[J]. 西北植物学报, 2017,37(9): 1 728-1 735.
ZHOU T H, DING J X, TIAN W,etal. Genomic microsatellite characteristic analysis and molecular marker development forGastrodiaelataBL[J].ActaBotanicaBoreali-OccidentaliaSinica, 2017,37(9): 1 728-1 735.
[11] LIU K, MUSE SV. PowerMarker: an integrated analysis environment for genetic marker analysis[J].Bioinformatics, 2005,21(9): 2 128-2 129.
[12] MILBOURNE D, MEYER R,etal. Comparison of PCR-based marker systems for the analysis of genetic relationships in cultivated potato[J].MolecularBreeding, 1997,3(2): 127-136.
[13] PRITCHARD J K, STEPHENS M, DONNELLY P. Inference of population structure using multilocus genetype data[J].Genetics, 2000,155(2): 945-959.
[14] EVANNO G, REGNAUT S,etal. Detecting the number of clusters of individuals using the software structure: a simulation study[J].MolecularEcology, 2005,14(8): 2 611-2 620.
[15] 仇 萍, 盛孝邦, 罗杰英, 等. DNA指纹图谱与测序技术在中药品质鉴定中的研究概述[J]. 中医药导报, 2006, 11: 77-79.
QIU P, SHENG X B, LUO J Y,etal. Overview on the studies of DNA finger printing and sequencing techniques in qualitative determination of Chinese Crude Drugs[J].GuidingJoumalofTCM, 2006, 11: 77-79.
[16] 吴会芳, 李作洲, 黄宏文. 湖北野生天麻的遗传分化及栽培天麻的种质评价[J]. 生物多样性, 2006,14(4): 315-329.
WU H F, LI Z Z, HUANG H W. Genetic differentiation among natural populations ofGastrodiaelata(Orchidaceae) in Hubei and germplasm assessment of the cultivated populations[J].BiodiversityScience, 2006,14(4): 315-329.
