冷冻消融软组织肉瘤消融率的影响因素
2018-06-23杨武威
金 龙,李 静,李 肖*,杨武威*
(1.国家癌症中心 中国医学科学院 北京协和医学院肿瘤医院介入治疗科,北京 100021;2.军事医学科学院附属医院肿瘤微创治疗科,北京 100071)
软组织肉瘤是罕见的间叶组织肿瘤,不同组织学类型具有不同临床和病理特征。软组织肉瘤发病率低,约占所有成人恶性肿瘤的1%;可发生于全身任何部位,且对于不同组织学类型和生物学行为的肿瘤,在治疗上存在很大不同。传统治疗方法有外科手术、放疗、化疗等,其中外科手术目前仍是治疗软组织肉瘤的主要手段。当前影像学引导下肿瘤消融技术已在恶性肿瘤综合治疗中发挥着重要作用。作为一种肿瘤微创技术,冷冻消融操作简便,创伤小,患者耐受性好,已成为治疗各种恶性肿瘤的重要方法。本研究分析在军事医学科学院附属医院肿瘤微创治疗科接受冷冻消融治疗的软组织肉瘤患者术前、术后临床资料,观察冷冻消融率的影响因素,以期为提高软组织肉瘤冷冻消融疗效提供理论依据。
1 资料与方法
1.1 一般资料 收集2011年5月—2017年10月在军事医学科学院附属医院肿瘤微创治疗科首次接受氩氦刀冷冻消融治疗的软组织肉瘤患者60例,男26例,女34例,年龄9~74岁,平均(46.8±17.4)岁,其中年龄≥50岁者30例,<50岁30例;冷冻消融术前病理诊断明确,均已接受增强CT或MR检查(图1A);肿瘤最长径10~240 mm,平均(85.92±45.81)mm,其中29例最长径≤80 mm,31例>80 mm。AJCC分期Ⅰ期2例、Ⅱ期6例、Ⅲ期1例、Ⅳ期51例。肿瘤恶性程度分期G1期13例,G2期47例。分化程度分级G1级9例,G2级1例,G3级5例,G4级33例,12例无法确定(Gx)。 39例有远处转移,21例无远处转移。冷冻消融术后联合应用阿帕替尼靶向治疗10例,联合帕唑帕尼靶向治疗5例。冷冻消融治疗部位:腹盆腔26例、肩背部4例、臀部3例、胸壁9例、肺部8例、下肢6例、头颈部4例。
1.2 治疗方法 CT引导下划定靶区、选定穿刺点、进针角度及深度。冷冻消融治疗采用Endocare Cryocare Surgical System氩氦刀。根据肿瘤部位,患者取仰卧或俯卧位,常规消毒、铺巾,局部麻醉穿刺点,经选定穿刺路径将冷冻消融针穿入靶区。氩气工作压力为2 800 PSI,迅速冷冻至-140℃~-160℃。行CT扫描,确认针尖形成冰球(图1B),持续冷冻15~20 min。氦气工作压力为1 000 PSI,迅速复温至10℃。再次行CT扫描,观察有无出血并确认消融范围,此为第1冷冻循环。以同样步骤行第2循环冷冻。对肿瘤较大者,布局多个冷冻消融针进行冷冻。术毕拔出冷冻消融针,局部无菌纱布压迫止血。全部消融治疗操作均在严密心电、脉搏、呼吸及血氧监护下进行。
1.3 疗效评价 冷冻消融术后1个月行增强CT或MR检查,对治疗病灶进行影像学评估(图1C),并计算消融率。消融率=消融术后靶病灶无对比剂灌注区体积(V1)/消融术后靶病灶体积(V2)×100%。肿瘤体积(V)计算公式为V=(a×b×c)π/6,其中a、b、c分别为肿瘤纵径、横径和厚径。
1.4 安全性评价 观察并记录冷冻消融术后并发症情况。依照美国介入放射学会(Society of Interventional Radiology, SIR)并发症分级标准[1],将其分为6级:A级,不需要治疗,无不良后果;B级,仅需简单处理,无不良后果,包括过夜留诊观察;C级,需要治疗,住院时间<48 h;D级,需提高护理级别,住院治疗48 h以上;E级,留下终身后遗症;F级,死亡。
1.5 统计学分析 采用SPSS 20.0统计分析软件。计量资料以±s表示,采用χ2检验对患者性别、年龄、肿瘤生长部位、肿瘤最长径、恶性程度、分化程度、分期(AJCC)、远处转移以及术后联合靶向治疗等进行单因素分析;对于发现与冷冻消融率有关的因素,再采用Cox比例风险回归模型进行多因素分析。以P<0.05为差异有统计学意义。
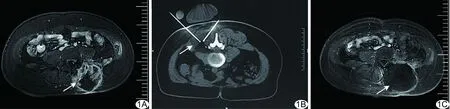
图1 患者女,36岁,左侧腰背部滑膜肉瘤 A.术前MRI示病灶活性部分呈高信号(箭),病灶中心低信号区为无活性部分; B.冷冻消融术中CT图像,患者俯卧,以两支冷冻消融针同时进行消融,形成冰球覆盖整个病灶(箭); C.冷冻消融术后1个月MRI示整个病灶呈低信号(箭),肿瘤完全灭活
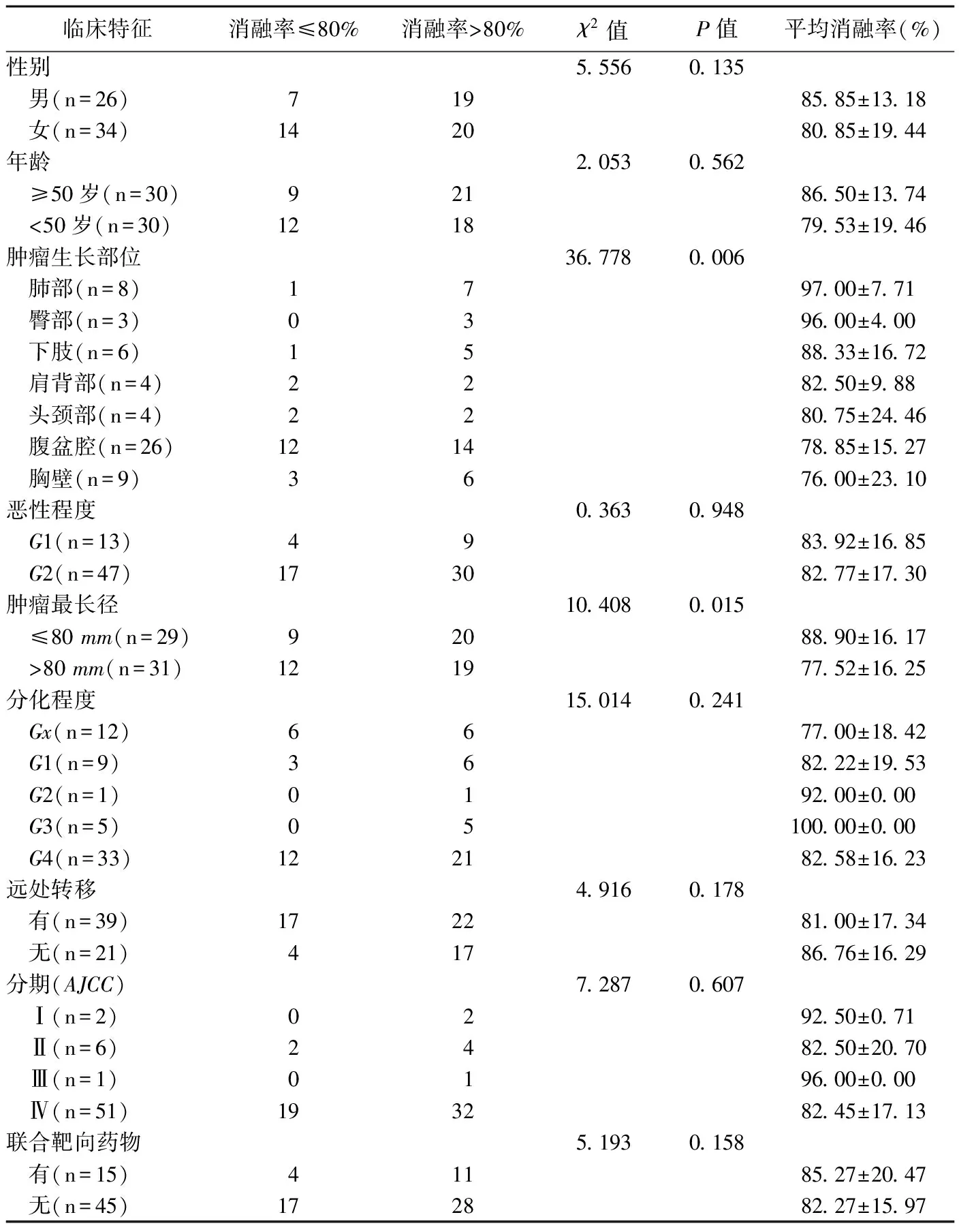
临床特征消融率≤80%消融率>80%χ2值P值平均消融率(%)性别5.5560.135 男(n=26)71985.85±13.18 女(n=34)142080.85±19.44年龄2.0530.562 ≥50岁(n=30)92186.50±13.74 <50岁(n=30)121879.53±19.46肿瘤生长部位36.7780.006 肺部(n=8)1797.00±7.71 臀部(n=3)0396.00±4.00 下肢(n=6)1588.33±16.72 肩背部(n=4)2282.50±9.88 头颈部(n=4)2280.75±24.46 腹盆腔(n=26)121478.85±15.27 胸壁(n=9)3676.00±23.10恶性程度0.3630.948 G1(n=13)4983.92±16.85 G2(n=47)173082.77±17.30肿瘤最长径10.4080.015 ≤80 mm(n=29)92088.90±16.17 >80 mm(n=31)121977.52±16.25分化程度15.0140.241 Gx(n=12)6677.00±18.42 G1(n=9)3682.22±19.53 G2(n=1)0192.00±0.00 G3(n=5)05100.00±0.00 G4(n=33)122182.58±16.23远处转移4.9160.178 有(n=39)172281.00±17.34 无(n=21)41786.76±16.29分期(AJCC)7.2870.607 Ⅰ(n=2)0292.50±0.71 Ⅱ(n=6)2482.50±20.70 Ⅲ(n=1)0196.00±0.00 Ⅳ(n=51)193282.45±17.13联合靶向药物5.1930.158 有(n=15)41185.27±20.47 无(n=45)172882.27±15.97

表2 氩氦刀冷冻消融软组织肉瘤消融率影响因素Cox多因素分析

表3 冷冻消融软组织肉瘤术后并发症及SIR分级
2 结果
60例软组织肉瘤,冷冻消融治疗后消融率为42.00%~100.00%,平均(83.02±17.07)%;其中39例消融率>80%,21例≤80%。单因素分析显示,肿瘤最长径、肿瘤生长部位与消融率有关(表1)。多因素分析显示,肿瘤生长部位是氩氦刀冷冻消融软组织肉瘤消融率的独立影响因素(P<0.05),见表2。
冷冻消融术后31例出现不同程度局部疼痛、术区皮肤肿胀、皮肤颜色改变、肢体麻木、咳嗽咳痰等并发症,SIR分级均为A或B级;其中30例于1周内自行缓解或经简单对症处理后缓解,1例下肢肉瘤冷冻消融术后神经损伤患者下肢活动障碍持续近1个月后自行缓解(表3)。未出现严重感染、皮肤坏死、脏器功能障碍等严重并发症。
3 讨论
软组织肉瘤约占成人恶性肿瘤的1%,占儿童恶性肿瘤的6.50%[2]。在北美,软组织肉瘤年发病率为 1.5/10万~2.0/10万[3];欧洲软组织肉瘤年发病率为4/10万~5/10万[4]。组织学上软组织肉瘤有19个类型、50余种不同亚型[5]。目前外科手术切除仍是治疗软组织肉瘤最有效的方法[6],但术后易复发、转移,而放化疗效果不甚理想。冷冻消融目前广泛已应用于肝、肺、肾、前列腺等恶性肿瘤的临床治疗,NCCN指南推荐冷冻消融可用于治疗复发性或转移性软组织肉瘤。冷冻消融可直接破坏肿瘤组织,坏死细胞产物则可刺激和诱导机体产生抗肿瘤免疫反应[7-13]。
研究[14-16]显示,冷冻消融疗效是影响临床预后的重要因素。冷冻消融治疗的技术优点之一是可以通过CT影像来判断冷冻冰球的范围;但是,由于冰球边缘温度为摄氏0度,不能导致组织坏死,通常情况下冷冻冰球内的组织坏死率、即冷冻消融率为70%~80%。分析冷冻消融率的影响因素,有助于提升和控制局部消融率,以获得更好的治疗有效性和安全性。本研究显示:①不同部位软组织肉瘤冷冻消融术后消融率存在显著差异。肺内病灶和臀部病灶的平均消融率显著高于其他部位,可能与病灶相对孤立、周围冷冻危险组织相对少、易于实现超范围消融等因素有关;此外,靶区组织结构的特点,如脂肪层厚度、骨骼成分、纤维结缔组织比例等组织学特征的影响有待于进一步观察。②无论何种肿瘤,对于较小肿瘤的消融效果通常优于较大肿瘤,可能与较小病灶更易达到超范围消融、组织及周边血供负载量相对少有关。③患者性别、年龄、肿瘤分化程度、临床分期等生物学因素对于局部消融率未见显著影响,提示肿瘤局部组织的冷冻物理学特征可能是决定冷冻疗效的主要因素,而肿瘤的生物学特征可能会更多影响肿瘤长期控制和临床转归,但不能排除样本量少、分布不均匀等因素造成的干扰。④本组15例术后联合应用肿瘤血管生成抑制剂类的靶向药物,包括10例应用阿帕替尼、5例应用帕唑帕尼,均未发现肿瘤消融率有显著变化,可能与此类药物的主要作用机制是抑制肿瘤新生血管、而非直接导致肿瘤组织坏死有关,其临床价值更多体现在疾病的长期控制方面。
冷冻消融并发症少,且程度低。本组60例中,31例冷冻消融术后出现并发症,SIR分级均为A或B级,进一步证实了冷冻消融治疗的安全性。
综上所述,氩氦冷冻消融具有安全、有效、耐受性好、恢复快、可重复、冷冻范围CT影像可视等优点,为局部治疗软组织肉瘤的有效方法。软组织肉瘤生长部位是本组冷冻消融后消融率的独立影响因素。
[参考文献]
[1] Degirmenci T, Gunlusoy B, Kozacioglu Z, et al. Utilization of a modified Clavien Classification System in reporting complications after ultrasound-guided percutaneous nephrostomy tube placement: Comparison to standard Society of Interventional Radiology practice guidelines. Urology, 2013,81(6):1161-1167.
[2] 师英强.软组织肉瘤诊治中国专家共识(2015年版). 中华肿瘤杂志,2016,38(4):310-318.
[3] Gordon EM, Sankhala KK, Chawla N, et al. Trabectedin for Soft tissue sarcoma: Current status and future perspectives. Adv Ther, 2016,33(7):1055-1071.
[4] Stiller CA, Trama A, Serraino D, et al. Descriptive epidemiology of sarcomas in Europe: Report from the RARECARE project. Eur J Cancer, 2013,49(3):684-695.
[5] Doyle LA. Sarcoma classification: An update based on the 2013 World Health Organization Classification of Tumors of Soft Tissue and Bone. Cancer, 2014,120(12):1763-1774
[6] Fa CO, Sole CV, Cambeiro M, et al. Prognostic value of external beam radiation therapy in patients treated with surgical resection and intraoperative electron beam radiation therapy for locally recurrent soft tissue sarcoma: A multicentric long-term outcome analysis. Int J Rad Oncol Biol Physics, 2014,88(1):143-150.
[7] Akbay EA, Koyama S, Carretero J, et al. Activation of the PD-1 pathway contributes to immune escape in EGFR-driven lung tumors. Cancer Discov, 2013,3(12):1355-1363.
[8] Kim HK, Pyun JH, Cho S, et al. Tumor-specific immunity induced by cryoablation in a murine renal cell carcinoma model. Korean J Urol, 2014,55(12):834-840.
[9] Li C, Li W, Xiao J, et al. ADAP and SKAP55 deficiency suppresses PD-1 expression in CD8+ cytotoxic T lymphocytes for enhanced anti-tumor immunotherapy. EMBO Mol Med, 2015,7(6):754-769.
[10] Nishida H, Yamamoto N,Tanzawa Y, et al. Cryoimmunology for malignant bone and soft-tissue tumors. Int J Clin Oncol, 2011,16(2):109-117.
[11] Shiota M, Zardan A, Takeuchi A, et al. Clusterin mediates TGF-β-induced epithelial-mesenchymal transition and metastasis via Twist1 in prostate cancer cells. Cancer Res, 2012,72(20):5261-5272.
[12] Wu CT, Chang YH, Lin WY, et al. TGF beta1 expression correlates with survival and tumor aggressiveness of prostate cancer. AnnSurg Oncol, 2015,22(Suppl 3):S1587-S1593.
[13] Sabel MS. Tumor Ablation. Dordrecht: Springer, 2013:77-107.
[14] Aubry S, Dubut J, Nueffer JP, et al. Prospective 1-year follow-up pilot study of CT-guided microwave ablation in the treatment of bone and soft-tissue malignant tumours. Eur Radiol, 2017,27(4):1477-1485.
[15] Cornelis F, Havez M, Lippa N, et al. Radiologically guided percutaneous cryotherapy for soft tissue tumours: A promising treatment. Diagn Interv Imaging, 2013,94(4):364-370.
[16] Filippiadis DK, Tutton S, Mazioti A, et al. Percutaneous image-guided ablation of bone and soft tissue tumours: A review of available techniques and protective measures. Insights Imaging, 2014,5(3):339-346.