Ⅱ/Ⅲ期结直肠癌术后早期胸腹盆CT随访的临床意义
2018-06-22闫俊平刘国臣黄基伟曹东林
闫俊平,刘国臣,黄基伟,曹东林
尽管手术技术在不断进步,但仍有约50%接受根治性手术的结直肠癌患者会出现复发或者转移[1,2]。结直肠癌最常出现复发转移的部位是肝和肺[3]。不接受任何治疗的转移性结直肠癌患者的中位生存时间不到10个月,5年生存率小于5%[4,5]。目前对于结直肠癌局限性的肝/肺转移,手术是一种具有潜在根治意义的治疗手段。转移灶根治性切除的患者5年生存率可达20%~40%[6]。然而,遗憾的是,仅有10%~15%的结直肠癌转移灶能进行根治手术[7],而且据报道这其中的57%归功于对转移灶的早期发现[8,9]。早期诊断发现的转移大多体积小且数目较少,因此肿瘤负荷相对较小,而有研究证实转移灶的数目和大小与能否手术及术后的长期生存有关[10,11],既往的研究也表明采用计算机X线断层扫描(computed tomography,CT)和癌胚抗原(carcino-embryonic antigen,CEA)检查密切随访可显著提高转移灶的早期发现率并可改善长期预后[12]。目前临床对于接受了根治手术的结直肠癌患者何时行第一次CT评价尚无确切定论,基于此,本研究采用病例对照研究探索结直肠癌根治术后早期(6个月内)CT检查与6个月后开始CT检查在转移发现率、转移灶的数目/大小、可再手术率、患者总生存率等方面的差异,以期为临床实践提供借鉴。
1 资料与方法
1.1 资料 借助大肠癌电脑数据库和中山大学肿瘤防治中心医院信息系统,回顾性地收集2009-01-01至2012-05-31结直肠癌患者3 152例的病例资料,根据资料筛选标准最终纳入了447例符合条件的Ⅱ期(228例)、Ⅲ期(219例)结直肠癌患者。其中,第一次CT时间距离手术时间<6个月的记为早期CT检查组(n=150),第一次CT时间距离手术时间≥6个月的记为非早期CT检查组(n=297)。
1.2 资料筛选标准 纳入标准:初诊于中山大学肿瘤防治中心,在该院行根治性手术,并有术后病理组织证实的TNM分期(T是原发灶,N是淋巴结,M是远处转移)为Ⅱ期及Ⅲ期(根据第7版美国癌症联合委员会肿瘤分期)结直肠癌患者。排除标准:(1)未在该院门诊随诊;(2)未在该院行CT检查者(以评估复发/转移为目的);(3)合并其他恶性肿瘤。
1.3 CT成像方法 所有纳入的患者均同时接受了CT平扫和增强扫描。使用Brilliance TM16螺旋扫描机,参数如下:厚度5 mm,电压125 kV,电流200 mA,矩阵256×256。患者接受CT平扫后,以2.5 ml/s的速度静注非离子型碘造影剂100 ml。注射造影剂后60 s采集增强CT影像。
1.4 资料收集 收集患者姓名、性别、年龄、原发灶、血清CEA水平、手术时间及术后TNM病理分期等。如第一次CT随访发现转移,记录转移部位,并对第一次CT片中转移灶数目和大小(取最长径和长径之和)进行登记。记录患者转移灶的治疗方法,复习手术记录,判断是否接受以根治为目的的手术治疗(包括转移灶的R0切除或者转移灶损毁完全的介入治疗)。记录术后第一次CT随访的时间,仔细重读患者CT影像,若现有的影像资料不足以判定病变是否为转移或者和现有的影像报告不一致的,则与两位经验丰富的影像科医师阅片讨论,结合后续的CT检查和临床表现来得出病灶是否为转移。统计总生存率以评估患者的预后。研究资料保密,并隐去所有纳入研究患者的真实信息。
1.5 随访情况 随访资料来源于医院专门的随访小组和门诊随访资料,对于随访资料不全的患者,通过电话等方式补充。查阅门诊记录或病历收集患者术后第一次CT检查前临床症状、体检情况及最近一次血清CEA水平,记录后续治疗、有无复发转移、是否死亡、死亡时间等随访信息。随访截止时间为2015-09-30。
1.6 统计学处理 应用SPSS 19.0软件进行数据分析,计数资料以频数和率表示,组间比较采用Pearsonχ2检验;非正态分布的计量资料以中位数(四分位数)表示,组间比较采用Mann-Whitney U秩和检验;采用Kaplan-Meier法绘制生存曲线。以双侧P<0.05为差异有统计学意义。
2 结 果
2.1 一般资料 两组在性别、年龄、原发灶、TNM分期、术前CEA水平、术后是否化疗、术后2年内CT检查次数等临床病理资料上,差异无统计学意义(P>0.05),具有可比性。早期CT检查组术后第一次CT检查前有临床症状及CEA异常比例均高于非早期CT检查组(P<0.05,表1)。
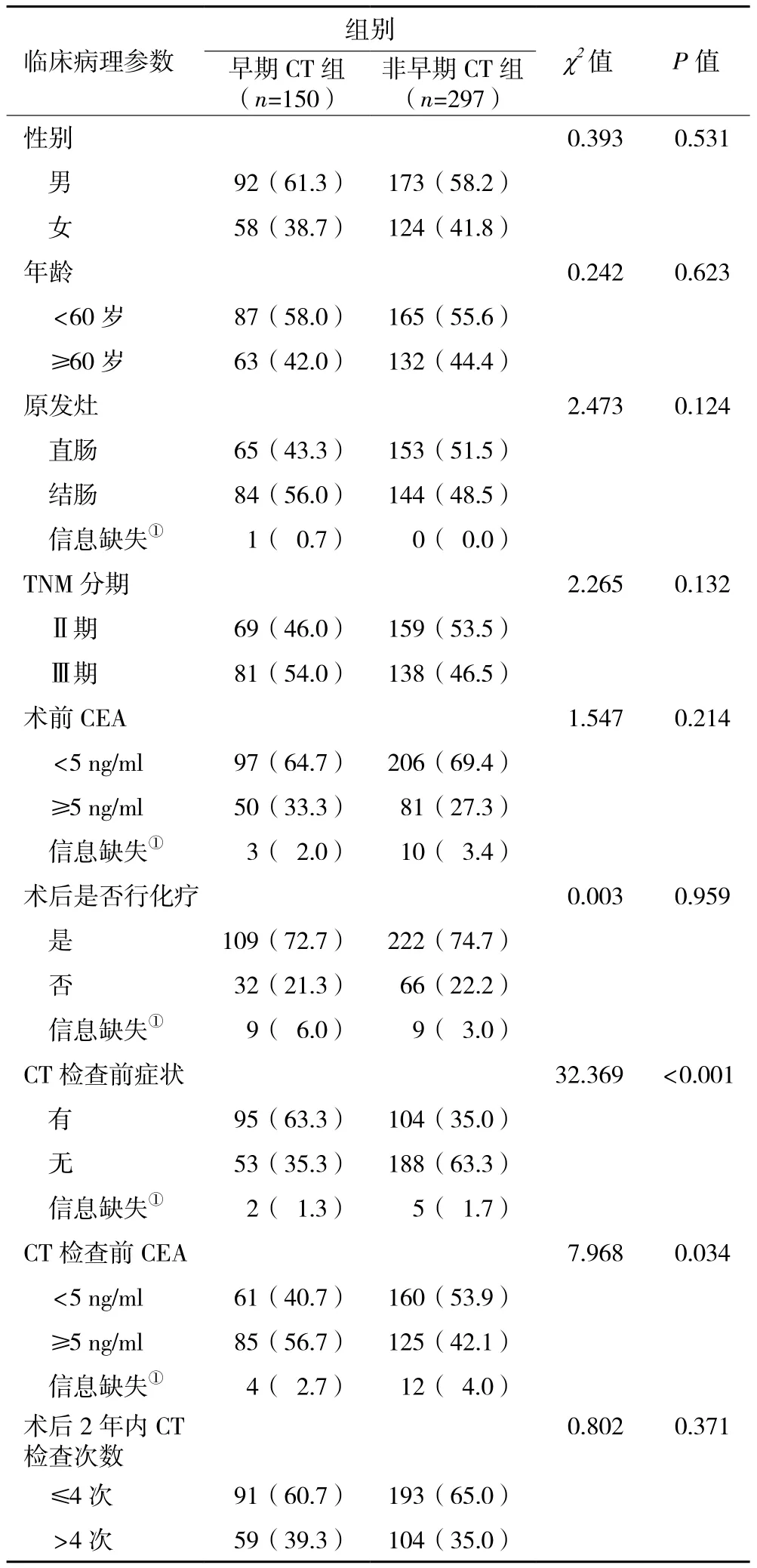
表1 早期CT检查组与非早期CT检查组结直肠癌患者临床病理参数构成情况[n(%)]
2.2 远处转移发现率 截至随访结束,共有93例(20.8%)出现远处转移(26例为随访得知,未见我院报告),其中早期CT检查组37例(24.7%)、非早期CT检查组56例(18.9%)。
第一次CT检查时共发现远处转移49例,其中早期CT检查组10例(6.7%),转移发生在肝脏5例、肺3例、骨2例;Ⅱ期1例、Ⅲ期9例。非早期CT检查组39例(13.1%),18例肝脏转移、13例肺转移、3例非区域淋巴结转移、2例腹腔种植、1例骨转移、2例肝肺同时转移;Ⅱ期12例、Ⅲ期27例。
两组比较,非早期CT检查组和早期CT检查组最终出现转移患者的比例差异无统计学意义(χ2=2.043,P=0.153);但是在第一次CT检查时,非早期CT检查组比早期CT检查组检出更多转移患者(χ2=4.267,P=0.039);而按分期来看,非早期CT检查组Ⅱ期患者(χ2=2.290,P=0.130)和Ⅲ期患者(χ2=2.656,P=0.103)比例均高于早期CT检查组,但差异无统计学意义。
2.3 转移灶的大小和数目比较 通过对第一次CT检查发现的49例远处转移灶秩和分析发现(图1):早期CT 检查组转移灶长径和[(9.5,36.75)vs(18.75,94.5);Z=-2.642,P=0.008] 小于非早期CT 检查组,但是二者转移灶数目[(1,3.75)vs(1,6.50);Z=-1.117,P=0.264]与最长径[(4,24.5)vs(12,32.0);Z=-1.938,P=0.053]差异无统计学意义。
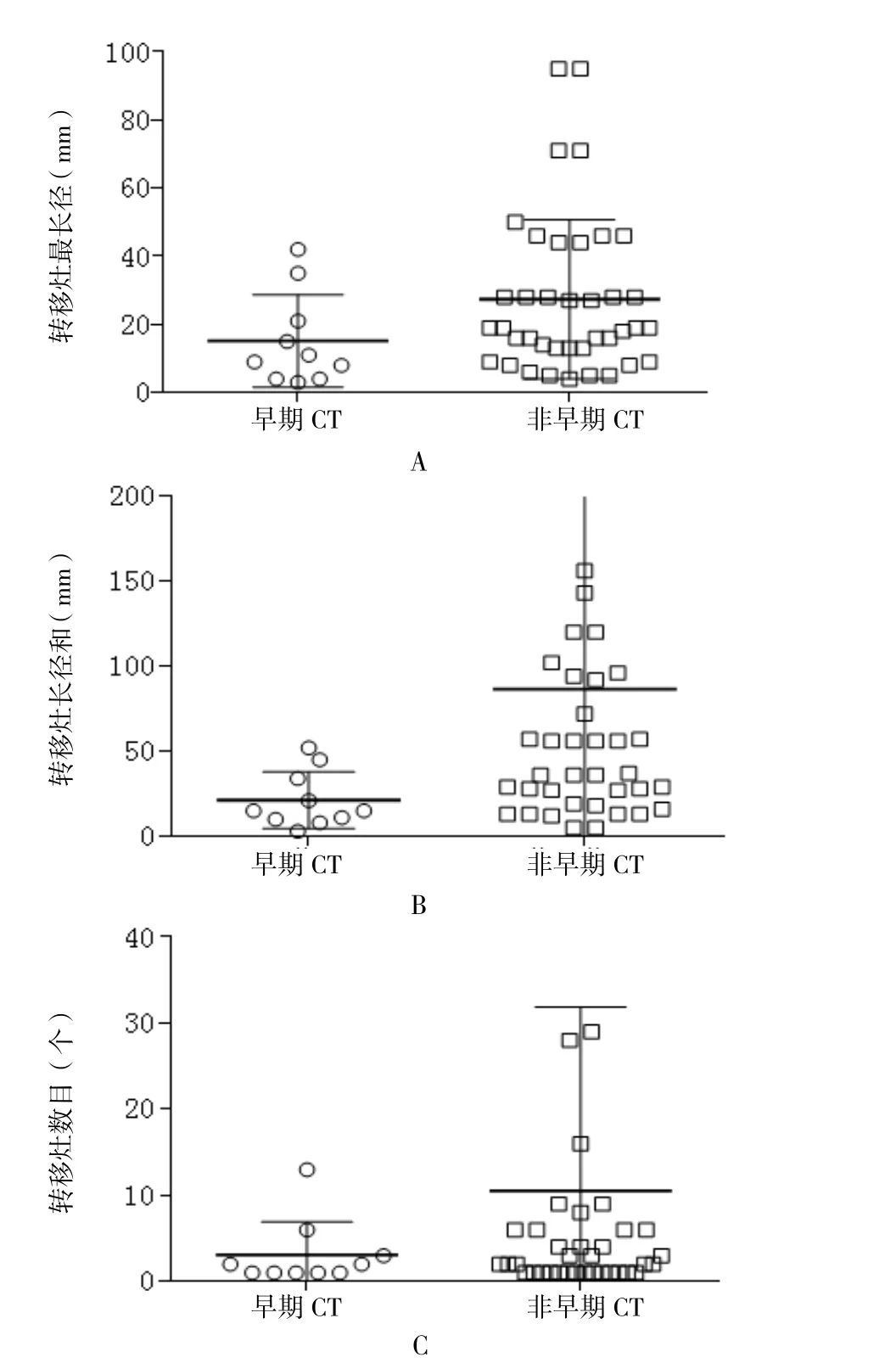
图1 早期CT检查组和非早期CT检查组结直肠癌患者转移灶大小、数目和最长径比较
2.4 对于转移灶的补救手术 早期CT检查组10例转移患者中,3例接受了潜在根治目的的补救手术,3例均为Ⅲ期;1例单发的肺转移患者接受了肺转移灶的楔形切除(图2),并随后接受化疗;1例肝转移接受肝转移瘤切除术,但是患者5个月后再次出现肝内转移,随后接受了经皮射频消融治疗;1例出现了肝单发转移,并接受了肝转移瘤切除(图3)和随后的化疗;另有1例肺转移患者可进行补救手术,但是患者拒绝手术治疗。

图2 肺单发转移患者肺楔形切除术前后CT成像

图3 肝单发转移患者肝切除术前后CT成像
非早期CT检查组39例转移患者中14例(肝转移9例,肺转移5例)接受了潜在根治目的的补救手术,其中,Ⅱ期有6例(6/12),Ⅲ期8例(8/27)。
两组比较,非早期CT检查组和早期CT检查组总的可再手术率差异无统计学意义(35.9%vs30.0%;χ2=0.122,P=0.727);Ⅲ期患者中,非早期CT检查组和早期CT检查组的可补救手术率差异无统计学意义(29.6%vs33.3%;χ2=0.044,P=0.853)。
2.5 生存分析 截至随访结束,中位随访时间为50.7个月(7.3~63.9个月),随访超过4年的有312例(69.8%),失访19例(4.2%),随访期间死亡138例,生存期最短的一位患者术后7.3个月死于化疗不良反应。第一次CT发现转移的患者至随访结束存活的仅有7例(早期CT组1例,非早期CT组6例;无瘤存活5例,带瘤存活2例),且均为接受了再次手术者。所有患者4年总生存率为64.9%。
非早期CT检查组4年总生存率高于早期CT检查组,但两者差异无统计学意义(70.4%vs66.7%;χ2=2.032,P=0.150;图 4)。
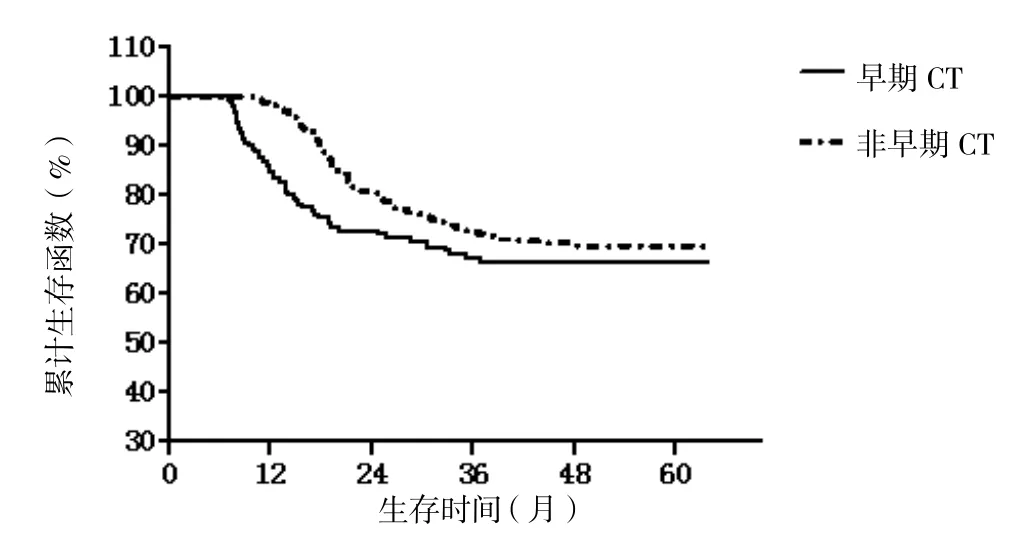
图4 早期CT检查组与非早期CT检查组累积生存函数
3 讨 论
结直肠癌根治术后最常见的远处转移器官是肝和肺,而不同于其他常见恶性肿瘤的远处转移,局限的结直肠癌肝/肺转移是有可能切除,并被治愈的。有报道显示结直肠癌肝转移瘤R0切除术后的5年总生存率达到33%~58%[13,14],肺转移瘤R0切除术后5年总生存率达21%~64%[15,16]。结直肠癌肝/肺转移能否手术切除与转移灶的大小、数目密切相关,单发、较小的转移灶手术切除难度小,更易达到阴性切缘,对肝、肺功能影响小,切除后患者的预后也更好[17]。目前,接受根治术后的结直肠癌患者最早开始CT检查的时间尚不确定[18]:2005年美国临床肿瘤学会指南推荐结直肠癌根治术后前3年每年接受胸腹CT检查[19];欧洲肿瘤学会推荐对于高危的结肠癌患者前3年每6~12个月接受胸腹CT检查[20];既往研究报道的根治术后第一次CT检查时间也相差较远,从3~12个月不等,且未提及6个月内发现转移的比例及其临床意义[21,22]。
依据肿瘤转移的机理,结直肠癌术后6个月内使用CT早期随访可能发现早期的转移。理论上,由于根治手术将肿瘤原发灶完整切除,所以根治术后出现的转移其“起源”是在手术或手术之前的某个时间。既往有研究发现单个细胞长大到足以被CT分辨只需约6个月[23]。Kim等[24]发现CT上结直肠转移病灶体积增倍的时间约为160 d。这些研究提示结直肠癌术后5~6个月的CT检查有可能发现一些术前就存在,只是未被CT发现的“微转移”。
本研究结果显示术后6个月内和6个月后开始行CT检查的患者临床病理特征无差异,但术后早期CT检查组有症状、体征或CEA异常比例较高,这点符合临床实际,除了临床医师自身习惯外,患者术后感觉不适、门诊发现异常体征、CEA异常都可能是较早开始CT检查的原因。从发现转移上来看,非早期CT检查组发现转移更多,这点也合乎情理。早期CT检查的价值体现在缩短转移灶从出现到被发现的时间,发现体积小、数目少、可切除的转移。本研究结果显示早期CT检查组与非早期CT检查组发现的转移灶数目和转移灶最长径无统计学差异,但早期CT检查组发现的转移灶长径和小于非早期CT检查组。然而,无论总体还是Ⅲ期患者,两组的转移灶可切除率差异无统计学意义,提示术后6个月内行CT检查并不能发现更多适合手术切除的患者。这是因为转移灶的大小并不是决定能否手术切除的唯一因素,转移灶的数目也非常关键;另一方面,目前应用转化治疗可缩小转移灶的体积,使一些原本不可切除的转移灶转化为可切除,所以转移灶大小对能否手术的影响力已经减弱。反而在临床上,很多时候转移灶太多才是不能切除或不能彻底切除的原因。一个10 cm大的肝转移的治疗效果显然好于10个1 cm大的肝转移灶,大的单发转移灶肿瘤多呈局部膨胀性生长,而散发、广布的转移则可能提示转移灶多点起源,预后较差。
生存方面,早期行CT检查并未能使患者获益,反而在K-M生存曲线上有劣于非早期CT检查组的趋势。这种生存上的劣势和早期CT检查组的患者组成有一定关系,因为早期CT组第一次CT检查前有症状、CEA升高的患者比例显著高于非早期CT组,而这两点恰恰和差的预后相关,是影响患者生存的混杂因素。这点也质疑早期CT检查,尤其是对预后较好人群(比如Ⅱ期患者)的必要性。
本研究49例患者4年总生存仅为14.3%(7/49),且术后早期CT检查发现转移的10例患者中,仅1例肺转移患者术后长期无瘤生存,其余患者均在补救治疗后出现肿瘤的进展,这说明早期出现转移的患者预后较差。对此可能有多种原因:(1)早期出现转移本身就是结直肠癌肝/肺转移预后差的一个因素。既往关于肝转移瘤切除的研究发现,术后6个月内发生转移的患者预后相对较差[25]。(2)术后6个月正处于患者术后化疗的过程中,在术后辅助化疗过程中出现肿瘤进展也是肿瘤生物学行为较差的一个表现。(3)在较短的时间内接受两次手术,手术对患者造成的损害(麻醉、手术并发症、身体机能的下降)也可能影响患者的预后。(4)本研究所收集患者中,大部分在术前2周内接受了CT检查,短时间内多次CT检查造成的射线暴露可能会对患者的生存造成一定影响,并可能增加二次肿瘤的发生。以上不利因素可能会抵消6个月内行CT检查早期发现转移带来的获益。
结合本研究结果,笔者对Ⅱ/Ⅲ期结直肠癌根治术后随访提出如下建议:(1)无阳性症状、体征,CEA无升高患者(尤其是Ⅱ期)术后6个月内无需CT/磁共振成像(magnetic resonance imaging,MRI)检查;(2)有阳性症状、体征,CEA持续升高患者,可先接受低强度的检查(如B超等),如果有阳性发现,再行胸腹CT/MRI或者正电子发射计算机断层显像(positron emission tomography,PET)检查。另外,本研究也存在其局限性:(1)本研究是在单一中心所做的回顾性研究,由于接诊医师的治疗理念不同,不是所有患者都在同一规律的时间接受同一CT机的检查;(2)患者围手术期的(新)辅助放化疗策略不统一;(3)患者转移灶能否补救手术,不同接诊医师可能会有不同的判断,会导致治疗策略的不同,转移灶的可切除率也差别较大;(4)病例组成的不均衡可能会对分析结果产生一定影响。因此,今后需要更多病例数的前瞻性、随机、对照研究来印证本研究结果。
[1]Hwang M R, Park J W, Kim D Y,et al. Early intrapulmonary recurrence after pulmonary metastasectomy related to colorectal cancer [J]. Ann thorac surg, 2010, 90(2): 398-404. DOI: 10.1016/j.athoracsur.2010.04.058.
[2]Chau I, Allen M J, Cunningham D,et al. The value of routine serum carcino-embryonic antigen measurement and computed tomography in the surveillance of patients after adjuvant chemotherapy for colorectal cancer [J]. J Clin Oncol, 2004, 22(8): 1420-1429. DOI: 10.1200/JCO.2004.05.041.
[3]Cunningham D, Atkin W, Lenz H J,et al. Colorectal cancer [J]. Lancet, 2010, 375(9719): 1030-1047. DOI:10.1016/S0140-6736(10)60353-4.
[4]Simmonds P C. Palliative chemotherapy for advanced colorectal cancer: Systematic review and meta-analysis.Colorectal cancer collaborative group [J]. BMJ, 2000, 321(7260): 531-535.
[5]Seymour M T, Stenning S P, Cassidy J. Attitudes and practice in the management of metastatic colorectal cancer in britain. Colorectal cancer working party of the UK Medical Research Council [J]. Clin Oncol (R Coll Radiol),1997, 9(4): 248-251.
[6]Wang T, Cui Y, Huang W S,et al. The role of postoperative colonoscopic surveillance after radical surgery for colorectal cancer: A prospective, randomized clinical study[J]. Gastrointest Endosc, 2009, 69(3 Pt 2): 609-615.DOI: 10.1016/j.gie.2008.05.017.
[7]Mitry E, Fields A L, Bleiberg H,et al. Adjuvant chemotherapy after potentially curative resection of metastases from colorectal cancer: A pooled analysis of two randomized trials [J]. J Clin Oncol, 2008, 26(30): 4906-4911. DOI: 10.1200/JCO.2008.17.3781.
[8]Fora A, Patta A, Attwood K,et al. Intensive radiographic and biomarker surveillance in stage ii and iii colorectal cancer [J]. Oncology, 2012, 82(1): 41-47. DOI: 10.1159/000333855.
[9]Rodriguez-Moranta F, Salo J, Arcusa A,et al. Postoperative surveillance in patients with colorectal cancer who have undergone curative resection: A prospective, multicenter,randomized, controlled trial [J]. J Clin Oncol, 2006, 24(3):386-393. DOI: 10.1200/JCO.2005.02.0826.
[10]Watanabe I, Arai T, Ono M,et al. Prognostic factors in resection of pulmonary metastasis from colorectal cancer[J]. Br J Surg, 2003, 90(11): 1436-1440. DOI: 10.1002/bjs.4331.
[11]Welter S, Jacobs J, Krbek T,et al. Prognostic impact of lymph node involvement in pulmonary metastases from colorectal cancer [J]. Eur J Cardiothorac Surg, 2007, 31(2): 167-172. DOI: 10.1016/j.ejcts.2006.11.004.
[12]Renehan A G, Egger M, Saunders M P,et al. Impact on survival of intensive follow up after curative resection for colorectal cancer: Systematic review and meta-analysis of randomised trials [J]. BMJ, 2002, 324(7341): 813.
[13]Are C, Gonen M, Zazzali K,et al. The impact of margins on outcome after hepatic resection for colorectal metastasis[J]. Ann Surg, 2007, 246(2): 295-300. DOI: 10.1097/SLA.0b013e31811ea962.
[14]Jagad R B, Koshariya M, Kawamoto J,et al. Management of rectal cancer: Strategies and controversies [J]. Hepatogastroenterology, 2008, 55(81): 82-92.
[15]Ogata Y, Matono K, Hayashi A,et al. Repeat pulmonary resection for isolated recurrent lung metastases yields results comparable to those after first pulmonary resection in colorectal cancer [J]. World J Surg, 2005, 29(3):363-368. DOI: 10.1007/s00268-004-7537-7.
[16]Ike H, Shimada H, Ohki S,et al.Resultsof aggressive resection of lung metastases from colorectal carcinoma detected by intensive follow-up [J]. Dis Colon Rectum,2002, 45(4): 468-465.
[17]Altendorf-Hofmann A, Scheele J. A critical review of the major indicators of prognosis after resection of hepatic metastases from colorectal carcinoma [J]. Surg Oncol Clin N Am, 2003, 12(1): 165-192.
[18]Pfister D G, Benson A B, Somerfield M R. Surveillance strategies after curative treatment of colorectal cancer [J]. N Engl J Med, 2004, 350(23): 2375-2382. DOI: 10.1056/NEJMcp010529.
[19]Desch C E, Benson A B, Somerfield M R,et al. Colorectal cancer surveillance: 2005 update of an American society of clinical oncology practice guideline [J]. J Clin Oncol, 2005, 23(33): 8512-8519. DOI: 10.1200/JCO.2005.04.0063.
[20]Labianca R, Nordlinger B, Beretta G D,et al. Primary colon cancer: ESMO clinical practice guidelines for diagnosis,adjuvant treatment and follow-up [J]. Ann Oncol, 2008, 19(2): 29-30. DOI: 10.1093/annonc/mdq168.
[21]Sorensen N F, Jensen A B, Wille-Jorgensen P,et al. Strict follow-up programme including CT and 18F-FDG-PET after curative surgery for colorectal cancer [J]. Colorectal Dis, 2010, 12(10 Online): e224-e228. DOI: 10.1111/j.1463-1318.2009.02150.x.
[22]Ohlsson B, Breland U, Ekberg H,et al. Follow-up after curative surgery for colorectal carcinoma. Randomized comparison with no follow-up [J]. Dis Colon Rectum, 1995,38(6): 619-626.
[23]Poullis M, Littler J, Gosney J. Biology of colorectal pulmonary metastasis: Implications for surgical resection[J]. Interact Cardiovasc Thorac Surg, 2012, 14(2): 140-142. DOI: 10.1093/icvts/ivr050.
[24]Kim E Y, Lee J I, Sung Y M,et al. Pulmonary metastases from colorectal cancer: Imaging findings and growth rates at follow-up ct [J]. Clin Imaging, 2012, 36(1): 14-18.DOI: 10.1016/j.clinimag.2011.04.018.
[25]Malik H Z, Gomez D, Wong V,et al. Predictors of early disease recurrence following hepatic resection for colorectal cancer metastasis [J]. Eur J Surg Oncol, 2007, 33(8):1003-1009. DOI: 10.1016/j.ejso.2007.01.005.
