伴矿景天叶片愈伤组织诱导及植株再生
2018-06-22桂和荣
张 路,丁 晗,桂和荣
(1.安徽理工大学 地球与环境学院,安徽 淮南 232001;2.浙江农林大学 农业与食品科学学院,浙江杭州 311300)
伴矿景天Sedum plumbizincicola是景天科Crassulaceae景天属Sedum的新种,多年生肉质草本,以无性繁殖为主;适应性广,生物量大,生长速度快,在中国大部分地区均可正常生长[1]。作为一种新的锌、镉超富集植物[2],目前对伴矿景天重金属耐受和解毒的研究较多,主要集中在植株对重金属的响应和耐性机制及细胞生理等方面[3-4];对于重金属对蛋白质表达的影响、重金属胁迫下基因的调控及其与信号转导途径的关系等分子机制的研究甚少,目前,对伴矿景天再生体系的研究鲜有报道,伴矿景天再生体系的建立是基因枪法、农杆菌介导法遗传转化的基础,更是研究其重金属耐受和解毒分子机制、培育优良新品种的重要途径。现以伴矿景天幼嫩叶片为材料,研究了不同植物生长调节剂组合对伴矿景天再生培养的影响,以期为建立稳定的遗传转化体系提供良好的受体材料。
1 材料与方法
1.1 试验材料
伴矿景天(叶片)来自浙江农林大学农业与食品科学学院人工气候室。基本培养基为添加了300.00 mg·L-1水解酪蛋白的 MS(Murashige and Skoog)培养基, 同时添加 30.00 g·L-1蔗糖、7.00 g·L-1琼脂,pH 5.8。
1.2 试验方法
1.2.1 外植体处理 采集新鲜幼嫩的伴矿景天叶片,自来水冲洗20 min左右,转移到超净工作台上操作。用体积分数75.0%的乙醇消毒30 s,无菌水冲洗1~2次;有效氯质量浓度1.5%的次氯酸钠消毒10 min,无菌水冲洗2~3次,在无菌滤纸上晾干。
1.2.2 愈伤组织的诱导和增殖培养 将消毒过的叶片切成5 mm×5 mm的大小,接种至愈伤组织诱导培养基,40 d后统计愈伤组织诱导率。培养基设置参考吴龙华等[5]进行,用以研究2,4-二氯苯氧乙酸(2,4-D)与6-苄基腺嘌呤(6-BA),萘乙酸(NAA)与噻苯隆(TDZ)的组合对叶片愈伤组织诱导的影响。分别用添加 0.30 mg·L-16-BA 和不同质量浓度(0, 1.00, 2.00, 4.00 mg·L-1) 2,4-D, 添加 3.00 mg·L-1NAA和不同质量浓度(0,0.50,0.70,1.00 mg·L-1)TDZ的培养基培养叶片。收集诱导长成的愈伤组织并接种于添加 0.20 mg·L-12,4-D 和 0.05 mg·L-1TDZ的培养基中继续增殖培养。
1.2.3 愈伤组织分化 愈伤组织增殖培养20 d后,切成直径约5 mm的小块,接种于分化培养基,继续培养30 d后统计分化率。分化培养基添加0.10 mg·L-12,4-D和不同质量浓度(0,0.10,0.50,1.00,2.00 mg·L-1) 6-BA。
1.2.4 芽的增殖培养 将生芽的愈伤组织转接于添加0.10 mg·L-12,4-D和不同质量浓度(0.50,1.00 mg·L-1)6-BA的培养基中进行增殖培养。
1.2.5 生根培养 选取增殖良好、长势一致的丛生芽接种于生根培养基中,30 d后统计生根率。生根培养基添加不同质量浓度(0, 0.10, 0.50, 1.00, 2.00 mg·L-1)的吲哚丁酸(IBA)。
1.2.6 练苗与移栽 选取高度大于4 cm,比较粗壮的植株,在培养室开盖培养1周,之后取出再生苗用自来水洗净培养基后,移栽盛有V(蛭石)∶V(泥炭土)=1∶1混合的穴盘中并加盖保湿,1周之后开盖。
1.2.7 培养条件 培养温度均为(25±2)℃。愈伤组织的诱导和增殖培养在暗培养条件下进行,芽的诱导、增殖培养和生根诱导在光照强度为3 000 lx,光照16 h/黑暗8 h条件下培养。
1.3 数据统计分析
实验进行3次生物学重复,数据用Excel 2007整理,SPSS 17.0分析,Duncan法作方差分析。愈伤组织诱导率=(诱导出愈伤组织的叶片数/接种总叶片数)×100%,分化率=(分化出不定芽的愈伤组织数/愈伤组织总数)×100%,繁殖系数=(新生芽总数/接种芽数)×100%,根诱导率=(出根不定芽数/不定芽总数)×100%。
2 结果与分析
2.1 2,4-D与6-BA,NAA与TDZ的组合对愈伤组织诱导的影响
2,4-D在诱导愈伤组织中起着重要作用。培养基中只添加0.30 mg·L-16-BA,结果发现无愈伤组织产生;在添加2,4-D的培养基中,叶片生长10 d左右即开始膨大,30 d左右开始产生愈伤组织。2,4-D质量浓度对愈伤组织诱导率有影响,当2,4-D质量浓度从1.00 mg·L-1升高到2.00 mg·L-1时,愈伤组织诱导率从92.01%增加到94.91%,但差异不显著(P>0.05);当达 4.00 mg·L-1时,愈伤组织诱导率为81.58%,显著下降(表1)。TDZ可以促进愈伤组织的诱导,只添加3.00 mg·L-1NAA的培养基中,叶片多数分化出根,愈伤组织诱导率仅为4.67%;同时添加0.50~1.00 mg·L-1TDZ可以显著提高愈伤组织的诱导率(P<0.05), TDZ 质量浓度为 0.50 mg·L-1时诱导率最高, 为 66.82%(表 1)。
新生的愈伤组织通常有2种形态,一种是淡黄色透明型,一种为白色致密型;有研究认为,淡黄色透明状愈伤组织更有利于分化[6]。本研究发现,在添加 0.30 mg·L-16-BA 和 1.00 mg·L-12,4-D 的培养基中,叶片边缘多产生块状的淡黄色透明愈伤组织,体积大,生长快(图1A,图1B);而在添加 0.30 mg·L-16-BA 和 2.00~4.00 mg·L-12,4-D, 3.00 mg·L-1NAA 和 0.50~1.00 mg·L-1TDZ的培养基中叶片边缘多产生白色致密愈伤组织,体积小,生长慢。这说明添加0.30 mg·L-16-BA和1.00 mg·L-12,4-D的培养基对诱导伴矿景天叶片愈伤组织的质量更佳。

表1 不同植物生长调节剂组合对愈伤组织诱导的影响Table 1 Effects of different concentrations of plant growth regulators on callus induction from leaf
2.2 不同质量浓度的6-BA对愈伤组织分化的影响
增殖培养20 d后,挑选淡黄色透明状愈伤组织转接于分化培养基上。观察发现愈伤组织在光下逐渐由淡黄色变成绿色,表面长出突起,逐渐形成黄绿色的芽丛(图lC,图 1D)。未添加 6-BA,只添加 0.10 mg·L-12,4-D的培养基中,愈伤组织不能分化(表2);随着6-BA质量浓度的升高,愈伤组织分化率也升高,6-BA质量浓度为1.00 mg·L-1和 2.00 mg·L-1时 分 化 率 为27.44%和21.85%,两者无显著差异。6-BA的质量浓度影响愈伤组织的分化,伴矿景天愈伤组织分化最佳培养基为 1.00 mg·L-16-BA+0.10 mg·L-12,4-D。
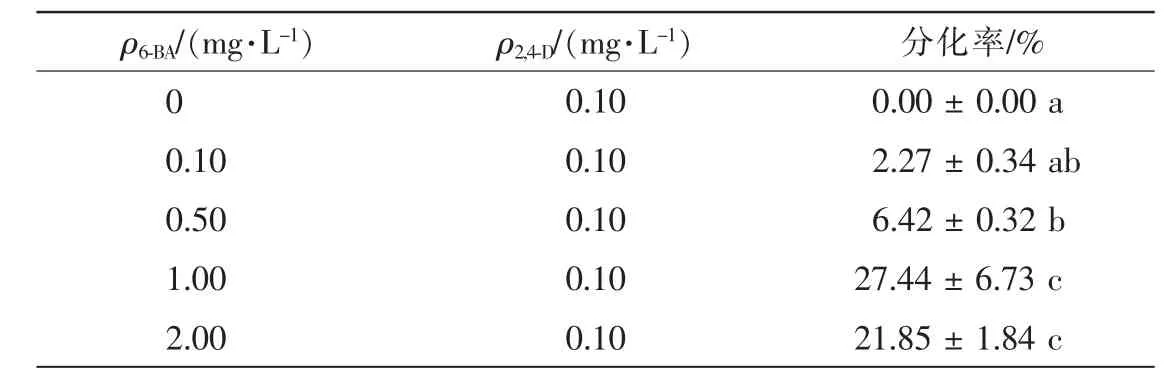
表2 不同质量浓度的6-BA对愈伤组织分化的影响Table 2 Effects of different concentrations of 6-BA on bud formation of callus
2.3 不同质量浓度6-BA对不定芽增殖的影响
出芽的愈伤组织转接于增殖培养基中,添加0.10 mg·L-12,4-D和不同质量浓度(0.50,1.00 mg·L-1)6-BA。培养30 d后,芽丛膨大,2种培养基中,不定芽的繁殖系数都在8.0以上;6-BA质量浓度为0.50 mg·L-1时,芽生长健壮、叶片鲜绿(图1E),6-BA质量浓度为1.00 mg·L-1时增殖效果更加明显,但是芽细小,生长较弱 (图1F)。因此,伴矿景天最佳不定芽增殖培养基为0.10 mg·L-12,4-D+0.50 mg·L-16-BA。
2.4 IBA对伴矿景天生根的影响
伴矿景天易生根,在添加不同质量浓度(0,0.10,0.50,1.00,2.00 mg·L-1)IBA的培养基中根诱导率都能达100%,但影响根和植株的生长状态。在添加1.00,2.00 mg·L-1IBA的培养基中,根较粗壮,植株生长快且健壮(图1G,图1H);在IBA质量浓度小于0.50 mg·L-1的培养基中,根较细小,植株矮小,生长势差。添加1.00~2.00 mg·L-1IBA的培养基是适宜伴矿景天愈伤组织的生根培养基(图1I)。
3 结论与讨论
本研究以伴矿景天幼嫩叶片为外植体,以添加了300 mg·L-1水解酪蛋白的MS培养基为基本培养基,研究不同植物生长调节剂组合对伴矿景天愈伤组织诱导及分化的影响,建立其再生体系。结果表明:添加1.00~2.00 mg·L-12,4-D和0.30 mg·L-16-BA的培养基对愈伤组织诱导效果最佳,诱导率为92.01%; 添加0.10 mg·L-12,4-D和 1.00 mg·L-16-BA对愈伤组织分化效果最佳,分化率为27.44%。添加 0.10 mg·L-12,4-D 和 0.50~1.00 mg·L-16-BA 最适宜芽增殖; 添加 1.00~2.00 mg·L-1IBA 最适宜生根。

图1 伴矿景天叶片愈伤组织的诱导及植株再生Figure 1 Callus induction and shoot regeneration from leaf of Sedum plumbizincicola
植物的不同器官在组织培养过程中诱导形成愈伤组织的难易程度存在差异[6]。本研究也尝试用幼嫩茎段作为外植体,在添加0.30 mg·L-16-BA和1.00~4.00 mg·L-12,4-D的培养基中生长时比叶片更易被诱导出愈伤组织。但是茎段消毒不如叶片彻底,污染率较高,茎段材料相对较少;同时茎段在培养基中不如叶片膨大生长得快,愈伤组织的产生量比叶片少很多。
植物生长调节剂在植物可塑性发育中起着很直接和非常重要的作用[7]。伴矿景天叶片在添加较高质量浓度(1.00~4.00 mg·L-1)的生长素培养基中被诱导形成愈伤组织,愈伤组织在添加较高质量浓度(1.00~2.00 mg·L-1)的细胞分裂素培养基中分化出不定芽。 这与刘勇军等[8]对东南景天 Sedum alfredii组织培养的研究结果一致。1.00~4.00 mg·L-12,4-D均可高效诱导愈伤组织发生(诱导率>81.58%),但质量浓度为2.00和4.00 mg·L-1时愈伤组织质量差,多呈现白色致密的形态,生长慢,不易分化;当质量浓度为1.00 mg·L-1时,愈伤组织多为淡黄色透明状,生长快,愈伤组织较易分化。这可能是因为2,4-D对植物细胞有一定的毒害作用[9]。只添加3.00 mg·L-1NAA的培养基对叶片愈伤组织诱导率仅为4.67%,添加0.50~1.00 mg·L-1TDZ可以显著提高愈伤组织的诱导率(>46.74%),与李焕秀等[10]发现外源 TDZ能诱导黄芩Scutellaria baicalensis外植体幼茎、子叶柄和下胚轴产生愈伤组织的结果一致。
暗培养处理可以促进不定芽的再生[11-14],其原因可能是暗培养条件会减缓生长素的降解过程,有助于调节外植体内生长素和细胞分裂素的比例,从而有助于愈伤组织的器官形成[15]。本研究中分化实验并未进行暗处理,在添加1.00 mg·L-16-BA和 0.10 mg·L-12,4-D的培养基中分化率最高,为27.44%。另外,本研究尝试将愈伤组织接种于添加0.10 mg·L-12,4-D和2.00 mg·L-1玉米素(ZT)的分化培养基中,光下培养30 d,结果发现分化率小于5.00%;将其转到暗处培养,分化率达17.00%。这说明暗培养同样可以促进伴矿景天愈伤组织的分化。因此,今后将研究暗培养条件下6-BA,ZT,TDZ等外源植物生长调节剂对愈伤组织分化的影响,以期提高分化率。
4 参考文献
[1]吴龙华,周守标,毕德,等.中国景天科植物一新种:伴矿景天[J].土壤,2006,38(5):632-633.WU Longhua,ZHOU Shoubiao,BI De,et al.Sedum plumbizincicola,a new species of the crassulaceae from Zhejiang,China [J].Soils,2006,38(5):632 - 633.
[2]MA Ying,OLIVEIRA R S,NAI Fengjiao,et al.The hyperaccumulator Sedum plumbizincicola harbors metal-resistant endophytic bacteria that improve its phytoextraction capacity in multi-metal contaminated soil [J].J Environ Manage,2015,156(1):62 - 69.
[3]HU Pengjie,YIN Yonggen,ISHIKAWA S,et al.Nitrate facilitates cadmium uptake,transport and accumulation in the hyperaccumulator Sedum plumbizincicola [J].Environ Sci Pollut Res,2013,20(9):6306 - 6316.
[4]MA Ying,ZHANG Chang,OLIVEIRA R S,et al.Bioaugmentation with endophytic bacterium E6S homologous to Achromobacter piechaudii enhances metal rhizoaccumulation in host Sedum plumbizincicola [J].Front Plant Sci,2016,7:75.doi:10.3389/fpls.2016.00075.
[5]吴龙华,贲爱玲,谭维娜,等.锌镉超积累植物伴矿景天的组织培养育苗方法:中国,201010228740.2[P].2010-07-15.
[6]范诸平,王立雪,杨东,等.重瓣长寿花组织培养再生体系的建立[J].东北林业大学学报,2016,44(7):54-58.FAN Zhuping,WANG Lixue,YANG Dong,et al.Establishing the regeneration system for double-flowered Kalanchoe blossfeldiana [J].J Northeast For Univ,2016,44(7):54 - 58.
[7]SAUNDERS J W,BINGHAM E T.Growth regulator effects on bud initiation in callus cultures of Medicago sativa[J].Am J Bot,1975,62(8):850 - 855.
[8]刘勇军,冯英,杨肖娥.东南景天的组织培养和快速繁殖[J].植物生理学通讯,2007,43(3):514.LIU Yongjun,FENG Ying,YANG Xiaoe.Tissue culture and rapid propagtion of Sedum alfredii Hance [J].Plant Physiol Commun,2007,43(3):514.
[9]李代丽,康向阳.植物愈伤组织培养中内外源激素效应的研究现状与展望[J].生物技术通讯,2007,18(3):546-548.LI Daili,KANG Xiangyang.The status and prospect of exodogenous hormone and endogenous hormone impact in plant callus tissue culture [J].Lett Biotechnol,2007,18(3):546 - 548.
[10]李焕秀, MURCH S J, SAXENA P K.TDZ 诱导的黄芩(Scatellaria baicalensis Georgi)外植体枝再生研究[J].四川农业大学学报,2000,18(4):325-329.LI Huanxiu,MURCH S J,SAXENA P K.Study of thidiazuron-induced de novo shoot organogenesis on huangqin(Scutellaria baicalensis Georgi) explants [J].J Sichuan Agric Univ,2000,18(4):325 - 329.
[11]王鲁北,张春红,王小敏,等.黑莓品种 ‘Arapaho’离体叶片不定芽诱导影响因素分析及再生体系建立[J].植物资源与环境学报,2012,21(1):47-51.WANG Lubei,ZHANG Chunhong,WANG Xiaomin,et al.Analysis of influence factors of adventitious bud induction from in vitro leaves of blackberry cultivar ‘Arapaho’ and establishment of regeneration system [J].J Plant Resour Environ,2012,21(1):47 - 51.
[12]王烨,顾兴芳,张圣平.暗培养对黄瓜子叶节再生频率及其相关酶活性和可溶性蛋白含量的影响[J].西北植物学报, 2011, 31(9): 1793 - 1798.WANG Ye,GU Xingfang,ZHANG Shengping.Effect of dark culture on enzyme and soluble protein variance during cucumber cotyledon node regeneration [J].Acta Bot Boreal-Occident Sin,2011, 31(9):1793 - 1798.
[13]邢文,包颖,丁萌,等.玫瑰叶片直接再生及其影响因素[J].华中农业大学学报,2014,33(1):29-34.XING Wen,BAO Ying,DING Meng,et al.Factors affecting direct organogenesis from unexpanded leaf lets of Rosa rugosa [J].J Huazhong Agric Univ,2014,33(1):29 - 34.
[14]赵银萍,胡洁,张九东.杂交景天组织培养和植株再生[J].中药材,2007,30(9):1059-1061.ZHAO Yinping,HU Jie,ZHANG Jiudong.Tissue culture and regeneration of Sedum hybridum [J].J Chin Med Mater,2007,30(9):1059 - 1061.
[15]苗红梅,琚铭,魏利斌,等.芝麻愈伤组织诱导与植株再生体系的建立[J].植物学报,2012,47(2):162-170.MIAO Hongmei,JU Ming,WEI Libin,et al.Establishment of sesame callus induction and shoot regeneration system [J].Chin Bull Bot,2012,47(2):162 - 170.
