YAP1基因敲除对胰腺癌L3.6细胞增殖及迁移能力的影响
2018-06-21陈千杰张金三郭强董晶莱郭丽莎李校堃
陈千杰,张金三,郭强,董晶莱,郭丽莎,李校堃
(温州医科大学 药学院,浙江 温州 325035)
胰腺癌是恶性肿瘤,患者5年生存率不足5%[1]。 其增殖、侵袭能力极强,往往在发病早期即发生转移,是治疗的难点[2-4]。Yes-关联蛋白1(Yesassociate protein 1,YAP1)作为Hippo通路的关键转录辅助因子在胰腺癌的发生发展中有重要作用[5],但相关机制仍不明了。YAP1具有调控细胞存活和增殖作用,参与癌细胞上皮-间质转化(epithelial-mesenchymal transitions,EMT)[6]。EMT是肿瘤转移的关键环节[7-8]。YAP1通过与转录因子结合参与胚胎发育进程[7,9-12],在胚胎发育中起重要作用的因子,在癌变过程中往往被激活[13-14]。 当抑制KRAS后,会上调YAP1的表达,使YAP1直接参与肿瘤的形成[15-17]。本研究构建敲除YAP1基因的L3.6细胞,检测YAP1对L3.6细胞的增殖及迁移能力的影响。
1 材料和方法
1.1 材料 人胰腺癌细胞株L3.6购自美国模式培养物集存库;pSpCas9(BB)-2A-Puro V2载体购自美国Addgene公司;DMEM培养液、胰蛋白酶、1%青链霉素、胎牛血清购于美国Gibco公司;RNA提取试剂购于美国Invitrogen公司;EndoFectinTMMax转染试剂购自广州复能基因有限公司;考马斯亮蓝购自上海碧云天生物公司;YAP(D8H1X)XP Rabbit抗体购自美国Cell Signaling Technology公司,GAPDH 单克隆抗体购自英国Abcam公司;Western blot相关试剂、羊抗小鼠IgG二抗与羊抗兔IgG二抗购自武汉博士德生物科技有限公司;正置、倒置荧光显微镜购自日本尼康公司;PCR仪、电泳仪、电泳槽、化学发光成像仪购自美国Bio-Rad公司,BD Accuri C6流式细胞仪购自美国BD公司;NanoDrop 2000C超微量分光光度计购自赛默飞世尔科技(中国)有限公司;酶联免疫检测仪购自美谷分子仪器(上海)有限公司。
1.2 方法
1.2.1 细胞培养:L3.6细胞在含有10%胎牛血清和1%青链霉素的DMEM培养基中培养,常规置于37℃、5% CO2环境下生长。细胞融合至80%左右时常规传代。
1.2.2YAP1敲除载体的构建:采用CRISPR-Cas9技术在L3.6细胞中敲除YAP1基因。首先针对YAP1基因的第1个外显子序列,筛选出最佳的先导序列:5’-CATCAGATCGTGCACGTCCG-3’,并据此设计合成用于pSpCas9-KOYAP1构建的寡聚核苷酸序列:oligo1: 5’-CACCGCATCAGATCGTGCACGTCCG-3’,oligo2:5’-AAA CCGGACGTGCACGATCTGATGC-3’。经磷酸化修饰,并退火成双链后,连接克隆到BbsI酶切和去磷酸化修饰的pSpCas9(BB)-2A-Puro V2载体。转化到感受态的大肠杆菌DH5α后,挑单克隆提取质粒和测序分析,验证得到正确克隆的质粒。
1.2.3 筛选YAP1敲除的L3.6稳定细胞株:用CRISPRCas9-YAP1质粒转染L3.6细胞24h后,经过嘌呤霉素筛选48h,再采用有限稀释法,将单细胞悬液按50、100和200个细胞/皿的密度接种于10 cm培养皿,培养14 d,让肿瘤细胞生长成单克隆团,然后用克隆环定点消化各个克隆并接种至24孔板中,细胞生长至布满24孔板底75%时收集细胞,扩大培养以后,裂解获得细胞蛋白,应用Western blot法检测L3.6细胞的YAP1蛋白表达以验证YAP1敲除是否成功。
1.2.4 Western blot检测蛋白表达:分别收集WT组细胞(L3.6野生型细胞)和YAP1-KO组细胞(已敲除内源YAP1基因的L3.6细胞),细胞裂解液4℃裂解,12 000r/min离心,提取各组细胞总蛋白,用Bradford法测量蛋白浓度。变性后的蛋白样本进行10% SDS-PAGE凝胶电泳,用孔径0.45 μm的PVDF膜进行转膜,封闭后用YAP1(1:1 000)、GAPDH(1:5 000)抗体杂交。TBST洗膜3次/7min,再加入相应的辣根过氧化物酶标记的羊抗兔(鼠)二抗(1:10 000)室温摇床孵育1h,TBST洗3次后,ECL化学发光法显影,凝胶成像系统曝光并分析结果。
1.2.5 MTT法检测细胞增殖情况:分别取对数生长期的WT组及YAP1-KO组细胞,铺到60 mm培养皿中,待细胞汇合到70%~80%后,胰酶消化,用培养基重悬细胞并计数,将稀释好的细胞悬液以每孔2×103个细胞接种于96孔板,每组细胞做6个复孔。放置于37℃、5% CO2培养箱中分别培养1、2、3、4、5、6 d后,每孔加入10μL MTT溶液(5 mg/mL),在培养箱中继续培养4h后,吸弃上清,加入150μL DMSO溶液,于490 nm波长时测各孔吸光度值并记录结果。重复实验3次,取均值。
1.2.6 EdU细胞标记和流式细胞仪检测细胞周期:分别提前1 d将WT组及YAP1-KO组细胞以1×105个/mL浓度接种于培养皿中,以调整为细胞最优状态,待细胞融合度达70%~80%时,用不含EDTA的胰蛋白酶消化分装(操作过程要轻柔),离心,4%多聚甲醛固定20min后,2 mg/mL甘氨酸中和5min,0.5% Triton X-100渗透后,加500μL的1×Apollo®染色反应液,重悬细胞,避光室温孵育10min后,1 500r/min 离心5min,弃染色反应液。0.5% Triton X-100渗透剂室温清洗1~3次,PBS重悬,置于流式细胞仪中检测,观察增殖细胞的染色情况。
1.2.7 细胞划痕实验检测细胞迁移能力:提前用马克笔在6孔板背后,每孔均匀画3条等距离横线,然后每孔铺约7×105个细胞,待次日观察细胞已长满皿底,用10μL小枪头比着直尺垂直于背后的横线划痕。PBS洗细胞3次,去除脱了漂浮的细胞,加入无血清培养基,放入37℃、5% CO2细胞培养箱。按第1、第2、第3天的同一时间点取出6孔板,置于显微镜下观察同一位置细胞迁移变化,最后拍照记录。重复本实验3次,取均值。
1.2.8 Transwell实验检测细胞迁移能力:首先消化并收集各组细胞,离心,用无血清培养基重悬并计数,以200μL共1×105个/孔的细胞密度铺至小室的上室。下室内加入500μL含20%胎牛血清的完全培养基,置于37℃、5% CO2细胞培养箱24h。培养结束后取出小室,用棉签小心擦去微孔膜上层未穿过膜的细胞,将小室用PBS浸泡清洗3次/5min, 4%多聚甲醛固定35min,0.1%结晶紫对微孔膜下细胞染色25min,再用PBS浸泡清洗3次/5min,至膜上背景紫色基本消失,用倒置显微镜观察微孔膜。每组设定3个复孔实验,取均值。
1.3 统计学处理方法 采用SPSS18.0软件进行统计分析。计量资料以±s表示,2组间比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 CRISPR-Cas9载体及YAP1敲除细胞株构建 如图1所示,构建的pSpCas9-KOYAP1质粒经测序分析表明插入的序列及位点正确,目的基因YAP1的敲除载 体质粒构建成功。为获得YAP1敲除的稳定细胞系,用上述CRISPR-Cas9质粒转染人胰腺癌细胞系L3.6,筛选后产生的单克隆团(见图2A),分离培养后,获稳定细胞株。经Western blot验证,相对于WT组,YAP1-KO组细胞中的YAP1蛋白表达完全缺失,说明成功获得了YAP1敲除的L3.6稳定细胞株(见图2B)。
2.2 检测敲除YAP1前后细胞增殖能力的变化 为检测YAP1基因敲除对细胞增殖的影响,采用MTT实验构建细胞生长曲线。结果发现,相对于野生型的WT组细胞,YAP1-KO组细胞的增殖速度明显下降,差异有统计学意义(P<0.05),见图3A。进一步采用EdU细胞增殖实验结合流式细胞仪观察细胞周期分布,发现YAP1-KO组及WT组细胞的EdU阳性率,即处于S期的细胞数所占各自总细胞数的比例,分别为37.4%和54.7%,见图3B。此结果表明Cas9敲除YAP1基因表达显著抑制胰腺癌细胞L3.6的增殖能力。

图1 用于YAP1基因敲除的质粒测序图谱(下划线为设计插入的先导序列)
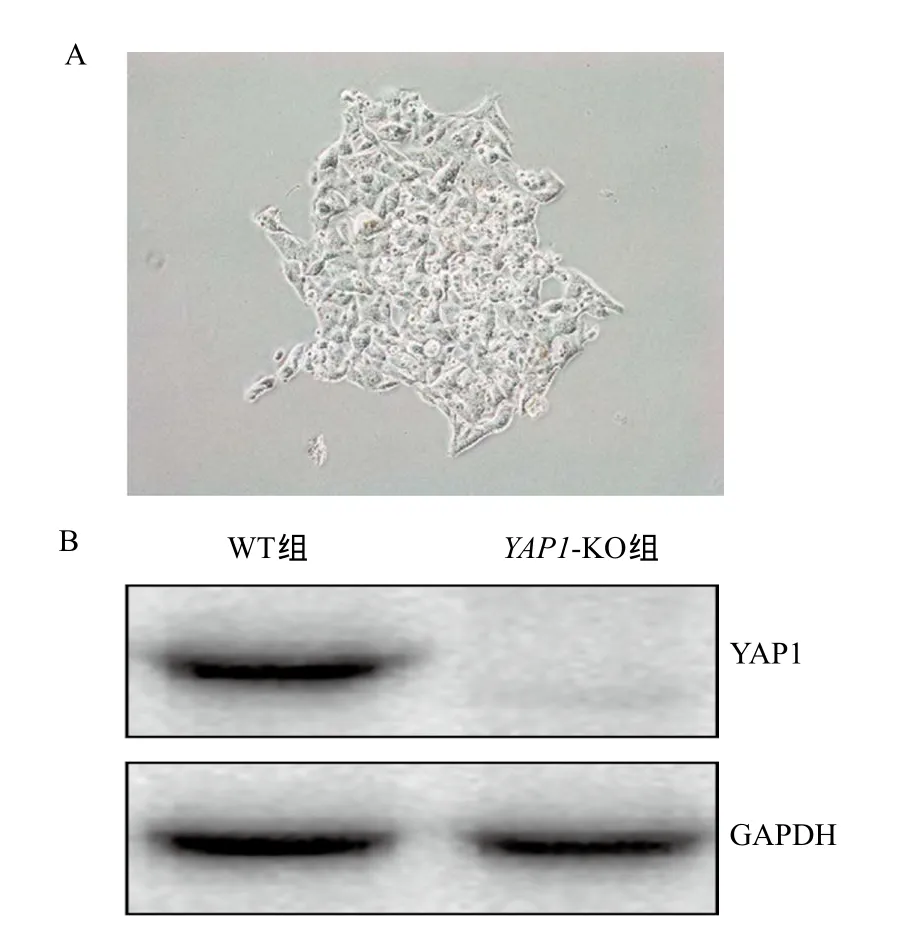
图2 YAP1基因敲除细胞株的构建
2.3 YAP1对胰腺癌细胞体外迁移能力的影响 为了观察YAP1基因敲除对胰腺癌L3.6体外迁移的影响,采用划痕实验来比较细胞的迁移能力。结果发现,WT组在第1、第2、第3天的划痕闭合进程日渐明显,而YAP1-KO组划痕几乎没有闭合,表明WT组细胞的迁移速度随着时间的推进而增加,在第3天达到最大值,但是YAP1-KO组的迁移速度明显下降,几乎丧失迁移能力。2组细胞各时间段对应的迁移情况差异明显(见图4A)。进一步的Transwell实验发现,在所有观察的时间点,YAP1-KO组细胞转移、穿透到下室的细胞数量与WT组比较均显著降低(见图4B)。

图3 比较YAP1敲除前后L3.6细胞的增殖情况
3 讨论
YAP1作为Hippo通路下游的主要效应蛋白之一,在肿瘤发生发展中的作用逐渐被认知。绝大部分的胰腺癌中存在KRAS突变,但研究发现抑制KRAS后,复发的胰腺癌中存在YAP1的过度激活,并且使胰腺癌细胞的侵袭转移能力增强[16-17]。这提示过表达YAP1在胰腺癌复发、恶性化的过程中起重要作用,但是其机制仍不明确。尽管人们已经认识到YAP1参与部分肿瘤细胞增殖及转移的进程,但是对胰腺癌细胞YAP1缺失后的增殖及转移能力的具体变化还鲜有涉及。因此本研究利用CRISPR-Cas9技术构建YAP1敲除的稳定胰腺癌细胞系,通过一系列细胞生物学实验,检测敲除YAP1后对胰腺癌细胞增殖和转移能力的影响。

图4 YAP1敲除对L3.6细胞迁移能力的影响(×10)
CRISPR-Cas9技术是当下热门的基因编辑技术。该技术可以方便、快捷地编辑细胞的基因组,在DNA水平调控目的蛋白的表达、突变[18-19]。在本研究 中,我们设计了针对YAP1的寡聚核苷酸的先导序列,基于pSpCas9(BB)-2A-Puro的载体,构建了CRISPRCas9-YAP1质粒。转染L3.6细胞后,经过抗性筛选和单克隆化以后,成功获得了敲除YAP1基因的L3.6细胞,标记为YAP1-KO细胞株。经验证,其YAP1蛋白已经被完全敲除,且经多次传代后,细胞性状仍保持稳定,能进行下一步的增殖、迁移等生物学功能实验。
细胞的恶性增殖与转移在肿瘤的初发-恶性化过程中起着关键作用[20-21],由于癌细胞增殖速度快,从肿瘤原发灶侵袭近端的正常组织并发生迁移到远端脏器,甚至扩散到全身,因此癌细胞的增殖和迁移能力在肿瘤研究过程中至关重要[22-23]。本课题利用经Cas9技术敲除胰腺癌细胞中YAP1基因的模型,研究YAP1缺失对胰腺癌细胞增殖及迁移能力的影响,为此后进一步解析YAP1在胰腺癌发生发展中的作用及机制研究奠定基础,结果表明YAP1缺失后,能显著抑制胰腺癌L3.6细胞的增殖和迁移能力。EdU是胸腺嘧啶类似物,能在细胞增殖中代替胸腺嘧啶,嵌入复制中的DNA分子内,通过EdU与荧光染料的特异性结合,探测荧光信号,从而检测细胞中DNA的复制活性,计算新增殖的细胞数量。MTT可以被细胞增殖过程中线粒体内的一些脱氢酶还原生成深紫色产物,当细胞增殖数越多,则在570 nm波长吸光度越高,因而被广泛用于监测细胞增殖变化。本研究发现YAP1-KO组L3.6细胞的EdU阳性增殖率(即处于S期的细胞比例)和MTT吸光度(即细胞的相对活性)明显低于WT组的L3.6细胞,表明敲除YAP1后,细胞周期受到阻滞,DNA复制活性、线粒体活性降低,表明YAP1敲除的胰腺癌细胞的增殖能力受到抑制。细胞划痕法可以测定细胞的迁移能力,其借鉴体外细胞致伤愈合模型,在体外培养的单层细胞上,划痕致伤,然后比较各组细胞间的迁移能力。Transwell是在上室接种细胞,下室加入FBS或特定趋化因子如FGF,细胞可能会穿透过聚碳酸酯膜向营养成分高的下室转移,对下室的细胞染色,可直观反映细胞的迁移情况。本研究结果显示YAP1缺失的胰腺癌细胞,其划痕愈合和穿透过膜等迁移能力受到极大地抑制。
综上所述,在胰腺癌L3.6细胞敲除内源YAP1后,其增殖和转移能力明显减弱,这揭示YAP1有望成为治疗胰腺癌的新靶标。
[1] PHUA L C, GOH S, TAI D W M, et al. Metabolomic prediction of treatment outcome in pancreatic ductal adenocarcinoma patients receiving gemcitabine[J]. Cancer Chemother Pharmacol, 2018, 81(2): 277-289.
[2] YUAN Y, LI D, LI H, et al. YAP overexpression promotes the epithelial-mesenchymal transition and chemoresistance in pancreatic cancer cells[J]. Mol Med Rep, 2016, 13(1):237-242.
[3] ZHANG H, VON GISE A, LIU Q, et al. Yap1 is required for endothelial to mesenchymal transition of the atrioventricular cushion[J]. J Biol Chem, 2014, 289(27): 18681-18692.
[4] ZHANG Q, ZHANG Y, PARSELS J D, et al. Fbxw7 deletion accelerates kras(G12D)-driven pancreatic tumorigenesis via yap accumulation[J]. Neoplasia, 2016, 18(11): 666-673.
[5] 史梦婕, 邵松军, 李洁媚, 等. H i p p o通路与肿瘤相关性研究进展[J]. 中国细胞生物学学报, 2014, 36(3): 361-365.
[6] DIEPENBRUCK M, WALDMEIER L, IVANEK R, et al.Tead2 expression levels control the subcellular distribution of Yap and Taz, zyxin expression and epithelial-mesenchymal transition[J]. J Cell Sci, 2014, 127(Pt 7): 1523-1536.
[7] PEI T, LI Y, WANG J, et al. YAP is a critical oncogene in human cholangiocarcinoma[J]. Oncotarget, 2015, 6(19):17206-17220.
[8] VLUG E J, VAN DE VEN R A, VERMEULEN J F, et al.Nuclear localization of the transcriptional coactivator YAP is associated with invasive lobular breast cancer[J]. Cell Oncol(Dordr), 2013, 36(5): 375-384.
[9] SHEN S, GUO X, YAN H, et al. A miR-130a-YAP positive feedback loop promotes organ size and tumorigenesis[J].Cell Res, 2015, 25(9): 997-1012.
[10] WEI H, WANG F, WANG Y, et al. Verteporfin suppresses cell survival, angiogenesis and vasculogenic mimicry of pancreatic ductal adenocarcinoma via disrupting the YAPTEAD complex[J]. Cancer Sci, 2017, 108(3): 478-487.
[11] ZHANG Y, ZHOU M, WEI H, et al. Furin promotes epithelial-mesenchymal transition in pancreatic cancer cells via Hippo-YAP pathway[J]. Int J Oncol, 2017, 50(4): 1352-1362.
[12] ZHU Z M, XU Y F, SU Q J, et al. Prognostic significance of microRNA-141 expression and its tumor suppressor function in human pancreatic ductal adenocarcinoma[J]. Mol Cell Biochem, 2014, 388(1-2): 39-49.
[13] HAN D, BYUN S H, PARK S, et al. YAP/TAZ enhance mammalian embryonic neural stem cell characteristics in a Tead-dependent manner[J]. Biochem Biophys Res Commun,2015, 458(1): 110-116.
[14] HIRATE YSASAKI H. The role of angiomotin phosphorylation in the Hippo pathway during preimplantation mouse development[J]. Tissue Barriers, 2014, 2(1): e28127.
[15] GRETEN F R. YAP1 takes over when oncogenic K-Ras slumbers[J]. Cell, 2014, 158(1): 11-12.
[16] KAPOOR A, YAO W, YING H, et al. Yap1 activation enables bypass of oncogenic Kras addiction in pancreatic cancer[J]. Cell, 2014, 158(1): 185-197.
[17] 宋娟,叶小群. H i p p o-Y A P信号通路为靶点的肿瘤治疗研究进展[J]. 中国肿瘤临床, 2015(17): 876-880.
[18] HSU P D, SCOTT D A, WEINSTEIN J A, et al. DNA targeting specificity of RNA-guided Cas9 nucleases[J]. Nat Biotechnol, 2013, 31(9): 827-832.
[19] RAN F A, HSU P D, LIN C Y, et al. Double nicking by RNA-guided CRISPR Cas9 for enhanced genome editing specificity[J]. Cell, 2013, 154(6): 1380-1389.
[20] 周文媛, 任军, 纪元, 等. N-乙酰氨基半乳糖转移酶6对乳腺癌细胞MC F-7增殖和迁移的影响[J]. 温州医科大学学报, 2017, 47(12): 864-868, 874.
[21] 郑斌, 吴齐全, 周克文, 等. 转录因子S O X 7对前列腺癌P C-3细胞生物学活性的影响及其机制[J]. 温州医科大学学报, 2017, 47(9): 678-682.
[22] ZHANG Q, CHEN X, ZHANG X, et al. Knockdown of TMEM14A expression by RNAi inhibits the proliferation and invasion of human ovarian cancer cells[J]. Biosci Rep,2016, 36(1): e00298.
[23] CHIU K Y, WU C C, CHIA C H, et al. Inhibition of growth,migration and invasion of human bladder cancer cells by antrocin, a sesquiterpene lactone isolated from Antrodia cinnamomea, and its molecular mechanisms[J]. Cancer Lett,2016, 373(2): 174-184.
