猪高致病性蓝耳病病毒和猪大肠杆菌混合感染的诊断
2018-06-21于季申倪宏波
于季申,李 鹏,倪宏波
(黑龙江八一农垦大学动物科技学院,黑龙江 大庆163000)
在集约化中国养猪产业系统疾病呈现传播速度快、范围广的特点。猪消化系统疾病是一种典型的多因素性疾病。近年来,因腹泻死亡的仔猪占仔猪死亡总数的38.9%[1],给养殖场造成较大的经济损失。引起猪消化系统衰竭的病原很多,其中传染性病原是导致猪群高发病率和高死亡率的重要原因之一,为了防止疾病的进一步蔓延,需要对病原进行快速、准确的诊断。
猪蓝耳病(PRRS)是由猪繁殖与呼吸综合征病毒引起的一种猪的高度接触性传染病,不同年龄、品种和性别的猪均可发生,但以妊娠母猪和仔猪最为常见[2]。该病以母猪发生流产,产死胎、弱胎、木乃伊胎以及仔猪呼吸困难、高死亡率等为主要特征,严重危害养猪产业。在2006年夏季,由猪繁殖与呼吸综合征病毒变异毒株引起的“高热综合征”在我国暴发,呈现高发病率和高病死率的特点,成为危害我国养猪业的新疫病之一,我国将其称为“高致病性猪蓝耳病”,列入一类动物疫病[3],且深得各大养猪户日益关注。
大肠杆菌病(E.coli)是指由致病性大肠杆菌引起多种动物不同疾病或病型的统称,主要分为仔猪黄痢、仔猪白痢和猪水肿3种。包括动物的局部性或全身性大肠杆菌感染、大肠杆菌腹泻、败血症和毒血症等[4]。猪感染致病性大肠杆菌时主要分为早发性大肠杆菌病和迟发性大肠杆菌病2种,即仔猪黄痢和仔猪白痢。仔猪黄痢可造成仔猪排黄白色水样便,体重减轻甚至死亡;仔猪白痢主要以排灰白色的粪便为主,呈浆糊状,有腥臭味[5]。致病性大肠杆菌主要存在于母猪的肠道、产道及周围环境中,因此带菌母猪是本病的主要传染源。猪的各种大肠杆菌病主要通过消化道感染。仔猪黄痢最容易发生于1~3日龄的仔猪,但个别仔猪也可能在生后12 h内发病,往往在同窝仔猪中的发病率达80%以上,病死率较高。仔猪白痢多发生于10~30日龄的仔猪,如果一窝仔猪有1头发病,其余仔猪便可同时或相继发生,发病率中等,病死率低,猪水肿病主要发生于断奶后1~2周的仔猪,并且病猪绝大多数是生长快而肥壮的仔猪,其发病率虽低,病死率可达90%以上[6]。
本试验根据对大庆安达市某猪场送检猪的流行病学调查、病理剖检和实验室诊断,确诊其发病原因是该猪群同时感染猪高致病性蓝耳病毒和大肠杆菌,该猪场饲养管理水平低,饲养密度大,饲料骤变;环境消毒不合格,排泄物没有无害化处理,没有经过科学的疫苗免疫程序,这些因素给病原提供大量繁殖并发生变异的机会,造成多种病原存在猪只体内,当环境骤变、天气寒冷、猪体抵抗力下降时,造成大肠杆菌与猪蓝耳病毒混合感染,该猪场防治措施不完善,可能多次诊断失误没有对症下药来治疗,所以必要时要进行实验室诊断来确保万无一失,现将诊断过程总结如下。
1 材料与方法
1.1 病料的采集 大庆安达市地区某猪场送检的病死仔猪,实验室无菌采集猪的肺脏、肝脏、脾脏、肾脏和肠,保存备用。
1.2 试验材料DL 2000 DNA Marker购自大连宝生物工程有限公司,TIANamp Genomic DNA Kit DNA提取试剂盒购自TIANGEN公司,PCR Master Mix缓冲液,RNeasy Plus Mini Handbook RNA提取试剂盒购自QIAGEN公司,RevertAid First Strand cDNA Synthesis Kit反转录试剂盒购自MBI公司。其余试剂均为国产分析纯。
1.3 引物设计 根据GenBank中已发表的猪瘟病毒(HC)、高致病性猪蓝耳病(PRRS)、猪普通致病性猪蓝耳病(PRRS)、猪圆环病毒(PCV)、猪伪狂犬病毒(PR)、猪细小病毒(PP)、猪流行性腹泻(PED)、猪传染性胃肠炎(TGE)的基因序列计特异引物。
1.4 细菌分离培养 无菌剪取一小块深部组织脏器,接种涂抹于5%兔血琼脂培养基上,分别做需氧和厌氧培养,置37℃恒温箱中24 h,同时用接菌环挑取肠内容物接种在伊红美蓝和麦康凯培养基上,置37℃恒温箱中需氧培养24 h,观察菌落形态和溶血情况等,挑取疑似菌的单个菌落进行纯培养。
1.5 核酸的提取与PCR鉴定
1.5.1 组织DNA和RNA提取 按照TIANamp Genomic DNA Kit操作进行提取DNA;按照RNeasy Plus Mini Handbook RNA提取盒进行提取RNA,-20℃保存备用。
1.5.2 RNA反转录和PCR扩增 按RevertAid First Strand cDNA Synthesis Kit反转录盒说明书操作步骤将病毒提取的RNA进行反转录,得到的cDNA在-20℃进行保存备用。用得到的DNA和cDNA为模板,猪瘟病毒(HC)、高致病性猪蓝耳病(PRRS)等特异性引物进行PCR反应扩增,取10 μL的扩增产物于1%琼脂糖凝胶电泳鉴定。
1.6 药敏试验 将上述分离到的病原菌接种棒均匀涂布在鲜血培养基上,将药敏纸片(庆大霉素、卡那霉素、恩诺沙星等10种药物)分别贴于平皿中,37℃培养24 h,测定抑制菌圈直径大小,抑菌环直径<15 mm为低度敏感;≥15 mm为高度敏感。

表1 引物序列Table 1 Primer sequence
2 结果与分析
2.1 病理变化 病猪在临死前1周表现为严重的腹式呼吸,眼睑水肿及腹泻,耳间至耳根皮肤发绀;病猪也出现了神经症状,如肌肉震颤、呆立或运动失调、后躯麻痹,逐日消瘦,精神萎靡不振,尸体表面有红紫色瘢痕,臀部较为严重。剖检可见剖检病死猪淋巴结都有不同程度淤血、出血、肿胀等症状,切面湿润多汁;脾呈暗紫色,轻度肿胀。肾脏肿大颜色黑紫色、可见肾脏布满大小不一的、弥漫型的出血点脏、肝脏肿大,胸包有大量积液。尸体严重脱水,胃肠道膨胀、有多量黄色液体内容物和气体,肠黏膜有卡他性炎症病变。

图1 耳间至耳根皮肤发绀Fig.1 Ear to ear skin cyanosis

图2 眼睑水肿、肌肉震颤Fig.2 Blepharoedema,muscle tremor

图3 尸体严重脱水、消瘦、表面红紫色瘢痕,臀部较为严重Fig.3 The body is severely dehydrated,emaciated,red and purple cicatricial,and the hips are more seriouseffusion

图4 肾脏肿大颜色黑紫色Fig.4 Kidney swollen color and black purple
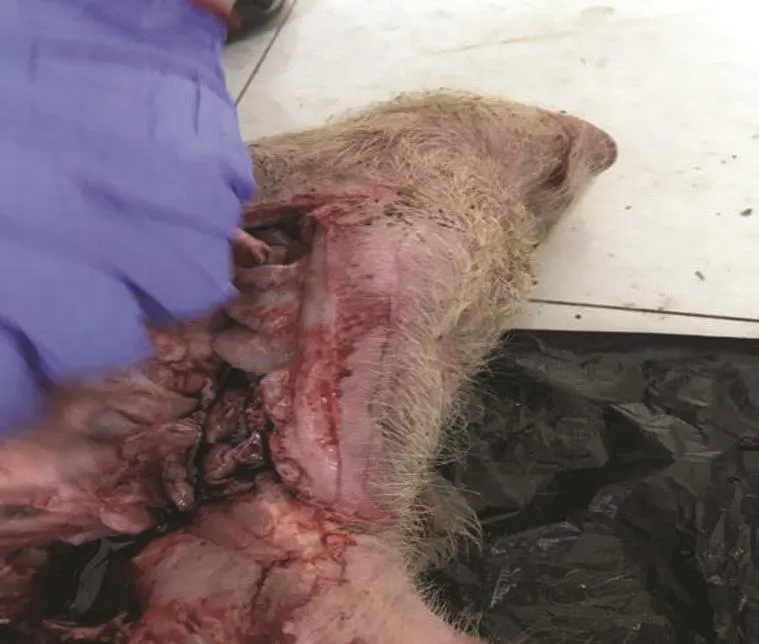
图5 病死猪淋巴结不同程度出血、淤血、肿胀Fig.5 Different degrees of bleeding,congestion and swelling of the dead pig's lymph nodes

图6 胃肠道膨胀,有少量鼓气Fig.6 Swelling of the gastrointestinal tract with a small amount of drums
2.2 涂片染色特性 将病料中所分离的细菌进行纯培养,进行革兰氏染色、涂片、镜检。可见到革兰氏染色阴性杆菌,中等大小,直杆菌(见图7)。由于大肠杆菌和沙门氏菌的形态及染色特征十分相似,所以为了区分这两种细菌,又分别接种于伊红美蓝和麦康凯培养基进行鉴别培养,结果为麦康凯培养基长出粉色,光滑,圆形菌落;在伊红美蓝培养基长出紫黑色,金属光泽菌落(见图8和图9)。
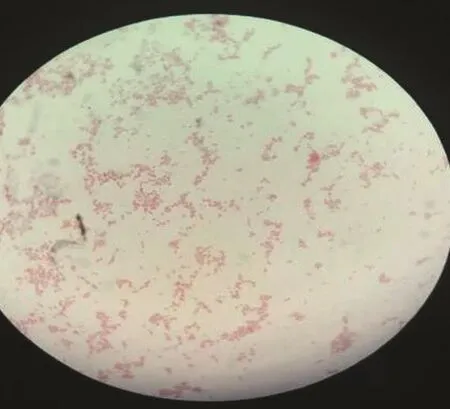
图7 革兰氏染色两端钝圆杆状菌(10×10)Fig.7 Gram staining at both ends of blunt rod-shaped baculovirus

图8 伊红美蓝培养基 菌落金属光泽Fig.8 Eosin methylene blue medium colony metallic luster
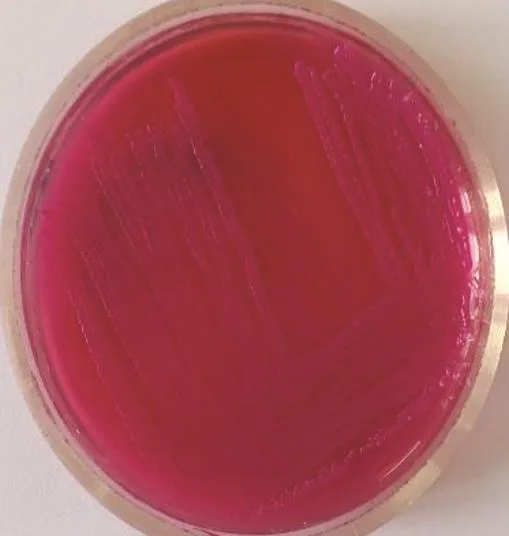
图9 麦康凯培养基 圆形菌落粉色、光滑Fig.9 Makanke culture base round colony pink and smooth
2.3 PCR检测结果 以组织中提取的病毒DNA以及病毒RNA反转录的cDNA为模板,分别选用猪瘟病毒(HC)、高致病性猪蓝耳病(PRRS)、猪普通致病性猪蓝耳病(PRRS)、猪圆环病毒(PCV)、猪伪狂犬病毒(PR)、猪细小病毒(PPV)、猪流行性腹泻(PED)、猪传染性胃肠炎(TGE)的特异性引物进行PCR鉴定。第1孔猪瘟病毒与第6孔猪细小病毒分别出现在非特异性条带中,原因是俩个病毒分别呈现阴性,不呈阳性结果不成立,所以俩个病毒除外,其中第2孔在420bp左右有一条条带,与猪高致病性蓝耳病毒预期片段大小相符如图10)。

图10 PCR产物琼脂糖凝胶电泳结果Fig.10 PCR electrophoresis analysis chart
2.4 药敏试验结果

表2 药敏结果Table 2 The results of drug susceptibility
3 讨论
3.1 发病原因 对该猪场猪群的发病原因进行调查:该牛场饲养管理水平低,不卫生,饲养密度大,饲料混杂;环境消毒不合格,排泄物没有无害化处理;没有在特定时间内进行免疫,这些因素给病原提供大量繁殖并发生变异的机会,当环境骤变时,牛体抵抗力下降,病原侵入牛体内仍然没有及时送检治疗,给猪场带来巨大的经济损失,通过本试验细菌分离鉴定、PCR诊断、药敏试验高度加深了诊断结果的准确性和真实性,可以对症下药紧急采取治疗措施,以防误诊漏诊,确保万无一失。
3.2 防治措施
3.2.1 加强猪场管理 病死猪要进行无害化处理,被污染的圈舍、器具要进行消毒,粪便要进行堆积发酵处理,保持猪舍通风、干燥。在多数猪场尚无多点生产体系情况下,保育舍和育肥舍要作到单元式全进全出生产管理,即每个牛舍的用具、人员等要独立,用具不可共用,人员不要来往[7]。要加强护理,一旦发现病牛最好隔离,单独饲养,给其创造一个安静舒适的环境,减少应激,有利于疾病的康复。
3.2.2 全面消毒 猪场环境要经常消毒,疫情严重威胁时,每天消毒1次,连续消毒1周,以后夏天2次/周,冬天1次/周。
3.2.3 紧急措施 发病猪应立即隔离,病情较重病猪果断淘汰,对病死猪采用深埋处理。粪便作为重要传播源应进行发酵或深埋处理,猪舍和工具应及时清洗并消毒,
3.2.4 对症治疗 对于腹泻较严重的仔猪还可服用神经性止泻药阿托品[8-9]。对于无明显症状的猪进行紧急猪蓝耳疫苗接种[10]。
4 结论
通过对该病死猪的病理解剖、实验室诊断和猪场全规模调查,确诊送检的病死猪死亡原因是该猪感染了大肠杆菌和猪蓝耳病病毒,引起猪群混合感染,并非偶然,发生主要原因是该猪场环境卫生偏差,没有科学免疫措施,粪便没有及时处理,环境温差骤变,猪群抵抗力下降,造成继发混合感染。
[1]于晓龙.猪流行性腹泻病毒和猪传染性胃肠炎病毒混合感染的调查[J].安徽农学通报,2007,13(14):156-157.
[2]Kadoi K,Sugioka H,Satoh T,et al.The propagation of a porcine epidemic diarrhea virus in swine cell lines[J].The new microbiologica,2002,25(3):285.
[3]武瑞.兽医临床诊断学[M].北京:科学出版社,2009.
[4]钱峰.仔猪出血性大肠杆菌病的诊断与防治[J].上海畜牧兽医通讯,2009(4):101.
[5]周军,李红斌,李睿鸿.引起仔猪腹泻的细菌性疾病及其防控措施[J].当代畜禽养殖业,2012(2):31-33.
[6]何芙蓉,邓奇风,高凤仙.仔猪腹泻的原因及其综合防治[J].广东畜牧兽医科技,2014,39(3):1-4.
[7]万遂如.规模化猪场防控猪疫病的综合技术措施[J].现代畜牧兽医,2014(2):33-40.
[8]祁学来,蔡子东,殷正军,等.断奶仔猪腹泻的原因与综合防治[J].中国畜牧兽医文摘,2013,29(1):134-135.
[9]李国城.仔猪腹泻的发病机理及防治[J].山东畜牧兽医,2013,(8):33-34.
[10]陈盛强,胡朝军,高俊,等.血清学与PCR检测HLA-B27的 比较[J].广东 医学,1999,20(9):679-680.
