恶性孤立性肺微小结节的独立预测因子及预测模型*
2018-06-21朱颖许攀峰姚亚克潘建芳周建英
朱颖 许攀峰 姚亚克 潘建芳 周建英
肺结节(pulmonary nodule,PN)为边界清楚的、影像学不透明的、直径≤3 cm、周围完全被含气肺组织包绕的单发肺部结节,不伴肺不张、肺门肿大和胸腔积液[1]。孤立性肺微小结节指直径≤10 mm的孤立性肺结节(solitary pulmonary nodules,SPN)[2]。
肺癌为中国发病率、死亡率最高的恶性肿瘤[3]。既往中国大样本调查提示大多数肺癌患者就诊时为晚期(Ⅲ期或Ⅳ期),而Ⅲb和Ⅳ期患者的5年生存率仅5%~20%,治疗效果较差,死亡率较高[4]。结节越大恶性可能性越高,国际肺癌研究会(IASLC)在肺癌TNM分期的第8次修订中对T分期作出修改,将T1分期细分为T1a(肿瘤直径≤10 mm)[5],明确提出T1a肺癌患者的生存时间和预后要明显优于其他分期患者[6]。近年来,随着体检的开展和CT检查的普及,越来越多微小SPN被发现[7],而微小SPN是许多肺癌的早期表现,所以体检发现微小SPN后对其中的早期肺癌进行准确预测,并及时行手术治疗,可提高患者生存期[8-10]。同样地,也可以尽量减少对可能的良性结节行外科手术而带来的风险。
事实上,临床对微小SPN良恶性的诊断非常困难。有资料显示[11],肺癌的早期诊断率仅为14%,对微小SPN手术后的临床资料进行回顾性研究也较少。本研究整理10 234例甲状腺术后病理资料,筛选出102例微小SPN的病例(5年内有肿瘤病史的除外)进行回顾性分析,找出恶性微小SPN的独立预测因子并建立预测模型加以验证。
1 材料与方法
1.1 临床资料
选取浙江大学附属第一医院2012年6月至2014年3月10 234例术后病理资料,找出因微小SPN而行手术治疗的患者102例(A组),所有结节均行外科手术切除,且所有患者术前两周内均在浙江大学附属第一医院行胸部CT检查。病理类型按照世界卫生组织(WHO)肺部肿瘤组织学分类(2015年版)标准进行分类[1]。回顾性分析所有病例的临床资料,如年龄、性别、临床症状、吸烟史、肿瘤史、血CEA水平,CT影像上结节直径和位置、钙化否、边界清楚否、是否规则球形,结合术后病理资料进行二元Logistic分析,找出独立预测因子,并建立预测模型。选择浙江金华广福医院胸外科2015年1月至2017年8月间手术759例,其中行微小SPN手术并取得病理诊断结果的患者共10例(B组),对微小SPN预测模型及经典模型梅奥诊所模型(Mayo Clinic Model)[12]的诊断效果进行比较。本研究经浙江大学附属第一医院伦理委员会审查通过,所有患者及其家属均签署知情同意书。
1.2 方法
采用美国GE公司Light speed型号64排螺旋CT扫描。所有患者均取仰卧位,双臂上举,扫描范围包括肺尖至肺底、两侧锁骨上区和腋窝。扫描参数为120 kV、250 mA,螺距为0.984 mm,层厚及层隔均为0.625 mm。所有患者微小SPN均经胸部CT证实。图像处理后由两位高年资影像科医师独立分析病灶位置、形态、内部结构及周围改变,意见不一致时讨论协商决定。
1.3 统计学分析
采用SPSS 21.0软件对A组进行统计学分析。连续性数据以±s表示,采用独立样本t检验。分类数据采用χ2检验或Fisher精确检验进行分析。采用二元Logistic回归进行多因素分析。筛选出恶性微小SPN的独立预测因子并建立预测模型。应用受试者工作特征曲线(receive operating characteristic curve,ROC),计算曲线下面积(AUC值),确定最佳临界值,计算对应的敏感性,特异性。以P<0.05为差异具有统计学意义。
2 结果
2.1 一般临床特征
A组共收集102例微小SPN,其中男性41例,女性61例;平均年龄为(55.31±10.77)岁。23例患者具有吸烟史,13例患者既往有其他系统肿瘤史(5年内有肿瘤病史的除外),而77例患者首诊时无临床症状。所有102例患者中,77例(75.5%)病理诊断为恶性肿瘤,其中包括62例原发性肺腺癌(图1,2),10例不典型增生伴原位癌变,3例转移癌,2例原发性肺鳞癌;25例(24.5%)病理诊断为良性病变,其中包括10例炎性假瘤,5例淋巴增生,4例结核及软骨样他错构瘤1例、硬化性血管瘤2例、隐球菌感染2例,上皮不典型增生1例。B组共收集10例微小SPN,其中男性4例,女性6例,平均年龄为(55.00±9.73)岁。3例患者有吸烟史,2例患者既往有其他系统肿瘤史(5年内有肿瘤病史的除外),9例患者首诊时无临床症状。6例(60.0%)病理诊断为恶性肿瘤,其中包括5例原发性肺腺癌,1例不典型增生伴原位癌变。4例(40.0%)病理诊断为良性病变,其中包括2例慢性肉芽肿性炎,1例肌纤维母细胞瘤样增生,1例慢性炎症。

图1 CT提示右下肺见一直径9 mm结节(A),手术后病理提示肺中分化腺癌(B) (H&E×200)
2.2 不同病理类型肺结节的临床特征分析
对A组患者一般临床特征及CT影像进行单因素分析,发现两组患者在年龄、性别、吸烟史、肿瘤史、血CEA水平、CT影像上是否实性结节,差异均无统计学意义(P>0.05)。与非恶性肿瘤组相比,恶性肿瘤组结节直径>5 mm(P=0.011),多位于上叶肺(P<0.001),多无钙化(P=0.018)及不规则球形(P<0.001,表1)。
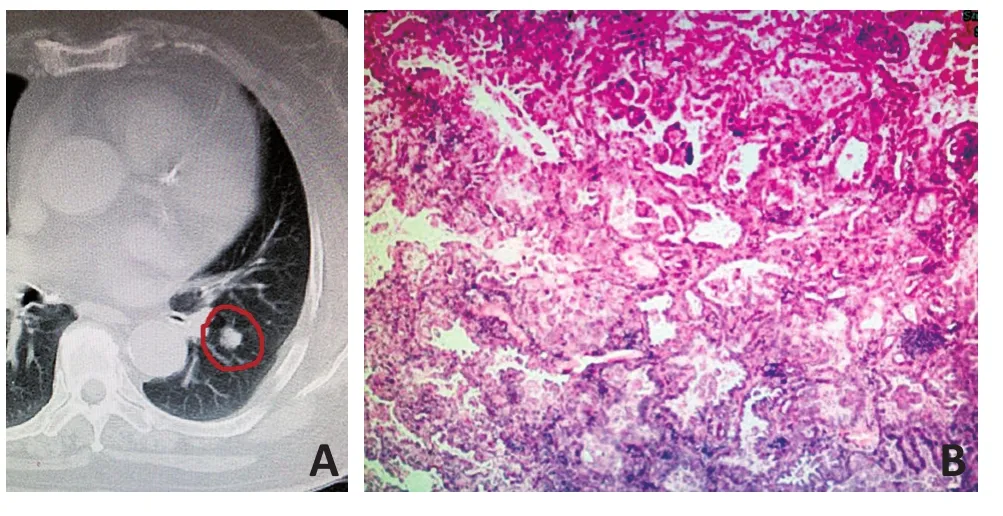
图2 CT提示左肺下叶背段见0.6 cm×0.9 cm结节(A),术后病理提示周围型中分化腺癌(B)(H&E×400)
将不同病理类型肺结节的临床特征均进行二元Logistic回归分析,结果显示:无临床症状、上肺叶>5 mm、边界不清楚、无钙化、非规则球形,上述6项因素为恶性微小SPN的独立预测因子(表2)。
可建立预测模型为P=ex/(1+ex),X=-0.537-(2.056×症状)-(2.501×部位)+(2.047×边界)-(2.036×是否规则球形)+(4.368×直径)-(3.423×钙化)。e为自然对数,上述6项因素中,1为是,0为否(如有症状、部位在中下肺、边界不清楚、无规则球形、直径>5 mm、有钙化)。可绘出上述模型在A组的ROC曲线(图3),模型的ROC曲线下面积为0.922,95%CI:0.857~0.986,最佳临界值P=0.619,对应的诊断敏感性为88.3%,特异性为84.0%。

表1 不同病理类型肺结节临床特征的单因素分析

表2 不同病理类型肺结节临床特征的二元Logistic回归分析
采用B组患者验证微小SPN模型的诊断效果,并绘制ROC曲线(图4),ROC曲线下面积为0.979,95%CI:0.90~1.000,对应的诊断敏感性83.0%,特异性为100.0%。采用B组患者验证梅奥诊所模型的诊断效果,并绘制ROC曲线(图5),ROC曲线下面积为0.750,95%CI:0.425~1.000,对应的诊断敏感性为67.0%,特异性为100.0%。对两个模型所绘ROC曲线进行比较,微小SPN模型ROC曲线下面积明显高于梅奥诊所模型(P<0.05,表3、图6)。提示本研究微小SPN预测模型诊断效果更佳。
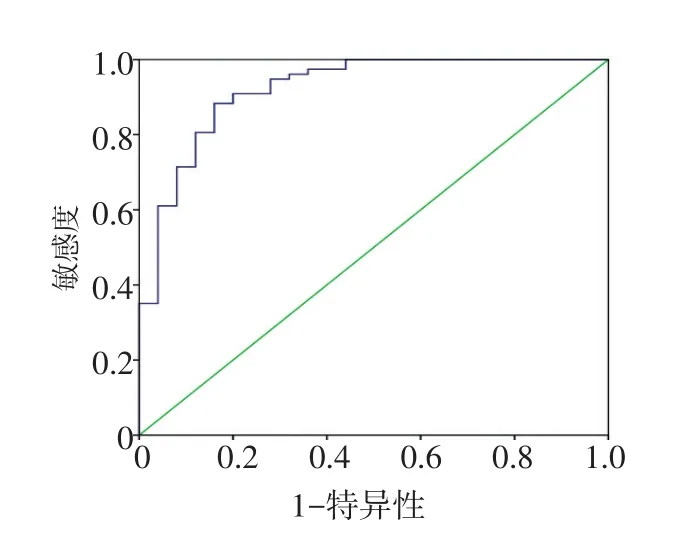
图3 微小SPN模型在A组的ROC曲线(蓝色),AUC值为0.922,最佳临界值P=0.619,敏感性为88.3%,特异性为84.0%

表3 用ROC曲线对本微小SPN模型及梅奥诊所模型验证结果对比

图4 微小SPN在B组的ROC曲线(蓝色),AUC值为0.979,对应的敏感性为83.0%,特异性为100.0%

图5 梅奥诊所模型在B组的ROC曲线(蓝色),AUC值为0.750,对应的诊断敏感性为67.0%,特异性为100.0%

图6 恶性微小SPN诊断模型(蓝色)与梅奥诊所模型(绿色)在B组ROC曲线对比,恶性微小SPN诊断模型的ROC曲线下面积明显比梅奥诊所模型高
3 讨论
随着CT检查普及,SPN检出率增高,≤10 mm的微小SPN是其中量最大,挑战难度最高的部分。越来越多的研究提示使用预测模型预测肺结节良恶性的重要性[13-14]。
英国胸科协会(BTS)建议使用基于临床和放射学特征的复合预测模型,由肺癌筛查项目开发的Brock model(Brock模型)[15]是推荐的一线预测模型。目前常用的模型还有1997年Swensen建立的梅奥诊所模型[12],其为最早建立的预测模型,预测因素包括年龄、吸烟状况、癌症史以及结节直径、毛刺和结节所在位置(AUC=0.80)。预测模型P=ex/(1+ex),X=-6.827 2+(0.039 1×年龄)+(0.791 7×吸烟史)+(1.338 8×肿瘤病史)+(0.127 4×直径)+(1.040 7×毛刺)+(0.783 8×上肺)。在其队列中,前5年有任何肺癌史或胸腔外癌史的患者除外。2015年中国肺部结节诊治专家共识推荐使用梅奥诊所模型进行肺结节临床肺癌概率的预测[16]。所以本研究模型也是与其进行比较的。2007年Gould等[17]建立的VA模型。使用退伍(VA)患者,他们的恶性比率相对较高(54%),从而构建了一个更为简洁的模型,其预测因素包括年龄、吸烟状况、戒烟后的时间和结节直径(AUC=0.78)。虽然未排除肿瘤病史,但其研究对象肺结节≥7 mm,且仅限于年龄较大的男性吸烟者。该类模型因为容易获得、经济性和实用性较好,且具有一定的预测价值,在临床上得到广泛的应用。2013年McWilliams等[15],根据多中心、大样本、前瞻性研究开发的Brork模型(McWilliams模型)是唯一评估LDCT(低剂量螺旋CT)筛查发现的结节恶性风险的模型。预测因素包括年龄、性别、肺癌的家族史、肺气肿、结节直径、毛刺、位置、结节类型和结节计数(AUC>0.90),其被部分文献认为在分辨微小SPN良恶性方面较梅奥诊所模型、VA模型更佳[18],AUC值达0.91。同时也被其他文献认为AUC值并无那么优秀[19]。
由 Herder等[20]开发的 Herder model(Herder模型),是在梅奥诊所模型基础上优化的模型,其在原梅奥诊所模型中加入PET-CT的数据进行预测,有研究认为其是对原梅奥诊所模型的一个有益改进[20],但仍有其他文献认为其具有不确定性[21-22]。Soardi等[23]开发的贝叶斯推断恶性计算器模型和Herder模型预测指标有很多类似的地方,但其还考虑了肿瘤的体积倍增时间(VDT)、病灶密度、增强CT中的强化,PET-CT的数据同样包含在预测特征中。这类添加PET-CT数据的模型,同样具有一定的预测价值,但相对费用较高。
在中国,对肺结节风险预测模型的研究也在持续进行中,其中较为著名的是北京大学人民医院李运等建立的李运模型[24]。该模型针对中国人群,预测因素包括年龄、家族肿瘤病史、直径、毛刺、边界和钙化(AUC=0.89)。
肺结节风险预测模型较多,其制作的方式均为类似的,都有临床设定、患者选择、放射学特征等内容;其可能是准确、可靠并可推广应用于预期目标人群。但仍有部分文献在对上述各模型进行平行验证分析发现,AUC并非十分完善,原因可能是由于研究设计及方法存在缺陷,在研究人群、变量测量中出现问题[25-26],即一个模型在其所开发的人群外可能表现不佳。目前的证据尚不足以确定哪些风险预测模型在临床上较为有用。对肺结节风险预测模型的改进一直在进行中,如针对特定人群研究,新的放射学特征,新的生物标记物也加入模型中等,让模型更为精确,更好地融入临床工作流程,并促进患者与医者之间的风险沟通。
国际上的模型在建模过程中的使用数据来源于西方人群,而中国是结核病高发地区,所建模型并不一定适合中国人群。中国地区科研人员对本国恶性肺结节诊断模型也做出许多研究,目标主要是肺结节活检后及术后有病理标本的人群[27-31],微小SPN有其特殊性,活检难度较高且同意行手术获得病理标本的量非常少,进入各研究的样本量少,所以有理由认为上述模型并不能充分预测微小SPN良恶性。本研究所做的微小SPN的诊断模型是针对微小SPN的恶性风险进行预测的基础研究,是对中国肺结节风险预测模型研究有益的补充。
综上所述,临床上发现微小SPN的患者,如有下述6项因素:无临床症状,影像学中在上叶、结节的直径>5 mm、边界不清楚、不规则球形、无钙化,则更可能是恶性肿瘤。并可代入数学预测模型,P=ex/(1+ex),X=-0.537-(2.056×症状)-(2.501×部位)+(2.047×边界)-(2.036×是否规则球形)+(4.368×直径)-(3.423×钙化)。e是自然对数,上述6项因素中患者如果有症状、部位在中下肺、边界不清楚、是规则球形、直径>5 mm、有钙化,用1表示,反之用0表示。当计算出P>0.619时临床医生需要认真考虑是否有早期肿瘤可能,并客观分析和早期处理。本研究的恶性微小SPN诊断模型针对难以诊断的肺微小结节人群,能辅助鉴别早期肺癌,可对临床医生提供有效的帮助,是对中国肺结节风险预测模型研究的有益的补充。本研究A组样本量和B组样本量均较小,且缺乏PET-CT、电子导航支气管镜、更多生物标记物等数据,可能会影响预测模型的准确率及敏感性。期待今后能有多中心、大样本的资料来进一步研究。
[1]Harzheim D,Eberhardt R,Hoffmann H,et al.The solitary pulmonary nodule[J].Respiration,2015,90(2):160‐172.
[2]Austin JH,Müller NL,Friedman PJ,et al.Glossary of terms for CT of the lungs:recommendations of the nomenclature committee of the fleischner society[J].Radiol,1996,200(2):327‐331.
[3]陈万青,左婷婷,郑荣寿,等.2013年中国肺癌发病与死亡分析[J].中华肿瘤杂志,2017,39(10):795‐800.
[4]彭红,韩宝惠,李小青,等.1 279例肺癌患者临床特征及生存率分析[J].中国癌症杂志,2011,21(5):354‐358.
[5]Rami‐PortaR,Bolejack V,Crowley J,et al.TheIASLClungcancer staging project:proposals for the revisions of the T descriptorsin the forth‐coming eighth edition of the TNM classification for lung cancer[J].J Thorac Oncol,2015,10(7):990‐1003.
[6]Ito M,Miyata Y,Kushitani K,et al.Prediction for prognosis of resected pT1a‐1bN0M0 adenocarcinoma based on tumor size and histological status:relationship of TNM and IASLC/ATS/ERS classifications[J].Lung Cancer,2014,85(2):270‐275.
[7]Truong MT,Ko JP,Rossi SE,et al.Update in the evaluation of the solitary pulmonary nodule[J].Radiographics,2014,34(6):1658‐1679.
[8]Lee KH,Goo JM,Park SJ,et al.Correlation between the size of the solid component on thin‐section CT and the invasive component on pathology in small lung adenocarcinomas manifesting as ground‐glass nodules[J].J Thorac Oncol,2014,9(1):7.
[9]Patel VK,Naik SK,Naidich DP,et al.A practical algorithmic approach to the diagnosis and management of solitary pulmonary nodules:part 1:radiologiccharacteristicsandimagingmodalities[J].Chest,2013,143(3):825‐835.
[10]Patel VK,Naik SK,Naidich DP,et al.A practical algorithmic approach to the diagnosis and management of solitary pulmonary nodules:part 2:pretest probability and algorithm[J].Chest,2013,143(3):840‐846.
[11]杨拴盈.肺癌早期诊断的现状、困惑和希望[J].西安交通大学学报(医学版),2011,32(1):1‐4.
[12]Swensen SJ,Silverstein MD,Llstrup DM,et al.The probability of ma‐lignancy in solitary pulmonary nodules:Application to small radio‐logically indeterminate nodules[J].Arch Intern Med,1997,157(8):849‐855.
[13]Nakamura K,Yoshida H,Engelmann R,et al.Computerized analysis of the likelihood of malignancy in solitary pulmonary nodules with use of artificial neural networks[J].Radiol,2000,214(3):823‐830.
[14]Detterbeck FC,Mazzone PJ,Naidich DP,et al.Screening for lung cancer:diagnosis and management of lung cancer:American college of chest physicians evidence‐based clinical practice guidelines[J].Chest,2013,143(5 suppl):e7859.
[15]McWilliams A,Tammemagi MC,Mayo JR,et al.Probability of cancer in pulmonary nodules detected on first screening CT[J].N Engl J Med,2013,369(10):910‐919.
[16]中华医学会呼吸病学分会肺癌学组,中国肺癌防治联盟专家组.肺部结节诊治中国专家共识[J].中华结核和呼吸杂志,2015,38(4):249‐254.
[17]Gould MK,Ananth L,Barnett PG,et al.A clinical model to estimate the pretest probability of lung cancer in patients with solitary pulmonary nodules[J].Chest,2007,131(2):383‐388.
[18]Al‐Ameri A,Malhotra P,Thygesen H,et al.Risk of malignancy in pul‐monary nodules:a validation study of four prediction models[J].Lung cancer,2015,89(1):27‐30.
[19]Talwal A,Rahman NM,Kadir T,et al.A retrospective validation study of three models to estimate the probability of malignancy in patients with small pulmonary nodules from a tertiary oncology follow‐up centre[J].Clini Radiol,2017,72(2):177e1‐177e8.
[20]Herder GJ,van Tinteren H,Golding RP,et al.Clinical prediction model to characterize pulmonary nodules:validation and added value of18F‐fluorodeoxyglucosepositronemissiontomography[J].CHEST,2005,128(4):2490‐2496.
[21]Perandini S,Soardi GA,Motton M,et al.Limited value of logistic re‐gression analysis in solid solitary pulmonary nodules characterization:a single‐center experience on 288 consecutive cases[J].J Surg Oncol,2014,110(7):883‐887.
[22]Perandini S,Soardi GA,Motton M,Montemezzi S,et al.(2015)‐Risk of malignancy in pulmonary nodules:a validation study of four prediction models[J].Lung cancer,2015,90(1):118‐119.
[23]Soardi GA,Perandini S,Motton M,et al.Assessing probability of malignancy in solid solitary pulmonary nodules with a new Bayesian calculator:improving diagnostic accuracy by means of expanded and updated features[J].Eur Radiol,2015,25(1):155‐162.
[24]Li Y,Chen KZ,Wang J.Development and validation of a clinical pre‐diction model to estimate the probability of malignancy in solitary pulmonary nodules in chinese people[J].Clin Lung Cancer,2011,12(5):313‐319.
[25]Altman DG,Vergouwe Y,Royston P,et al.Prognosis and prognostic research:validating a prognostic model[J].BMJ,2009,(28):339.
[26]Justice AC,Covinsky KE,Berlin JA,et al.Assessing the generalizability of prognostic information[J].Ann Int Med,1999,16,130(6):515‐524.
[27]Dong J,Sun N,Li J,et al.Development and validation of clinical diag‐nostic models for the probability of malignancy in solitary pulmonary nodules[J].Thorac Cancer,2014,5(2):162‐168.
[28]Jin C,Cao J,Cai Y,et al.A nomogramfor predicting the risk of invasive pulmonary adenocarcinoma for patients with solitary peripheral subsolid nodules[J].J Thorac Cardiovasc Surg,2017,153(2):462‐469.
[29]Yang L,Zhang Q,Bai L,et al.Assessment of the cancer risk factors of solitary pulmonary nodules[J].Oncotarget,2017,8(17):29318‐29327.
[30]Zhang M,Zhuo N,Guo Z,et al.Establishment of a mathematic model for predicting malignancy in solitary pulmonary nodules[J].J Thorac Dis,2015,7(10):1833‐1841.
[31]Zheng B,Zhou X,Chen J,et al.A modified model for preoperatively predicting malignancy of solitary pulmonary nodules:an Asia cohort study[J].Ann Thorac Surg,2015,100(1):288‐294
