鹿粪对栽参黑土团聚体中碱解氮与蛋白酶活性的影响
2018-06-21郭绮雯韩雅棋徐雅婧宋欣蔚高纪超许永华
郭绮雯 ,韩雅棋 ,徐雅婧 ,宋欣蔚 ,高纪超 ,许永华 ,关 松 *
(1.吉林农业大学资源与环境学院;2.吉林农业大学生命科学学院;3.吉林农业大学中药材学院,吉林长春130118)
中国是传统名贵药材——人参(Panax ginseng C.A.Mey)主产国,其栽培面积和产量均居世界首位[1]。林地土壤因其有机质含量高,结构疏松、肥沃,养分充足而优质高产[2],因此,“伐林栽参”是我国传统的人参栽培模式。但是,人参连作障碍问题导致我国可用林地资源正逐年减少,对森林资源和生态环境造成严重破坏,栽参与养林矛盾突出,发掘新参地资源势在必行。农田栽参可实现传统作物与人参轮作,从而解决参林争地矛盾,是我国参业发展的必然趋势[3]。但与林地土壤相比,农田因开垦导致养分库容减少,有机质含量下降,土壤结构变坏[4-5],为了创造利于农田栽参优质高产的良好土壤环境,施用有机肥料是改土培肥实现农田栽参的重要手段之一。农田栽参土壤施用畜禽粪肥后养分增加[6-7],施用有机肥能显著促进土壤大团聚体的形成[8-10],而土壤团聚体通过物理化学保护机制对于土壤养分的蓄持具有重要作用[11]。有机肥中的氮素多以有机氮形式存在,在土壤中,需要在酶的分解作用下转变为植物可利用的形式,蛋白酶能够分解蛋白质、肽类为氨基酸,是土壤氮矿化过程的限速酶和氮矿化的一种指示剂,是促进土壤氮循环的重要组分[12],蛋白酶活性可以评价土壤氮素的转化、循环及保肥供肥能力。研究表明,人参连作后,土壤中酶活性显著降低,对土壤养分的转化及人参对土壤养分的有效吸收产生重大影响[13]。近年来,随着北方地区鹿业养殖规模的扩大,鹿粪资源增多,参地施用鹿粪,可调节参土养分含量,降低人参锈腐病发生[14]。从资源再利用角度考虑,鹿粪中含有植物生长必需的氮磷钾等营养元素,是优质的有机肥源。因此,研究施用鹿粪对栽参黑土团聚体结构及其碱解氮与蛋白酶活性的影响,对于农田栽参改良土壤的养分供给与蓄持具有重要意义。
1 材料与方法
1.1 研究区概况与试验设计
试验地位于吉林农业大学药用植物试验基地(N43°48′11″,E125°24′28″)。试验地所处气候条件为温带半湿润大陆性季风气候,年平均降水量500~600mm,有效积温2800℃~3000℃,无霜期130~140d。土壤类型为发育于黄土母质上的中层黑土,相当于美国土壤系统分类的粘化黑软土(Argaltoll)。
2015年4月,从农田施用畜禽粪肥1年的定位小区,选取不施肥对照(CK)和施鹿粪(DeM)2个处理的土壤,采用盆栽试验方式,试验用盆高30 cm,宽40 cm,长50 cm,栽培植物为人参(品种为大马牙),每盆种植9颗人参,每个处理6次重复,补水至土壤质量含水量为23%,称重,每三天定期补水。盆栽土壤采集时间分别为,人参初始栽培0 d(2015年4月25日)、出苗期(2015年 5月20日)、结果期(2015年 7月 28日),枯萎越冬期(2015年10月15日)。离根系10 cm处采集土样,采样深度0~10 cm。盆栽试验开始前不施肥对照土壤有机碳11.3 g/kg,全氮 0.69 g/kg,全钾 0.72 g/kg,碱解氮 67.7 mg/kg,有效磷 62.1 mg/kg,速效钾 299.5 mg/kg,pH 6.85,容重 1.07 g/cm3,孔隙度60%,土壤质地为壤黏土(砂粒20.0%,粉粒46.4%,黏粒33.6%)。
1.2 团聚体分级
团聚体分级采用湿筛法[15],称取风干土样50 g,置于孔径分别为2mm、0.25mm和0.053mm组成的机械自动振荡套筛的最上层,于室温下蒸馏水浸润5min,以30/min速度在蒸馏水中振荡2min,上下振幅为3cm,将筛上的团聚体冲洗到烧杯中,获得>2mm和 2~0.25mm大团聚体,0.25~0.053mm微团聚体,<0.053mm粉+黏粒粒级需在桶内沉降72h,虹吸弃去上清液后,将团聚体转移至烧杯中。所获各级团聚体,于50℃条件下烘干,称重。
1.3 化学分析
碱解氮采用NaOH碱解扩散法[16],蛋白酶活性测定采用茚三酮比色法[17]。
1.4 数据处理
采用 Excel 2003和SPSS 17.0软件进行数据分析处理,差异显著性分析采用单因素方差分析LSD方法,进行5%水平的差异显著性分析。
2 结果与分析
2.1 土壤团聚体组成
根据图1,研究地黑土团聚体组成以2~0.25mm大团聚体为主(质量比例为39.48%~71.06%),其次为微团聚体(0.25~0.053 mm),>2mm大团聚体所占比例极低(1.52%~5.82%)。施用鹿粪对>2mm大团聚体比例无显著影响,但随着施肥时间增加,人参由苗期生长至枯萎越冬期,施用鹿粪处理2~0.25mm大团聚体较CK显著增加7.94%~56.57%(p<0.05),微团聚体比例较CK显著减少 32.45%~43.50%,<0.053mm粉 +黏粒粒级比 CK减少31.43%~55.40%(p<0.05),表明施用鹿粪显著促进了2~0.25mm大团聚体的形成。
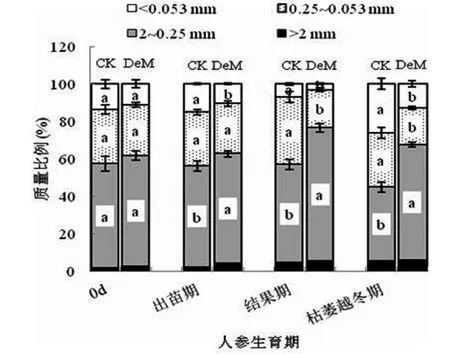
图1 土壤水稳性团聚体组成
2.2 土壤及其团聚体中碱解氮含量
从表1可以看出,在人参生长过程中,全土土壤碱解氮含量显著下降,至枯萎越冬期减少了43.11%~44.34%,在结果期和枯萎越冬期碱解氮含量降低幅度最大,表明人参对氮的吸收主要集中在结果期至枯萎越冬期。但在不同粒径团聚体中,随着人参生长,碱解氮含量下降幅度不同:在>0.25mm大团聚体中,随人参生长至枯萎越冬期,与初始栽培期(0 d)相比,CK与鹿粪处理中碱解氮含量分别减少了15.39%和25.53%;在0.25~0.053mm微团聚体中碱解氮含量是稳定的;在<0.053mm粉+黏粒粒级中,CK与鹿粪处理中碱解氮含量分别减少了21.64%和15.13%(见表1)。不同粒径团聚体之间相比,>0.25mm大团聚体中碱解氮分布最多,分别比0.25~0.053mm微团聚体和<0.053mm粉+黏粒粒级碱解氮含量高20.01%~43.69%和32.21%~70.11%,且随着团聚体粒径的减小,碱解氮含量减少(0 d CK处理除外)(见表1),表明大团聚体是养分的重要贮存场所。不同处理之间相比,施用鹿粪显著增加了土壤及其各级团聚体中碱解氮含量(见表1),至枯萎越冬期,鹿粪处理土壤及其各级团聚体中碱解氮含量仍较CK提高25.26%~78.78%(p<0.05)。
3 讨论
黑土团聚体组成是以2~0.25 mm水稳性大团聚体为优势粒级(见图 1),表明黑土具有良好的土壤结构。施用鹿粪促进了2~0.25mm大团聚体的形成,而0.25~0.053 mm微团聚体和<0.053mm粉+黏粒粒级显著减少,表明鹿粪作为有机胶结物质促进了土壤的聚合作用,较多研究已经表明施用有机粪肥能显著增加土壤大团聚体的数量[8-9],大团聚体结构内部大小孔隙兼备,协调水、气、蓄肥和供肥。研究表明:在>0.25 mm大团聚体中碱解氮分布最多(见表1),且随着团聚体粒径的减小,碱解氮分布也随之减少,反映了大团聚体是土壤养分的重要贮藏库,与Wang等[18]研究一致。这与大团聚体的形成机制密切相关,按照Tisdall等[19-20]的土壤团聚体多级形成理论,微团聚体和粉/黏粒在不同来源有机胶结物质作用下胶结形成大团聚体,因此,在各级团聚体中的有机质等养分分布必然随着团聚体粒径的增加而增多。施用鹿粪显著增加了土壤碱解氮含量(见表1),归因于粪肥中有机态氮在土壤中的矿化分解,较多研究表明施用粪肥提高了土壤氮、磷等养分的有效性[9-10,21-22],这与酶的活性提高有关,土壤酶直接参与土壤中养分的转化、释放和固定过程,与土壤供肥能力密切相关[7]。而土壤蛋白酶可用来作为氮矿化的指示剂,且与全氮矿化速率呈显著正相关关系[12],土壤蛋白酶来源于土壤微生物、植物、动物以及根系分泌物[12,23],施用粪肥可为土壤微生物提供碳、氮源,刺激土壤微生物的活性,显著增加土壤蛋白酶的活性(见图2),从而加快了土壤氮循环[9,24]。有研究表明,施用有机肥可提高土壤蛋白酶活性,且施用比例越大,即有机物料中蛋白质含量越高,其土壤蛋白酶活性增加幅度越大[12]。在研究中,蛋白酶活性随着人参生长表现为:随人参结果期增加而在人参生长末期下降(见图2),表明蛋白酶活性是随着季节的变化而变化[23],王素娟等[25-26]研究表明在夏季由于温度较高,土壤微生物活跃,土壤蛋白酶活性较高,与研究一致。和渊等[27]运用聚丙烯酰胺凝胶电泳(SDS-PAGE)技术的定性研究也验证了蛋白酶活性随着温度的升高而增加,但达到最适温度后再升温,酶的活性反而逐渐降低。另外,在不同粒径团聚体中蛋白酶活性不同,>0.25mm大团聚体中蛋白酶活性显著高于0.25~0.053mm微团聚体与<0.053mm粉+黏粒粒级(见图2),这归因于不同粒径团聚体具有不同大小的孔隙及数量等微观结构的复杂性,导致微生物可利用的基质、胞外酶和氧气的不同[28],>0.25mm大团聚体大小孔隙兼备,是土壤有机质等养分的重要贮藏库,有利于微生物和蛋白酶活性的提高,促进有机氮的矿化,因而富含有机物料来源的大团聚体中有机质等养分是不稳定的[29-30],随着团聚体粒径的减小,超微细孔隙增加,0.25~0.053mm微团聚体和<0.053mm粉+黏粒粒级中蛋白酶活性下降(见图2)。有研究认为,微团聚体对其中的有机质等养分提供物理保护免于微生物攻击[19,31],而利于保肥。因此,本研究中,在>0.25mm大团聚体中碱解氮随着人参生长下降幅度较大,而0.25~0.053mm微团聚体中碱解氮含量稳定(见表1)。另一方面,Tietjen等[32]研究认为土壤蛋白酶能够与粘粒矿物等无机物通过吸附结合而受到保护,从而降低蛋白酶的活性,或许也是<0.053mm粉+黏粒粒级的蛋白酶活性较低的原因之一(见图2)。
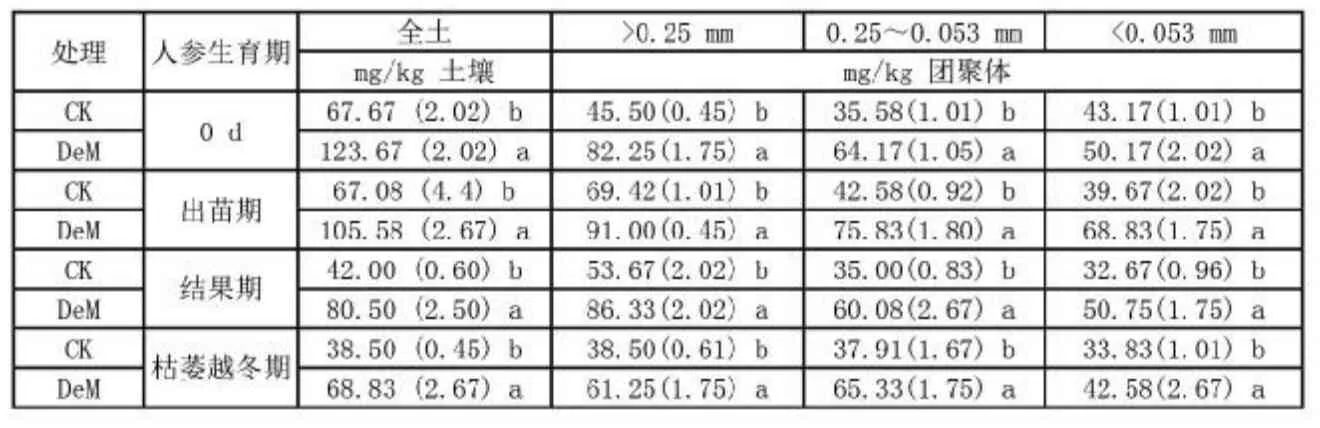
表1 土壤及其团聚体中碱解氮含量
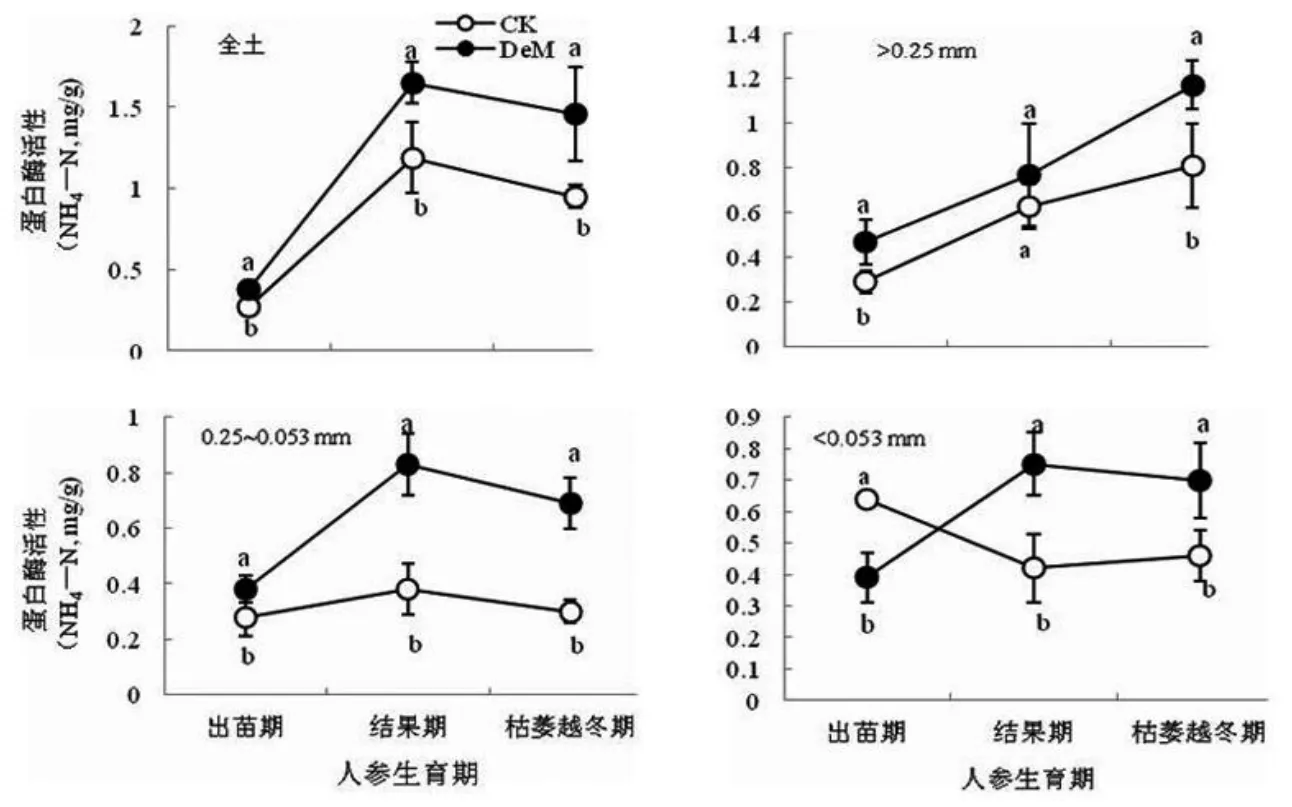
图2 土壤及其团聚体中蛋白酶活性
4 结论
施用鹿粪促进了土壤2~0.25mm水稳性大团聚体的形成,提高了土壤及其各级团聚体中碱解氮含量和蛋白酶活性,在>0.25mm大团聚体中碱解氮含量和蛋白酶活性最高,且随着团聚体粒径的减小碱解氮减少。相比较而言,土壤水稳性大团聚体既是重要的土壤养分储备库,也是植物所需养分的供给室,微团聚体则更有利于土壤养分的蓄持。
[1]徐江,董林林,王瑞,等.综合改良对农田栽参土壤微生态环境的改善研究[J].中国中药杂志,2017,42(05):876-881.
[2]孙宏法,李军,朱平,等.山参适宜生态环境的调查研究[J].特产研究,1993(01):26-30.
[3]沈亮,李西文,徐江,等.人参无公害农田栽培技术体系及发展策略[J].中国中药杂志,2017,42(17):3267-3274.
[4]刘显娇,张连学.人参土壤改良技术研究进展[J].人参研究,2012(01):30-33.
[5]魏丹,匡恩俊,迟凤琴,等.东北黑土资源现状与保护策略[J].黑龙江农业科学,2016(01):158-161.
[6]高纪超,关松,许永华.不同畜禽粪肥对农田栽参土壤养分及腐殖物质组成的影响[J].江苏农业科学,2017,45(06):255-259.
[7]董志新,卜玉山,刘秀珍,等.不同有机物料对土壤养分和酶活性的影响[J].山西农业大学学报(自然科学版),2014,34(03):220-225.
[8]Udoma B E,Nugaa B O,Adesodunb J K.Water-stable aggregates and aggregate-associated organic carbon and nitrogen after three annual applications of poultry manure and spent mushroom wastes[J].Applied Soil Ecology,2016,101:5-10.
[9]Mitran T,Mani P K,Bandyopadhyay P K,et al.Influence of organic amendments on soil physical attributes and aggregate associated phosphorus under long-term rice-wheat cropping[J].Pedosphere,2017,zoi:10.1016/S1002-0160(17)60423-5.
[10]Liu C A,Zhou L M.Soil organic carbon sequestration and fertility response to newly-built terraces with organic manure and mineral fertilizer in a semi-arid environment[J].Soil and Tillage Research,2017,172:39-47.
[11]Totsche K U,Amelung W,Gerzabek M H,et al.Microaggregates in soils[J].Journal of Plant Nutrition and Soil Science,2018,181(01):104-136.
[12]张威,张明,张旭东,等.土壤蛋白酶和芳香氨基酶的研究进展[J].土壤通报,2008,39(06):1468-1474.
[13]韩忠明,杨颂,韩梅,等.不同菌剂对人参连作土壤酶活性的影响[J].东北农业科学,2016,41(01):50-53.
[14]白容霖,张惠丽,曲力涛,等.施用鹿粪对参地土壤改良效果的研究[J].特产研究,2000,22(03):26-28.
[15]Six J,Elliott E T,Paustian K.Soil macroaggregate turnover and microaggregate formation:A mechanism for C sequestration under no-tillage agriculture [J].Soil Biology and Biochemistry,2000,32:2099-2103.
[16]鲍士旦.土壤农化分析 [M].北京:中国农业出版社,2008.
[17]关松荫.土壤酶及其研究法[M].北京:中国农业出版社,1986:121-123.
[18]WangW,ChenW C,WangK R,etal.Effectsof Long-Term Fertilization on the Distribution of Carbon,Nitrogen and Phosphorus in Water-Stable Aggregates in Paddy Soil[J].Agricultural Sciences in China,2011,10(12):1932-1940.
[19]Tisdall J M,Oades J M.Organic matter and water-stable aggregates in soils[J].Journal of Soil Science,1982(33):141-163.
[20]Six J,Bossuyt H,Degryze S,et al.A history of research on the link between(micro)aggregates,soil biota,and soilorganic matter dynamics[J].Soil and Tillage Research,2004(79):7-31.
[21]Guo L Y,Wu G L,Li Y,et al.Effects of cattle manure compost combined with chemical fertilizer on topsoil organic matter,bulk density and earthworm activity in a wheat-maize rotation system in Eastern China[J].Soil and Tillage Research,2016,156:140-147.
[22]Hao Y J,Wang Y H,Chang Q R,et al.Effects of Long-Term Fertilization on Soil Organic Carbon and Nitrogen in a Highland Agroecosystem[J].Pedosphere,2017,27(04):725-736.
[23]金建丽,石兰英,杨春文,等.人参地土壤的酶活性[J].江苏农业科学,2014,42(03):333-334.
[24]Parham J A,Deng S P,Raun W R,et al.Long term cattle manure application in soil.I.Effect on soil phosphorus levels,microbial biomass C,and dehydrogenase and phosphatase activities[J].Biology and Fertility of Soils,2002(35):328-337.
[25]王素娟,高丽,苏和,等.内蒙古库布齐沙地土壤蛋白酶初步研究[J].草业科学,2009,26(09):13-17.
[26]秦纪洪,张文宣,王琴,等.亚高山森林土壤酶活性的温度敏感性特征[J].土壤学报,2013,11(06):1241-1245.
[27]和渊,佟奕聪,白津菁,等.温度对蛋白酶活性影响的实验探究[J].生物学通报,2015,50(11):45-46.
[28]Zhao,J.S.,Chen,et al.Aggregate stability and size distribution of red soils under different land uses integrally regulated by soil organic matter,and iron and aluminum oxides[J].Soil and Tillage Research,2017,167:73-79.
[29]Guan S,Dou S,Chen G,et al.Isotopic characterization of sequestration and transformation of plant residue carbon in relation to soil aggregation dynamics [J].Applied Soil Ecology,2015,96:18-24.
[30]Zhong,X,Li J,Li X,et al.Physical protection by soil aggregates stabilizes soil organic carbon under simulated N deposition in a subtropical forest of China[J].Geoderma,2017,285:323-332.
[31]Verchot,L V,Dutaur L,Shepherd,K D,et al.Organic matter stabilization in soil aggregates:understanding the biogeochemical mechanisms that determine the fate of carbon inputs in soils[J].Geoderma,2011,161:182-193.
[32]Tietjen T,Wetzel R G.Extracellular enzyme-clay mineral complexes:Enzyme adsorption,alteration of enzyme activity,and protection from photodegradation [J].Aquatic Ecology,2003(37):331-339.
