姜黄素对人食管癌Eca-109细胞放射增敏作用的研究
2018-06-19
(青岛大学,山东 青岛 266003; 1 附属医院肿瘤科; 2 基础医学院)
食管癌是指原发于食管黏膜上皮的恶性肿瘤,为常见恶性肿瘤之一,严重威胁着人类的健康。在全球范围内,食管癌居于肿瘤死因的第6位。2010年由中国国家癌症中心发布,食管癌发病率位居我国恶性肿瘤的第5位,死亡率位居恶性肿瘤的第4位[1]。由于病人就诊时多为中晚期,食管癌病人仅约25%可行食管根治术,同时研究发现经过术前放疗可以提高手术切除率[2]。对于中段及上段的食管癌病人,放射治疗和手术是最主要和有效的治疗手段。但是由于放射治疗的疗效受多种因素的影响,寻找可以增敏的药物对提高疗效具有重要作用。姜黄素是从草本植物姜黄、郁金、菖蒲等根茎中提取出的一种酸性多酚类物质,具有极广泛的药理作用,可调控多种信号转导分子,如趋化因子、转录因子、生长因子、炎性因子、细胞周期调控蛋白、酶、药物抗性蛋白、受体、DNA等[3-6]。同时姜黄素具有抗炎、抗动脉粥样硬化、抗凝、抗氧化及抗类风湿等功效[7-8]。本研究旨在探讨姜黄素对食管癌Eca-109细胞的放疗增敏作用,以便于临床应用。
1 材料与方法
1.1 材料与仪器
人食管癌细胞系Eca-109购自中国科学院上海细胞库。姜黄素购买自美国Sigma公司,纯度为95%。胎牛血清购买自南美HyClone公司。PRIM-1640培养基购自北京赛默飞世尔公司。6 MV医用直线加速器(型号23EX)购自美国Varian公司。流式细胞仪(型号Flow-CheckTM)购自德国BD公司。
1.2 实验方法
1.2.1细胞培养 将人Eca-109细胞培养于含体积分数0.10胎牛血清的PRIM-1640培养液中,置于37 ℃,含体积分数0.05 CO2细胞培养箱中培养。每2~3 d细胞传代一次,细胞贴壁生长至对数生长期,且细胞融合达70%~80%时进行后续实验。
1.2.2CCK-8法测定姜黄素对Eca-109细胞增殖的影响 取对数生长期的细胞接种于96孔板中,每孔细胞数量约为5 000个。置于37 ℃,含体积分数0.05 CO2培养箱中过夜,待细胞贴壁时实验组加入浓度分别为5、10、20、40和80 μmol/L的姜黄素,对照组加同等体积双蒸水,每组设置5个复孔。将96孔板置于培养箱中孵育24和48 h,加入CCK-8。2 h后用酶标仪在450 nm波长处测定吸光度(A)值。计算细胞抑制率,细胞抑制率=100%-(A加药-A空白)/(A对照-A空白)×100%,并计算细胞抑制率为10%的姜黄素浓度,即IC10,用于测定放疗增敏性的实验浓度。
1.2.3平板克隆法测定姜黄素对Eca-109细胞的放疗增敏性 取对数生长期细胞,制成细胞悬液,调整细胞悬液浓度为(5~10)×106个/L,并接种于6孔培养板中。过夜,待细胞贴壁后,将细胞分为对照组和实验组。实验组加入10 μmol/L姜黄素,对照组加同等体积双蒸水,继续培养24 h。两组分别给予0、2、4、6、8 Gy放射线照射,然后继续培养1 h。每2 d更换培养液,培养约2周直至出现肉眼可见的克隆时,行Giemsa染液染色,晾干,计数每个培养皿集落数,从而计算集落形成率(PE)及细胞存活分数(SF)。PE=照射剂量0 Gy时对照组的集落形成数/照射剂量0 Gy时对照组的接种细胞数×100%。SF=某一剂量照射实验组的集落形成数/此组接种细胞数×集落形成率。存活曲线使用GraphPad Prism 5.0单靶多击模型拟合,并计算准阈剂量(Dq)、平均致死剂量(D0)、外推数(N)、2 Gy时的细胞存活分数(SF2)和放疗增敏比(SER)。
1.2.4细胞凋亡测定 取对数生长期细胞,接种于6孔板中,待细胞过夜,将细胞分为对照组和实验组。实验组加入10 μmol/L姜黄素,对照组加同等体积双蒸水,继续培养24 h,两组分别给予0、2、4、6、8 Gy放射线照射。将经过处理的细胞离心,弃上清液,PBS充分洗涤沉淀在底部的细胞3次,再次2 000 r/min离心5 min,逐滴加入体积分数为0.70冰乙醇,边加边震荡,使细胞充分分散,将样品放入-4 ℃冰箱保存。取出固定的细胞,2 000 r/min离心5 min弃上清液,加预冷的PBS 3 mL充分洗涤沉淀在底部的细胞,制成单细胞悬液,用400目的筛网过滤。2 000 r/min离心5 min,弃上清液。每管加入1 mL碘化丙啶染液染色,充分混匀,4 ℃避光保存30 min。采用流式细胞仪检测红色荧光,然后采用细胞分析软件进行细胞DNA含量分析。实验重复3次。
1.2.5细胞周期检测 取对数生长期细胞,接种于6孔板中,待细胞过夜,将细胞分为空白组(A组)、加药组(B组)、单纯放疗组(C组)以及放疗和加药组(D组),D组以及B组加入姜黄素使其浓度为10 μmol/L,A、C组加同等体积双蒸水,继续培养24 h,将C、D组给予4 Gy放射线照射,离心,用预冷PBS洗涤沉淀3次,加入体积分数0.70冰乙醇于4 ℃过夜。再次离心,于沉淀细胞中加入约1 mL预冷的PBS重悬细胞。每组细胞分为3管,每管加入0.5 mL碘化丙啶染色液,轻柔吹打细胞沉淀至单细胞悬液,4 ℃避光存放30 min。用流式细胞仪检测红色荧光,然后采用细胞分析软件进行细胞DNA含量及细胞周期分析。实验重复3次。
2 结 果
2.1 不同浓度姜黄素对食管癌Eca-109细胞增殖抑制作用
实验结果表明,相同时间下不同药物浓度对细胞生长抑制率差异有显著性;不同时间下对生长抑制率差异有显著性(F=280.21、5.53,P<0.05)。见表1。选择IC10浓度为测定细胞放疗增敏的实验浓度[9],即选取10 μmol/L姜黄素作用细胞24 h。
2.2 姜黄素对食管癌Eca-109的放射增敏比
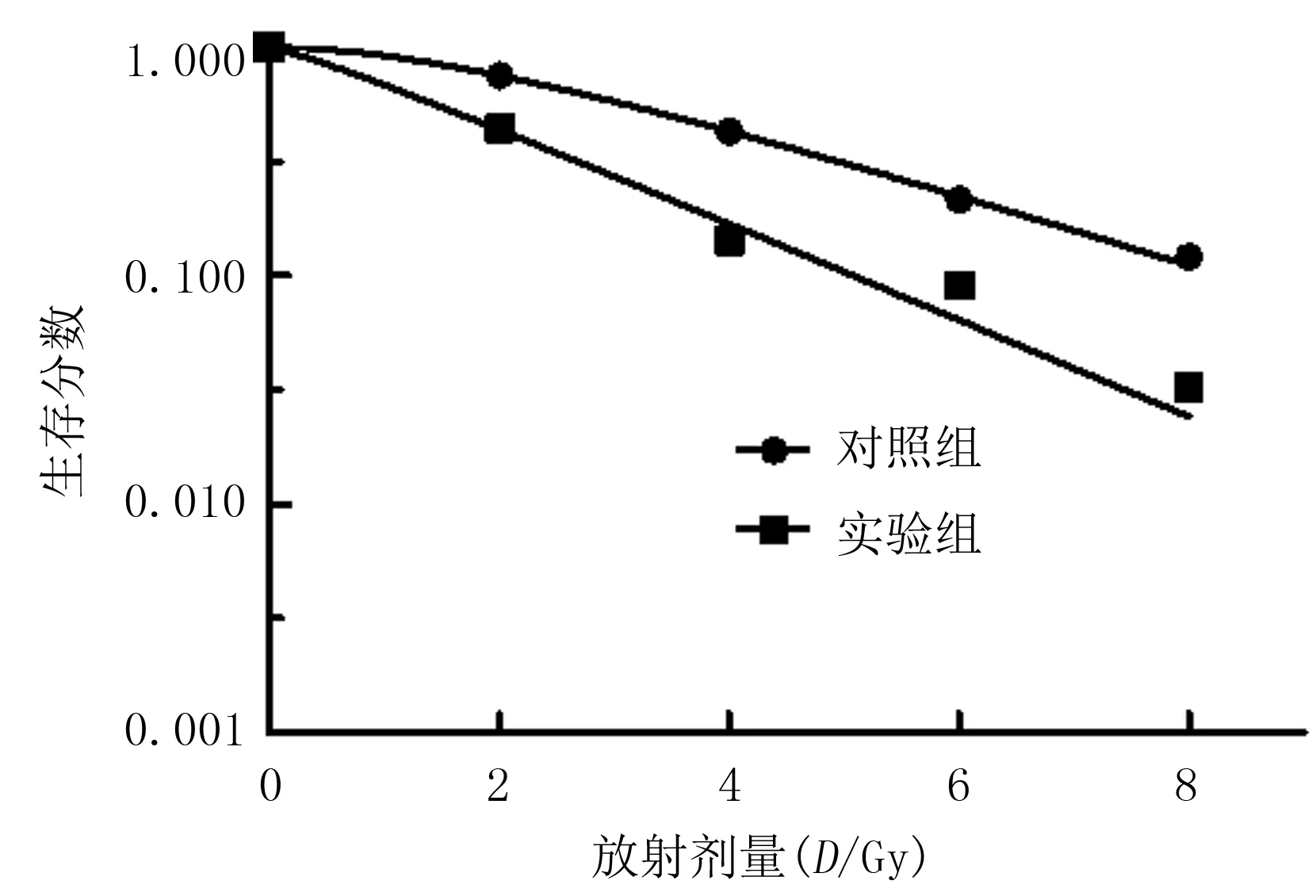
使用姜黄素预处理过的Eca-109细胞的SF明显低于对照组(F=3.55,P<0.05)。结果见表2。采用GraphPad Prism 5.0软件,用单靶多击模型SF=1-(1-еxp-Dq/D0)N,拟合生存曲线,如图1所示,计算得到N、D0、Dq、SF2、SER。见表3。
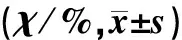
表1 姜黄素对Eca-109细胞的增殖抑制作用比较
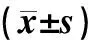
表2 不同照射剂量对两组Eca-109细胞SF的影响
2.3 姜黄素对Eca-109细胞凋亡的影响
姜黄素作用Eca-109细胞后接受放射与单纯放射相比,细胞凋亡率差异具有显著性(F=4.429,P<0.05)。实验组随着放射剂量的增加,凋亡率差异有显著性(F=31.198,P<0.05)。见表4。
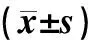
表4 两组Eca-109细胞凋亡率比较
2.4 姜黄素对食管癌Eca-109细胞周期的影响
单纯姜黄素处理可将Eca-109细胞周期阻滞于G2/M期,单纯放疗也可阻滞细胞周期于G2/M期,放疗与姜黄素双重作用可使更多细胞阻滞于G2/M期,差异有显著性(F=6.786,P<0.05)。见表5。
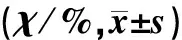
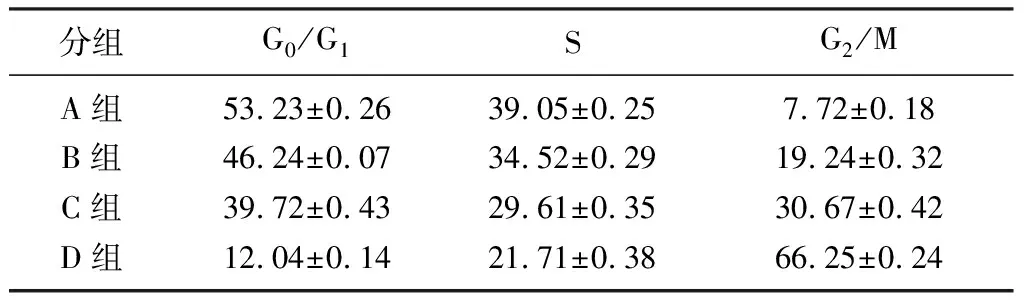
分组G0/G1SG2/MA组53.23±0.2639.05±0.257.72±0.18B组46.24±0.0734.52±0.2919.24±0.32C组39.72±0.4329.61±0.3530.67±0.42D组12.04±0.1421.71±0.3866.25±0.24
3 讨 论
放疗增敏剂是一种化学或药物制剂,当与放射同时应用时可以提高射线对生物体的杀伤效应。本实验根据放疗增敏剂量的选择原则[9],选取对细胞生长抑制率低的低剂量浓度作为姜黄素对Eca-109细胞的放疗增敏浓度。
剂量存活曲线反映的是照射剂量与细胞凋亡率之间的关系,是分析受照射细胞群体辐射效应的一种模式[10]。剂量存活曲线的直线部分斜率的倒数为D0值,为细胞的平均致死剂量。D0值代表细胞放射敏感性的高低。Dq是准阈剂量,为克服肩区所需的剂量,代表细胞亚致死性损伤修复的能力。细胞接受照射后受到亚致死性损伤,并不造成死亡,经过一定时间,细胞所受损伤可被修复,称为亚致死性损伤修复。SF2为离体肿瘤细胞经受2 Gy照射后的SF,代表肿瘤细胞内在放射敏感性[11]。D0、Dq、SF2值越小,细胞放射敏感性越高,细胞修复亚致死性损伤的能力越小,细胞内在放射敏感性越高。本实验中经过姜黄素处理的Eca-109细胞较单纯放疗组D0、Dq、SF2值增大,SER为1.37,表明经姜黄素处理的Eca-109细胞与对照组相比,放射敏感性高。
放疗敏感性与凋亡有密切关系[12]。许多机制可激活细胞凋亡,有研究表明某些凋亡通路与放疗敏感性相关。研究显示,经姜黄素处理后的宫颈癌HeLa细胞Bax蛋白的表达渐增,Bcl-2/Bax比值下降[13]。姜黄素可以增加促凋亡基因p53在G2细胞期的表达,并促使其凋亡[14]。JNK通路也与放疗敏感及细胞凋亡有关[15-16]。在本实验中,姜黄素和放射线的联合作用对食管癌Eca-109细胞系有明显促凋亡作用,伴随放射剂量的增加细胞凋亡比例明显增高。改变细胞凋亡水平可能增加放疗的敏感性。
细胞周期有4个阶段,包括G1、S、G2、M期,其中G2、M期对放疗敏感性最高,G1期次之,对放疗敏感性最差的是G0、S期。使肿瘤细胞停留在G2和M期是增强放疗敏感性的一个重要途径。研究发现,姜黄素可使鼻咽癌细胞G1期增加、G2/M期阻滞,从而增加放疗敏感性[17]。喉癌Hep-2细胞系细胞周期G2/M期阻滞也可增加放疗增敏性[18]。姜黄素组和射线的联合应用比放射线的单独应用增大了宫颈癌细胞的凋亡率,且处于G0/G1期的细胞明显减少,细胞周期阻滞于G2/M期[19-20]。本实验中,姜黄素将食管癌Eca-109细胞系阻滞于G2/M期,增加了其放射增敏性。
总之,姜黄素对人食管癌Eca-109细胞系有增殖抑制作用,并与时间和剂量有关,并且可以增加Eca-109细胞系的SER,增加其细胞凋亡,阻滞其细胞周期。本实验为下一步探讨姜黄素对人食管癌Eca-109细胞放射增敏的具体机制提供了依据。
[参考文献]
[1] 陈万青,张思维,曾红梅,等. 中国2010年恶性肿瘤发病与死亡[J]. 中国肿瘤, 2014,23(1):1-10.
[2] 董国华,许飚,姚圣,等. 食管癌放疗后手术切除116例临床分析[J]. 医学研究生学报, 2013,26(9):948-951.
[3] PUTERI B, NAZILAH S, SHAIK F K, et al. Curcumin improves the efficacy of cisplatin by targeting cancer stem-like cells through p21 and cyclin D1-mediated tumour cell inhibition in non-small cell lung cancer cell lines[J]. Oncol Rep, 2016,35(1):13-25.
[4] 高文,何彦津,梁凤鸣. 姜黄素抗肿瘤血管生成分子机制研究进展[J]. 国际眼科杂志, 2016,16(3):466-468.
[5] 李军,熊琨,龚元,等. 基于信号转导通路的姜黄素抗氧化机制研究进展[J]. 中草药, 2016,47(13):2373-2380.
[6] 李强,赵曙光,王旭霞,等. 姜黄素激活转录因子Nrf2对人肝细胞氧化应激的影响[J]. 胃肠病学和肝病学杂志, 2010,19(2):154-156.
[7] BIMONTE S, BARBIERI A, LEONGITO M, et al. Curcumin anticancer studies in pancreatic cancer[J]. Nutrients, 2016,8(7):433.
[8] 涂燕华,孙连娜. 姜黄素与类风湿性关节炎的相关实验研究进展[J]. 中国实验方剂学杂志, 2012,18(19):310-314.
[9] 魏伟,吴希美,李元建. 药理实验方法学[M]. 北京:人民卫生出版社, 2010:976-978.
[10] 朱广迎. 放射肿瘤学[M]. 北京:科学技术文献出版社, 2005:98-139.
[11] 江浩. 肿瘤细胞SF-2的放射生物学意义及临床价值[J]. 实用癌症杂志, 2002,17(5):558-560.
[12] TOFILON P J, CAMPHAUSEN K. Molecular targets for tumor radiosensitization[J]. Chem Rev, 2009,109(7):2974-2988.
[13] SINGH M, SINGH N. Molecular mechanism of curcumin induced cytotoxicity in human cervical carcinoma cells[J]. Mol Cell Biochem, 2009,325(2):107-119.
[14] CHOUDHURI T, PAL S, DAS T, et al. Curcumin selectively induces apoptosis in deregulated cyclin D1-expressed cells at G2phase of cell cycle in a p53-dependent manner[J]. J Biol Chem, 2005,280(20):20059.
[15] 侯炳旭,冯丽英. JNK信号通路介导的凋亡在疾病中的作用[J]. 世界华人消化杂志, 2011(17):1819-1825.
[16] SUI X, KONG N, YE L, et al. P38 and JNK MAPK pathways control the balance of apoptosis and autophagy in response to chemotherapeutic agents[J]. Cancer Lett, 2014,344(2):174-179.
[17] WANG J, CHANG L, LAI X, et al. Tetrandrine enhances radiosensitivity through the CDC25C/CDK1/cyclin B1 pathway in nasopharyngeal carcinoma cells[J]. Cell Cycle, 2017(1):33.
[18] 梁慧玲,何晓琴,甘园园,等. SHIP2在放射线处理后喉癌Hep-2细胞中的增殖、凋亡及细胞周期中作用[J]. 中国医药导报, 2017,14(36):4-8,20.
[19] 沈方方,李银萍. CYP 2J2和MMP-9在宫颈癌组织中的表达及其临床意义[J]. 武汉大学学报(医学版), 2014,35(1):81-84.
[20] 张莉,邓守恒,李芳,等. 姜黄素体外同步放疗对宫颈癌细胞增殖影响的实验研究[J]. 山西医药杂志(下半月刊), 2013,42(4):369-371.
