钙结合蛋白S100A1对卵巢癌细胞A2780增殖和迁移的影响
2018-06-19
(青岛大学附属医院妇产科,山东 青岛 266003)
卵巢癌是女性最常见的恶性肿瘤之一,在女性生殖系统恶性肿瘤中发病率居第三位,但死亡率位居第一。卵巢癌发病隐匿,早期不易发现,就诊时卵巢癌患者中大多数都处于病变晚期,即使积极治疗预后仍然不良。因此,深入探索卵巢癌发生发展的分子机制对于卵巢癌的诊断和治疗有着重要的意义。S100家族是EF-手型钙结合蛋白家族中最大的亚家族,与多种肿瘤的发生发展、侵袭和转移有关。S100A1作为其中一员,在多种肿瘤中异常表达,但是在卵巢癌中的作用机制仍然不清。因此,本课题以卵巢癌细胞A2780作为研究对象,探讨S100A1对卵巢癌细胞增殖及迁移的影响。
1 材料与方法
1.1 细胞及试剂
293T细胞和卵巢癌细胞A2780获自美国典型培养物保藏中心(ATCC),由妇产科实验室惠存;针对S100A1的shRNA为课题组前期构建;质粒PLP1、PLP2和VSVG由中国医学科学院肿瘤医院刘芝华教授惠赠;RPMI 1640培养基以及嘌呤霉素(美国GIBCO公司);胎牛血清以及转染试剂Lipofectamine 2000(美国Invitrogen公司);逆转录试剂盒(美国ABI公司);实时定量PCR试剂盒(日本Takara公司);Western blot试剂(美国Pierce公司);β-Actin抗体和二抗IgG(美国Sigma公司);CCK-8试剂盒(日本Dojindo公司);Transwell小室购买自美国Costar Cambridge公司;单克隆鼠抗S100A1抗体购买自美国Santa Cruz公司。
1.2 细胞培养
将293T细胞及卵巢癌细胞A2780置于含体积分数0.10胎牛血清、100 kU/L青霉素和100 mg/L链霉素的RPMI 1640培养基中进行培养,培养基置于37 ℃、含体积分数0.05 CO2的培养箱中,每1~2天换液一次,对数生长周期传代,细胞贴壁生长,待细胞覆盖培养基底壁85%的表面时收集细胞,用于后续实验。
1.3 细胞转染及分组
本研究将空质粒pLVX-IRES-Neo以及带有S100A1反向序列目的基因的质粒pLVX-IRES-Neo-shS100A1分别与质粒PLP1、PLP2以及VSVG共同转染293T细胞,实验转染过程严格地按照Lipofectamine 2000说明书进行。收集病毒上清液,将重组慢病毒感染卵巢癌细胞A2780用嘌呤霉素筛选细胞2周以获得稳定表达的细胞株,分别获得对照组细胞株(对照组)和实验组细胞株(实验组)。靶向S100A1的shRNA的序列为:5′-GATCCGTGGACTTCCAGGAGTATGTGCTTCCTGTC-AGACACATACTCCTGGAAGTCCACTTTTTG-3′。
1.4 实时定量PCR检测S100A1 mRNA水平
提取实验组以及对照组的A2780细胞的总RNA,后采用逆转录试剂盒合成cDNA。将SYBR Green染料10 μL、上游引物1 μL、下游引物1 μL、dNTP 1 μL、Taq聚合酶2 μL、待测cDNA 5 μL、ddH2O 30 μL配置成总体积50 μL的实时定量PCR反应体系。PCR的反应条件为:95 ℃预变性2 min;然后93 ℃ 1 min,55 ℃ 1 min,72 ℃ 1 min,共进行40个循环;最后以72 ℃延伸7 min。引物序列如下:S100A1-F:5′-CCGCTCGAGAGCAGCCACATTTGCAACCT-3′;S100A1-R:5′-CGCGGAT-CCGCTGGTGAGAGA-3′;β-action-F:5′-GGCGG-CACCACCATGTACCCT-3′;β-action-R:5′-AGG-GGCCGGACTCGTCATACT-3′。
1.5 蛋白质印迹法检测S100A1蛋白质表达水平
将实验组及对照组的A2780细胞裂解后提取总蛋白,用质量分数为0.10的SDS-PAGE分离后转至聚偏二氟乙烯膜上,用含体积分数0.05的胎牛血清封闭1 h,加入1∶1 000稀释的一抗,在4 ℃下孵育过夜,洗膜,加入1∶5 000稀释的二抗,在室温下反应1 h,洗膜。β-action以相同方法进行实验并作为内参照。采用增强型化学发光检测系统检测S100A1蛋白质表达水平。
1.6 CCK-8实验检测细胞增殖能力
将实验组及对照组A2780细胞以3×107个/L接种于96孔板中,每组设5孔平行对照。分别培养24、48、72 h后向每孔加入10 μL的CCK-8溶液,室温下继续培养细胞1 h,用分光光度法测定波长450 nm处各孔的吸光度(A)值,实验重复3次,取均值。
1.7 Transwell小室实验检测细胞迁移能力
将实验组及对照组的A2780细胞用0.25 g/L的胰蛋白酶消化后制成单细胞悬液,将1.5×104个细胞接种于含无血培养基200 mL的Transwell小室中,此为上室,下室加入含体积分数0.10胎牛血清的培养基500 mL,培养24 h后用湿棉签擦去微孔膜上层未穿透小室的细胞,风干后用含质量分数0.20的甲醇固定,用含质量分数0.03的结晶紫染色,在显微镜下计数随机选取的5个视野中的穿膜细胞数,实验重复3次,取均值。
1.8 划痕愈合实验检测细胞迁移能力
将实验组及对照组的A2780细胞接种于6孔板中培养过夜,至细胞融合至单层状态时,用相同宽度的无菌吸头做“+”字划痕,用PBS反复冲洗孔板去除细胞碎片,更换含体积分数0.10的胎牛血清培养基,立即记录划痕宽度并拍照,室温下继续培养细胞,48 h后在相同的位置记录划痕宽度并拍照对比划痕愈合情况。实验重复3次。
2 结 果
2.1 稳定表达敲降S100A1的A2780细胞株的构建与鉴定
实时定量PCR检测结果显示,对照组与实验组的S100A1 mRNA表达水平分别为1.000±0.001、0.654±0.007,与对照组相比较,实验组A2780细胞中S100A1 mRNA的水平显著下降(t=83.898,P<0.05)。蛋白质印迹法检测结果显示,实验组A2780细胞中S100A1蛋白质表达水平较对照组下降。见图1。结果显示,成功建立了敲降S100A1的A2780细胞株,可用于后续研究。
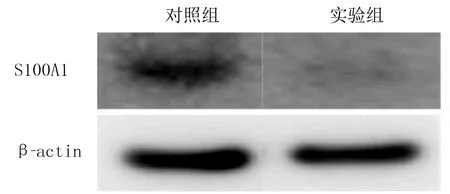
图1 两组A2780细胞中S100A1 mRNA蛋白表达水平比较
2.2 敲降S100A1对A2780细胞增殖能力的影响
CCK-8实验检测结果显示,与对照组相比,实验组A2780细胞在第48、72小时的细胞增殖能力明显下降,差异具有显著意义(t=4.975、7.393,P<0.05)。见表1。
2.3 敲降S100A1对A2780细胞迁移能力的影响
Transwell小室实验结果显示,对照组以及实验组的穿膜细胞数分别为274.750±21.093、185.750±39.373,实验组A2780细胞的穿膜细胞数显著小于对照组(t=3.985,P<0.05)。划痕愈合实验检测结果提示,敲降S100A1的A2780细胞在48 h后的划痕愈合能力较对照组减弱。见图2。
表1 各组细胞增殖能力的变化

①、③为对照组,②、④为实验组,HE染色,100倍。
3 讨 论
卵巢癌是全球女性癌症的相关死亡的第5大原因[1],每年预计有22 000多新发病例,5年生存率低于30%[2]。缺乏早期诊断是卵巢癌病人预后不良的主要原因。关于卵巢癌的发病原理及分子机制目前仍不明确。
S100A1是S100蛋白家族中的一员,定位于人染色体1q21,作为多功能信号因子参与不同细胞生物过程的调控[3]。与大多数的S100家族成员一样,S100A1通过与钙离子结合而发生自身构象改变,从而结合相应靶蛋白发挥相应生物学效应[4]。目前已知S100A1的靶蛋白有:Ca2+信号转导蛋白,细胞骨架和丝连蛋白(如微管蛋白、F-肌动蛋白、中间丝),神经递质释放相关蛋白(如突触蛋白Ⅰ、Ⅱ),转录因子(如p53),酶以及其他的Ca2+激活蛋白(如S100B、S100A4、S1001P)等[5-7]。S100A1与不同靶蛋白结合后可参与肌肉收缩、细胞代谢以及肿瘤细胞的增殖、凋亡、侵袭以及迁移等多种生物过程[8-9]。S100A1与人体多种疾病有关,如神经系统疾病、代谢综合征、心力衰竭衰等[10-12]。WRIGHT等[13]研究显示,S100A1过表达可促进神经系统疾病如阿兹海默症的病理进展;EBRAHIMI等[14]研究显示,S100A1与脂肪的生成以及肥胖的发展等有关;DU等[15]的研究显示,S100A1可调控心肌细胞内Ca2+转运,心力衰竭时S100A1表达减少,并通过实验证明敲降S100A1的心肌细胞凋亡增加、心力衰竭进程加快、心肌梗死后心力衰竭的发生率升高。ERYILMAZ等[16]研究显示,S100A1可作为评估某些癌症化疗心脏毒性的潜在标志物。
S100A1与多种肿瘤的发生发展有关[17]。据报道,S100A1在多种肿瘤中表达上调,如肾癌、乳腺癌、黑色素瘤等[3]。但也有研究显示,S100A1在某些肿瘤如口腔癌、膀胱癌中表达下降[18-20]。研究显示,S100A1在不同亚型的肾脏肿瘤中表达不一,可用于鉴别肾嫌色细胞癌、肾嗜酸细胞乳头状癌与肾嗜酸细胞腺瘤[21-22]。目前关于S100A1与卵巢癌的研究较少。DERYCKE等[23]研究结果显示,在卵巢浆液性囊腺癌中S100A1的阳性率及表达程度高于其他病理类型,且S100A1的表达程度随着卵巢癌Silverberg分级的增加而增加,该研究还发现在子宫内膜癌及宫内膜样卵巢癌中S100A1阳性病人的无复发生存率下降,说明S100A1可能与卵巢癌的病理类型、肿瘤分级及预后有关。此外,虽然S100A1在不同卵巢癌亚型中表达不一,但目前在临床实践中仍难以通过S100A1免疫组化标记来区分卵巢癌的不同亚型[24-25]。本课题组在前期研究中证实,与正常卵巢组织相比,S100A1在卵巢癌组织中的表达明显上调,可能在卵巢癌的发生发展中发挥重要的作用。因此,本研究通过分子功能学实验进一步对S100A1在卵巢癌发生发展中的功能角色进行验证。同时本研究成功建立了敲降S100A1的卵巢癌A2780细胞株,通过细胞增殖实验及迁移实验证实了敲降S100A1后的卵巢癌A2780细胞增殖及迁移能力明显减弱,证明了S100A1在调控卵巢癌细胞的增殖和迁移中起重要作用,与卵巢癌的发生发展密切相关。S100A1在卵巢癌中的作用机制仍不清楚,S100A1过表达促进卵巢癌的侵袭和转移可能与NF-κB信号传导途径的激活有关[20],但具体分子机制有待进一步研究。
综上所述,钙结合蛋白S100A1可能通过促进卵巢癌细胞的增殖能力及迁移运动能力,进而促进卵巢癌的发展与转移。S100A1有望成为监测卵巢癌的有力标志物以及可能的治疗靶点,值得进一步研究。
[参考文献]
[1] SIEGEL R L, MILLER K D, JEMAL A, et al. Cancer statistics, 2017[J]. CA Cancer J Clin, 2017,67(1):7-30.
[2] MILLER K D, SIEGEL R L, LIN C C, et al. Cancer treatment and survivorship statistics, 2016[J]. CA Cancer J Clin, 2016,66(4):271-289.
[3] BRESNICK A R, WEBER D J, ZIMMER D B, et al. S100 proteins in cancer[J]. Nat Rev Cancer, 2015,15(2):96-109.
[4] GRYCOVA L, HOLENDOVA B, LANSKY Z, et al. Ca2+binding protein S100A1 competes with calmodulin and PIP2 for binding site on the C-terminus of the TPRV1 receptor[J]. ACS Chem Neurosci, 2015,6(3):386-392.
[5] WRIGHT N T, CANNON B R, ZIMMER D B. S100A1: structure, function, and therapeutic potential[J]. Curr Opin Chem Biol, 2009,3(2):138-145.
[6] BENNETT M K, SWEET W E, BAICKER-MCKEE S, et al. S100A1 in human heart failure: lack of recovery following left ventricular assist device support[J]. Circ Heart Fail, 2014,7(4):612-618.
[7] MELVILLE Z, ALIGHOLIZADEH E, MCKNIGHT L E, et al. X-ray crystal structure of human calcium-bound S100A1[J]. Acta Crystallogr F Struct Biol Commun, 2017,73(Pt 4):215-221.
[8] MELVILLE Z, HERNANDEZ-OCHOA E O, PRATT S J P, et al. The activation of protein kinase a by the calcium-binding protein S100A1 is independent of cyclic AMP[J]. Biochemistry, 2017,56(17):2328-2337.
[9] MACIEJEWSKI A, PRADO V F, PRADO M A M. Molecular basis for the interaction between stress-inducible phosphoprotein 1 (STIP1) and S100A1[J]. Biochem J, 2017,474(11):1853-1866.
[10] AFANADOR L, ROLTSCH E A, HOLCOMB L, et al. The Ca2+sensor S100A1 modulates neuroinflammation, histopathology and Akt activity in the PSAPP Alzheimer's disease mouse model[J]. Cell Calcium, 2014,56(2):68-80.
[11] DUARTE-COSTA S, CASTRO-FERREIRA R, NEVES J S. S100A1: a major player in cardiovascular performance[J]. Physiol Res, 2014,63(6):669-681.
[12] DIAZ-ROMERO J, NESIC D. S100A1 and S100B: Calcium sensors at the cross-roads of multiple chondrogenic pathways[J]. J Cell Physiol, 2017,232(8):1979-1987.
[13] WRIGHT N T, CANNON B R, ZIMMER D B. S100A1: structure, function, and therapeutic potential[J]. Curr Chem Biol, 2009,3(2):138-145.
[14] EBRAHIMI E, KHEIROURI S, ALIZADEH M. Down-regulation of S100A1 protein in patients with metabolic syndrome and its association with zinc-α2-glycoprotein [J]. Scott Med J, 2017,62(3):88-95.
[15] DU X J, COLE T J, TENIS N, et al. Impaired cardiac contractility response to hemodynamic stress in S100A1-deficient mice[J]. Mol Cell Biol, 2002,22(8):2821-2829.
[16] ERYILMAZ U, DEMIRCI B, AKSUN S, et al. S100A1 as a potential diagnostic biomarker for assessing cardiotoxicity and implications for the chemotherapy of certain cancers[J]. PLoS One, 2015,10(12):e0145418.
[17] SALAMA I, MALONE P S, MIHAIMEED F. A review of the S100 proteins in cancer[J]. Eur J Surg Oncol, 2008, 34(4):357-364.
[18] TYSZKIEWICZ T, JARZAB M, SZYMCZYK C, et al. Epidermal differentiation complex (locus 1q21) gene expression in head and neck cancer and normal mucosa[J]. Folia Histochem Cytobiol, 2014,52(2):79-89.
[19] YAO R, LOPEZ-BELTRAN A, MACLENNAN G T, et al. Expression of S100 protein family members in the pathogenesis of bladder tumors[J]. Anticancer Res, 2007,27(5A):3051-3058.
[20] RAFFAT M A, HADI N I, HOSEIN M, et al. S100 proteins in oral squamous cell carcinoma[J]. Clin Chim Acta, 2018,480:143-149.
[21] CONNER J R, HIRSCH M S, JO V Y. HNF1β and S100A1 are useful biomarkers for distinguishing renal oncocytoma and chromophobe renal cell carcinoma in FNA and core needle biopsies[J]. Cancer Cytopathol, 2015,123(5):298-305.
[22] NG K L, MORAIS C, BERNARD A, et al. A systematic review and meta-analysis of immunohistochemical biomarkers that differentiate chromophobe renal cell carcinoma from renal oncocytoma[J]. J Clin Pathol, 2016,69(8):661-671.
[23] DERYCKE M S, ANDERSEN J D, HARRINGTON K M, et al. S100A1 expression in ovarian and endometrial endometrioid carcinomas is a prognostic indicator of relapse-free survival[J]. Am J Clin Pathol, 2009,132(6):846-856.
[24] YORDANOV A, IVANOV I, POPOVSKA S, et al. Evaluation of the expression of S100A1 protein in serous, mucinous and endometroid ovarian carcinoma[J]. Akush Ginekol (So-fiia), 2013,52(5):22-26.
[25] HIBBS K, SKUBITZ K M, PAMBUCCIAN S E, et al. Diffe-rential gene expression in ovarian carcinoma: identification of potential biomarkers[J]. Am J Pathol, 2004:165(2):397-414.
