Bacillus amyloliquefaciens Pb-4对穴盘育苗番茄生长及生理特性的影响
2018-06-19武爱莲丁玉川王立革王劲松董二伟焦晓燕
武爱莲,郭 珺,丁玉川,闫 敏,王立革,王劲松,董二伟,焦晓燕
(山西省农业科学院农业环境与资源研究所,山西太原 030031)
利用促生微生物菌株生产生物制剂并将其应用在农业生产中,能够减少或代替部分化学肥料和农药[1–6]、促进作物生长[7–9]、改良土壤环境[10–12],是改善植物营养、降低化肥施用的重要途径[13–14]。促生菌通过促进植物吸收营养物质、合成植物激素、调节植物体内乙烯水平等机制直接促进植物生长,以及通过诱导系统抗性,提高植物抗病能力等间接促进植物生长[15–18]。利用固氮菌003PWXZ6和分泌3-吲哚乙酸 (IAA) 菌株NXP17制备的接种剂对披碱草的株高、地上部生物量和地下部生物量均有显著促进作用[19]。解淀粉芽孢杆菌B1619可分泌产生生长素(IAA)、细胞分裂素 (CTK)、赤霉素 (GA3) 等,其发酵液的上清液可显著促进番茄幼苗生长[20]。赵青云等[21]将根际促生菌Bacillus subtilis Y-IVI接种在有机肥上制成了生物有机肥,与施用化肥和有机肥相比,生物有机肥更有效地促进了香草兰地上部和根系的生长。目前有关促生菌的促生效果研究较多,促生机理的研究主要集中在对促生菌自身代谢产物的研究,而对接种促生菌后植物的生理响应及其与植物生长因子之间的关系研究较少。
笔者通过平板对峙法,自主分离、筛选了抑制番茄枯萎病病原菌的Pb-4菌株,经菌落和菌体形态特征观察、菌株生理生化反应、16SrDNA同源性系列分析及Neighbor-Jionig法构建系统发育树确定Pb-4菌株为解淀粉芽孢杆菌 (Bacillus amyloliquefaciens)。该菌株可产生抗菌蛋白、抗菌素和酶等3类以上促生抑菌物质,对黄瓜枯萎病菌、西瓜枯萎病菌和青椒枯萎病菌等均具有较强的抑制能力[22]。产业高度集约化、信息化、工业化的一体化治理模式是未来农业产业化经营的方向和目标,为适应产业结构调整、加速工业化的进程,本文以穴盘育苗条件下的番茄幼苗作为供试植物,研究了施用不同剂量的Pb-4菌株发酵液对番茄生长、根系形态、叶绿素含量以及植物激素含量的影响,并分析了植物生长与生理特性之间的关系,为解淀粉芽孢杆菌Pb-4在番茄穴盘育苗中的应用提供理论依据。
1 材料与方法
1.1 供试材料
菌株:解淀粉芽孢杆菌 (Bacillus amyloliquefaciens)Pb-4是本研究小组自主分离的一株安全、高效的促生抑菌菌株。
育苗基质:德国FLORA BALT公司生产的泥炭与珍珠岩按5∶1(体积比) 的比例充分混匀。
番茄品种:环球大果NS3389(广州南蔬农业科技有限公司)。
肉汤培养基:牛肉膏5.0 g、蛋白胨10.0 g、氯化钠5.0 g、水1000 mL、pH 7.2。
PYJ培养基:葡萄糖15.0 g、蛋白胨5.0 g、酵母粉5.0 g、水1000 mL、pH 7.2。
1.2 试验方法
Pb-4发酵液的制备: 1) 菌种活化,取保存于–80℃超低温冰箱的Pb-4菌种划线接种到肉汤培养基,28℃培养3 d;2) 种子液的制备,挑取上述经活化的Pb-4菌株的单菌落接种于已灭菌的PYJ液体培养基 (100 mL/250 mL三角瓶) 中,28℃,180 r/min培养18 h;3) 发酵液制备,按3%的接种量将上述种子液接种于已灭菌的PYJ液体培养基 (200 mL/500 mL三角瓶),28℃,180 r/min培养48 h后备用,发酵液的菌数为3 × 108cfu/mL。
试验于2016年1月在山西省晋中市大禾育苗基地的联栋温室进行。设基质中发酵液施用量0、20、60、100、200 mL/L,共5个处理,分别表示为CK、T20、T60、T100、T200,每个处理设3盘重复,每盘72株。将Pb-4发酵液按比例添加到育苗基质中,加水至适宜播种的含水量 (CK处理加PYJ液体培基),充分混匀,孵育2 d后装入育苗穴盘(72穴,每盘装育苗基质2 L),播种 (1粒/穴),覆湿润的珍珠岩后浇透水,置于催芽室催芽,出芽后置于联栋温室育苗床,由育苗工人统一管理。
1.3 测试项目及方法
2016年3月番茄苗达到商品苗标准时 (4叶一心),每个处理随机选取10株,调查生长状况并测定有关生理指标。
株高为根茎部到生长点间的长度。茎粗测量位置为根茎部向上1 cm处。叶面积采用叶面积测定仪测定。番茄幼苗洗净后用吸水纸吸干,将地上部和地下部分开,65℃烘干称量地上部和地下部干重。
番茄幼苗根系形态分析采用EPSON扫描仪双面光源扫描根系,图片用WinRHIZO根系形态分析系统分析根系参数。光合色素含量的测定参照李合生[23]的方法,选取各处理番茄幼苗叶片,准确称取0.20 g,用95%的乙醇提取色素并定容至100 mL棕色容量瓶,用TU-1950型紫外可见分光光度计测定其在665、649和470 nm处的光吸收值。植物激素含量采用酶联免疫法测定,准确称取番茄幼苗不同组织0.5000 g,按重量体积比加入4倍的磷酸盐缓冲液(PBS) 制成10%的组织匀浆,3500 r/min离心10 min,取上清液40 μL,按照试剂盒的说明进行操作,最后采用华东电子DG5033A酶标仪测定450 nm处的光吸收值。
1.4 数据分析
采用Microsoft Excel 2016软件进行数据处理及作图,SPSS 18.0软件进行统计分析,采用Duncan检验法进行差异显著性分析 (P < 0.05,n = 3)。
2 结果与分析
2.1 Pb-4发酵液对番茄幼苗生长特性的影响
不同处理对番茄幼苗株高、茎粗以及叶面积的影响达显著水平 (P < 0.05)(图 1)。CK、T20、T60、T100处理表现为随着发酵液施用量的增加,番茄幼苗的株高、茎粗、叶面积均呈增加的趋势,在T100处理时达到最高值,但T200处理的促生作用效果降低。与CK处理相比,T20、T60、T100和T200处理的株高分别增加7.1%、19.2%、28.5%和16.3%;茎粗分别增加7.5%、17.1%、23.9%和15.2%;叶面积分别增加25.9%、36.7%、57.4%和19.8%。
2.2 Pb-4发酵液对番茄幼苗生物量的影响
不同用量的Pb-4发酵液显著影响番茄幼苗地上部和根系干重 (P < 0.05)(图2)。随着发酵液施用量的增加,番茄幼苗的地上部干重呈增加的趋势,在T100处理时达到最高值。与CK处理相比,T20、T60、T100和T200处理的地上部生物量分别增加15.4%、21.7%、42.4%和27.9%。根系干重也以T100处理最高,但与T20、T60处理间差异不显著(P > 0.05),与 CK 处理相比,T20、T60、T100和T200处理分别增加14.2%、8.0%、18.8%和3.4%。
2.3 Pb-4发酵液对番茄幼苗根系形态的影响
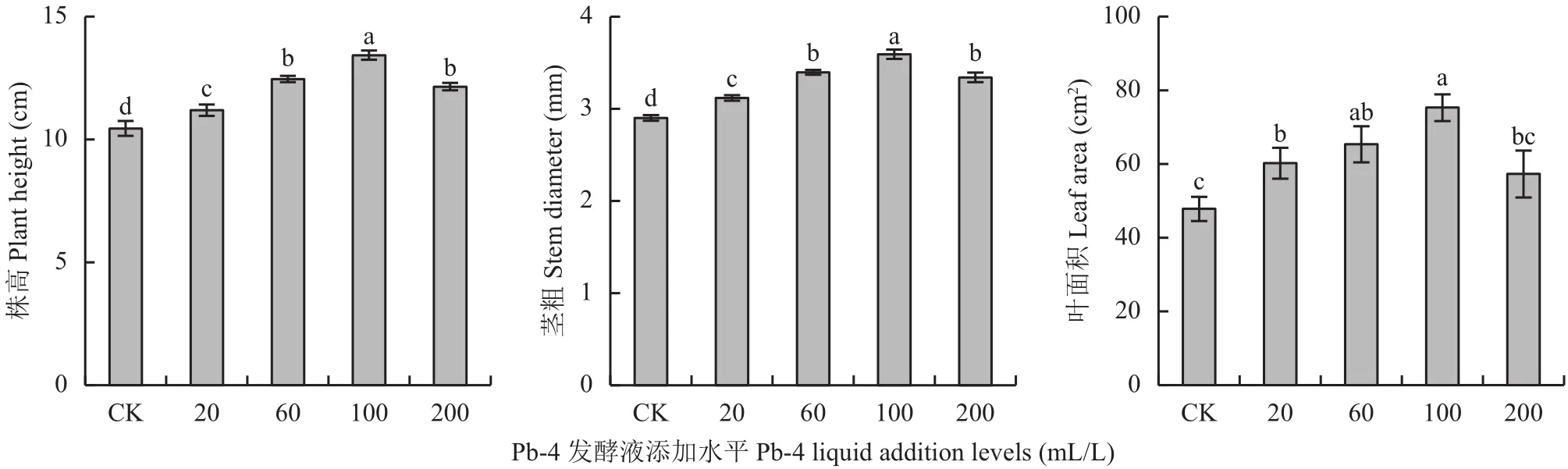
图 1 不同处理番茄幼苗株高、茎粗及叶面积Fig. 1 Plant heightstem diameter and leaf area of tomato seedlings under different addition levels of Pb-4
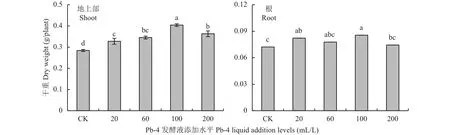
图 2 不同处理番茄幼苗地上部干重、根系干重Fig. 2 Dry weight of shoot and root of tomato seedlings under different Pb-4 addition levels
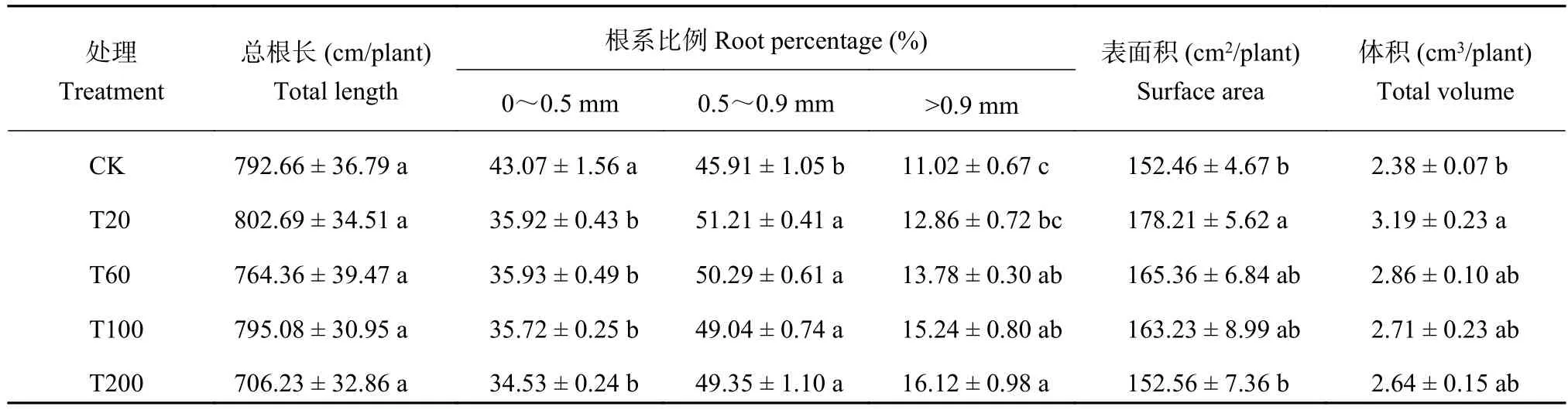
表 1 不同处理番茄幼苗根系生长参数及不同直径根系在总根长中的比例Table 1 Growth parameters and percentage of roots with different diameters in total toot length influenced by Pb-4 addition levels
各处理间总根长差异不显著 (P > 0.05)(表1),总体表现为 T20 > T100 > CK > T60 > T200;将总根长按不同直径所占比例划分后,不同处理在各根系直径范围内差异显著 (P < 0.05),在0~0.5 mm范围内,CK处理所占比例最大,显著高于其他处理 (P <0.05),T20、T60、T100和T200处理较CK处理分别降低16.6%、16.6%、17.0%和19.8%;在0.5~0.9 mm根长范围内,CK处理所占比例最小,显著低于其他处理 (P < 0.05),T20、T60、T100 和 T200 处理较CK处理分别增加11.6%、9.6%、6.8%和7.5%;大于 0.9 mm 时,整体表现为 T200 > T100 > T60 >T20 > CK,T20、T60、T100和T200处理较CK处理分别增加16.7%、25.0%、38.3%和46.3%。
根表面积在各处理间差异显著 (P < 0.05),整体表现为 T20 > T60 > T100 > T200 > CK,T20、T60、T100、T200处理较CK处理分别增加16.9%、8.5%、7.1%和0.1%;根体积在各处理间差异显著(P < 0.05),整体表现为 T20 > T60 > T100 > T200 >CK,T20、T60、T100和T200处理较CK处理分别增加34.2%、20.4%、13.9%和10.9%。
2.4 Pb-4发酵液对番茄幼苗叶片光合色素含量的影响
番茄叶片光合色素总含量在各处理间差异显著(P < 0.05)(表2),其中叶绿素a、叶绿素b以及类胡萝卜素含量在各处理间差异均显著 (P < 0.05)。T100处理的叶绿素总量最高,CK处理最低,T20、T60、T100和T200处理分别较CK处理增加5.8%、9.4%、12.6%和7.6%,其中叶绿素a分别增加5.9%、8.8%、12.1%和8.5%,叶绿素b分别增加5.1%、10.9%、16.8%和5.1%,类胡萝卜素分别增加6.4%、9.3%、8.5%和7.1%。
2.5 Pb-4发酵液对番茄幼苗植物激素含量的影响
番茄根系中IAA含量各处理间差异不显著 (表3),T20、T60、T100和T200处理较CK处理分别增加2.9%、–0.6%、–1.2%和2.3%,番茄茎中各处理的IAA含量均高于CK处理,其中以T100处理最高,各处理较CK处理分别增加15.2%、40.3%、42.4%和7.6%;番茄叶片中各处理的IAA含量高于CK处理,其中以T20处理最高,T20、T60、T100和T200处理的IAA含量较CK处理分别增加21.0%、16.8%、9.4%和10.8%。
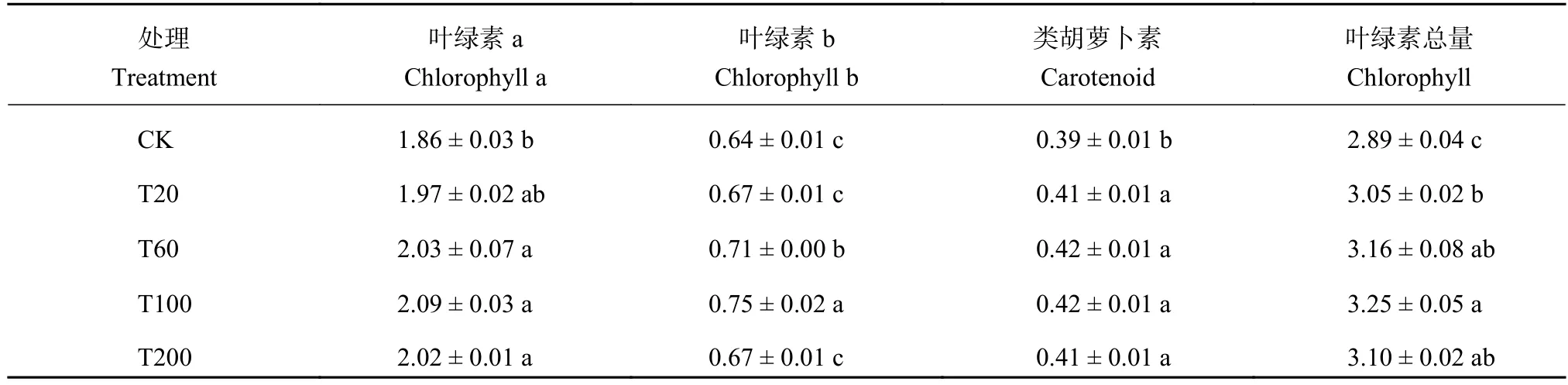
表 2 不同处理的番茄幼苗叶片光合色素含量 (mg/g,FW)Table 2 Photosynthetic pigment contents of tomato seedlings leaves under different treatments
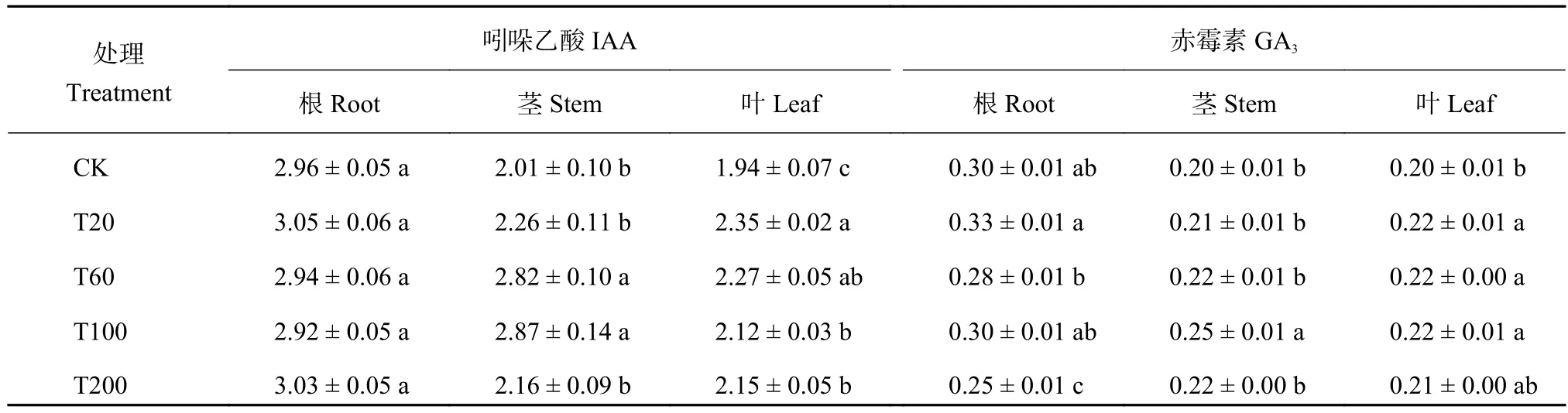
表 3 不同处理下番茄幼苗不同器官吲哚乙酸 (IAA) 和赤霉素 (GA3) 含量 (ng/g,FW)Table 3 IAA and GA3 concentrations in different organs of tomato seedlings under different treatments
番茄根系中GA3含量只有T20处理较CK增加,而其余处理均小于CK处理,T20、T60、T100和T200处理的GA3含量分别增加7.5%、–6.6%、–1.4%和–17.0%;番茄茎中各处理的GA3含量均高于CK处理,其中以T100处理的GA3含量最高,各处理较CK处理分别增加1.1%、7.5%、20.7%和3.4%;番茄叶片中各处理的GA3含量高于CK处理,T60处理的GA3含量最高,T20、T60、T100和T200较CK处理分别增加6.8%、10.5%、10.0%和5.1%。
2.6 相关性分析
从表4可以看出,番茄地上部的株高、茎粗、叶面积、干重与叶片光合色素含量、茎IAA、茎GA3含量以及叶片GA3含量显著相关,而根系干重与光合色素含量、茎IAA含量显著相关,根表面积与叶片IAA含量以及根系GA3含量显著相关,根体积与叶片IAA含量显著相关,但各生长指标与根系中IAA含量相关性不显著。
3 结论与讨论
穴盘育苗中常用株高、茎粗和叶面积等指标作为健壮商品苗的指标。本研究结果表明解淀粉芽孢杆菌Pb-4发酵液显著增加了番茄幼苗株高、茎粗、叶面积、地上部生物量和地下部生物量,这与大部分研究结果相一致[4–6,20,24]。根系是植物吸收养分和水分的重要器官[25],直接影响着植物地上部分的生长和发育[26]。Zemrany等[27]研究发现接种Azospirillum lipoferum可增加玉米幼苗根系生物量、根长和根表面积,但不会改变根系平均直径,而接种Azospirillum brasilense会增加菜豆根鲜重和根长,但根直径小了[28];也有研究表明接种Pseudomonas trivialis 使杂草双雄省麦的根系生物量、根表面积和根体积减少[29]。与本研究结果一致的是,促生菌可增加植物根系的生物量、根表面积和根体积,但对根系直径的影响结果存在分歧,这可能与菌株分泌的植物激素种类、数量以及接种量的大小不同有关,也与植物种类以及试验条件的不同有关。
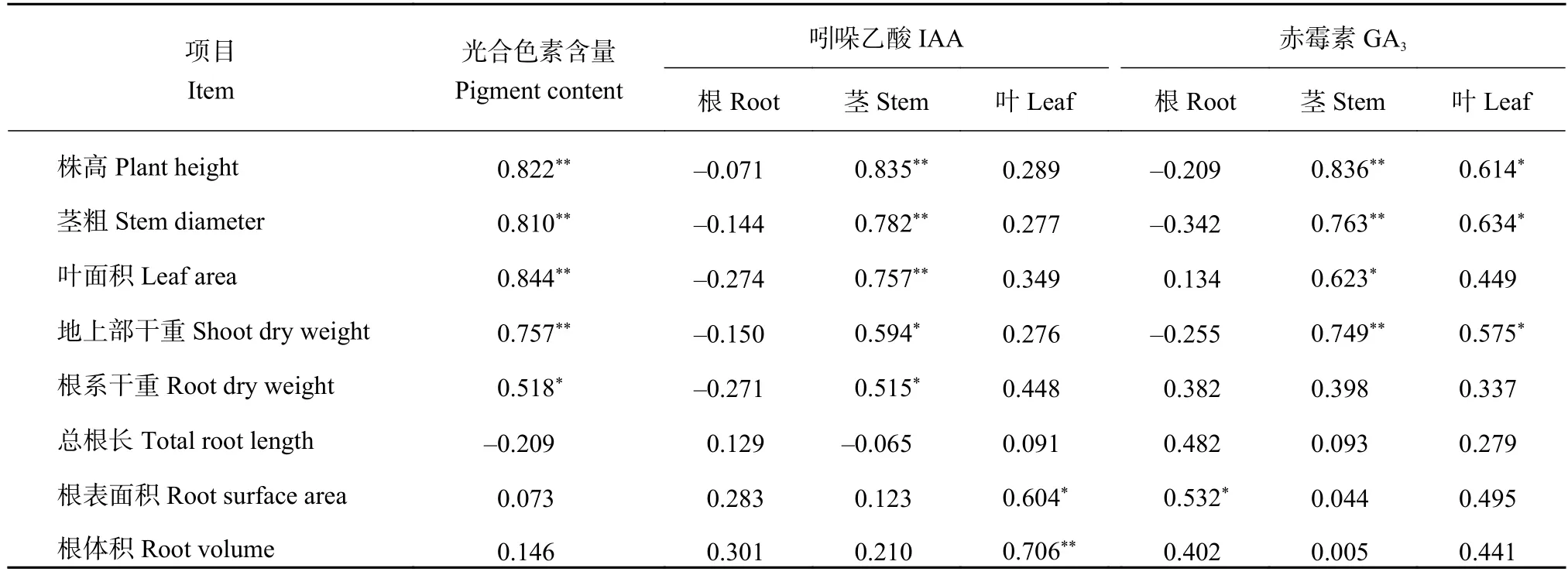
表 4 番茄植株生长指标与生理指标的相关系数Table 4 Correlation coefficients between growth indexes and physiological indexes of tomato seedlings
光合色素是叶绿体中能吸收光能的绿色色素,其含量的高低直接影响光合作用的产物[30]。施用T4发酵液显著增加了番茄叶片叶绿素a、叶绿素b以及类胡萝卜素含量,这与杨晓云等[20]、崔晓双等[31]研究结果相一致。大部分促生菌都具有分泌植物激素类物质的能力[16],产植物激素是促生菌促进植物生长的主要机制之一[15]。植物根际促生菌可以通过干扰植物内源激素或提供外源激素两种方式对植物的生长发育产生影响[32]。本研究结果显示,施用Pb-4发酵液均提高了番茄幼苗根、茎、叶中IAA和GA3的含量,这可能是因为促生菌分泌的植物激素被植物吸收利用,也可能是由于促生菌分泌合成植物激素的前体物质或关键酶,从而诱导植物产生更高浓度的植物激素。刘方春等[33]研究表明,干旱环境下金银花幼苗接种B. cereus L90可显著提高植株细胞分裂素的含量。施用量为100 mL/L基质的Pb-4发酵液,显著增加了番茄茎中IAA、GA3以及叶片中GA3的含量,IAA能够促进植物根系的发育,使植物根部伸展到更大的土壤范围[32]。施用量为200 mL/L基质的Pb-4发酵液对番茄的促生效果下降,Arkhipova等[34]报导植物根系中激素含量的增加是PGPR抑制植物生长的主要原因,从本研究的结果分析 (表3),施用量为200 mL/L基质的番茄根系中IAA和GA3含量较100 mL/L基质处理并没有显著增加,说明Pb-4发酵液对番茄促生效果的下降并不是由于这2种植物激素含量的增加所致;而可能与本研究中Pb-4发酵液的电导率 (2.86 mS/cm) 较高有关,施用量在200 mL/L基质时已达到播种时的最佳含水量,过高的施用量造成生长介质中盐分含量的增加,致使作物根系不能正常吸收水分和养分[35],番茄幼苗生长受挫。
本研究结果表明,Bacillus amyloliquefaciens Pb-4促进了番茄幼苗株高、茎粗以及叶面积的生长,增加了生物量,改变了番茄幼苗根系形态特征,使根系直径大于0.9 mm的根长所占比例增加,提高了番茄叶片的光合色素含量以及茎和叶片中IAA和GA3的含量。Pb-4发酵液对番茄幼苗的促生作用在施用量为100 mL/L基质时表现最佳,超过该用量促生作用降低。本试验结果可以为Bacillus amyloliquefaciens Pb-4在番茄穴盘育苗上的应用提供一定的参考依据,但其作用机制还有待进一步深入研究。
[1]Jetiyanon K, Plianbangchang P. Potential of Bacillus cereus strain RS87 for partial replacement of chemical fertilizers in the production of Thai rice cultivars[J]. Journal of the Science of Food and Agriculture, 2012, 92(5): 1080–1085.
[2]Adesemoye A O, Torbert H A, Kloepper J W. Enhanced plant nutrient use efficiency with PGPR and AMF in an integrated nutrient management system[J]. Canadian Journal of Microbiology, 2008,54(10): 876–886.
[3]Adesemoye A O, Torbert H A, Kloepper J W. Plant growthpromoting rhizobacteria allow reduced application rates of chemical fertilizers[J]. Microbial Ecology, 2009, 58(4): 921–929.
[4]朱震, 张国漪, 徐阳春, 等. 产脂肽菌株发酵生物有机肥的生物防治与促生作用研究[J]. 土壤学报, 2012, 49(1): 104–110.Zhu Z, Zhang G Y, Xu Y C, et al. Bio-control and growth-promoting effects of bio-manure fermented by lipopeptied-producing bacteria[J].Acta Pedologica Sinica, 2012, 49(1): 104–110.
[5]连清贵, 甘良, 马青, 等. 番茄灰霉病菌胁迫下壮观链霉菌SC11对寄主的促生作用及防病机理[J]. 植物病理学报, 2016, 46(3):401–408.Lian Q G, Gan L, Ma Q, et al. The disease prevention and growthpromoting effect and mechanism of Streptomyces spectabilis SC11 to Botrytis cinerea stress[J]. Acta Phytopathologica Sinica, 2016, 46(3):401–408.
[6]康贻军, 沈敏, 王欢莉, 等. 两株植物根际促生菌对番茄青枯病的生物防治效果评价[J]. 中国生物防治学报, 2012, 28(2): 255–261.Kang Y J, Shen M, Wang H L, et al. Biological control of tomato bacterial wilt caused by Ralstonia solanacearum with Erwinia persicinus RA2 and Bacillus pumilus WP8[J]. Chinese Journal of Biological Control, 2012, 28(2): 255–261.
[7]许进娇, 宋萍, 封磊, 等. 雷公藤内生细菌的促生作用及其对雷公藤甲素生成的影响[J]. 应用生态学报, 2014, 25(6): 1681–1687.Xu J J, Song P, Feng L, et al. Growth-promoting effect and triptolide production regulation of endophytic bacteria from Tripterygium wilfordii[J]. Chinese Journal of Applied Ecology, 2014, 25(6):1681–1687.
[8]张苗, 施娟娟, 曹亮亮, 等. 添加三种外源蛋白研制生物有机肥及其促生效果[J]. 植物营养与肥料学报, 2014, 20(5): 1194–1202.Zhang M, Shi J J, Cao L L, et al. Adding three protein resources as solid-state fermentation medium for producing bio-organic fertilizer[J]. Journal of Plant Nutrition and Fertilizer, 2014, 20(5):1194–1202.
[9]邓开英, 凌宁, 张鹏, 等. 专用生物有机肥对营养钵西瓜苗生长和根际微生物区系的影响[J]. 南京农业大学学报, 2013, 36(2): 103–109.Deng K Y, Ling N, Zhang P, et al. Effects of bio-organic fertilizers on the growth and rhizosphere microflora of watermelon plants in nursery pots[J]. Journal of Nanjing Agricultural University, 2013,36(2): 103–109.
[10]王世强, 魏赛金, 杨陶陶, 等. 链霉菌JD211对水稻幼苗促生作用及土壤细菌多样性的影响[J]. 土壤学报, 2015, 52(3): 673–681.Wang S Q, Wei S J, Yang T T, et al. Effect of Streptomyces JD211 promoting growth of rice seedlings and diversity of soil bacteria[J].Acta Pedologica Sinica, 2015, 52(3): 673–681.
[11]刘方春, 邢尚军, 马海林, 等. 干旱生境中接种根际促生细菌对核桃根际土壤生物学特征的影响[J]. 应用生态学报, 2014, 25(5):1475–1482.Liu F C, Xing S J, Ma H L, et al. Effects of inoculating plant growthpromoting rhizobacteria on the biological characteristics of walnut(Juglans regia) rhizosphere soil under drought condition[J]. Chinese Journal of Applied Ecology, 2014, 25(5): 1475–1482.
[12]刘丽, 马鸣超, 姜昕, 等. 根瘤菌与促生菌双接种对大豆生长和土壤酶活的影响[J]. 植物营养与肥料学报, 2015, 21(3): 644–654.Liu L, Ma M C, Jiang X, et al. Effect of Rhizobia and PGPR coinoculant on soybean characteristics and soil enzyme activities[J].Journal of Plant Nutrition and Fertilizer, 2015, 21(3): 644–654.
[13]Tikhonovich I A, Provorov N A. Microbiology is the basis of sustainable agriculture: an opinion[J]. Annals of Applied Biology,2011, 159(2): 155–168.
[14]邢永秀, 莫遥, 罗丽静, 等. 接种固氮菌Klebsiella sp. 120对甘蔗光合特性和主要矿质营养元素含量的影响[J]. 植物营养与肥料学报,2015, 21(2): 467–474.Xing Y X, Mo Y, Luo L J, et al. Effects of inoculating nitrogen fixing bacteria Klebsiella sp. 120 on photosynthetic characteristics and mineral nutrient contents of sugarcane[J]. Journal of Plant Nutrition and Fertilizer, 2015, 21(2): 467–474.
[15]康贻军, 程洁, 梅丽娟, 等. 植物根际促生菌作用机制研究进展[J].应用生态学报, 2010, 21(1): 232–235.Kang Y J, Cheng J, Mei L J, et al. Action mechanisms of plant growth-promoting rhizobacteria(PGPR): A review[J]. Chinese Journal of Applied Ecology, 2010, 21(1): 232–235.
[16]Malhotra M, Srivastava S. Stress-responsive indole-3-acetic acid biosynthesis by Azospirillum brasilense SM and its ability to modulate plant growth[J]. European Journal of Soil Biology, 2009,45(1): 73–80.
[17]Glick B R, Cheng Z, Czarny J, Duan J. Promotion of plant growth by ACC deaminase-producing soil bacteria[J]. European Journal of Plant Pathology, 2007, 119(3): 329–339.
[18]Shanmugam V, Kanoujia N, Singh M, et al. Biocontrol of vascular wilt and corm rot of gladiolus caused by Fusarium oxysporum f. sp.gladioli using plant growth promoting rhizobacterial mixture[J]. Crop Protection, 2011, 30(7): 807–813.
[19]马骢毓, 张英, 孙广正, 等. 披碱草根际促生菌筛选及其接种剂的促生作用[J]. 植物营养与肥料学报, 2016, 22(4): 1039–1048.Ma C Y, Zhang Y, Sun G Z, et al. Identification of plant growth promoting rhizobacteria Elymus dahuricus and their effectives[J].Journal of Plant Nutrition and Fertilizer, 2016, 22(4): 1039–1048.
[20]杨晓云, 陈志谊, 蒋盼盼, 等. 解淀粉芽孢杆菌B1619对番茄的促生作用[J]. 中国生物防治学报, 2016, 32(3): 349–356.Yang X Y, Chen Z Y, Jiang P P, et al. Growth-promotion effect of Bacillus amyloliquefaciens B1619 on tomato plant[J]. Chinese Journal of Biological Control, 2016, 32(3): 349–356.
[21]赵青云, 赵秋芳, 王辉, 等. 根际促生菌Bacillus subtilis Y-IVI在香草兰上的应用效果研究[J]. 植物营养与肥料学报, 2015, 21(2):535–540.Zhao Q Y, Zhao Q F, Wang H, et al. Beneficial effects of plant growth promoter rhizobacteria on vanilla(Vanilla planifolia Ames.)growth[J]. Journal of Plant Nutrition and Fertilizer, 2015, 21(2):535–540.
[22]郭珺, 武爱莲, 闫敏, 等. 芽孢杆菌Pb-4菌株鉴定及其抑菌活性的研究[J]. 华北农学报, 2016, 31(2): 224–230.Guo J, Wu A L, Yan M, et al. Identification of Bacillus sp. Pb-4 and its utilization for antimicrobial activity[J]. Acta Agriculturae Boreali-Sinica, 2016, 31(2): 224–230.
[23]李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000.Li H S. Principles and techniques of plant physiological biochemical experiment [M]. Beijing: Higher Education Press, 2000.
[24]赵静, 夏海波, 李艳青, 国家进. 根际促生菌YHN对番茄和茄子的促生作用研究[J]. 北方园艺, 2014, (4): 30–32.Zhao J, Xia H B, Li Y Q, Guo J J. Study on growth-promoting effect of plant growth-promoting rhizobacteria strain YHN on the seedling of tomato and eggplant[J]. Northern Horticulture, 2014, (4): 30–32.
[25]Bailey P H J, Currey J D, Fitter A H. The role of root system architecture and root hairs in promoting anchorage against uprooting forces in Allium cepa and root mutants of Arabidopsis thaliana[J].Journal of Experimental Botany, 2002, 53(367): 333–340.
[26]陈伟立, 李娟, 朱红惠, 等. 根际微生物调控植物根系构型的研究进展[J]. 生态学报, 2016, 36(17): 5285–5297.Chen W L, Li J, Zhu H H, et al. A review of the regulation of plant root system architecture by rhizosphere microorganisms[J]. Acta Ecologica Sinica, 2016, 36(17): 5285–5297.
[27]Zemrany H E, Czarnes S, Hallett P D, et al. Early changes in root characteristics of maize (Zea mays) following seed inoculation with the PGPR Azospirillum lipoferum CRT1[J]. Plant and Soil, 2007,291(1/2): 109–118.
[28]German M A, Burdman S, Okon Y, Kigel J. Effects of Azospirillum brasilense on root morphology of common bean (Phaseolus vulgaris L.) under different water regimes[J]. Biology and Fertility of Soils,2000, 32(3): 259–264.
[29]Mejri D, Gamalero E, Tombolini R, et al. Biological control of great brome (Bromus diandrus) in durum wheat (Triticum durum):specificity, physiological traits and impact on plant growth and root architecture of the fluorescent pseudomonad strain X33d[J].Biocontrol, 2010, 55(4): 561–572.
[30]杜胜蓝, 黄岁樑, 臧常娟, 等. 浮游植物现存量表征指标间相关性研究Ⅳ: 叶绿素a与生物量[J]. 水资源与水工程学报, 2011, 22(1):40–44.Du S L, Huang S L, Zang C J, et al. Correlation research between the indicators of phytoplankton standing stock iv: chlorophyll a and biomass[J]. Journal of Water Resources and Water Engineering,2011, 22(1): 40–44.
[31]崔晓双, 王伟, 张如, 张瑞福. 基于根际营养竞争的植物根际促生菌的筛选及促生效应研究[J]. 南京农业大学学报, 2015, 38(6):958–966.Cui X S, Wang W, Zhang R, Zhang R F. Screening of plant growthpomoting rhizobacteria based on rhizosphere nutrition competiveness and investigation of their promoting effects[J]. Journal of Nanjing Agricultural University, 2015, 38(6): 958–966.
[32]王卉, 尚庆茂, 张志刚, 等. 解淀粉芽孢杆菌L-H15产促生物质分析及发酵工艺优化[J]. 食品科学, 2017, 38(10): 74–81.Wang H, Shang Q M, Zhang Z G, et al. Plant growth promoting characteristics of Bacillus amyloliquefaciens L-H15 and optimization of its culture conditions[J]. Food Sciences, 2017, 38(10): 74–81.
[33]刘方春, 马海林, 杜振宇, 等. 金银花容器苗对干旱胁迫下接种根际促生细菌的生理响应[J]. 生态学报, 2015, 35(21): 7003–7010.Liu F C, Ma H L, Du Z Y, et al. Physiological responses of Lonicera japonica container seedlings to plant growth-promoting rhizobacteria inoculation under drought stress[J]. Acta Ecologica Sinica, 2015,35(21): 7003–7010.
[34]Arkhipova T N, Prinsen E, Veselov S U, et al. Cytokinin producing bacteria enhance plant growth in drying soil[J]. Plant and Soil, 2007,292(1/2): 305–315.
[35]Turan M A, Elkarim A H A, Taban N, et al. Effect of salt stress on growth and ion distribution and accumulation in shoot and root of maize plant[J]. African Journal of Agricultural Research, 2010, 5(7):584–588.
