菜豆品种黄金勾伽玛射线突变体库的建立及突变表型观察
2018-06-19若琳
,, ,,若琳,,,, ,
(1.中国科学院 东北地理与农业生态研究所 大豆分子设计育种重点实验室,黑龙江 哈尔滨150081;2.中国科学院大学,北京 100049;3.哈尔滨师范大学 生命科学与技术学院,黑龙江 哈尔滨 150052)
0 引 言
菜豆(PhaseolusvulgarisL.)在我国广泛种植,地方品种资源丰富,是我国主要的蔬菜种类之一[1-2],也是世界上重要的食用豆类之一[3-4]。食用菜豆富含维生素C,有利于提高人体免疫能力,可预防上呼吸道感染等疾病。维生素C作为抗氧化剂,能将胆固醇分解成硫化物而排出体外,从而清洁血管,有利于营养物质的运输和大脑发育[5]。菜豆品种黄金勾因豆荚果实色泽呈浅黄色,具有纤维少、味甘甜等独特的口感,成为我国东北三省最具特色的地方品种之一。
与大豆相同,菜豆也是光周期敏感的短日照作物。在短日条件下,菜豆开花、结荚及成熟期均提前。反之,在长日条件下,菜豆开花、结荚及成熟期推迟,枝叶徒长,甚至不能开花结荚。光周期不仅影响菜豆开花结实的迟早,对叶的形态、生长习性、株高和产量等也具有一定影响[6]。生育期是光周期反应的重要指标,也是育种主要选择的目标性状。大豆是早期研究光周期现象的重要模式作物[7-11]。经典遗传学发现了10多个与开花期相关的基因位点[12-19],除与“长童期”相关的J位点[16]外,其余习惯称为E系列(E1至E10)基因。大豆的生育期是大豆的生理特性在一定条件下的表现,是大豆重要的生态性状[20]。在众多的E基因中,大豆生育期基因E1对大豆的开花期及成熟期的影响最大[12,21-24]。Xia等[25]用2个含有不同E1基因型Harosoy近等基因系所建立的群体,成功地实现了对该基因的精细图位克隆。其中E1基因只在菜豆和蒺藜苜蓿等豆科作物中发现有与其同源性很高的基因序列。来源于菜豆的E1同源基因PvE1L具有与大豆中E1基因相似的抑制开花的功能[26]。
通过比较植物遗传连锁图谱,菜豆与大豆在宏线性水平和微线性水平都具有较高的共线性关系[27]。菜豆的基因组为587Mb[28],小于大豆基因组。同时重复序列比例低,并可为较复杂的豆科植物基因组解析做参考。在植株生长上具有生长周期短,便于表型观察等优势。最新的菜豆(Phaseolusvulgaris)基因组有 11 条染色体(http://phytozome.com),是以三代测序技术PacBio为基础拼装而成,同时基因注释是由GMI(Gene Model Improvement) 自动流程来完成的。本基因组版本已组装了87个大于50 kb的scaffolds,代表着约99.1%的总基因组,注释了27 433个基因位点,含有36 995个可翻译蛋白的转录本,同时预测有9 562个可变剪切转录本。近年来,由基因组发展而来的技术手段如芯片技术[29]不断出现,为基因克隆提供了极大的便利。
遗传多样性是作物遗传改良的基础,也是育种领域中最重要的前提。突变体被认为是育种计划中理想性状的供体。诱变技术发展至今,主要有物理诱变、化学诱变和生物诱变,物理诱变主要包括:60Co γ 射线、航天诱变、激光诱变、热中子诱变和快中子轰击诱变等[30];化学诱变主要包括:叠氮化纳和烷化类诱变剂诱变等;生物诱变主要包括:T-DNA 插入诱变和转座子介导诱变。Chen等[31]为解决菜豆种质资源遗传更新问题,通过化学诱变剂叠氮化纳(NaN3)诱变地方菜豆品种Hwachia,获得了具有不同性状的突变体,达到了扩大菜豆遗传多样性的目的。化学诱变剂甲基磺酸乙酯(EMS)具有产生点突变频率较高,染色体畸变相对较少的诱变特点,可以产生范围较广的突变类型,如转换、颠换等。Porch等[32]用EMS诱变菜豆品种BAT93,并通过比较EMS浓度梯度对植物存活、发育和产量等的影响,确定了40 mM EMS具有最佳的诱导效率。
与上述诱变技术相比较,60Co γ 射线诱变种粒后代突变性状较为明显,突变体易于观察和筛选,被广泛应用于突变体库的建立。本研究通过60Co γ辐射诱变旨在获得丰富的变异材料,特别是与菜豆生育期性状产生变异的材料,进而进行克隆引致变异的功能基因,丰富菜豆的生育期及光周期调控机制,为全面解析菜豆功能基因组提供重要的遗传材料。
1 材料与方法
1.1 供试材料
菜豆品种黄金勾购自黑龙江都业电子商务有限公司。
1.2 诱变处理方式
黄金勾种子约2 500粒,在浙江省农业科学院作物与核技术利用研究所进行60Co γ 射线诱变处理,吸收剂量为200 Gy,剂量率为每分钟1 Gy。
1.3 突变体库的建立与表型观察
诱变处理后的种子于2016年5月种于哈尔滨市平房区试验田中,出苗约1 660株,约半数以上植株呈现死苗或迟发苗。于2016年8月左右单株收获M1代800株种子;2016年11月于云南省中国科学院西双版纳植物园南繁基地进行加代繁种,2017年4月底单株收获M2种子;2017年5月中旬M2代单株收获的种子于哈尔滨市平房区试验田和黑龙江省海伦市进行种植,M3代群体植株总数为约为3 500株行,在田间定期观察表型变化。根据观察到的表型特征选择株行的收获方式,如有明显性状分离的植株单株收获单株脱粒。选择部分明显变异的材料,在M4代进行表型及分离比验证。M4代植株于2017年9月在江苏省淮安市种植。鉴于M2代突变体容量相对较小,表型观察始于M3代株行,全生育期每 2 ~ 3 d 田间调查 1 次,重点考察开花期、成熟期、叶形、叶色、株高、株型、育性、百粒重、豆荚与种子性状等变异情况,并进行数据记载。
1.4 统计方法与数据分析
随机选取菜豆黄金勾突变体库110个株系,用电子天平测定百粒重,游标卡尺测定种粒的长和宽。每株系分别随机测量3次百粒重及种粒的长、宽,取平均值作为该品种的表型数值。野生型对照百粒重随机测量30次。
用分析工具SigmaPlot 12.5结合Excel的分析功能对突变体库部分种粒,大粒、小粒及野生型对照的平均值、最小值、标准误差、偏度和峰度等指标进行统计学分析。
2 结果与分析
2.1 突变体库中数量性状的观察
110份种粒的百粒重变化范围为20.9~46.4 g,野生型对照,均值为30.3 g。统计结果显示在百粒重、粒长及粒宽3个性状中,突变体库部分种粒变异系数均显著高于野生型对照,野生型粒宽变异系数最小,为5.73%;突变体库百粒重变异系数和变异幅度最大,百粒重变异系数为17.7%,变异幅度为20.9~48.7 g;突变体库粒长、粒宽呈偏态分布,而百粒重呈高偏态分布,表明突变体库中所研究的该性状差异较大,存在丰富的遗传多样性且在群体中产生连续分布(表1),而且突变体库中部分材料在种皮颜色与野生型对照相比存在肉眼可见的显著差异,见图1。
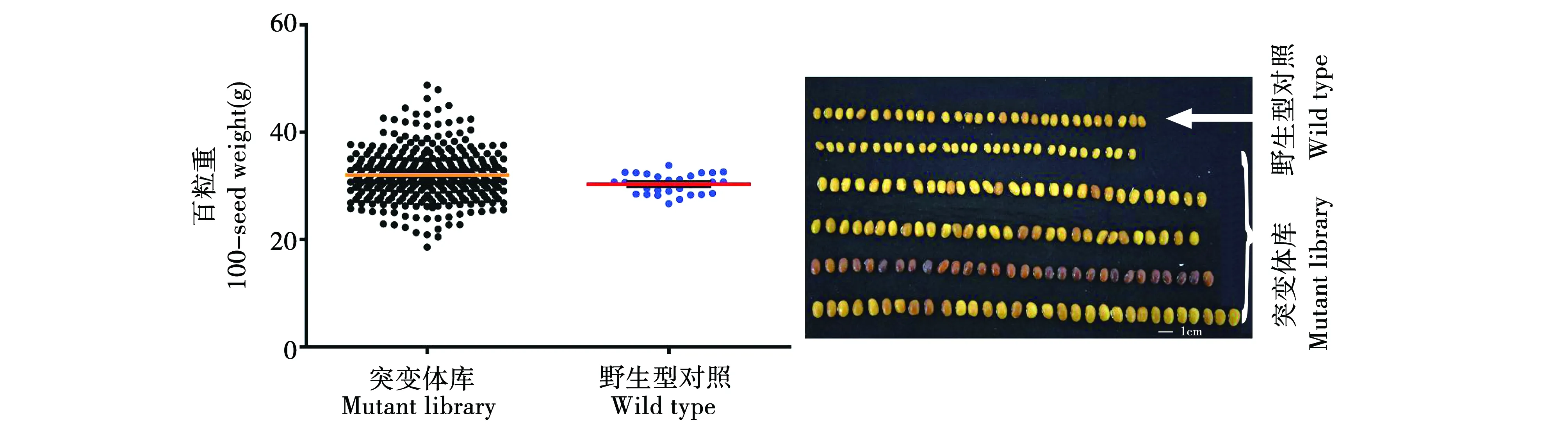
图1 黄金勾突变体库部分种粒百粒重分布Fig.1 100-seed weight distribution of mutant library and wild type of Golden Hook
选取差异较大的代表性状材料如大粒(菜434)、小粒(菜601),与野生型对照分别随机重复测定百粒重、粒长及粒宽各30次,方差分析结果显示差异显著(P<0.05)。菜434百粒重比野生型重8.31 g,重27.4%;菜601比野生型轻7.45 g,轻24.6%。菜434、菜601突变株种粒与野生型分布范围差异明显,百粒重和粒宽性状分布存在显著性差异,说明此次研究在数量性状方面具有丰富的筛选潜力,可在育种研究中提供百粒重和粒型方面种质优良的亲本,见图2。
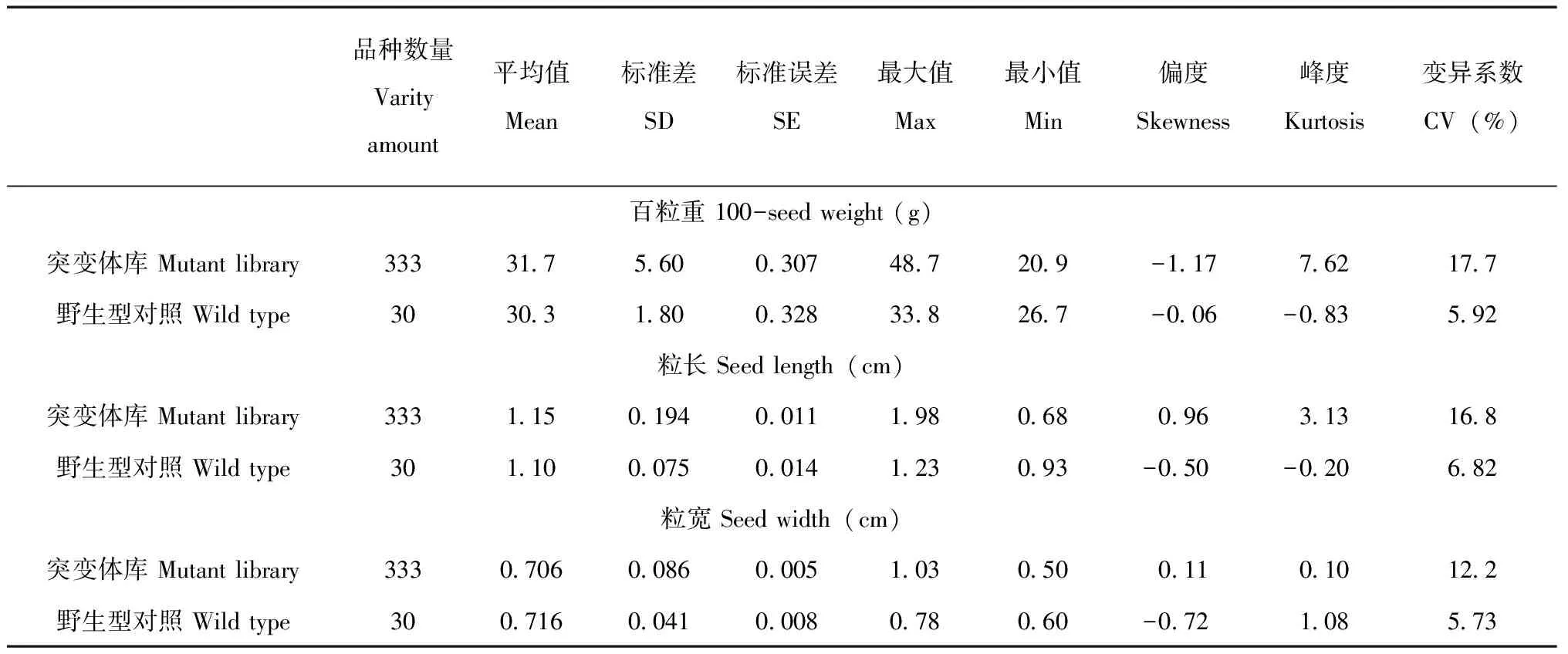
表1 黄金勾突变体库与野生型百粒重、粒长及粒宽比较Table 1 A comparison of 100-seed weight,seed length and seed width between mutant library and wild type of Golden Hook
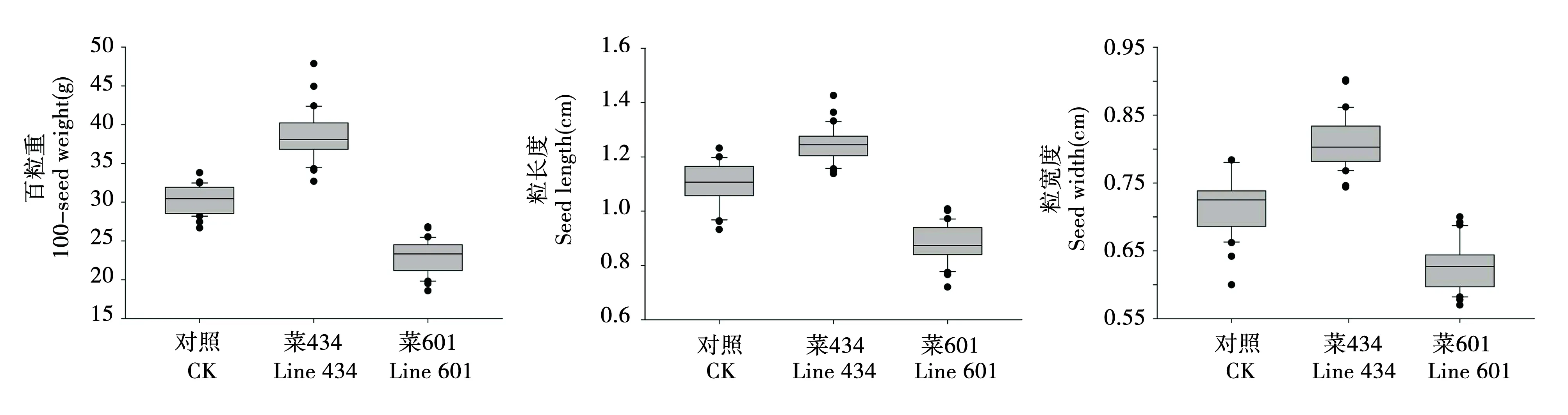
图2 黄金勾突变体大粒、小粒与野生型百粒重、种粒长及种粒宽分布Fig.2 Distribution of 100-seed weight,seed length and width of wild type and mutants with large and small seed of Golden Hook
2.2 M1-3代植株表型变异观察
经60Co γ诱变处理的黄金勾于M1代田间种植出苗率明显低于对照,出苗后白化及死苗率约20%,不少植株生长明显迟缓,至出苗后一个月左右才恢复生长,说明处理剂量适中。M1代收获的种子混收后,M2代种植在中国科学院西双版纳植物园园区内(云南省)加代繁种,单株收获。
60Co γ 射线辐射诱变处理菜豆黄金勾,M3代607株行发现了表型变异,占辐射诱变M3代群体总株行数的17.3%,其中叶性状突变占总表型变异的50.4%,株高性状突变占总表型变异的20.3%,见表2。
2.2.1 生育期性状突变。生育期性状包括开花与成熟期。因黄金勾生长周期短,开花较为集中,开花表型与成熟存在变异,总变异为34株行,见表2。
2.2.2 株型突变。因野生型品种为非蔓生的地架豆品种,在M3代表型的植株矮化较易观察,共有123株行在株高上出现了明显的变异。出现的矮化变异株行中,有39株行的野生型与矮化突变体的比例呈3∶1分离。

表2 菜豆品种黄金勾伽玛射线突变体库的M3代变异表型观察Table 2 Phenotypic observation of a gamma-radiation-induced mutant library of Golden Hook in M3 generation
2.2.3 豆荚表型突变。诱变处理后得到的黄金勾突变群体中,观察到成熟期植株豆荚荚色呈绿色,豆荚宽大且直的宽豆荚变异植株,具有特异性,在M4代验证得到相同表型,见图3A;因野生型黄金勾品种的可食用的豆荚为黄色且呈弯状勾型,豆荚表型易于观察。最典型的变异就是豆荚呈绿色,同时绿色豆荚的弯曲度变小呈直线型,勾状特征消失,见图3B。绿荚变异共8株行,其中2株行绿荚∶黄荚比例呈3∶1分离,1株行黄荚∶绿荚比例呈15∶1分离;除此之外还有分离比偏离3∶1分离的株行及所有株均为绿荚的株行。

注:A:大型豆荚变异;B:豆荚黄绿分离突变表型;C:叶色黄化;D:叶片皱缩突变。Note:A:Larger pod; B: Green pod ; C: Etiolated seedling; D:Wrinkly Leaf.图3 菜豆黄金勾部分突变体表型变异Fig.3 Phenotypic variations of some Golden Hook mutants
2.2.4 叶突变。诱变处理后得到的菜豆黄金勾,叶部变异较易观察。叶色突变常始于苗期,观察到的共有379株行在叶型、叶色上有明显变化。黄金勾突变群体中叶性状突变体占较大比重。白化苗在苗期大部分死亡,黄化苗叶色变化在苗期较为明显[33],见图3C。同时观察到有叶型变窄、叶片皱缩的突变表型,见图3D。
2.2.5 种子突变。在株行或单株收获、脱粒后观察到种子形态发生变化,如种皮皱缩或种子大小上呈现明显变异。
2.2.6 育性。不育表型在突变库中较为丰富,见图4。其中,有不同类型的不育特征。大多不育为产生无籽粒的肉荚。豆荚短小,长度最小仅有1.3 cm左右。但不育株中还产生少数几粒籽粒,推测该不育类型为雄性不育,因昆虫或风媒的传播致使能产生少数籽粒。还有一些类型,为花器官异常,如双柱头突变,即在一个花序处生长出两个豆荚,且豆荚顶端重叠与畸型,见图5A-C。

图4 不育株和野生型 Fig.4 Sterile plant and wild type

图5 双柱头突变体表型Fig.5 Sterile mutant with two stigmas per pod
2.3 重要突变体M4代表型验证
选取部分重要变异性状株行,进一步在M4代进行表型观察,验证M3代性状观察的结果。菜突230在M4代种植11株行共166株,其中2株行正常表型∶矮化突变体比例呈3∶1分离;菜突372在M4代种植10株行,其中3株行野生型∶叶片卷曲突变体比例呈3∶1分离;菜突777和菜突772表型均发生明显变异,符合M3代表型观察结果,并在菜突772中发现新表型变异材料如双柱头突变。
3 讨 论
本研究运用辐射诱变的方法使生物DNA损伤或断裂,在修复过程中发生错误拼接与复制,致使其表型产生变异,辐射诱变在培育优良种质资源的研究中更是获得了很多的成就。彭振英等[34]利用60Coγ辐射诱变处理花生种子进行并构建花生突变体库,获得了如高油突变体、高蛋白突变体等有价值的突变体,为花生功能基因组学研究提供了丰富的材料。鹿文成等[35]利用60Coγ辐射诱变大豆种子,经多代选育早熟、高产、稳产、优质及广适性等突出特点的大豆新品种,为大豆产量和品质的提高提供良好的种质基础。
不同于表型差异明显的质量性状,个体差异表现连续的数量性状由多基因控制。百粒重是大豆等作物产量方面的重要农艺性状,也是重要的育种目标之一[36]。菜豆突变体的百粒重、粒型分析在一定程度上优化突变体材料的选择和应用,扩大优良单株的繁种优势,在今后的研究中找出与菜豆百粒重、粒型关系密切的相关因素,可为菜豆育种提供重要的种质资源,根据需求选育优良品种。
菜豆具有生长周期短,基因组小,重复序列比率低,营养价值高及与大豆亲缘关系近等特点,所建立的突变体库对于研究菜豆基因组功能具有重要意义。本研究通过伽玛诱变处理所获得菜豆突变体库中,已观察到了丰富的变异类型如在株型、叶部性状、荚部性状、籽粒大小及生育期性状与育种上均获得了较为丰富的可观察的性状。其中不少变异性状是研究大豆光周期反应、产量性状等功能基因及基因调控网络的重要遗传材料。
前期的研究表明,我国主要菜豆品种为短日照作物,但品种间生育期与光周期反应存在着明显的差异,其分子机理并不明确。研究明确其相关的分子基础,在理论上可以解释菜豆为什么为短日照作物,可与大豆的光周期反应途径进行比较;在生产上可通过分子设计育种来培育具有不同生育期长度与不同光周期反应敏感性的品种,扩大品种的种植范围等具有重要应用前景。本突变体库中所获得的成熟期变异,在M3株行中如该性状出现明显的3∶1分离比,可以通过极端性状混池测序,并利用现代的生物信息学技术手段鉴定可能的候选基因。同时将突变体与不同生态类型的菜豆品种杂交配制遗传定位群体,验证所鉴定出的候选基因准确性。在获得候选基因的基础上,进行功能验证。
我们将继续在除哈尔滨市以外具有季节特点的育种基地对菜豆品种黄金勾南繁加代,投入更多精力,深入、细致地对特殊材料进行观察、记录表型、测量行间距等研究,选育出具有稳产、广适用性的菜豆新品种。目前,菜豆光周期开花调控的研究依然停留在基因的定位水平,基因功能的研究很少,这些突变体新性状的发现不仅丰富了菜豆的育种信息,也为豆科植物基因功能的分析提供材料。
本论文所报道的表型,是初步肉眼所能观察的简单性状的表型,具有特殊风味口感的黄金勾品种在纤维素含量、次生代谢物质、维生素含量及类胡萝卜素等含量上还要经过生物学测定,特别是利用现代代谢组学的技术手段来进行研究。
在本试验中,我们还利用黑龙江大学提供的一个矮生15品种,用同样的方法制成了一个大荚类型的菜豆品种的小型突变体库。该品种属于我国东北地区特有的地方油豆角品种,具有豆荚大、绿色、植株为非蔓生的矮杆类型等特点。两个突变体不仅代表两个不同类型,同时所获得的突变体可相互与对方品种的野生型配制杂交组合来配制验证遗传群体。
虽然部分性状已在M4代中得以验证与较深入的研究,大多突变株库的材料,将于今后数年陆续种植,很多材料将会继续分离出不同变异类型的表型性状,同时,我们要建立一个Tilling 群体,用于筛选不同基因的变异类型。
本试验中所获得的很多与产量性状直接相关的性状,如大荚性状、多荚性状可直接用于育种中。总之,深入研究黄金勾突变体库中的重要的突变类型,有利于我们加深对菜豆基因组的了解,同时在为豆科其他近缘种的基因功能及豆科植物的进化提供重要的遗传材料。
参考文献(References):
[1] 郑卓杰.中国食用豆类学[M].北京: 中国农业出版社,1997:222-249.
ZHENG Z J.Food Legumes in China[M].Beijing: China Agriculture Press,1997:222-249.
[2] VAN SCHOONHOVEN A,VOYSEST O.Common reans-research for crop improvement[M].CAB International.Cali,CO:Centro Internacional de Agricultoura Tropical(CIAT),Oxon,GB,1991.
[4] 王兰芬,武 晶,王昭礼,等.普通菜豆种质资源表型鉴定及多样性分析[J].植物遗传资源学报,2016,17(6):976-983.
WANG L F,WU J,WANG Z L,et al.Morphological diversity and classification of common bean(PhaseolusvulgarisL.) germplasm resources[J].Journal of Plant Genetic Resources,2016,17(6):976-983.
[5] 张福平,陈蔚辉,许秀彦,等.菜豆的营养成分分析[J].中国食物与营养,2006(2):55.
ZHANG F P,CHEN W H,XU X Y,et al.Analysis on the nutritious ingredient of phaseolus vulgaris[J].Food and Nutrition in China,2006(2):55.
[6] 李曙轩.几种豆类作物的光周期反应[J].作物学报,1963,2(3):251-260.
LEE S H.The influence of photoperiod on the growth and flowering of beans in China[J].Acta Agronomica Sinica,1963,2(3): 251-260.
[7] GARNER W W,ALLARD H A.Effect of the relative length of day and night and other factors of the environment on growth and reproduction in plants[J].Journal of Agricultural Research,1920,18: 553-606.
[8] OWEN F V.Inheritance studies in soybeans: II.Glabrousness,color of pubescence,time of maturity,and linkage relations[J].Genetics,1927,12(6): 519-529.
[9] GARNER W W.Comparative responses of long-day and short-day plants to relative length of day and night[J].Plant Physiology,1933,8(3): 347-356.
[10] HEINZE P H,PARKER M W,BORTHWICK H A.Floral initiation in Bi-loxi soybean as influenced by grafting[J].Botanical Gazette,1942,103(3): 518-530.
[11] COULTER M W,HAMNER K C.Photoperiodic flowering response of Biloxi soybean in 72-hour cycles[J].Plant Physiology,1964,39(5): 848-856.
[12] BERNARD R L.Two major genes for time of flowering and maturity in soybeans[J].Crop Science,1971,11(2): 242-244.
[13] BUZZELL R I.Inheritance of a soybean flowering response to fluorescent daylength conditions[J].Cenome,2011,13(4):703-707.
[14] BUZZELL R I,VOLDENG H D.Inheritance of insensitivity to long daylength[J].Soybean Genetics Newsletter,1980,7: 26-29.
[15] MCBLAIN B A,BERNARD R L,CREMEENS C R,et al.A procedure to identify genes affecting maturity using soybean isolinetesters[J].Crop Science,1987,27(6): 1127-1132.
[16] RAY J D,HINSON K,MANKONO J E B,et al.Genetic control of a long-juvenile trait in soybean[J].Crop Science,1995,35(4): 1001-1006.
[17] BONATO E R,VELLO N A.E6,a dominant gene conditioning early flowering and maturity in soybeans[J].Genetics and Molecular Biology,1999,22: 229-232.
[18] COBER E R,VOLDENG H D.A new soybean maturity and photoperiod-sensitivity locus linked toE1 andT[J].Crop Science,2001,41(3): 698-701.
[19] COBER E R,MOLNAR S J,CHARETTE M,et al.A new locus for early maturity in soybean[J].Crop Science,2010,50(2): 524-527.
[20] 杜维广,盖钧镒.大豆超高产育种研究进展的讨论[J].土壤与作物,2014,3(3): 81-92.
DU W G,GAI J Y.A discussion on advances in breeding for super high-yielding soybean cultivars[J].Soils and Crops,2014,3(3): 81-92.
[21] ABE J,XU D H,MIYANO A,et al.Photoperiod-insensitive Japanese soybean landraces differ at two maturity loci[J].Crop Science,2003,43(4):1300-1304.
[22] STEWART D W,COBER E R,BERNARD R L.Modeling genetic effects on the photothermal response of soybean phenological development[J].Agronomy Journal,2003,95(1):65-70.
[23] YAMANAKA N,NINOMIYA S,HOSHI M,et al.An informative linkage map of soybean reveals QTLs for flowering time,leaflet morphology and regions of segregation distortion[J].DNA Research,2001,8(2): 61-72.
[24] YAMANAKA N,WATANABE S,TODA K,et al.Fine mapping of theFT1 locus for soybean flowering time using a residual heterozygous line derived from a recombinant inbred line[J].Theoretical and Applied Genetics,2005,110(4):634-639.
[25] XIA Z J,WATANABE S,YAMADA T,et al.Positional cloning and characterization reveal the molecular basis for soybean maturity locusE1 that regulates photoperiodic flowering[J].Proceedings of the National Academy of Sciences of the United States of America,2012,109(32): 2155-2164.
[26] 张兴政.大豆E1基因及其豆科植物高度同源序列的功能保守及分化研究[D].北京: 中国科学院大学,2016.
ZHANG X Z.Functional conservation and diversification of the soybeanE1 gene and its homologs in legumes[D].Beijing: University of Chinese Academy of Sciences,2016.
[27] 魏臻武,盖钧镒.豆科模式植物蒺藜苜蓿基因组研究进展[J].中国草地学报,2006,28(6): 83-90.
WEI Z W,GAI J Y.Advances in genomic study on the legume model plantmedicagotruncatula[J].Chinese Journal of Grassland,2006,28(6):83-90.
[28] SCHMUTZ J,MCCLEAN P E,MAMIDI S,et al.A reference genome for common bean and genome-wide analysis of dual domestications[J] .Nature Genetics,2014,46(7):707-713.
[29] SONG Q J,JIA G F,HYTEN D L,et al.SNP assay development for linkage map construction,anchoring whole-genome sequence,and other genetic and genomic applications in common bean[J].G3-Genes Genomes Genetics,2015,5(11): 2285-2290.
[30] 吴春雷,翟 红,吴红艳,等.大豆极早熟品种60Coγ射线突变体库的建立及突变表型鉴定[J].大豆科学,2014,33(6):820-825.
WU C L,ZHAI H,WU H Y,et al.Identify of mutant phynotype and construction of60Co γ mutant population for soybean extremely early maturing cultivar[J].Soybean Science,2014,33(6):820-825.
[31] CHEN C L,WANG H H,JENG T L,et al.Genetic diversity in NaN3-induced common bean mutants and commercial varieties detected by AFLP[J].Crop Breeding and Applied Biotechnology,2011,11(4): 365-369.
[32] PORCH T G,BLAIR M W,LARIGUET P,et al.Generation of a mutant population for TILLING common bean genotype BAT 93[J].Journal of the American Society for Horticultural Science,2009,134(3): 348-355.
[33] 何 冰,刘玲珑,张文伟,等.植物叶色突变体[J].植物生理学,2006,42(1):1-9.
HE B,LIU L L,ZHANG W W,et al.Plant leaf color mutants[J].Plant Physiology Communications,2006,42(1):1-9.
[34] 彭振英,王兴军,田海莹,等.花生60Co-γ辐射诱变和突变体库的构建[J].核农学报,2016,30(3):422-429.
PENG Z Y,WANG X J,TIAN H Y,et al.60Co-γ radiation and construction of mutant bank ofArachishypogeaeL.[J].Journal of Nuclear Agricultural Science,2016,30(3):422-429.
[35] 鹿文成,闫洪睿,张 雷,等.60Co-γ射线诱变选育早熟和高产及优质大豆新品种黑河52[J].黑龙江农业科学,2011(9):4-6.
LU W C,YAN H R,ZHANG L,et al.Breeding of soybean cultivar heihe 52 with early maturity,high yield and good quality by hybridization and60Coγ-ray irradiation[J].Heilongjiang Agricultural Sciences,2011(9): 4-6.
[36] 陈远东,喻德跃.EMS诱发大豆“南农94-16”突变体库的扩建及部分突变体的SSR分析[J].大豆科学,2009,28(4):574-577,582.
CHEN Y D,YU D Y.Construction of mutant pools for soybean “nannong 94-16” induced by EMS and analysis of SSR marker on several mutants[J].Soybean Science,2009,28(4):574-577,582.
