不同乙状结肠造口位置的并发症及临床指标的对比分析
2018-06-19王正华徐衍香
王正华 徐衍香
(1 山东省日照市妇幼保健院,山东 日照276800;2 日照市市北经济开发区医院,山东 日照 276800)
直肠癌是常见的恶性肿瘤之一。各个国家之间直肠癌的发病率都存在差异[1]。亚洲和非洲国家以及南美地区直肠癌的发病率较低,东欧和北欧诸国属于中等发病率国家,而北美、西欧和澳洲等经济发达国家直肠癌的发病率较高[2]。其大肠癌常为第一、二位常见的恶性肿瘤,在我国大肠癌为第四、五位的常见恶性肿瘤。而我国大肠癌的发病率及病死率也在逐年增高[3]。为探讨探讨低位直肠癌保肛手术与腹部人工肛门治疗的临床疗效,本研究选取我院收治的低位直肠癌患者分组采用低位直肠癌保肛手术和腹会阴联合直肠癌根治术(Miles手术)治疗,报道如下。
1 资料与方法
1.1 一般资料:选取我院(2014年1月至2017年1月)收治的低位直肠癌患者46例为研究对象,均符合临床诊断标准。将所有患者根据手术方案差异分为观察组与对照组,每组23例,观察组采用低位直肠癌保肛手术治疗,对照组采用Miles术治疗。观察组男13例,女10例;年龄54~74岁,平均(61.8±8.2)岁;肿瘤大小1.3~4.9 cm,平均(2.6±1.2)cm;Ducks分期,2例A期、15例B期、6例C期;对照组男12例,女11例;年龄55~74岁,平均(63.8±6.5)岁;肿瘤大小1.3~5.1 cm,平均(2.7±1.4)cm;Ducks分期,3例A期、14例B期、6例C期。两组患者性别、年龄、肿瘤大小、Ducks分期等一般资料相比无明显差异,且P>0.05,无统计学意义,具有可比性。
1.2 方法:两组患者均进行直肠癌切除术的术前准备。手术前准备根据患者的术前状况应作外科手术前的准备。对患者的全身情况做全面的估价,有针对性地处理好可能同时存在的心脑血管病、糖尿病和贫血等病症,使患者能安全度过围手术期,减少术后并发症。纠正患者的营养状况和水电解质平衡紊乱,没有消化道功能异常的患者,可行完全肠道内营养支持,每天给5~8 MJ热量和8~12 g有机氮[4]。如果不能行肠内营养则应做静脉营养以达到上述目的。
除了要改善患者的营养状况外,还要做结肠内准备即清洁结肠内有渣内容物。传统的肠道准备方法是患者术前3 d流质饮食,口服泻药导泻,每晚灌肠,口服抗生素。常用的泻药为蓄泻叶15 g代茶饮或7%甘露醇500 mL口服,抗生素则为灭滴灵0.2 g和新霉素0.5 g或卡那霉素0.5 g口服。每6~8 h口服1次。同时建议患者大量饮水以稀释肠道内不能被肠壁吸收的内容物。术前一天晚和手术日晨则行清洁灌肠,以保证肠腔的清洁。这种由下而上的清洁肠道的方法费时较多,且易引起肿瘤细胞在近端肠腔内的脱落、种植,故近年来多数学者主张做全肠道灌洗,即由上而下的准备方法,这样省去控制饮食、每晚灌肠、口服抗生素和术前清洁灌肠等步骤[5]。
对照组采用Miles术治疗,常规在左下腹进行人工肛门造口,手术切除的范围包括全部直肠及其固有筋膜内的脂肪组织、淋巴组织、大部分乙状结肠及其系膜和淋巴组织、腹主动脉前肠系膜下血管根部的淋巴组织、盆底腹膜、直肠侧韧带、提肛肌、肛管、肛门周围皮肤、肛管括约肌和坐骨直肠窝的脂肪淋巴组织。麻醉采用全麻或连续膜外麻醉,一般需要两根导管,分别由T12~L1椎间隙和L3~4椎间隙插入,管端向头侧,深入3 cm。手术体位多采用膀胱截石位,大腿外展呈120°;骶尾部垫以8 cm厚的软垫,使肛门提高并超越该垫游离缘5~6 cm,以便会阴部操作。托腿架上必须放置3~5 cm厚的海绵垫,并注意小腿放置于适当位置,以免因腓总神经受压而致术后神经麻痹。操作步骤:①切口与探查。采用下腹部正中切口或旁正中切口,逐层切开进入腹腔。先探查肝脏有无转移灶,继而探查全部结肠有无多原发癌灶,然后由十二指肠第三段向下。最后将乙状结肠向上拉紧,轻轻探查局部病变,确定病变与腹膜反折的关系,浆膜是否已被累及,盆底腹膜有无种植转移,病变与周围组织浸润的程度,以检查肿瘤的活动度。②乙状结肠及其系膜的分离。提起乙状结肠,将小肠裹以纱布垫回纳入上腹腔,并在腹腔安置三叶固定拉钩防止小肠脱出。于肿瘤近端约10 cm用纱布条结扎肠腔,并于结扎远端肠腔注入5-Fu 1500 mg,以防止脱落癌细胞的扩散。提起乙状结肠并拉向右侧,沿乙状结肠系膜左叶根部及直肠左侧向下切开后腹膜,对女性患者应达直肠子宫陷凹,对男性患者则可沿直肠膀胱壁切开,与对侧切口会合。经此切开后稍行分离即可显露两侧输精管及精囊。以此作为标志,在游离直肠两侧韧带时,如在精囊水平后方操作将不致损伤输尿管。在此操作过程中注意勿损伤两侧输尿管。③结扎肠系膜下血管,提起乙状结肠并拉向左侧,向上延长乙状结肠右叶系膜根部切口,直达肠系膜下动脉根部,双重结扎切断肠系膜下动脉,于其左侧找到肠系膜下静脉,亦予以结扎切断。左侧输尿管与肠系膜上静脉在此处行程较近,结扎时应特别小心,防止损伤。④直肠后壁的分离。提起乙状结肠用电刀自乙状结肠系膜根部与腹主动脉分叉处进行分离,达直肠固有筋膜之后,沿盆筋膜壁层和下腹下神经丛游离进入骶前直肠间隙。此间隙为疏松的结缔组织,可采用手指钝性分离及电刀、剪刀的锐性分离,向下达尾骨尖水平。当直肠固有筋膜与盆筋膜壁层有纤维束带紧密相连不易分离时,须用电刀或钳夹锐性分离,切莫盲目硬性分离,否则易撕裂盆筋膜壁层及其深面的骶前静脉丛,引致不易控制甚至致命的大出血。⑤直肠前壁的分离。直肠前壁的分离以手指进行钝性分离为好,锐性分离常易造成出血。男性病员可沿膀胱、精囊后壁平面进行分离,一般均较疏松,用手指向下稍行分离即可顺利地到达前列腺尖端平面。分离时宜靠近精囊和前列腺,以防止穿破直肠。女性患者沿直肠阴道间隔分离,至阴道后壁中段。⑥直肠侧韧带的切断。将下段直肠向左侧拉紧,即可清晰显示右侧侧韧带,用电刀或钳夹切断。此处血供是直肠中动脉,常较细小,多数不用结扎。当动脉较粗出血明显时才需结扎。在切断侧韧带时应将输尿管进入膀胱处以深拉钩向侧前方轻轻拉开,以避免损伤。继之将直肠下段拉向右侧,以相同方法切断左侧韧带。⑦乙状结肠腹壁造口。乙状结肠的造口位置应因人而宜,一般选择在左下腹壁髂前上棘至脐连线的中外1/3处,以有齿组织钳垂直拉起皮肤,用手术刀或剪刀与皮肤平行切去直径约3 cm的圆形皮肤及皮下组织,在腹外斜肌膜及腹膜做十字形切开,使造口能容纳2指。在乙状结肠近端选择切断点,其保留长度要求能拉出至腹壁外造口处约2 cm而无张力。结扎乙状结肠系膜血管,横断乙状结肠,近端自造口处拉出,远端用7号线做双层荷包缝合结扎并套避孕套以防污染。荷包缝合结肠旁沟间隙,以免术后形成小肠内疝。近端乙状结肠与造口处腹壁分四层缝合固定,即将腹膜、腹外斜肌腱膜、皮下组织及皮肤(后缝)分别缝合。最后应将肠黏膜外翻,并放置一次性造口袋。⑧会阴部手术。会阴部手术应重新消毒并双重荷包缝合肛门防止污染。肛门周围皮肤切除的范围,可据病变的位置而定,肛管癌和肛门癌切除范围应较大,直肠癌切除范围可稍小。会阴部手术困难和易出血者是肛管和直肠前方,因而一般先由两侧和后方进行游离,用4把Alies钳夹住切口内侧皮肤缘做牵引,用椎板牵开器牵引皮肤,沿两侧及后方逐层切脂肪,此过程注意结扎两侧肛门动脉。继续向深部分离切断提肛肌,并提肛肌上筋膜切开,多数情况下应在腹部术者的引导下将此筋膜切开,防止撕脱骶前筋膜致术中骶前静脉出血。将肛管向下牵拉,沿会阴浅横肌逐步向深处分离,用食指、中指和无名指由内向外抵在前列腺后壁和直肠之间作为标志,电刀对准手指方向于直肠和前列腺之间逐层切断耻骨直肠肌和直肠尿道肌,标本移除后,应仔细止血并冲洗盆腔,间断缝合盆底腹膜,重建盆底。于骶前放置双腔引流管后,逐层缝合会阴部。如细微止血后创面仍少量渗血,也可用2只剪去5指的无菌手套,内填妇科用填塞纱布条填塞会阴腔压迫止血,会阴皮肤做部分缝合,术后4~7 d逐步将纱布条抽出[6]。
表1 两种患者一般手术情况对比[n(±s)]
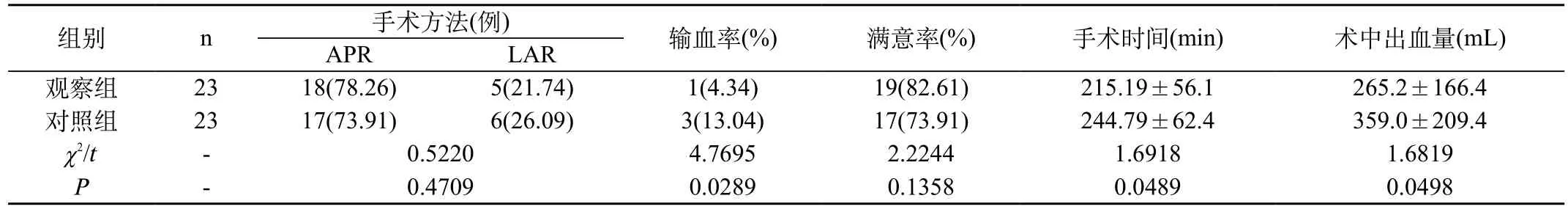
表1 两种患者一般手术情况对比[n(±s)]
注:APR为经腹会阴联合切除术;LAR为经肛门低位直肠肿瘤切除
组别 n 手术方法(例) 输血率(%) 满意率(%) 手术时间(min) 术中出血量(mL)APR LAR观察组 23 18(78.26) 5(21.74) 1(4.34) 19(82.61) 215.19±56.1 265.2±166.4对照组 23 17(73.91) 6(26.09) 3(13.04) 17(73.91) 244.79±62.4 359.0±209.4 χ2/t - 0.5220 4.7695 2.2244 1.6918 1.6819 P-0.4709 0.0289 0.1358 0.0489 0.0498
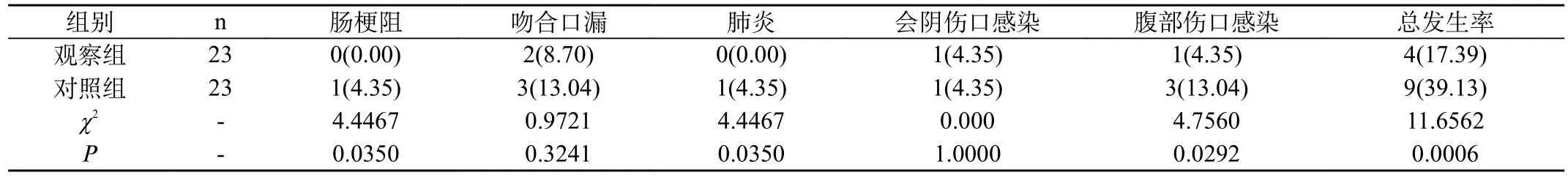
表2 两组患者术后并发症对比[n(%)]
观察组采用低位直肠癌保肛手术治疗,此手术显露好,损伤不大,只需经腹进行手术并能保留正常肛门,是较为理想的手术。此术式的体位、繁琐程度、切口均同Miles手术。直肠的解剖游离亦同Miles手术。远端直肠的切除范围应根据肿瘤的生物学特性决定。需要特别强调的是横断远端直肠前应先用直角Kc-cker-钳夹住远端切线,然后扩肛达四指后用1∶2000洗必泰1000 mL冲洗远端直肠,切除病灶行肠管端端吻合术[7]。我们认为吻合口以置于盆底腹膜外为妥,防止发生吻合漏致腹膜炎,术后3 d应定期扩肛。此术式亦可采用吻合器吻合,常用的方法有两种即EEA(Endto End Anastomcsis)吻合器吻合法和DTT(Double Tampler Techickes)吻合器吻合法。前者是端端吻合而后者则是端侧吻合,其更适宜于低位吻合术[8]。
1.3 观察指标:观察并记录两组患者的输血率、满意率、手术时间、术中出血量、术后并发症发生情况[6]。
1.4 统计学处理:选用SPSS20.0统计学软件,计数资料以n(%)表示,组间疗效比较采取χ2检验,计量资料以(±s)表示,采用t检验,完成组间临床指标的比较,设P<0.05为差异有统计学意义。
2 结 果
2.1 两种患者一般手术情况对比:两组患者满意率对比无明显差异,不具有统计学意义(P>0.05);观察组手术时间、术中出血量均优于对照组,差异具有统计学意义(P<0.05)。见表1。
2.2 两组患者术后并发症对比:观察组术后并发症发生率为17.39%,对照组术后并发症发生率为39.13%,观察组术后并发症发生率明显低于对照组,差异具有统计学意义(P<0.05)。见表2。
3 讨 论
直肠癌很少见于40岁以下的成人,国外<40岁的直肠癌患者发病率约占2.5%,但我国直肠癌的发病率青年人比欧美国家要高得多,占10%~12%。且直肠癌多发生于直肠的中下段,这是我国直肠癌流行病学的特点。我国直肠癌平均发病年龄为55.2岁,男女之比为1.35∶1。国外男性直肠癌的发病率明显高于女性,其比率为1.6∶1。40岁以后年龄组内,每增加10岁直肠癌的发病率就增加1倍[9]。
直肠癌的根治手术的选择直肠癌的根治手术方法分为两类,即腹会阴联合切除根治术和直肠部分切除保留肛门括约肌根治术。手术的选择与下列诸多因素有关:如患者的性别、年龄、体型及肿瘤的位置、病理类型、分化程度、大小和与周围组织的浸润固定程度[10]。女性骨盆宽,分离切除肿瘤吻合比较容易,较男性患者为保肛提供了更大的可能性。年轻患者即青年人直肠癌(年龄≤30岁),其分化程度差,病理类型多为印戒细胞癌和黏液腺癌,故易局部复发和远处转移,预后较差,手术方式的选择应考虑到上述因素。体型较瘦的患者较肥胖型的患者更宜于行保肛手术。肿瘤的位置是决定能否行保肛手术的重要因素之一,直肠在临床上将其分为上、中、下三段,对上段直肠癌即距肛门10 cm以上的肿瘤,经充分游离直肠后可行保留肛门的前切除术即Dnixon手术。对下段直肠癌因其距肛门缘为6 cm以下,故宜行腹会阴联合切除术即Miles手术。肿瘤距肛门缘在6~10 cm的称为中段直肠癌,此段行何术式争议较大,应依据肿瘤的病理类型、分化程度和浸润深度来决定[11]。作者认为如果肿瘤≤1/2肠周,病理为高分化腺癌(未侵出纤维膜,DukesB1期),远端切除够3 cm可考虑行保肛手术。本研究结果显示,观察组满意率、手术时间、术中出血量均优于对照组,肠道恢复时间明显短于对照组,术后并发症发生率明显低于对照组,差异具有统计学意义(P<0.05),结果与文献[12]基本相似,说明了低位直肠癌保肛手术治疗效果。综上所述,低位直肠癌采用低位直肠癌保肛手术治疗效果比Miles术治疗效果好,具有小创伤、出血量少、肠道恢复时间快、并发症发生率低等优点,值得临床推广。
[1] 南琼.3种术式治疗低位直肠癌的疗效比较[J].西南国防医药,2017,27(7):662-664.
[2] 陈峰.刍议Miles术与Dixon术在直肠癌患者临床中的疗效对比[J].中外医疗,2016,35(2):86-87.
[3] 朱维刚.Miles术和Dixon术治疗直肠癌疗效对比分析[J].承德医学院学报,2015,32(6):488-489.
[4] 蒋帅.低位直肠癌保肛手术(Dixon)与Miles手术疗效的比较[D].大连:大连医科大学,2015.
[5] 李德钢,孔凡彪,刘春强,等.Miles术与Dixon术治疗低位直肠癌的Meta分析[J].世界华人消化杂志,2014,22(26):4027-4035.
[6] 吴欣,匡荣康,蒋勇敢,等.Miles术与Dixon术对老年直肠癌的疗效观察[J].中国肿瘤外科杂志,2014,6(3):195-197.
[7] 谭明华,朱劲涛,吕益中,等.腹腔镜辅助Dixon及Miles根治术治疗低位直肠癌的疗效比较[J].岭南现代临床外科,2014,14(3):251-255.
[8] 林武,梁海燕.Miles与Dixon术治疗直肠癌临床疗效比较[J].现代诊断与治疗,2014,25(8):1877-1878.
[9] 韩中仁.Dixon保肛术与Miles术治疗直肠癌的临床疗效对比研究[J].中国伤残医学,2013,21(6):136-137.
[10] 王华.Miles术和Dixon术治疗直肠癌的临床疗效对比分析[J].中国卫生产业,2012,9(28):149.
[11] 赖浩.腹腔镜下的Dixon手术与Miles手术在低位直肠癌治疗中的疗效比较[D].南宁:广西医科大学,2012.
[12] 胡凤龙.Dixon+TME术式与Miles+TME术式对低位直肠癌的疗效比较[J].临床医学工程,2012,19(4):602-603.
