外源NO诱导下MAPK基因在采后柑橘果实抗绿霉病中的表达分析
2018-06-15王苗苗闫化学
王苗苗,于 杰,钟 云,姜 波,吴 波,闫化学
(1.广东省农业科学院果树研究所,广东 广州 510640;2.西南大学园艺园林学院,重庆 400716)
指状青霉又称柑橘绿霉病菌(Penicillium digitatum),其引发的绿霉病对柑橘果实的生产、运输和存储等诸多环节造成巨大的经济损失,通常占柑橘贮藏期病害损失的90%以上[1]。长期使用杀菌剂已使某些种群产生了耐药性,如甲基托布津的防效已基本丧失[2]。因此,探索绿色、安全、高效的柑橘采后抗性诱导调控方式具有重要意义。
研究发现,病原菌入侵能够在多种植物体内诱导产生一氧化氮(NO),外源NO能够延迟采后果实成熟、提高耐寒性、抑制乙烯生物合成和表面褐化、增强果蔬采后抗病力[3-6]。在拟南芥、烟草等模式植物中,NO参与的植物抗病力的提高与丝裂原激活蛋白激酶(Mitogenactivated protein kinase,MAPK)调控途径相关。MAPK级联可调节植物抗病反应的信号分子物质NO的生成,诱导植物的抗病反应[7],比如烟草可通过MEK2-SIPK途径调控NO的积累,增强植株抗病能力[8]。病原微生物侵染或激发子诱导可使植物体内产生NO,与ROS协同引起细胞超敏反应,同时NO又有可能作为细胞间的信号分子将超敏信息传递给相邻细胞,激发细胞死亡[9]。NO还参与植物抗病反应的苯丙氨酸解氨酶基因PAL及病程相关蛋白基因PR1的转录,抑制一氧化氮合酶(NOS)活性显著降低PAL和查尔酮合成酶基因(CHS)的转录[7]。
柑橘果皮是抵御病原菌入侵的天然屏障,含有抑制病原菌侵染和定植的物质(比如多巴胺、皂素等)[10],柑橘还可以通过诱导防卫反应(如活性氧、乙烯等信号分子诱导的抗病反应)来限制或杀死病原菌[11]。然而,柑橘果实一旦感染绿霉病,短时间内即快速腐烂。可见,从绿霉病菌孢子附着果面到攻克寄主防御体系,是一个快速且复杂的病原-寄主互作的结果。激活MAPKs是植物识别病原相关分子模式(PAMPs)和病原菌效应子(Effectors)过程的最早事件之一[12]。我们前期研究发现,外源NO能够提高采后甜橙对绿霉菌的抗性,因此探讨NO和MAPK基因在采后柑橘果实与绿霉病菌的互作机制,有助于完善柑橘果实的抗病信号网络研究,为采后病害的防控提供新思路和理论基础。
理论上,MAPK级联这一高度保守的信号传递系统在柑橘果实与柑橘绿霉病菌的互作过程中应该起到较为关键作用。作为目前唯一所知的细胞内和细胞间的信号传递分子,NO在将胞外信号传递到胞内过程中与哪些MAPKs基因相关,以及如何影响MAPKs基因的表达尚未见报道。本研究以埃及糖橙(Citrus sinensis)作为材料,采用50 μmol/L硝普钠(Sodium nitroprusside,SNP)溶液处理柑橘果实,接种柑橘绿霉病菌孢子悬浮液,分析外源NO对柑橘果实抗绿霉病能力和对果皮中MAPKs基因表达的影响,初步探明柑橘果皮中MAPKs基因响应绿霉病菌侵染的表达模式,以及在外源NO诱导柑橘果实抗绿霉病过程中,柑橘MAPKs基因可能发挥的作用及相关机制。
1 材料与方法
1.1 试验材料
试验于2017年在广东省农业科学院果树研究所进行。供试的埃及糖橙种植于广东省农业科学院白云基地。采摘和运输过程中避免机械伤害,挑取果形饱满端正、无病虫害、无机械损伤的果实作为试验材料。
柑橘绿霉病菌分离自白云基地的柑橘绿霉菌病病果,实验室内进行单孢分离,分离的菌株移至PDA培养基斜面,4℃冰箱保存。
SNP(NO供体)购自成都市科龙化工试剂厂,多糖多酚植物总RNA快速提取试剂盒(离心柱型)购自北京百泰克生物技术有限公司,PrimeScript RT reagent Kit with gDNA Eraser(Perfect Real Time)试剂盒购自宝生物工程(大连)有限公司,NanoDrop 2000C微量分光光度计购自赛默飞世尔科技公司。
1.2 果实处理与取样
果实采摘后用自来水清洗果面,然后使用1%次氯酸钠溶液浸泡柑橘果实2 min,再用灭菌蒸馏水洗净,自然晾干。将果实浸没在浓度为50 μmol/L的SNP溶液中,对照果实浸没在双蒸灭菌水中,处理10 min,滤纸蘸去果面水分,室温下置于密封黑色塑料袋内[6]。用含0.01%Tween-80的无菌水洗脱在PDA培养基上25℃培养7 d的柑橘绿霉病菌,在无菌操作条件下,震荡混合后用无菌纱布过滤,滤液即为孢子悬浮液。使用血球计数将孢子悬浮液浓度调整至约1×105CFU/mL,随配随用。在SNP处理4 h后接种绿霉病菌孢子悬浮液。用200 μL枪头在果面赤道部位对称扎两个1 mm宽、2 mm深的孔,向扎孔处注入1.5 μL孢子悬浮液,对照组注入1.5 μL含0.01% Tween-80的无菌水。接种后将柑橘果实置于室温25(±2)℃、相对湿度80%~90%环境下贮藏,统计发病率和病斑面积。每个处理3次重复,每个重复15个果实。
取样时间及方法:分别在接种柑橘绿霉病菌 0 、4 、8 、12 、24 、48 、72 h 后取样,在接菌果实及相应对照切取病斑周围1~2 cm宽度未发病果皮,迅速放入液氮中速冻,置于-80℃冰箱中保存。
1.3 总RNA提取及反转录
使用多糖多酚植物总RNA快速提取试剂盒(离心柱型)提取柑橘果皮总RNA,操作步骤参照试剂盒说明书,用1%琼脂糖凝胶电泳检测RNA的完整性。取1 μL洗脱液用微量分光光度计测定总RNA浓度。
反转录使用PrimeScript RT reagent Kit with gDNA Eraser(Perfect Real Time)试剂盒,操作步骤参照试剂盒说明书。
1.4 实时定量PCR及数据分析
从NCBI网站下载柑橘MAPKs基因序列,使用Beacon designer 7.0软件(Palo Alto,CA,USA)设计qPCR引物(表1)。使用Bio-Rad的CFX96 Touch™ 荧光定量 PCR 检测系统完成qPCR实验。使用Bio-Rad CFX Manager 3.1分析qPCR数据,基因表达量计算使用2-ΔΔCt方法,柑橘CsACTIN基因作为内参[13]。
1.5 数据统计分析
应用Excel 2013统计分析所有数据并绘制图表。使用SPSS软件(Version 22.0,IBM SPSS,Chicago,IL)的单因素方差分析(oneway ANOVA)方法对试验数据进行差异显著性分析。
2 结果与分析
2.1 外源NO对柑橘果实接种绿霉病菌后发病率和病斑直径的影响
埃及糖橙果实接种柑橘绿霉病菌24 h后,NO处理和对照的部分果实开始在接种点周围出现水渍状坏死斑病症;接菌48 h后,NO处理果实发病率低于对照20%左右;接菌72 h后,NO处理果实发病率达到95%左右,对照果实全部发病(图1A)。NO处理果实的病斑直径显著小于对照果实(图1B)。
2.2 柑橘果皮中MAPKs基因的基础表达
果皮中不同MAPKs基因的基础表达量差异很大(图2)。使用表1中的引物,没有扩增到CsMAP7-like和CsMAPKB1基因的目标条带。CsMAP13-like和CsMAPMMK1的相对表达量最高,约是CsMAP7的20倍;CsMAP、CsMAP1、CsNTF3和CsMAPMMK2的相对表达量约是CsMAP7的10~15倍;CsMAP15的相对表达量约是CsMAP7的7倍;CsMAP4-like、CsMAP9、CsMAP9-like、CsMAP19-like和CsMAP20-like的相对表达量是CsMAP7的2~4倍。
2.3 绿霉病菌对柑橘果实中MAPK基因表达的影响
为了分析柑橘绿霉病菌对果实中MAPKs基因表达的影响,分别在对照果实接种绿霉病菌0、4、8、12、24、48、72 h后收集柑橘果皮样品,RT-qPCR检测各MAPKs基因的表达。结果表明,柑橘果实中MAPKs基因响应绿霉病菌的表达方式不同(图3)。
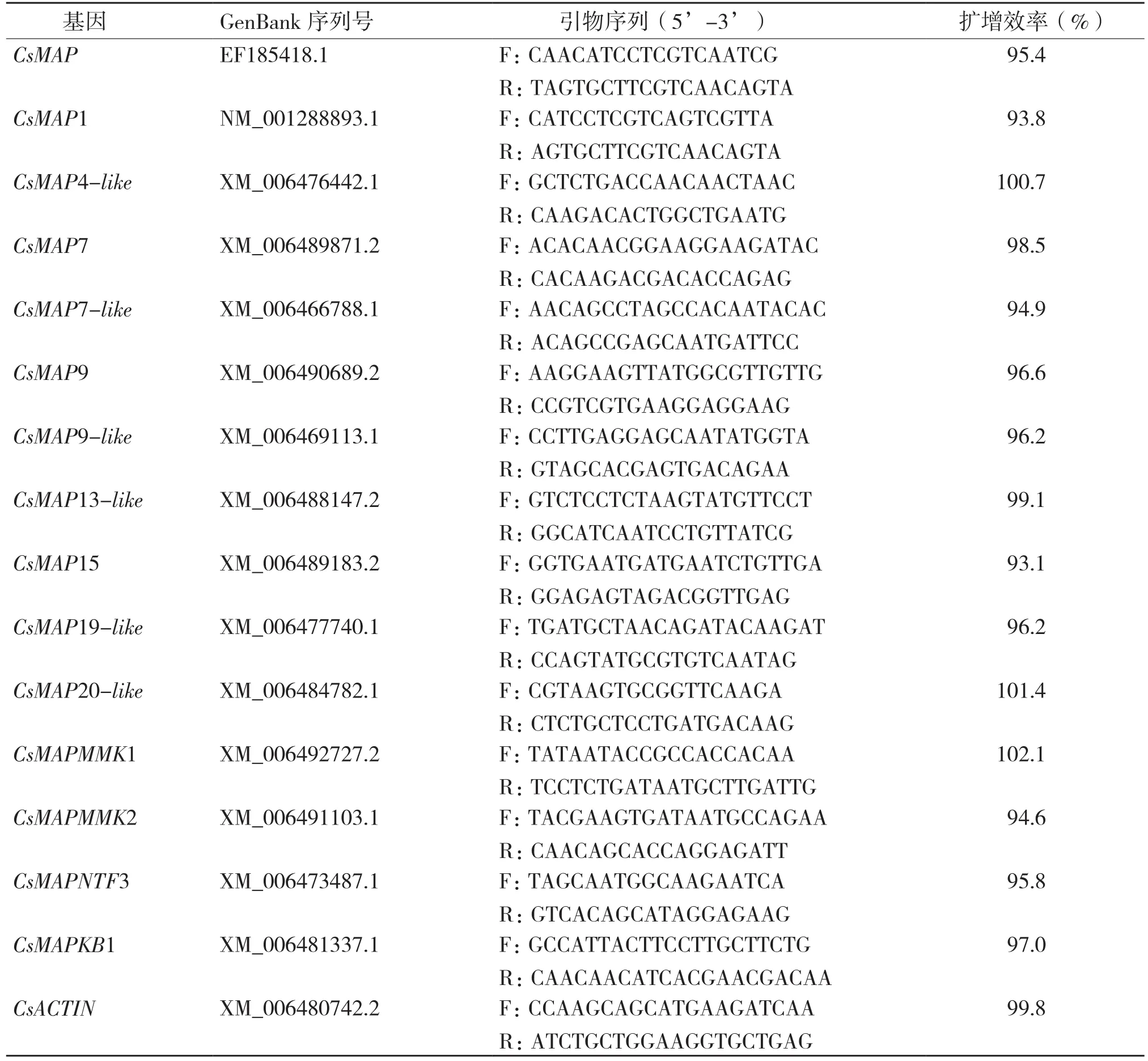
表1 柑橘MAPKs基因实时定量PCR引物序列
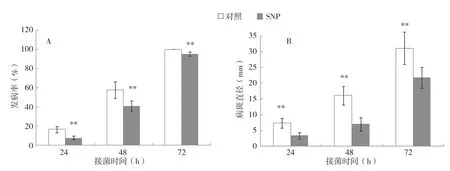
图1 外源NO处理对柑橘果实接种绿霉病后发病率和病斑直径的影响
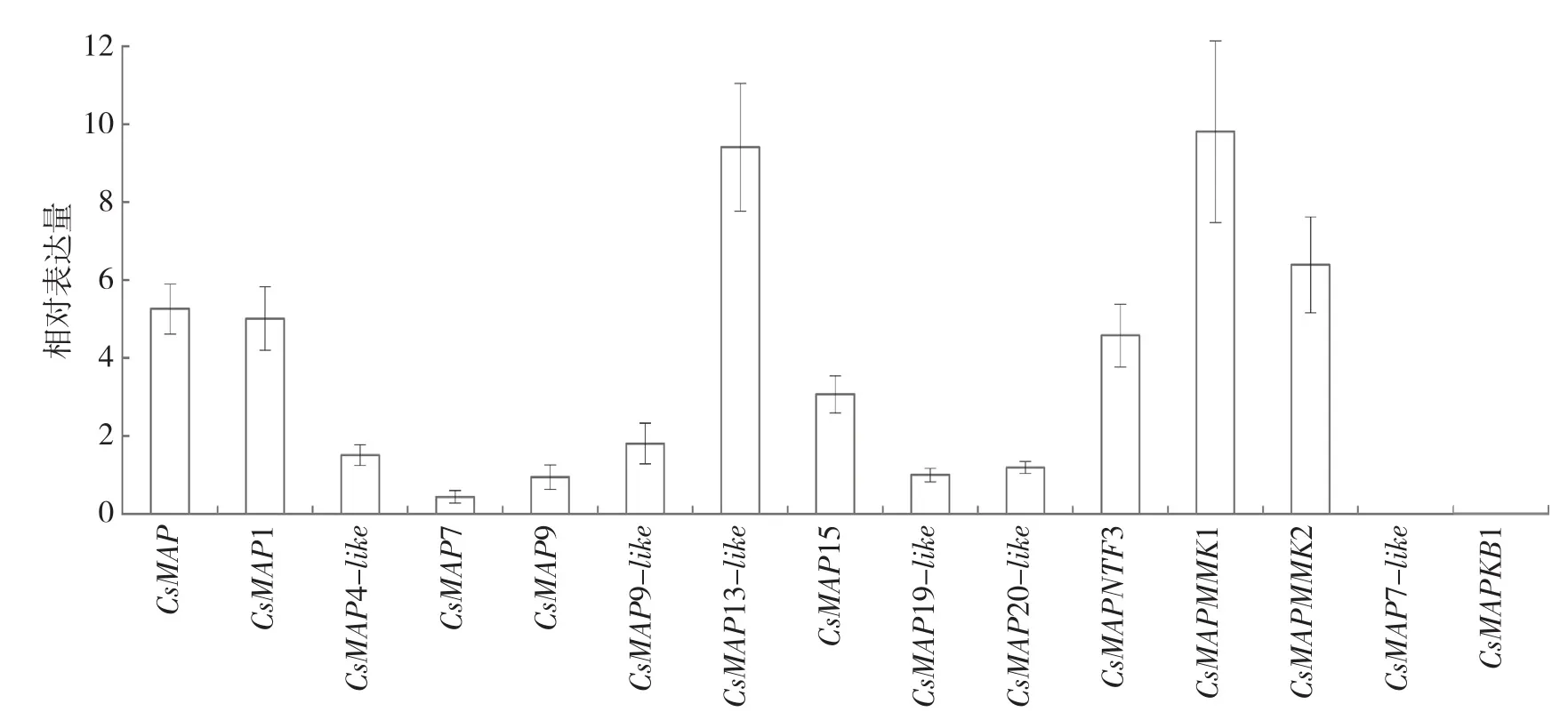
图2 柑橘果皮中MAPKs基因的基础表达情况
在整个试验期间,柑橘果皮中CsMAP和CsMAP1基因的表达都表现为先受到抑制后又受到诱导的模式。与接菌0 h的对照相比,CsMAP基因的表达在接种绿霉病菌4、8 h阶段受到抑制,相对表达量只有对照的60%左右;接种病原菌12~24 h,表达水平与对照相似,二者之间没有显著差异;接菌48 h后,CsMAP基因的表达受到绿霉病菌的诱导,直至试验结束的72 h,基因的表达水平显著高于对照果实,达到两倍以上。与同一时间点的对照相比,在接种绿霉病菌4 h后,CsMAP1基因的表达受到抑制,果皮中CsMAP1基因的相对表达量下调40%左右,随后相对表达量逐步增加,接菌24 h后达到显著水平,接菌72 h后的相对表达水平达到对照果实的2.5倍左右。
整个试验期间,对照果实中CsMAP9基因的相对表达量呈现阶段性下降的趋势,接菌0~8 h,CsMAP9基因的相对表达量无显著差异,接菌12~24 h的相对表达量相似,相比接菌0~8 h下降50%左右,贮藏48、72 h后,CsMAP9基因的相对表达量只有0 h时的25%左右。与同一时间点的对照相比,接种绿霉病菌48、72 h后,柑橘果皮中CsMAP9基因的表达受到病原菌诱导,相对表达量是对照果皮的5倍左右,其余时间点差异不显著。
在试验处理24 h之前,对照和处理柑橘果实中CsMAP20-like基因的表达相似,而接种绿霉病菌48、72 h后,果皮中CsMAP20-like基因的表达受到病原菌诱导,接菌48 h后表达水平达到顶峰,是同一时间点对照的2倍以上。
与对照相比,柑橘果皮中CsMAP19-like基因分别在接种绿霉病菌4、48、72 h后受到显著的诱导表达,接菌8~24 h与对照果实间无显著差异。
与对照相比,接种绿霉病菌4、8、12 h能够诱导柑橘果皮中CsMAP13-like基因的表达,表达量提高50%左右。而接菌24 h后,CsMAP13-like基因在同一时间点的对照和处理果实中的表达水平无显著差异。
对照柑橘果皮中CsMAP9-like基因的表达一直处于较高水平,贮藏48 h表达量到达顶峰,约是对照0 h的1.5倍。与对照相比,柑橘果皮中CsMAP9-like基因在接种绿霉病菌4、8、12 h后受到诱导表达,相对表达量都提高约40%。接菌24 h至试验结束,同一取样点对照和处理柑橘果皮中的CsMAP9-like基因表达水平无显著差异。
与同一取样点的对照柑橘果实相比,CsMAPMMK2基因在接菌4、8、12 h后受到绿霉病菌诱导表达,相对表达量分别提高约50.5%、42.9%和70.2%。接种病原菌24、48 h后,绿霉病菌处理和对照柑橘果皮中CsMAPMMK2基因的表达无显著差异,而贮藏72 h后,处理柑橘果皮中CsMAPMMK2基因表达水平迅速下降,仅为对照的44.1%。
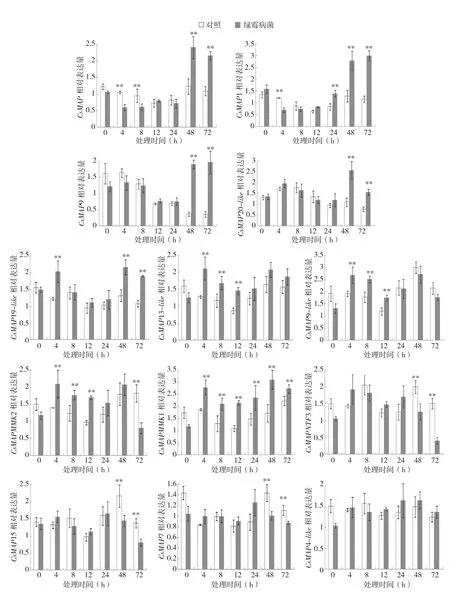
图3 绿霉病菌对柑橘果实中MAPK基因表达的影响
除接菌0 h以外,其余时间点柑橘果皮中CsMAPMMK1基因的表达均受绿霉病菌诱导。与对照相比,接菌 4、8、12、24、48、72 h取样点试验柑橘果皮中CsMAPMMK1基因的相对表达量分别提高了49.1%、62.7%、97.8%、80.1%和22.6%。
柑橘果皮中CsMAPNTF3、CsMAP15和CsMAP7基因受绿霉病菌诱导的表达模式相似,与对照相比,这3个基因都在接种绿霉病菌48、72 h后表达受到抑制,其余时间点无显著差异。其中处理柑橘果皮中CsMAPNTF3基因接菌72 h后相对表达量显著下降,仅为对照的40%左右;CsMAP15基因在接种柑橘绿霉病菌48、72 h果皮中的相对表达量仅为对照的67%和59%;CsMAP7基因在接种柑橘绿霉病菌48、72 h果皮中的相对表达量仅为对照的70%和79%。
CsMAP4-like基因的表达不受绿霉病菌的影响,处理和对照柑橘果皮中表达无显著差异。
2.4 外源NO对采后柑橘果实中MAPKs基因表达的影响
为了分析外源NO提高柑橘果实对绿霉病菌抗性的过程中MAPKs基因的表达变化,分别在SNP处理果实接种绿霉病菌0、4、8、12、24、48、72 h收集柑橘果皮样品,RT-qPCR检测各MAPKs基因的表达。结果显示,外源NO能够诱导柑橘果皮中MAPK基因的表达(图4)。
CsMAP基因在SNP处理4 h后到达表达高峰,相对表达量是同一时间对照的5.4倍,随后表达量下降,保持在对照的2~3倍的水平。
CsMAP1、CsMAP15和CsMAP13-like基因在SNP处理1 h(取样点0 h)受诱导表达,相对表达量是对照0 h的1.4~1.5倍。CsMAP1和CsMAP15基因都在接菌4、12 h获得两个表达高峰,CsMAP1在峰值时的相对表达量分别为对照柑橘的6.2、9.5倍,随后降至对照约2倍的表达水平。CsMAP15在峰值时的相对表达量分别为对照的4.3、4.8倍,随后下降至与对照无显著差异。CsMAP13-like基因在SNP处理4 h达到表达高峰,约是对照柑橘果皮中的3倍左右,随后稳定表达。
CsMAP4-like基因在SNP处理4 h后表达受到显著诱导,12 h达到表达高峰,约为对照柑橘果实的5.3倍。
CsMAP9基因受SNP诱导表达,处理4 h达到表达高峰,随后表达水平逐渐下降。与同一取样点的对照相比,试验柑橘果皮中CsMAP9的相对表达量都提高3倍以上,其中处理12 h差异最大,相对表达量约是对照的6.9倍。
与对照0 h相对表达量相比,CsMAP9-like基因在SNP处理4~72 h的相对表达量都提高1倍以上,在SNP处理4 h达到表达高峰。
CsMAP20-like基因在SNP处理4 h达到表达高峰,约是同一时间对照果皮中相对表达量的6.3倍,随后表达水平迅速下降,但仍为对照的两倍以上。
CsMAPMMK1和CsMAPMMK2基因的表达模式相似,分别在SNP处理4 h和12 h获得两个表达高峰。与同一取样点的对照相比,果皮中这两个基因的相对表达量都在SNP处理12 h时受诱导提高的倍数最大,分别为7、4.5倍。
CsMAP7 和CsMAP19-like基因只在 4、8、12、24 h受到SNP诱导表达,CsMAP7的表达高峰在12 h,与对照相比,相对表达量约提高了3倍左右。CsMAP19-like的表达高峰在4 h,与对照相比,相对表达量约提高了6.3倍左右,随后下降至48 h时与对照间无显著差异。
CsMAPNTF3基因只在12、24 h受到SNP诱导表达,表达高峰在12 h,与对照相比,相对表达量约提高3倍左右。
3 结论与讨论
本研究发现,柑橘绿霉病菌侵染能够改变柑橘果皮中MAPKs基因的表达,CsMAP9-like、CsMAP13-like和CsMAPMMK2在绿霉病菌侵染前期(4~12 h)受诱导表达,CsMAP、CsMAP1、CsMAP9、CsMAP19-like和CsMAP20-like在绿霉病菌侵染后期(48~72 h)受诱导表达,CsMAP7、CsMAP15和CsMAPNTF3在绿霉病菌侵染后期(48~72 h)受抑制表达。外源NO能够显著提高柑橘果皮中MAPKs基因的表达水平,可能参与了采后柑橘果实抗绿霉病的生理过程,降低了柑橘果实绿霉病的发病率和病原菌的扩散速度。
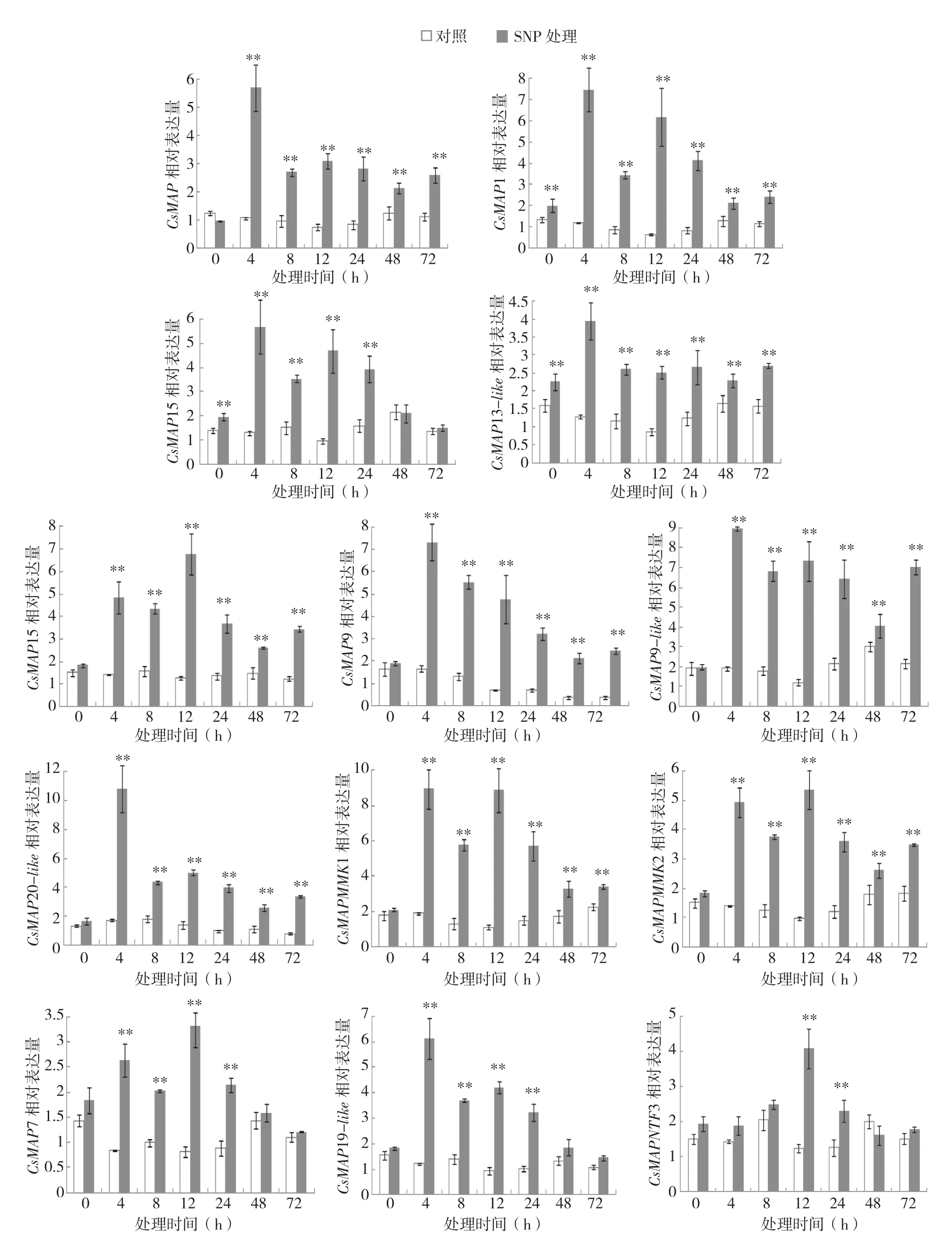
图4 外源NO对采后柑橘果实中MAPKs基因表达的影响
3.1 SNP处理提高采后柑橘果实对绿霉病菌的抗性
柑橘绿霉病菌是典型的死体营养型病菌,具有严格的寄主专化性,仅能通过伤口侵染成熟的柑橘类果实,一旦果实发生机械伤害,绿霉病菌孢子就能够迅速定植,并在短时间内造成果实腐烂[14]。本研究结果显示,接种柑橘绿霉病菌孢子24 h后,对照柑橘果实超过15%的侵染点能够观察到病斑,说明柑橘绿霉病菌能够快速攻克寄主的防御体系。生产上为减少由柑橘绿霉病造成的经济损失,主要采用在果实储存前用适量杀菌剂,单鉴于杀菌剂的安全性问题和病原体耐药性形成,应用化学杀菌剂控制果蔬采后病害越来越受到限制。一些新型的抗菌肽、拮抗菌等果实保鲜方法由于受到制备工艺、活性成分鉴定和使用方法等的限制,仍不能广泛应用于生产[15-16]。通过使用小分子物质来激活植物的先天免疫系统成为一种新型的植物病害防控策略。比如用精氨酸处理采前番茄果实能够诱导采后番茄果实的抗病性[17],MeJA能够诱导番茄果实的抗病性[18],SNP处理能够分别诱发采后番茄果实对灰霉病菌[4,19]和柑橘果实对胶孢炭疽菌的抗病性[6]。本研究结果也表明,SNP处理能够提高采后柑橘果实对绿霉病菌的抗性,发病率和平均病斑面积显著小于对照组果实。
3.2 绿霉病菌影响采后柑橘果实中MAPKs基因的表达
柑橘果实的抗病性主要源于高度协调的生化和结构防御体系的共同作用,以阻止病原菌的传播[20]。MAPKs是MAPK级联最后的激酶,能将底物的S/T磷酸化[12],活化磷酸脂酶、转录因子和其他底物等,参与茉莉酸生物合成、植物防御基因的激活、超敏反应以及系统获得性抗性等生理过程[21]。植物通过自身的MAPK级联来感知外界环境变化和病原菌的入侵,将细胞外的信号传递到胞内,从而使植物产生生理适应过程。比如利用原发免疫应答或先天免疫系统来识别病原物,依据辨识结果启动特异性的防卫反应来抵抗入侵病原物[22]。而病原菌效应子则通过直接或者间接的方式抑制植物的MAPK级联,从而打破植物的免疫系统[23]。因此,研究植物MAPKs如何应对病原菌的入侵,能够为开发新的病害防控措施提供理论基础。从本研究中柑橘果皮MAPKs基因应对绿霉病菌入侵的表达可知,各MAPKs基因在响应绿霉病菌侵染过程中发挥了不同的作用。CsMAP和CsMAP1基因在病原菌侵染早期(4~8 h)受到抑制表达,后期(48~72 h)起到了正调控的抗病作用。CsMAP9和CsMAP20-like基因仅在果实发病后期起到了正调控的抗病作用。CsMAP19-like基因在绿霉病菌侵染早期(4 h)和后期(48~72 h)起到了正调控的抗病作用。CsMAP9-like、CsMAP13和CsMAPMMK2基因在绿霉病菌侵染早中期(4~12 h)起到了正调控的抗病作用,而CsMAPMMK2基因在果实发病末期(72 h)受到病原菌抑制表达。CsMAPMMK1基因在病原菌入侵过程中被诱导表达,说明该基因在柑橘果实抗绿霉菌病过程中起到了正调控作用。CsMAPNTF3、CsMAP7和CsMAP15基因的表达在果实发病后期(48~72 h)受绿霉病菌抑制,果实的防御体系被进一步打破,腐烂加剧。
3.3 MAPKs参与了外源NO诱导的采后果实抗绿霉病反应
NO是唯一已知能够在植物细胞间和细胞膜与细胞质之间自由穿梭的抗病反应信号分子,通过多种途径参与植物的抗病反应[24-25],如作为细胞间信号分子传递超敏信息,激发细胞死亡[6],诱导植物体抗病反应的氨酸解氨酶基因(PAL)及病程相关蛋白基因(PR1)的转录[7];外源NO能够诱导果实中过氧化氢酶、酚类化合物、过氧化物酶、多酚氧化酶、过氧化氢酶等的活性,提高采后番茄和柑橘果实的抗病性[4,6];番茄SlMPK1/2/3 参与了外源 NO 诱导采后番茄果实抗灰霉病的反应[26]。本研究结果发现,柑橘果皮中13个MAPKs家族基因均受到外源NO的诱导表达,但表达模式存在较大差异,说明这些MAPKs可能在NO诱导的采后柑橘果实抗绿霉病菌过程中不同阶段发挥作用。CsMAP、CsMAP9和CsMAP20-like基因受NO诱导的表达模式相似,在4 h后达到表达高峰,随后表达开始回落(8~72 h),CsMAP4-like在处理后12 h到达表达高峰,说明这些基因在NO诱导的柑橘抗绿霉病菌的早期发挥了正调控作用。CsMAP1、CsMAP15和CsMAP13-like基因能够快速响应外源NO的诱导作用,在处理1 h即受到诱导表达,它们可能在发病初期即参与抵御病原菌入侵的过程。CsMAPMMK1、
CsMAPMMK2、CsMAP7和CsMAP19-like基因在NO处理前期(4 h)和中期(12 h)有两个表达高峰。总体上,NO处理前期(4~12 h)的MAPKs基因相对表达水平要高于后期(24~72 h),这也与果实发病率结果相呼应,NO处理24 h时果实的发病率只有对照的50%左右,而72 h时达到对照的95%左右,说明MAPKs基因的高水平表达利于柑橘果实抵抗绿霉病菌的入侵。
[1]Kanetis L,Förster H,Adaskaveg J E.Comparative efficacy of the new postharvest fungicides azoxystrobin,fludioxonil,and pyrimethanil for managing citrus green mold[J].Plant Disease,2007,91(11):1502-1511.
[2]王明爽,孙颖,陈国庆,等.赣南脐橙绿霉病菌对常用杀菌剂抗性监测[J].植物病理学报,2013,43(5):532-540.
[3]Huque R,Wills R B H,Pristijono P,et al.Effect of nitric oxide(NO)and associated control treatments on the metabolism of freshcut apple slices in relation to development of surface browning[J].Postharvest Biology and technology,2013,78:16-23.
[4]Zheng Y,Hong H,Chen L,et al.LeMAPK1,LeMAPK2,and LeMAPK3 are associated with nitric oxide-induced defense response againstBotrytis cinereain theLycopersicon esculentumfruit[J].Journal of Agricultural and Food Chemistry,2014,62(6):1390-1396.
[5]Wills R B H,Pristijono P,Golding J B.Nitric oxide and postharvest stress of fruits,vegetables and ornamentals//Nitric Oxide Action in Abiotic Stress Responses in Plants[M].Springer,Cham,2015:221-238.
[6]Zhou Y,Li S,Zeng K.Exogenous nitric oxideinduced postharvest disease resistance in citrus fruit toColletotrichum gloeosporioides[J].Journal of the Science of Food and Agriculture,2016,96(2):505-512.
[7]Delledonne M,Xia Y,Dixon R A,et al.Nitric oxide functions as a signal in plant disease resistance[J].Nature,1998,394(6693):585.
[8]Yoshioka H,Asai S,Yoshioka M,et al.Molecular mechanisms of generation for nitric oxide and reactive oxygen species,and role of the radical burst in plant immunity[J].Molecules and Cells,2009,28(4):321.
[9]Zhang C,Czymmek K J,Shapiro A D.Nitric oxide does not trigger early programmed cell death events but may contribute to cell-to-cell signaling governing progression of theArabidopsishypersensitive response[J].Molecular Plantmicrobe Interactions,2003,16(11):962-972.
[10]Osbourn A E.Preformed antimicrobial compounds and plant defense against fungal attack[J].The Plant Cell,1996,8(10):1821-1831.
[11]Fleury C,Mignotte B,Vayssière J L.Mitochondrial reactive oxygen species in cell death signaling[J].Biochimie,2002,84(2-3):131-141.
[12]Meng X,Zhang S.MAPK cascades in plant disease resistance signaling[J].Annual Review of Phytopathology,2013,51:245-266.
[13]Liu Q,Xu J,Liu Y,et al.A novel bud mutation that confers abnormal patterns of lycopene accumulation in sweet orange fruit(Citrus sinensisL.Osbeck)[J].Journal of Experimental Botany,2007,58(15-16):4161-4171.
[14]Bus V G,Bongers A J,Risse L A.Occurrence ofPenicillium digitatumandP.italicumresistant to benomyl,thiabendazole and imazalil on citrus fruit from different geographic origins[J].Plant Disease,1991,75(11):1098-1100.
[15]吴胜,霍光华,韩启灿,等.一株祼脚菇属菌株产抗菌活性物的基础液体培养碳,氮源等优化及其对柑橘青绿霉菌的作用[J].中国生物工程杂志,2015,36(2):51-61.
[16]王文军,曾凯芳,邓丽莉,等.抗菌肽及其在果蔬病害控制中的应用[J].食品与机械,2017,33(2):199-204.
[17]Zheng Y,Sheng J,Zhao R,et al.Preharvest L-arginine treatment induced postharvest disease resistance toBotrysis cinereain tomato fruits[J].Journal of Agricultural and Food Chemistry,2011,59(12):6543-6549.
[18]Yu M,Shen L,Zhang A,et al.Methyl jasmonateinduced defense responses are associated with elevation of 1-aminocyclopropane-1-carboxylate oxidase inLycopersicon esculentumfruit[J].Journal of Plant Physiology,2011,168(15):1820-1827.
[19]Fan B,Shen L,Liu K,et al.Interaction between nitric oxide and hydrogen peroxide in postharvest tomato resistance response toRhizopus nigricans[J].Journal of the Science of Food and Agriculture,2008,88(7):1238-1244.
[20]Zeng K,Deng Y,Ming J,et al.Induction of disease resistance and ROS metabolism in navel oranges by chitosan[J].Scientia Horticulturae,2010,126(2):223-228.
[21]Zhang S,Klessig D F.MAPK cascades in plant defense signaling[J].Trends in Plant Science,2001,6(11):520-527.
[22]Jones J D G,Dangl J L.The plant immune system[J].Nature,2006,444(7117):323.
[23]Bi G,Zhou J M.MAP kinase signaling pathways:a hub of plant-microbe interactions[J].Cell Host & Microbe,2017,21(3):270-273.
[24]Lamattina L,García-Mata C,Graziano M,et al.Nitric oxide:the versatility of an extensive signal molecule[J].Annual Review of Plant Biology,2003,54(1):109-136.
[25]Arasimowicz M,Floryszak-Wieczorek J.Nitric oxide as a bioactive signalling molecule in plant stress responses[J].Plant Science,2007,172(5):876-887.
[26]郑鄢燕.SlMPK1/2/3在外源 NO 诱导的采后番茄果实抗病途径中的作用[D].北京:中国农业大学,2015.
