氢键在晶体工程及难溶性药物开发中的应用
2018-06-14王悦,吴刚
王 悦,吴 刚
氢键在超分子化学、固体材料设计及生物化学(主要是蛋白质的折叠)中扮演了十分重要的角色[1]。其在20世纪初叶就为人所知,Pauling在1939年出版的化学键的本质一书中,引入了氢键的概念和知识[2]。在2011年,IUPAC给氢键(H-bonding)的新定义是:氢键是来自于一个分子或分子碎片X-H中的氢原子(X的电负性大于H)和相同分子或者不同分子中的一个原子或者原子团之间的相互吸引作用,并且有明显的键的形成[3]。
氢键以X-H…Y表示,在X-H…Y中,X被称作授体或给体(意为质子给体),Y被称作受体(意为质子接受体)。氢键的强度随着给体原子和受体原子的电负性的增加而增加[4,5],凡涉及到第二周期原子的氢键均严格遵守这条规律。对于类似N-H…O,O-H…O,N-H…N 和 O-H…N这样的氢键,X和Y原子都是高电负性的原子,这样的氢键被称作强氢键,有较大的键能。实际上,在超分子化学晶体工程中,N-H…O,O-H…O,N-H…N 和 O-H…N这样的强氢键在设计新的结构和功能的生物材料方面起着非常重要的作用[6-8]。若X和Y原子不同时为高电负性的原子,如X原子为电负性较小的C原子,Y原子为电负性较大的O原子,此时形成的C-H…O氢键即为弱氢键,键能较小。C-H…O氢键是Sutor在20世纪60年代提出来的[9], C-H…O氢键虽然键能比较小,但是广泛存在于小分子和生物晶体和配合物晶体中。
上述强氢键和C-H…O弱氢键已经被广泛应用于晶体工程中用来设计合成晶体,对于配合物晶体和药物晶体的形成起到了非常重要的作用[10,11]。
配合物根据结构可以分为零维、一维、二维、三维,零维、一维及许多二维结构构成三维结构是依靠氢键来实现的。
1 氢键将零维单分子结合形成一维结构
Wu Gang等[12]报道合成了零维结构的铜配合物[Cu(L1)(L2)(H2O)]·H2O(HL1= N-(imino(pyridin-2-yl)methyl)picolinamidine), HL2= 水杨酸),在这个配合物中,中心Cu(II)离子是五配位的四方锥结构。首先,配位的水分子和配体L1中的亚氨基形成六个强氢键:N(5)-H(5A)…N(4) 2.843(6) Å, N(5)-H-(5A)…O(2W) 2.856(5) Å, O(2W)-H(2WB)…N(5) 2.856(5) Å, N(4)-H(4A)…O 2.777(5) Å, O(2W)-H(2WA)…N(4) 2.777(5) Å, and O(2W)-H(2WB)…N(4) 2.996(6) Å),这六个氢键将相邻的零维结构结合在一起形成扩展的一维结构,如图1所示。
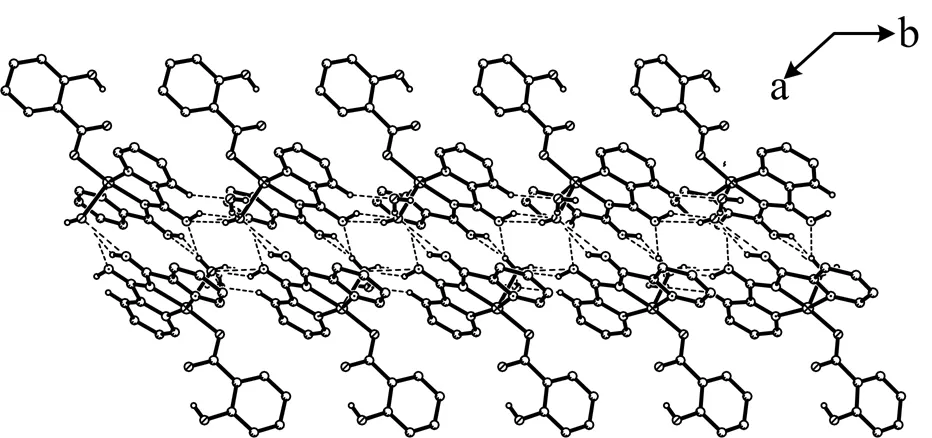
图1 N-H…O, N-H…N和O-H…N氢键将零维结构开展成一维链
2 氢键将一维链结合形成二维结构
配合物[Cd(hssal)(bipy)(H2O)2]·H2O (H2hssal:磺基水杨酸, bipy:2,2′-联吡啶)中,Cd2+离子分别和4个O原子和2个N原子配位,其配位几何构型为八面体,hssal2-作为双齿配体,联结2个不同的的Cd2+离子形成一维链结构,磺酸基上两个未配位的O原子作为受体和配位水分子的O原子之间形成强的O-H…O氢键。另外,未配位的晶格水分子和已经配位的水分子和未配位的羧基O原子之间也形成了O-H…O氢键,所有这些氢键将一维链联结在一起形成二维网结构[13],如图2所示。

图2 O-H…O氢键将一维链联结成二维网结构
在零维结构的铜配合物[Cu(L1)(L2)(H2O)]·H2O晶体中,由配位水分子和配体L1中的亚氨基形成的六个强氢键将相邻的零维结构结合在一起形成扩展的一维结构,然后,晶格水分子和配体水杨酸根形成氢键O(1)(hydroxyl group of salicylate ring)…H(1WB)-O(1W),C(9)-H(9)…O(1W)(lattice water molecule)和O(1W)-H(1WB)…O(2W),这3个氢键就像桥一样,将相邻的一维链结合在一起形成二维层结构,如图3所示。这3个氢键的键长分别是 2.948(8),3.280(8),2.896(9) Å,键角分别是152, 135 and 142o[14]。
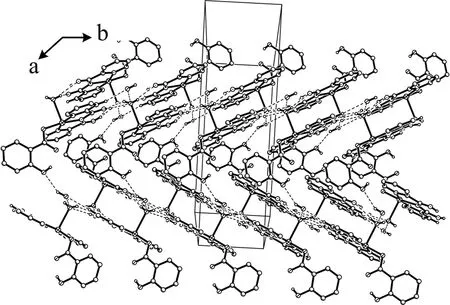
图3 由C-H…O和O-H…O氢键相互作用稳定的一维链的二维层结构
3 氢键将二维片结合形成三维结构
[Pr2(csph)2(H2O)4]·6H2O是个二维的金属有机配位聚合外物,Pr (III)离子和来自于4-磺基水杨酸离子csph3-的8个氧原子和2个水分子的氧原子配位,形成10配位的十二面体结构,在csph3-中,磺酸基采取 (μ2,η2) 桥联配位模式,羧基采取 (μ3,η2:η1) 桥联配位模式联结Pr (III)离子形成二维结构。磺酸基中未配位的氧原子和水分子通过O-H…O氢键,将二维结构联结在一起,形成三维结构,如图4所示,(H2O)O…O(=S) 和 (H2O-Pr)O…O(=S) 氢键键长分别是2.677(3)和2.725(3)Å[15]。
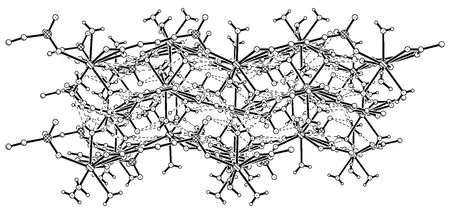
图4 由O-H…O氢键相互作用稳定的二维结构的三维结构
配合物[Ba2(pdc)2(H2O)3]晶体空间群的为Pnna,为正交晶系,具有二维网状结构。在配合物[Ba2(pdc)2(H2O)3]中,结构基元有两个独立的中心钡(II)离子,pdc2-阴离子和三个水分子配位。中心Ba1离子分别和四个pdc2-阴离子、两个μ2桥配位水分子中六个羧基的八个氧原子配位形成一个扭曲的四方反棱柱。Ba1-O键长可以分成6个短的(0.270 6(3)-0.281 6(2) nm)和2个长的(0.292 3(2)nm)。中心原子Ba2离子是10配位的,配位几何结构为扭曲的双帽四棱柱结构,和四个不同的pdc2-阴离子中六个不同羧基中的八个羧基氧原子配位,还和两个终端配位水分子的两个氧原子配位。Ba2-O键的键长在0.273 8(3)-0.320 9(3)nm范围内, O-Ba-O的键角和金属中心的角度也不同,为42.59(7),152.68(7)°。Ba-O键键长不同,可以划分成6短(0.238(3)-0.2833(2)nm)和四长(0.2910(3)-0.3209(3)nm),由于这些键长的不同晶体结构发生了明显的改变。吡啶中的N原子不和Ba2+离子进行配合,但是参与了O-H…N氢键的形成,该O-H…N氢键将二维层结合在一起形成了三维结构[16],如图5所示。[Ba2(pdc)2(H2O)3]中氢键的键长和键角如表1所示。

表1 [Ba2(pdc)2(H2O)3]中的氢键键长(Å)和键角(°)

图5 通过氢键O-H…N相互作用形成[Ba2(pdc)2(H2O)3]的三维结构
此外,每个pdc2-配体离开一维链后,形成了一个二维网。然后二维网由O-H…N进一步连接在一起形成三维结构。
另外,Wu等[17]还合成了配合物 [Sr2(pdc)2(H2O)7],研究了它的晶体结构和荧光性质,配合物 [Sr2(pdc)2(H2O)7]是一个二维(2D)的配位框架结构,属单斜晶系,P21/ n空间群。在该化合物中,有两个晶体学上独立的锶离子(Sr1和Sr2),其表现出类似的配位模式。Sr1是9配位的, Sr1中心的配位几何为扭曲的单帽四方反棱柱。Sr2也是九配位, Sr2配位几何是扭曲的单帽四方棱柱的几何形状。
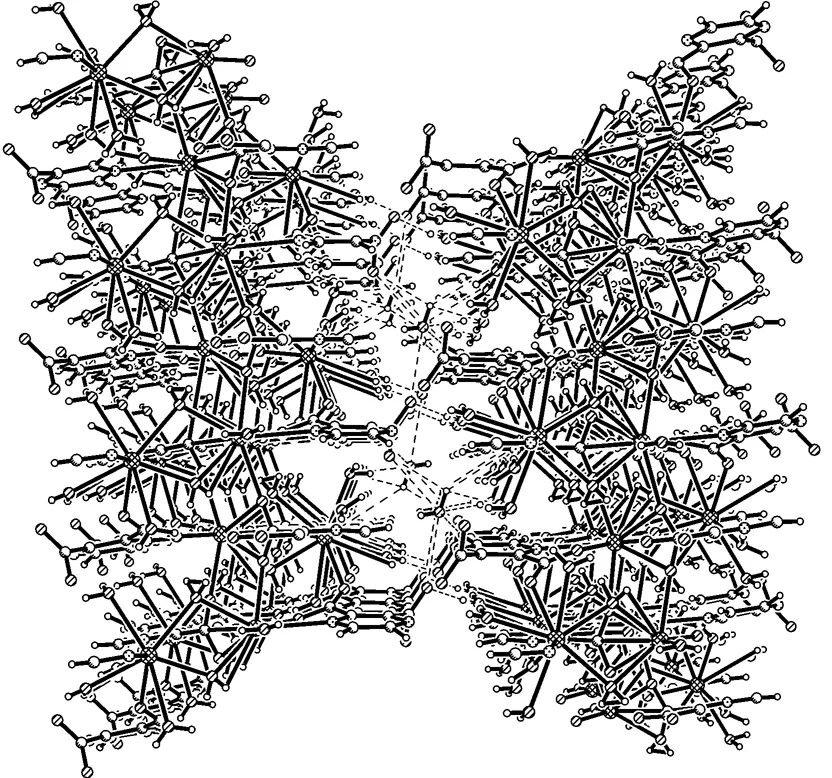
图6 [Sr2(pdc)2(H2O)7].H2O三维结构
在该配合物结构中存在十七圆环M4pdc2(μ2-H2O)4大环,pdc2-离子连接着这些大环构建成一个二维网状结构,二维层通过O-H…O 和 O-H…N构成氢键连接形成三维框架结构,如图6所示。[Sr2(pdc)2(H2O)7]结构中氢键的键长和键角如表2所示。。
Wu等[18]还合成了碱土金属钙的配合物[Ca(hssal)(H2O)]研究了它的结构和性质,在这个配合物中,Ca(II)离子是八配位的,Ca中心与八个氧原子配位,其配位几何为扭曲的单帽五角双锥。Ca-O键的长度范围为2.3722(15) 到2.6082(15) Å。
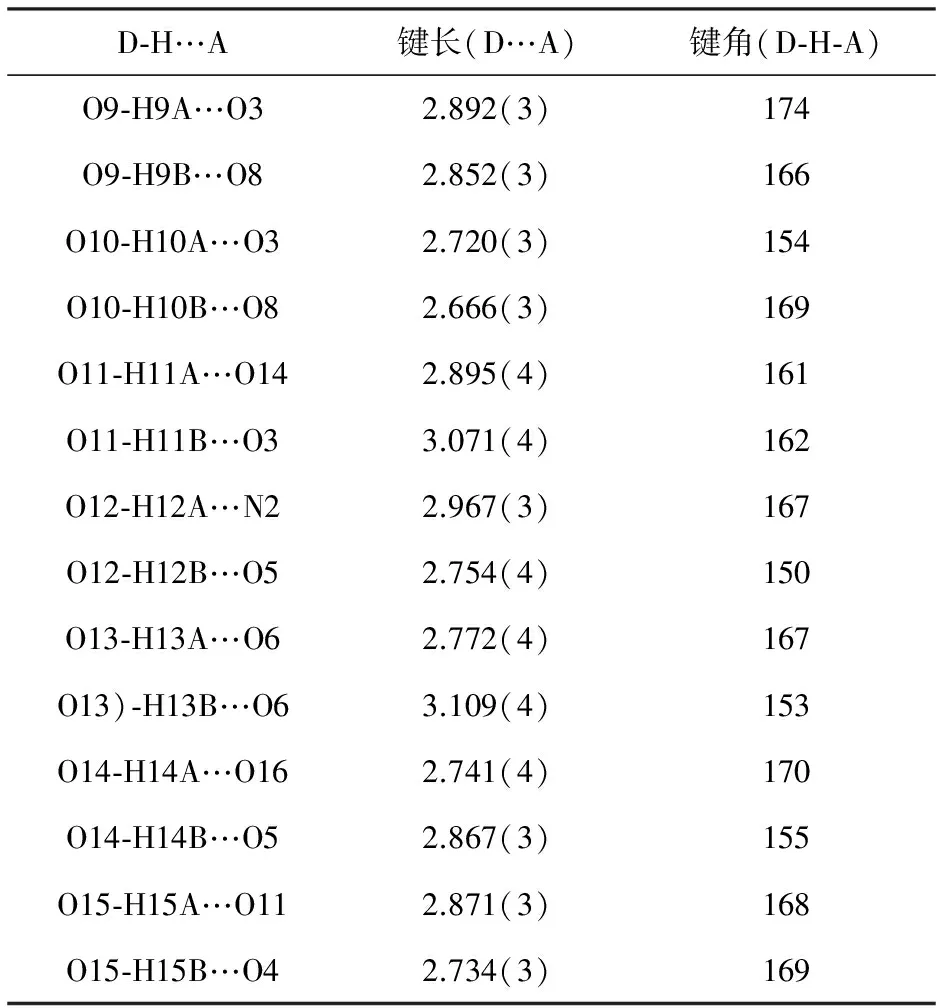
表2 [Sr2(pdc)2(H2O)7]中氢键的键长 (Å)和 键角 (°)
磺基水杨酸的阴离子作为 μ4-桥要连接四个不同的金属原子,形成二维网状结构。然后,以O…O 距离为 2.558(2) Å 和 O-H-O 角度为 149°(表3)的O-H…O氢键连接这些2D网形成三维立体结构如图7所示。

图7 [Ca(hssal)(H2O)]的三维结构

表3 [Ca(hssal)(H2O)]和[Sr(hssal)(H2O)]氢键的键长(Å)和键角(deg)
此外,氢键在难溶性药物开发中也有着重要应用。
目前,新开发药物中至少有40%表现出低的水溶性[19],可能导致不理想的口服生物利用度,或者难以开发成液体制剂如注射剂等,从而成为制约药物发展的瓶颈。提高难溶性药物溶出度的传统策略包括形成可溶性盐、调节pH、增溶及潜溶等[20]。然而对某些药物而言,即使使用以上方法有时仍难以达到适于临床使用的浓度,或者由于辅料的使用不当而产生潜在的安全性风险。因此,研究者们一直在探寻更多的方法用于提高难溶性药物的溶出度,固体分散体制备技术成为其中一个重要的研究方向[21-23]。
固体分散体(Solid dispersion, SD)系指难溶性药物以分子、胶态、微晶等形式均匀分散在某一固态载体物质中所形成的以固体形式存在的分散体系。载体中的药物粒径在0.001~0.1mm之间。难溶性药物制备成固体分散体后,由于药物高度分散在载体材料中,使药物的可润湿性增强,因而极大改善了药物的溶出与吸收特性,使药物溶出度及生物利用度显著提高[24]。
氢键在利用固体分散体制备技术提高难溶性药物溶出度方面发挥重要作用。
S. Hardeep等[25]以聚维酮(Polyvingypyrrolidone, PVP)为载体材料,使用溶剂蒸发法分别制备氟哌啶醇(Haloperidol, HP)和氟哌利多(Droperidol, DP)的固体分散体。并合成设计一种新分子:脱羟基氟哌啶醇(Heshydroxyhaloperidol, DHP),同样以PVP为载体材料以溶剂蒸发法制备为固体分散体,并与HP和DP固体分散体进行比较。测定各固体分散体在含水介质中溶出度,HP和DP固体分散体的溶出速率显著大于DHP固体分散体的溶出速率,推测原因在于:HP和DP均具有氢键供体官能团(分别为羟基-OH和氨基-NH),这两个氢键供体官能团都可以与PVP上的羰基-C=O形成氢键,而DHP中无羟基和氨基存在,因此不能与PVP形成氢键,进而对晶体堆积产生影响,药物与PVP间的氢键作用可以干扰药物自身的分子间氢键作用并为分散的药物分子提供足够的热力学稳定性,从而使药物在含水介质中的溶出度提高。
另有S. Yusuke等[26]以交联聚维酮(Crosslinking Polyvingypyrrolidone, CrosPVP)为载体材料,分别与20种具有不同熔点(70~2188℃)、分子量(135~504)、官能团(酰胺,氨基,羰基,羟基,酮等)的化合物以机械混合加热法制备成CrosPVP SDs,并研究化合物在SD中的稳定性。结果表明,熔点和分子量对化合物在SD中是否能够保持无定形态没有影响,而所有含有氢键给体官能团(如氨基、羧基、酰胺基、羟基等)的化合物都能以无定形态在SD中存在至少6个月。而没有氢键给体基团的化合物则不能保持无定形状态,并在1个月内发生重结晶。红外光谱分析结果表明,CrosPVP的每个吡咯烷酮部分含有两个能与药物发生相互作用的氢键受体(即酰胺基和羰基),能与含有氢键给体官能团的化合物发生相互作用。由此推测,化合物中氢键给体官能团的存在是影响含有氢键受体的CrosPVP形成稳定SD的重要因素,氢键在维持CrosPVP SDs非晶态中起重要作用。
此外,S. Deshvir等[27]以伊维菌素(Ivermectin,IVM)为模型药物,以气相二氧化硅为载体材料,制备表面固体分散体(Surface Solid Dispersion, SSD),并提出一种新的氢键替换分子机制。漫反射分析结果显示,在SSD形成期间,药物通过气相二氧化硅与药物的游离-OH基团之间的弱氢键结合而吸附在气相二氧化硅载体表面,其中,气相二氧化硅分子的氧原子起到质子受体作用,药物的-OH基团起到质子供体作用。该研究进一步分析了SSD释放药物过程中氢键发挥的作用。如图8所示,在SSD中,气相二氧化硅与药物分子之间以弱氢键连接,经水处理后,气相二氧化硅的氧原子与水的-OH基团(Si-O…H-O-H)之间倾向于形成强氢键相互作用,导致药物分子被来自SSD表面的水分子代替,使得气相二氧化硅与药物分子之间的弱氢键分裂并被取代,该现象使药物从SSD颗粒表面漂移到介质中,并且通过该系统可以获得药物的快速释放。SSD可以被认为是一个可行的产品开发系统,用于改善药物的溶解性能,使药物在临床使用中快速发挥作用。
(A)制备得到的干燥SSD颗粒,(B)SSD与水的相互作用,(C)水分子通过氢键替换机制取代药物,(D)完全不含药物的SSD。虚线代表分子之间的氢键。图8 SSD颗粒表面药物释放机制
由此可见,氢键在利用固体分散体制备技术提高难溶性药物溶出度方面发挥重要作用。对于含有氢键给体官能团(如氨基、羧基、酰胺基、羟基等)的难溶性药物,可以选择与含有氢键受体的载体材料(如PVP、CrosPVP、气相二氧化硅等)制备为固体分散体,在药物与载体材料间的氢键相互作用下,药物的溶解度和溶出速率可以得到提高,药物在固体分散体中的稳定性亦可得到提高,由此为难溶性药物开发提供新的研究思路和方向。
综上,氢键在晶体工程和难溶性药物开发中显示出良好的应用前景和潜能。
[参 考 文 献]
[1] M.J. Calhorda, Weak hydrogen bonds: theoretical studies, Chem. Commun., 2000, 801-809.
[2] L. Pauling, The Nature of the Chemical Bond,Cornell University Press, Ithaca, NY, 1939.
[3] E. Arunan, G.R. Desiraju, R.A. Klein, J. Sadlej, S. Scheiner, I. Alkorta, D.C. Clary, R.H. Crabtree, J.J. Dannenberg, P. Hobza, H.G. Kjaergaard, A.C. Legon, B. Mennucci, D.J. Nesbitt, Defining the hydrogen bond: an account (IUPACTechnical Report). Pure Appl. Chem., 2011, 83(8): 1619-1636.
[4] L. Pauling, The nature of the chemical bond, 3rd edn. Cornell University Press, Ithaca, 1960.
[5] G.C. Pimentel, A.L. McClellan, The hydrogen bond. W. H. Freeman and Company, New York, 1960.
[6] S.J. Grabowski, Hydrogen bonding-new insights challenges and advances in computational chemistry and physics, vol 3, 1st edn. Springer, New York, 2006.
[7] G. Gilli, P. Gilli, The nature of the hydrogen bond: outline of a comprehensive hydrogen bond theory. Oxford University Press, NewYork, 2009.
[8] P. Hobza, K. Müller-Dethlefs, Non-covalent interactions: theory and experiment. Royal Society of Chemistry, Cambridge, 2010.
[9] G.R. Desiraju, The C-H…O Hydrogen Bond: Structural Implications and Supramolecular Design, Acc. Chem. Res., 1996, 29, 441-449.
[10] G. Wu, X..F. Wang, T.-a. Okamura, W.Y. Sun, N. Ueyama, Syntheses, Structures, and Photoluminescence Properties of Metal(II) Halide Complexes with Pyridine-Containing Flexible Tripodal Ligands, Inorg. Chem., 2006, 45, 8523-8532.
[11] G. Wu, X.F. Wang, Yu L., T. Zhang., M. Zhang, An Extended Cu(II) Complex Structure Sustained by Hydrogen Bonding and C-H…π Interactions, Chinese J. Struct. Chem., 2010, 29 1337-1342.
[12] G. Wu, X..F. Wang, L. Yu, T. Zhang, M. Zhang, An Extended Cu(II) Complex Structure Sustained by Hydrogen Bonding and C-H…π Interactions, Chinese J. Struct., Chem. 2010, 29, 1337-1342.
[13] G. Wu, X.F. Wang, H. Wei, L. Yu, Synthesis, Structure and Luminescent Property of Cadmium(II) Complex of Sulphosalicylic Acid, Chinese J. Inorg. Chem., 2011, 27, 382-386.
[14] G. Wu, X.F. Wang., L. Yu, T. Zhang, M. Zhang, An Extended Cu(II) Complex Structure Sustained by Hydrogen Bonding and C-H…π Interactions, Chinese J. Struct. Chem., 2010, 29, 1337-1342.
[15] G. Wu, Z.M. Wang, X.T. Ge, X.L. Wang, Q.F. Zhang, A Two-dimensional Rare Earth Metal-Organic Polymer {[Pr2(csph)2(H2O)4]·6H2O}n with 3-Carboxylate-4-sulfonatophenolate(csph) Ligands, Z. Naturforsch,. 2010, 65b, 1- 5.
[16] L. Zuo, J.H. Feng, L. Guo, H.H. Li, G. Wu, Synthesis, Structure, Luminescest and Thermal Stable Properties of 3, 4-Pyridinedicarboxylic Acid Barium Complex, Chinese J. Inorg. Chem., 2013, 29(9), 1979-1984.
[17] H.H. Li, G. Wu, L. Guo, Synthesis, Structure and Properties of a Strontium(II) Complex with 2, 3-Pyrazinedicarboxylic Acid, Chinese J. Struct. Chem., 2012, 31(10),1447-1454.
[18] G. Wu, X.F. Wang, X.L. Guo, L. Yu, Synthesis, Structure, and Physical Properties of Calcium and Strontium Complexes with the Ligand Sulfosalicylic Acid, Z. Anorg. Allg. Chem., 2010, 636, 652-656.
[19] C.M. Keck, R.H. Muller. Drug Nanocrystals of Poorly Soluble Drugs Produced by High Pressure Homogenisation [J]. European Journal of Pharmaceutics And Biopharmaceutics, 2006, 62(1): 3-16.
[20] R.G. Strickley. Solubilizing Excipients in Oral and Injectable Formulations [J]. Pharm Res, 2004, 21(2): 201-30.
[21] 刘娱姗, 高署, 柯学, 孙宏张, 王欲斌. 难溶性药物固体分散体研究新进展[J]. 药学进展, 2013, 37(04) :166-173.
[22] 刘文利, 魏振平. 新型固体分散体技术改善水难溶药物溶解度的研究进展[J]. 中国药学杂志, 2016, 51(22): 1901-1906.
[23] 谭佳威, 孙如煜, 曾滟棱, 杜守颖. 固体分散技术在制剂领域的研究进展[J]. 药物评价研究, 2017, 40(08): 1182-1188.
[24] S. Sareen, G. Mathew, L. Joseph. Improvement in Solubility of Poor Water-soluble Drugs by Solid Dispersion[J].Int J Pharm Investig, 2012, 2(1):12-17
[25] S. Hardeep, M. Ahmed, P. Riccardo, A. Eman. Hydrogen Bonding: Between Strengthening the Crystal Packing and Improving Solubility of Three Haloperidol Derivatives[J]. Molecules, 2016, 719, 21
[26] S. Yusuke, F. Makiko, K. Makiko. etc. Effect of Characteristics of Compounds on Maintenance of an Amorphous State in Solid Dispersion With Crospovidone[J]. Journal of Pharmaceutical Sciences, 2007, 96(6): 1537-1547.
[27] S. Deshvir, P. Kamla. Hydrogen Bond Replacement—Unearthing a Novel Molecular Mechanism of Surface Solid Dispersion for Enhanced Solubility of a Drug for Veterinary Use [J]. International Journal of Pharmaceutics, 2013, 441: 99-110.
