IL-33的生物学功能以及对肿瘤作用的研究进展
2018-06-13王珺婷
王珺婷, 钟 鸣, 刘 洁
(1.中国医科大学 口腔医学院,沈阳 110002; 2.中国医科大学 中心实验室,沈阳 110002)
1 IL-33概述
1.1 IL-33的生物学特点
Baekkevold等[1]在小静脉高壁内皮细胞中分离得到IL-33分子,并命名为“高壁内皮细胞来源的核因子(NF-HEV)”。Schmitz等[2]通过搜索序列数据库发现该基因序列与IL-1,白细胞介素-18(interleukin-18,IL-18)相似,将其归类为IL-1家族,并命名为IL-33。IL-33的编码基因位于9号染色体短臂上的7个外显子,N端1-3外显子编码结构包括核定位序列和染色质结合序列,C末端4-7外显子编码细胞因子结构域[3]。因此,IL-33是一个双功能蛋白,既是促炎细胞因子,又是具有调控转录功能的细胞核因子。
IL-33不具有与炎症相关的半胱天冬酶(Caspase-1、Caspase-4、Caspase-5)直接剪切位点,而是通过激活细胞中半胱天冬酶(Caspase-3和Caspase-7)产生IL-331-178和IL-33179-270,这些形式主要由凋亡的细胞释放并且生物活性很低[4]。最近研究发现,中性粒细胞和肥大细胞中的丝氨酸蛋白酶、组织蛋白酶G和弹性蛋白酶可裂解全长IL-331-270并产生成熟的形式IL-3395-270、IL-3399-270和IL-33109-270,这些形式均由损伤或坏死的细胞释放到胞外,并且比全长IL-33的生物学活性高10倍、甚至30倍[5]。全长IL-331-270与组蛋白相互作用,促进染色质凝集,并通过P65抑制核转录因子(Nuclear factor kappa binding,NF-κB)信号通路的转录活性,使NF-κB表达基因变弱,从而抑制了炎症反应[6]。综上所述,细胞核内的全长IL-331-270不具有促炎反应。当细胞损伤或坏死时,释放到细胞外的成熟IL-3395-270、IL-3399-270和IL-33109-270促进炎症反应,激活免疫系统,提供了损伤信号。IL-33在多种疾病中发生作用,如过敏、自身免疫性疾病、变态反应性疾病、心血管疾病、感染和肿瘤[7]。在这里,我们主要总结IL-33在肿瘤中的作用。
1.2 IL-33的受体ST2
1989年Tominaga等[8]在BALB/c-3T3细胞系中发现ST2基因,ST2由IL1RL1基因编码,有sST2、ST2L、ST2V和ST2LV 4种亚型,其中sST2不具有跨膜序列,可分泌到细胞外,为可溶型ST2,仅表达于肥大细胞和成纤维细胞中。ST2L具有跨膜序列,不能分泌到细胞外,为跨膜型ST2,表达于成纤维细胞、肥大细胞、嗜酸性粒细胞、Th2(helper T cell2,Th2)淋巴细胞、树突状细胞、自然杀伤细胞(natural killer cell,NK)和NKT细胞等,并可在巨噬细胞中诱导产生[9]。ST2L与IL-1受体辅助蛋白和IL-33结合,刺激信号通路,激活NF-κB和丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)等途径[10]。
1.3 IL-33/ST2信号通路
IL-1受体辅助蛋白(IL-1 receptor accessory protein,IL-1RAcP)是ST2与IL-33结合的共受体,增加了ST2对IL-33的亲和力,IL-33、ST2和IL-1RAcP组成异二聚体,将信号传导到细胞内,募集髓样分化因子88(myeloid differentiation primary response gene 88,MyD88)及其相关蛋白IL-1R相关激酶1(interleukin-1 receptor-associated kinase1,IRAK1)、相关蛋白IL-1R相关激酶4(interleukin-1 receptor-associated kinase4,IRAK4)与肿瘤坏死因子受体相关因子6(tumor necrosis factor-associated factor 6,TRAF6)分子结合,激活NF-κB、MAPK等途径,强烈诱导前炎症因子和趋化因子的产生,从而发挥生物学效应[11](图1)。
IL-33/ST2信号是通过多种机制调节。在肥大细胞中,酪氨酸激酶受体c-kit可正向调节信号通路[12]。而IL-1受体家族成员单一免疫球蛋白IL-1受体相关因子/Toll IL-1R8 (SIGIRR,又称TIR8)可以负向调节IL-33/ST2信号通路[13]。sST2也可作为诱骗受体,与IL-33结合,对IL-33/ST2信号通路起负性调节作用,Tong等在培养上皮性卵巢癌细胞时发现,加入sST2培养的癌细胞减少了,并且Ki-67的表达也减少了[14]。
2 IL-33与肿瘤
2.1 IL-33及其受体的促肿瘤作用
炎症与肿瘤之间存在着密切的关系。各种炎症细胞因子或者细胞因子相关介质对肿瘤细胞的增殖与凋亡活动具有直接作用,从而影响肿瘤细胞的行为[15]。当机体受到感染或在创伤修复时会持久激活和趋化大量白细胞如巨噬细胞、中性粒细胞、肥大细胞、淋巴细胞、树突状细胞聚集在损伤部位,通过分泌多种不同的生长因子、炎性因子,促进肿瘤细胞生长,并使肿瘤成为永不愈合的创伤[16]。因此,肿瘤炎性微环境的维持在启动及促进肿瘤恶性演进的过程中发挥十分关键的作用。
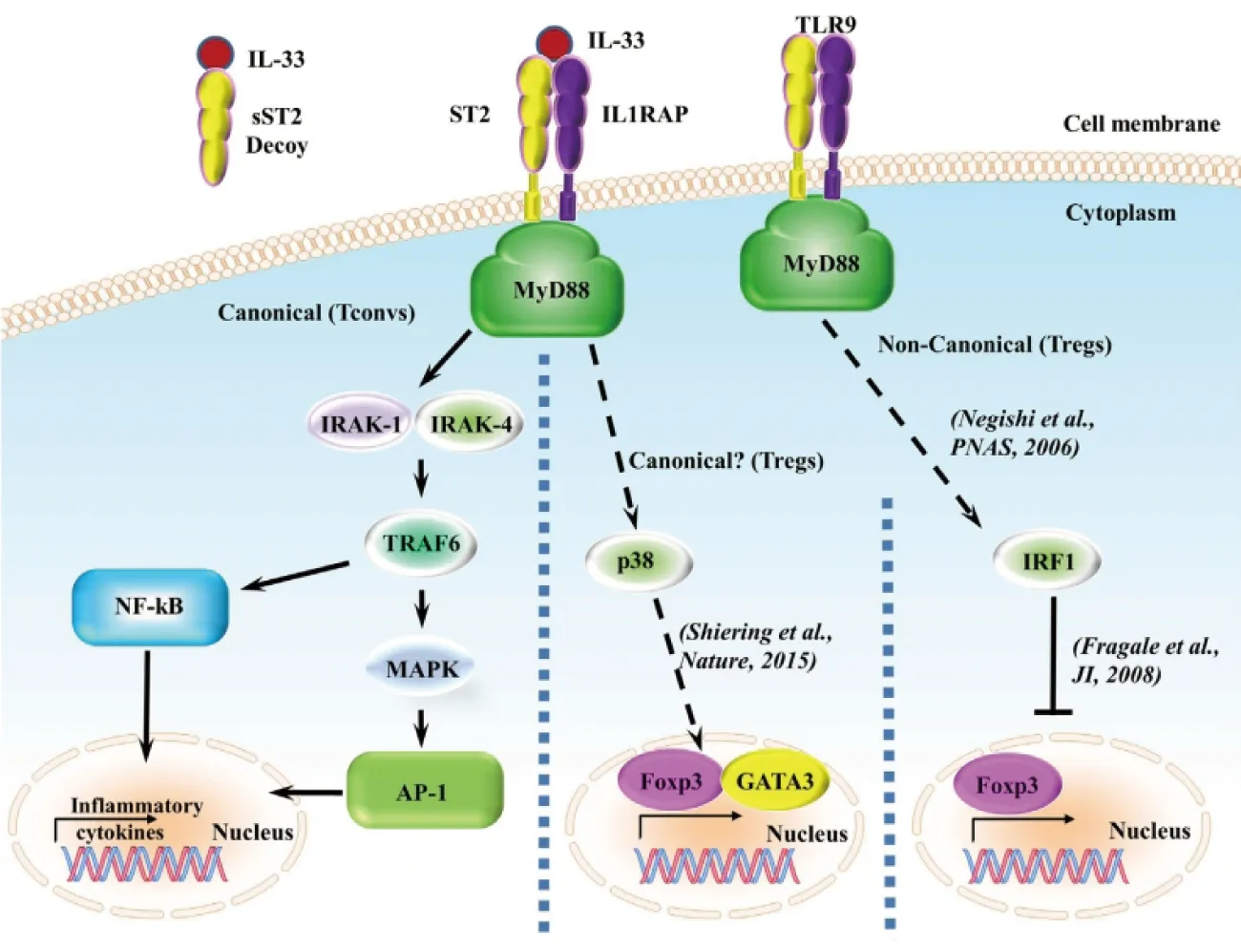
图1 IL-33/ST2信号通路[11]Fig 1 IL-33/ST2 signaling pathway
IL-33在多种细胞中表达,包括上皮细胞、纤维母细胞、巨噬细胞、内皮细胞、肥大细胞、树突状细胞以及成骨细胞等,这些细胞损伤时释放IL-33,而IL-33可以根据细胞类型产生不同的炎症反应[3]。IL-33诱导Th2淋巴细胞产生白细胞介素-5(interleukin-5,IL-5)和白细胞介素-13(interleukin-13,IL-13)等细胞因子;IL-33刺激肥大细胞产生白细胞介素-4(interleukin-4,IL-4)、白细胞介素-5(interleukin-5,IL-5)、白细胞介素-6(interleukin-6,IL-6)等细胞因子;IL-33使中性粒细胞迁移,巨噬细胞产生活性表型M2,嗜酸性粒细胞脱颗粒,并产生活性氧和IL-5[17]。因此,IL-33是肿瘤炎性微环境的主要成分,其促进着肿瘤的发生发展。肿瘤的发生是多阶段、多因素的恶性转化过程。IL-33主要通过以下机制促进肿瘤的发生和发展。
2.1.1 促进肿瘤的免疫调节
T淋巴细胞在机体免疫调节和免疫应答中具有重要作用,根据其在发育过程中细胞表面抗原不同,将其分为CD4+T细胞和CD8+T细胞,免疫应答过程中CD4+T细胞对宿主防御和炎症性反应均有重要作用[18]。CD4+T细胞有多个亚群,包括Th1(helper T cell1,Th1)、Th2、Th17(helper T cell17,Th17)、Th9(helper T cell9,Th9)、调节性T细胞(Regulatory cells,Treg)等细胞[19]。正常情况下,Th1细胞、Th2细胞及其相关细胞因子是处于一个动态平衡状态,在维持机体免疫平衡状态起到重要作用;在肿瘤微环境中,机体对肿瘤的免疫反应以Th1型免疫反应为主,若发生偏移,形成Th2型免疫反应,就会造成免疫功能的改变,并促进肿瘤发展[20]。
ST2是选择性表达在Th2细胞表面,而在Th1细胞上不表达,在炎症环境中,细胞损伤可以导致IL-33的释放,通过IL-33/ST2信号通路促进肿瘤的发生[10]。同时,在肿瘤微环境中也可产生IL-33,通过IL-33/ST2信号通路激活下游NF-κB等通路,诱导Th2型细胞因子分泌增多,Th1型细胞因子分泌减少,使得原本的平衡状态向Th2型偏移,促进肿瘤发展和免疫逃逸[21]。Jovanovic等[22]制作小鼠乳腺癌模型的研究发现IL-33可以诱导野生型小鼠的Th2细胞分泌白细胞介素-10(interleukin-10,IL-10)和IL-13,并且IL-33可以刺激未成熟的树突状细胞产生Treg,从而共同促进肿瘤发展和转移;此外,ST2L信号可能引起肿瘤细胞产生胸腺基质淋巴细胞生成素,其诱导树突状细胞产生IL-4与IL-10、IL-13共同促进肿瘤的免疫逃逸,在ST2L缺乏的小鼠体内,IL-33不能诱导Th2型细胞因子分泌,在这种情况下,M1型巨噬细胞产生白细胞介素-12(interleukin-12,IL-12),成熟树突状细胞,并促进Th1细胞分泌IFN-γ,激活NK、NKT细胞和CD8+的T淋巴细胞,从而促进抗肿瘤免疫。
2.1.2 促进肿瘤的增殖、侵袭和转移
经大量的研究表明,IL-33可以通过以下几种方式促进肿瘤的侵袭和转移。
1)通过激活MAPKs信号通路。ERK1/2通路属于MAPKs通路的一条分支,ERK1/2通路可以改变TGF-β,从而干扰细胞的抗增殖作用[23]。研究表明,IL-33及其受体ST2诱导ERK1/2通路的激活,并增加金属蛋白酶(MMP-3)和白细胞介素-6(interleukin-6,IL-6)的分泌,从而促进胃癌细胞侵袭和转移[24]。Tong等[14]通过研究信号通路表明,IL-33增加ERK和c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)的磷酸化,ERK和JNK也属于MAPKs通路的分支,使用ERK抑制剂U0126和JNK抑制剂SP600125,发现IL-33对上皮性卵巢癌细胞(EOC)增殖、侵袭和转移的作用得到抑制。
2)通过激活NF-κB信号通路。NF-κB是一种转录因子,在整个生命过程中起着至关重要的作用,包括免疫反应、炎症、细胞生长和存活,NF-κB信号通路的激活可以诱导金属蛋白酶(MMP-2)和血管内皮生长因子(vascular endothelial growth factor,VEGF)表达增加,促进肿瘤血管的生成,增强肿瘤的增殖与侵袭能力[25]。不仅如此,NF-κB亚基P65可以诱导上皮间充质转化(EMT),EMT是肿瘤发生发展中一种关键的细胞机制,通过改变细胞形态和细胞性质,使细胞与细胞之间的黏附消失,从而促进肿瘤细胞的转移[26]。
2.1.3 促进肿瘤血管的生成
一氧化氮(nitric oxide, NO)一般具有扩张血管等有益的生理作用,但其作用随着所处环境而改变,在肿瘤微环境中,低浓度的NO有助于血管生成,使肿瘤的血流量增加,营养增多,促进了肿瘤的生长[27]。IL-33及其受体ST2通过TRAF6介导的内皮型一氧化氮合酶途径,使血管内皮细胞产生NO,从而诱导血管生成和增加血管通透性[28]。Ishikawa等[29]通过CD34染色舌鳞状细胞癌间质,计算微脉管密度(microvessel density,MVD),发现IL-33的表达与MVD成正相关,证实IL-33可以诱导血管生成。在结肠癌小鼠模型中,腺瘤状细胞产生IL-33,并激活肥大细胞和上皮下肌纤维母细胞。这些细胞释放VEGF、破骨细胞分化因子(TNF-related activation-induced cytokine,TRANCE)等,从而促进肿瘤的生长[30]。
2.2 IL-33及其受体的抗肿瘤作用
最新的研究表明,由于ST2L还在NK、NKT、CD8+T等细胞中表达,这些细胞在IL-33刺激下产生IFN-γ,提示了IL-33/ST2可以增强抗原特异性Th1细胞和CD8+T细胞的免疫反应,其在提高肿瘤监测和抗肿瘤免疫中的作用是值得研究的[9]。Gao等[31]制作小鼠B16黑色素瘤和肺癌模型,并发现IL-33可以抑制小鼠肿瘤的生长和转移。IL-33诱导NF-κB的活化,并增加CD69的表达,CD69是CD8+T细胞和NK细胞亚群的一个活化标志,从而激活了CD8+T细胞和NK细胞,并发挥抗肿瘤作用[32]。此外,IL-33和IL-12能刺激Tc1细胞生产IFN-γ,IL-12和IFN-γ共同刺激NK细胞和NKT细胞,IL-33和IL-12还可以促进CD8+T细胞,促进Th1型免疫反应,共同发挥抗肿瘤作用[33]。
目前,对IL-33及其受体的抗肿瘤作用的研究还在不断地深入。在不同肿瘤所在的各种肿瘤微环境中,IL-33对肿瘤的作用是不同的,产生差异的具体原因尚不明确,需要进一步探究。
3 小结与展望
近年来研究表明,在肿瘤的发生、发展中存在着大量RNA异常,包括异常的微小RNA(microRNA,miRNA)、长链非编码RNA(long non-coding RNA,lncRNA)、环状RNA (circular RNA,circRNA)[34]等;还伴随有RNA 转录、加工及调控功能的异常,如RNA选择性剪接、RNA编辑、 竞争性内源RNA调控等,这些非编码RNA可以在转录后水平及表观遗传学水平调控癌基因和抑癌基因的功能,影响肿瘤的发生和发展,是肿瘤诊断、治疗及预后判断的潜在靶点[35]。目前,关于IL-33的相关非编码RNA的研究仅有两篇报道。Millar等[36]研究发现在肌腱修复重塑早期,从1型胶原过渡到3型胶原的过程中IL-33起重要作用,并发现IL-33受miRNA29a调控,当miRNA29a下调,IL-33表达上调,促进3型胶原的生成,帮助肌腱重塑。Xiang等[37]研究表明在骨髓来源巨噬细胞分化过程中,miRNA-487b可以抑制IL-33的表达,从而抑制抗原传递、共刺激分子和炎性介质的表达,影响先天免疫宿主防御反应和炎性反应。非编码RNA在疾病中发挥着重要的调控作用,IL-33相关的非编码RNA是值得进一步研究和探讨的。
随着人们对IL-33研究的逐渐深入,IL-33在疾病中的作用机制更加清晰,与各种肿瘤之间的联系也有了进一步的了解,不难发现IL-33在肿瘤发生发展中具有重要作用。通过上述多项研究证实 IL-33高表达与肺癌、卵巢癌、结肠癌、乳腺癌、鳞状细胞癌等肿瘤恶性程度密切相关,这提示IL-33能成为肿瘤临床诊断和预后评估的标志[14,22,24,29-30]。IL-33还可以诱导抗肿瘤反应,这预示着IL-33可以作为一种有效的抗肿瘤制剂[26]。虽然近年来有大量的针对IL-33的研究并取得一定进展,但IL-33在其他肿瘤中的作用及机制还需要进一步研究,为肿瘤的诊断、治疗以及预后评估开辟新思路。
[1]BAEKKEVOLD E S, ROUSSIGNÉ M, YAMANAKA T, et al.Molecular characterization of NF-HEV, a nuclear factor preferentially expressed in human high endothelialvenules[J].Am J Pathol, 2003, 163(1): 69-79.
[2]SCHMITZ J, OWYANG A, OLDHAM E, et al.IL-33, an interleukin-1-like cytokine that signals via the IL-1 receptor-related protein ST2 and induces T helper type2-associated cytokines[J].Immunity, 2005, 23(5): 479-490.
[3]XU H, TURNQUIST H R, HOFFMAN R, et al.Role of the IL-33-ST2 axis in sepsis[J].Mil Med Res, 2017, 4:3.
[4]GARLANDA C, DINARELLO C A, MANTOVANI A.The interleukin-1 family: back to the future[J].Immunity, 2013, 39(6): 1003-1018.
[5]LEFRANAIS E, ROGA S, GAUTIER V, et al.IL-33 is processed into mature bioactive forms by neutrophil elastase and cathepsin G[J].Proc Natl Acad Sci USA, 2012, 109(5): 1673-1678.
[6]LEFRANAIS E, DUVAL A, MIREY E, et al.Central domain of IL-33 is cleaved by mast cell proteases for potent activation of group-2 innate lymphoid cells[J].Proc Natl Acad Sci USA, 2014, 111(43): 15502-15507.
[7]ARSHAD M I, KHAN H A, NOEL G, et al.Potential therapeutic aspects of alarmin cytokine interleukin 33 or its inhibitors in various diseases[J].Clin Ther, 2016, 38(5): 1000-1016.
[8]TOMINAGA S, TAGO K, TSUDA H.Dual function of IL-33 on proliferation of NIH-3T3 cells[J].Cytokine, 2015, 72(1): 105-108.
[9]MILLAR N L, O′DONNELL C, MCINNES I B, et al.Wounds that heal and wounds that don′t-the role of the IL-33/ST2 pathway in tissue repair and tumorigenesis[J].Semin Cell Dev Biol, 2017, 61: 41-50.
[10]GRIESENAUER B, PACZESNY S, et al.The ST2/IL-33 axis in immune cells during inflammatory diseases[J].Front Immunol, 2017, 8: 475.
[11]MARTIN M U.Special aspects of interleukin-33 and the IL-33 receptor complex[J].Semin Immunol, 2013, 25(6): 449-457.
[12]DRUBE S, SCHMITZ F, GPFERT C, et al.C-Kit controls IL-1β-induced effector functions in HMC-cells[J].Eur J Pharmacol, 2012, 675(1-3): 57-62.
[13]GARLANDA C, ANDERS H J, MANTOVANI A.TIR8/SIGIRR: an IL-1R/TLR family member with regulatory functions in inflammation and T cell polarization[J].Trends Immunol, 2009, 30(9): 439-446.
[14]TONG X, BARBOUR M, HOU K, et al.Interleukin-33 predicts poor prognosis and promotes ovarian cancer cell growth and metastasis throughregulating ERK and JNK signaling pathways[J].Mol Oncol, 2016, 10(1): 113-125.
[15]吕雁玲, 梁文红.白细胞介素-22与口腔疾病研究进展[J].中国实用口腔科杂志, 2017, 10(2): 113-116
[16]GRIVENNIKOV S I, GRETEN F R, KARIN M.Immunity, inflammation and cancer[J].Cell, 2010, 140(6): 883-899.
[17]DE LA FUENTE M, MACDONALD T T, HERMOSO M A.The IL-33/ST2 axis: role in health and disease[J].Cytokine Growth Factor Rev, 2015, 26(6): 615-623.
[18]HIRAHARA K, NAKAYAMA T.CD4+ T-cell subsets in inflammatory diseases: beyond the Th1/Th2 paradigm[J].Int Immunol, 2016, 28(4): 163-171.
[19]TASHIREVA L A, PERELMUTER V M, MANSKIKH V N, et al.Types of immune-inflammatory responses as a reflection of cell-cell interactions under conditions of tissue regeneration and tumor growth[J].Biochemistry (Mosc), 2017, 82(5): 542-555.
[20]BLEOTU C, CHIFIRIUC M C, GRIGORE R, et al.Investigation of Th1/Th2 cytokine profiles in patients with laryngo-pharyngeal,HPV-positive cancers[J].Eur Arch Otorhinolaryngol, 2013, 270(2): 711-718.
[21]WASMER M H, KREBS P.The Role of IL-33-dependent inflammation in the tumor microenvironment[J].Front Immunol, 2017, 7: 682.
[22]JOVANOVIC I P, PEJNOVIC N N, RADOSAVLJEVIC G D, et al.IL-33/ST2 axis in innate and acquired immunity to tumors[J].Oncoimmunology, 2012, 1(2): 229-231.
[23]DHILLON A S, HAGAN S, RATH O, et al.MAP kinase signalling pathways in cancer[J].Oncogene, 2007, 26(22): 3279-3290.
[24]YU X X, HU Z, SHEN X, et al.IL-33 promotes gastric cancer cell invasion and migration via ST2-ERK1/2 pathway[J].Dig Dis Sci, 2015, 60(5): 1265-1272.
[25]PRASAD S, RAVINDRAN J, AGGARWAL B B.NF-kappa B and cancer: how intimate is this relationship[J].Mol Cell Biochem, 2010, 336(1-2): 25-37.
[26]JULIEN S, PUIG I, CARETTI E, et al.Activation of NF-kappa B by Akt upregulates snail expression and induces epithelium mesenchyme transition[J].Oncogene, 2007, 26(53): 7445-7456.
[27]VAHORA H, KHAN M A, ALALAMI U, et al.The potential role of nitric.Oxide in halting cancer progression through chemoprevention[J].J Cancer Prev, 2016, 21(1): 1-12.
[28]CHOI Y S, CHOI H J, MIN J K, et al.Interleukin-33 induces angiogenesis and vascular permeability through ST2/TRAF6-mediated endothelial nitricoxide production[J].Blood, 2009,114(14): 3117-3126.
[29]ISHIKAWA K, YAGI-NAKANISHI S, NAKANISHI Y, et al.Expression of interleukin-33 is correlated with poor prognosis of patients with squamous cell carcinoma of thetongue[J].Auris Nasus Larynx, 2014, 41(6): 552-557.
[30]MAYWALD R L, DOERNER S K, PASTORELLI L, et al.IL-33 activates tumor stroma to promote intestinal polyposis[J].Proc Natl Acad Sci USA, 2015, 112(19): E2487-E2496.
[31]GAO K, LI X, ZHANG L, et al.Transgenic expression of IL-33 activates CD8+ T cells and NK cells and inhibits tumor growth and metastasis inmice[J].Cancer Lett, 2013, 335(2): 463-471.
[32]VILLARREAL D O, WEINER D B.Interleukin 33: a switch-hitting cytokine[J].Curr Opin Immunol, 2014, 28: 102-106.
[33]KOMAI-KOMA M, WANG E, KUROWSKA-STOLARSKA M, et al.Interleukin-33 promoting Th1 lymphocyte differentiation dependents on IL-12[J].Immunobiology, 2016, 221(3): 412-417.
[34]BEERMANN J, PICCOLI M T, VIERECK J, et al.Non-coding RNAs in development and disease: background, mechanisms, and therapeutic approaches[J].Physiol Rev, 2016, 96(4): 1297-1325.
[35]QU J, LI M, ZHONG W, et al.Competing endogenous RNA in cancer: a new pattern of gene expression regulation[J].Int J Clin Exp Med, 2015, 8(10): 17110-17116.
[36]MILLAR N L, GILCHRIST D S, AKBAR M, et al.MicroRNA29a regulates IL-33-mediated tissue remodelling in tendon disease[J].Nat Commun, 2015, 6: 6774.
[37]XIANG Y, EYERS F, HERBERT C, et al.MicroRNA-487b is a negative regulator of macrophage activation by targeting IL-33 production[J].J Immunol, 2016, 196(8): 3421-3428.
