2型糖尿病患者血糖控制对种植体龈沟牙周致病菌的影响
2018-06-08姜茂庆牛忠英汤楚华闫澍马攀
姜茂庆, 牛忠英, 汤楚华, 闫澍, 马攀
(1. 解放军第306医院口腔中心种植科, 北京 100101; 2. 首都医科大学附属北京口腔医院种植科, 北京 100050)
目前,采用种植修复牙列缺损和牙列缺失已成为常用手段,然而种植体的长期稳定与众多因素有关。糖尿病作为常见的一种系统性疾病,由于血糖偏高,患者免疫力及自愈力明显降低,易引起感染等并发症,因此糖尿病也是种植牙治疗的相对禁忌证[1-2]。有研究表明,有效控制2型糖尿病患者的血糖浓度有利于改善患者的牙周状况,减少种植体植入术后感染和并发症的出现[3]。因此,本研究的目的主要是探讨2型糖尿病患者血糖控制对种植体龈下牙周致病菌的影响。
1 材料与方法
1.1 病例
全部病例均为2012年9月至2016年9月间在首都医科大学附属口腔医院种植科进行种植式固定义齿修复术的伴2型糖尿病患者,共106例136颗种植体。排除标准:合并心脑血管疾病、糖尿病肾病以及视网膜病变等慢性疾病;患有其他系统性疾病(除2型糖尿病外);孕产妇或者哺乳期女性;吸烟者;3个月内使用免疫药物治疗者。两组患者基线资料差异无统计学意义,具有均衡性。2型糖尿病标准:糖化血红蛋白(HbA1c,%)≥6%,确诊时间超过半年,近期血糖浓度无明显波动,无严重糖尿病并发症。根据患者术前HbA1c值,将106例患者分为两组:HbA1c<8% 组48例,72颗种植体;HbA1c≥8%组58例,64颗种植体。
1.2 主要试剂、仪器和实验菌株
龈下菌斑收集自受试者。本研究采用的菌株引物购自Thermofisher公司,引物序列:牙龈卟啉单胞菌(Porphyromonasgingivalis,Pg),5′-TGCAACTTGCCTTACAGAGGG-3′,3′-ACGTTGAACGGAATGTCTC-C-5′;福塞坦氏菌(Tannerellaforsythia,Tf),5′-GATAGGCTTAACACATGCAAGTC-3′,3′-ACTCGTATCG-CCCGTTATTC-5′;齿垢密螺旋体(Treponemadenticola,Td),5′-GACGCAAACGATTAAGTG-3′,3′-GCTACG-CTGCCATATCT-5′;具核梭杆菌(Fusobacteriumnucleatum,Fn):5′-GCGCGTCTAGGTGGTTAT-3′,3′-TAGTTCCGCTTACCTCTCCAG-5′;中间普氏菌(Prevotellaintermedia,Pi):5′-CCACATATGGCATCTGACGTG-3′, 3′-TCAATCTGCACGCTACTTGGC- 5′;伴放线共聚菌(Actinobacillusactinomycetemcomitans,Aa),5′-ACGTCATCCCCACCTTCCTC-3′,3′-ATTGGGGTTTAGCCCTGGTG-5′。PCR仪和PCR反应试剂盒(Tag DNA聚合酶,10×PCR缓冲液)为日本TaKaRa公司产品。
1.3 检查者校准和信息采集
参加此次研究各项指标检测的口腔医师共两名,在实验前均经过专业培训并进行一致性检验,Kappa值为0.76。由专业人员记录患者基本临床信息,包括年龄、性别、糖尿病史等。
1.4 口腔检查
采集入选牙位的6个位点(颊舌侧近中、正中和远中)的龈沟出血指数(sulcus bleeding index,SBI)、菌斑指数和牙周探诊深度(periodontal depth,PD)。
1.5 龈下菌斑的收集
棉球隔湿选取牙位,去除龈上菌斑,吹干牙面,用不锈钢取菌环伸入龈沟底(内径1 mm)收集龈下菌斑,取出后剪下不锈钢取菌环,置于生理盐水中,-80 ℃保存备用。
1.6 DNA提取和PCR扩增
从-80 ℃取出菌斑样品,在漩涡振荡器上混合均匀,常规采用酚氯仿抽提法提取6种细菌的DNA,置于-20 ℃冰箱保存。 引物设计参照文献[4-6],并由Thermofisher公司设计合成。参照TaKaRa试剂盒说明书进行PCR扩增。将上述DNA置于总体积为10 μL的混合液体中,包括2.5 μL DNA(18 ng/μL)、引物和探针等。制作标准曲线,根据标准曲线,对细菌数目(CFU/mL)进行统计分析。
1.7 统计学方法
所有数据均采用SPSS 13.0统计软件处理,计量资料用均值±标准差的形式表示,根据数据资料性质,采用t检验、χ2检验、Pearson相关性分析等统计学方法。P<0.05为差异有统计学意义。
2 结果
从表1可见,HbA1c<8%组与HbA1c≥8%组年龄间差异无统计学意义。HbA1c<8%组HbA1c比例明显低于HbA1c≥8%组(P<0.05)。HbA1c≥8%组SBI和PD值均明显高于HbA1c<8%组(P均<0.05)。两组间菌斑指数无明显差异。
HbA1c≥8%组牙周致病菌Tf、Pi和Fn数量明显高于HbA1c<8%组(P均<0.05);而HbA1c<8%组Td数量更多,但差异并无统计学意义(表2)。表3显示,HbA1c≥8%组种植体牙周致病菌Tf、Pi和Fn的检出率明显高于HbA1c<8%组(P均<0.05)。
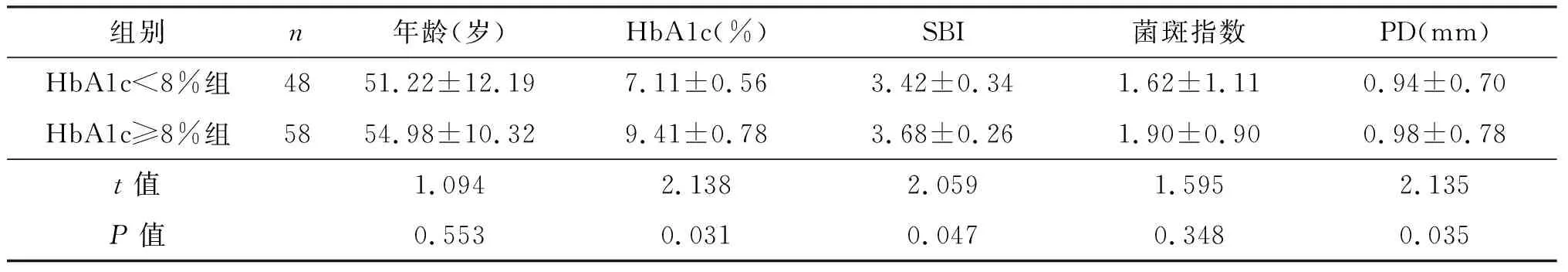
表1 两组年龄、HbA1c、菌斑指数和PD比较

表2 两组患者牙周致病菌含量比较

表3 两组患者种植体牙周致病菌检出率 颗(%)
Pearson相关分析结果显示,糖尿病患者的血糖控制水平与龈下牙周致病菌的菌群种类有一定的相关性。Fn与血糖水平存在弱相关,Pg和Tf与血糖水平呈中度正相关(P<0.05),Pi与血糖水平呈弱负相关(P均<0.05)。
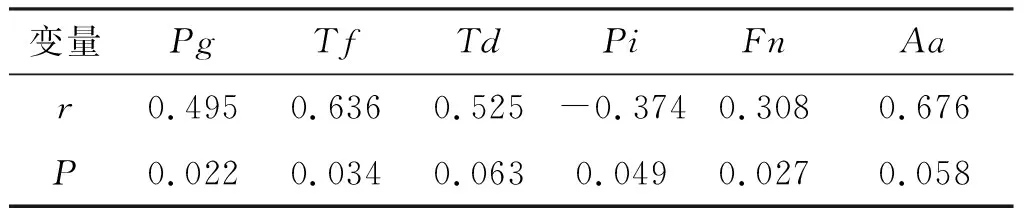
表4 HbA1c与牙周致病菌种类的相关性分析
3 讨论
糖代谢障碍可引起机体的免疫和愈合能力下降,不利于种植体周围组织愈合,因此糖尿病在以往常被视为种植牙的禁忌证。持续的高血糖可导致菌群失衡,进而诱发牙周或口腔疾病,影响种植体的长期稳定。菌斑微生物尤其是龈下菌斑,是引起种植体周围组织炎症的关键因素。HbA1c可反映2型糖尿病患者近期血糖控制水平,HbA1c控制在6%~8%视为可接受范围,大于8%视为控制不好[7]。因此本研究将伴2型糖尿病进行种植牙的患者,分为血糖控制理想(HbA1c<8%)和血糖控制不佳(HbA1c≥8%)两组,HbA1c<8%组SBI和PD值明显高于HbA1c≥8%组,表明血糖浓度与牙周组织的炎症程度相关。
在两组间年龄、糖尿病史等匹配的情况下,对两组种植体龈下致病菌的分析结果显示,HbA1c≥8%组Pi、Tf、Fn数量和检出率较高,与李浩萍[8]的研究结果一致。Pi是一种非酵解糖的革兰氏阴性厌氧球杆菌,是研究广泛且证据充足的重要牙周致病菌之一,多分离自牙周病患者的病变部位,在健康的龈沟中检出率极低。Pi是极具侵袭型的菌种,其存在的部位有进一步发生牙周组织破坏的可能[9-10]。Tf是牙周致病菌中常见的优势菌,可产生大量毒力因子(如蛋白水解酶、脂蛋白、表面BspA蛋白等),可激发宿主的免疫炎症反应,最终导致牙周组织破坏[11-12]。本组血糖控制不佳组Pi检出率较高,有可能会加快种植体周围组织炎症的发展进程。Fn是一种牙周致病菌中的厌氧菌,在牙周炎呈进行性进展时数量快速增加。其致病机制主要是通过产生毒力因子,与其他细菌聚集,结合宿主的相关因子,侵袭宿主细胞,产生混合感染。由于Fn能聚集其他可疑致病菌,因此,Fn在牙菌斑形成的早期和晚期发挥桥梁作用[13-14]。在本研究结果中,Fn与血糖水平呈正相关,血糖控制不理想时,细菌数量增加,可见控制血糖可减少Fn聚集。此外,关于Pi与糖尿病患者的血糖水平的关系仍存在争议,马丽等[4]的报道与本研究结果一致,即Pi与血糖水平呈负相关。然而也有研究显示Pi与血糖水平呈正相关[5],本研究由于样本量少,结果仍需进一步证实。
种植体植入时,种植体表面及种植位点为相对无菌区,种植体的植入为微生物提供了新的滞留区。随着时间的延长,余留天然牙的细菌不断向种植体区迁移,直到种植牙局部菌群与整个口腔微生态环境达到平衡。本研究中,血糖控制不达标的患者种植体牙周Pi、Fn和Tf检出率明显高于血糖控制良好的患者。由此可见,种植体周围可疑致病菌的种类与口内余留牙的牙周致病菌种类存在一定的相关性,后者是前者的“细菌库”[15]。
综上,伴有2 型糖尿病患者的血糖控制水平与种植体龈下牙周致病菌群的种类和数量有关。在进行种植体维护时,需严格控制血糖,加强口腔卫生宣教,必要时可采取种植体袋内冲洗、根据菌斑检查结果用药等措施。同时,应做好余留天然牙的口腔护理,以利于种植体周围组织的健康和菌群生态的长期稳定。
[ 1 ] 吕万龙. 糖尿病患者种植牙16例临床观察[J]. 中国卫生标准管理, 2015, 6(28): 63-64.
[ 2 ] Salvi GE, Carollo-Bittel B,Lang NP.Effects of diabetes mellitus on periodontal and peri-implant conditions: update on associations and risks[J]. J Clin Periodontol,2008, 35(8 supple): 398-409.
[ 3 ] 纪张磊,王立刚,许广杰. 糖尿病患者种植修复的临床分析[J]. 临床医药文献电子杂志,2016, 3(45): 8913,8916.
[ 4 ] 马丽,潘亚萍,张建全. 2型糖尿病伴慢性牙周炎患者牙周可疑致病菌的定植研究[J].上海口腔医学, 2010, 19(6): 611-615.
[ 5 ] Miranda TS, Feres M, Retamal-Valdés B,et al. Influence of glycemic control on the levels of subgingival periodontal pathogens in patients with generalized chronic periodontitis and type 2 diabetes[J]. J Appl Oral Sci, 2017, 25(1): 82-89.
[ 6 ] 黄香娥,肖水清. PCR法检测正畸治疗中伴放线放线杆菌临床价值研究[J]. 中国实用口腔科杂志, 2009, 2(10): 615-617.
[ 7 ] 闫威,姜海燕. 糖化血红蛋白检测在糖尿病监测中的价值[J]. 中国现代药物应用,2010,4(8): 169.
[ 8 ] 李浩萍. 老年2型糖尿病患者血糖水平对口腔内牙周炎可致病菌定植情况的影响分析[J]. 现代仪器与医疗,2015, 21(2): 40-41.
[ 9 ] Makiura N, Ojima M, Kou Y, et al. Relationship of Porphyromonas gingivalis with glycemic level in patients with type 2 diabetes following periodontal treatment[J].Oral Microbiol Immunol,2008,23(4): 348-351.
[10] 王者玲,岗本公彰,杨圣辉,等. PCR直接检测龈下菌斑主要可疑牙周致病菌[J]. 中国微生态学杂志,2003, 15(2): 56-57.
[11] Ruan Y,Shen L,Zou Y, et al. Comparative genome analysis ofPrevotellaintermediastrain isolated from infected root canal reveals features related to pathogenicity and adaptation[J].BMC Genomics,2015,16:122.
[12] Sharma A. Virulence mechanisms ofTannerellaforsythia[J]. Periodontol,2010, 54(1): 106-116.
[13] Han YW.Fusobacterium nucleatum:a commensal-turned pathogen[J]. Curr Opin Microbiol, 2015, 23:141-147.
[14] Signat B, Roques C, Poulet P, et al.Fusobacterium nucleatum in periodontal health and disease[J]. Curr Issues Mol Biol,2011, 13(2):25-36.
[15] 王珏,焦艳军,李英,等. Xive种植体周龈下可疑致病菌变化的1年观察[J]. 中国微生态学杂志,2008, 20(5): 478-479.
