丹参酮ⅡA磺酸钠抑制低氧诱导的大鼠肺动脉平滑肌细胞增殖及其机制
2018-06-08杨磊郑金旭史小东钱海孙金玲
杨磊, 郑金旭, 史小东, 钱海, 孙金玲
(1. 江苏大学附属医院呼吸内科, 江苏 镇江 212001; 2. 江苏大学医学院, 江苏 镇江 212013)
肺动脉高压是多因素所致的一种病理生理状态,包含5种临床亚组,其预后不良。慢性低氧所致肺动脉高压(hypoxia-induced pulmonary hypertension,HPH)是肺动脉高压中最常见的亚组之一,其发病机制与肺动脉中层平滑肌细胞异常增殖引起的肺血管重塑有关[1]。研究揭示,HIF-2α、Wnt、TGF和MAPKs等多种信号通路参与肺动脉平滑肌细胞(pulmonary arterial smooth muscle cells, PASMC)增殖和肺血管重塑,但针对HPH仍缺乏有效的治疗药物[2-5]。近来文献报道mTOR信号途径也与PASMC增殖有关,慢性低氧启动mTOR活化,通过磷酸化激活下游关键调节因子eIF2α,进一步增加c-myc表达,从而促进血管平滑肌细胞过度增殖[6]。
丹参酮ⅡA磺酸钠(sodium tanshinone ⅡA sulfonate,STS)是丹参酮ⅡA的水溶性衍生物,是中药丹参的主要有效成分之一。研究提示STS可改善肺血管重塑,降低肺动脉压力,从而治疗慢性低氧肺动脉高压模型大鼠[7]。也有临床研究结果表明,STS可改善肺动脉高压患者的临床症状,降低肺动脉压力[8],但其具体作用机制尚未明确。故本研究通过建立PASMC缺氧模型并予STS干预,检测细胞内mTOR和eIF2α蛋白的表达,观察其对低氧诱导的大鼠PASMC增殖的影响,进一步探讨STS治疗肺动脉高压的可能机制。
1 材料与方法
1.1 材料
大鼠PASMC购于赛齐(上海)生物工程有限公司(货号CBR130556);STS冻干粉(成都瑞芬思生物科技有限公司);雷帕霉素(RAM),CCK-8试剂盒(上海生工生物工程有限公司);mTOR抗体、p-mTOR抗体及c-myc抗体(美国Cell Signaling Technology);eIF2α抗体、p-eIF2α抗体(英国Abcam公司);β-肌动蛋白抗体(北京博奥森生物技术有限公司);蛋白裂解液及蛋白酶抑制剂苯甲基磺酰氟(上海博彩生物公司);Trizol(美国Invitrogen公司);DEPC原液(上海生工生物工程有限公司);PrimeScriptTMRT Reagent Kit(日本TaKaRa公司)。倒置光学显微镜,CO2培养箱,细胞缺氧培养箱(美国Thermo公司);DU800核酸蛋白定量仪(美国Beckman公司);DNA Engine普通PCR仪及CFX96荧光定量PCR仪(美国Bio-Rad公司)。
1.2 细胞分组及给药
取PASMC传代后用于后续实验,实验中施加干预时用含10%胎牛血清的DMEM高糖培养基作为基质。在验证STS抑制低氧诱导的PASMC增殖实验中,将细胞分为常氧组,常氧+STS组(5、10、20 ng/mL)、低氧组(3%O2)、低氧+STS组(5、10、20 ng/mL)。在STS作用机制实验(细胞通路实验)中,行荧光定量PCR检测时,将PASMC分为常氧组、低氧组、低氧+STS组(10 ng/mL);行蛋白质印迹检测时,将PASMC分为常氧组、低氧组、低氧+STS组(10 ng/mL)、低氧+RAM组(20 nmol/L)。
1.3 CCK-8法检测细胞增殖能力
待PASMC生长至80%~90%时,将其消化重悬,以5×103/mL密度接种于48孔板内培养;每组设5个复孔(分组见“1.2”验证实验)。培养60 h后用CCK-8试剂盒测定波长450 nm处各孔D值,代表细胞的相对增殖率。
1.4 荧光定量PCR检测大鼠PASMC中mTOR、eIF2α和c-myc mRNA的表达
取PASMC,去除培养基;用Trizol法提取总RNA,在紫外分光光度计下定量;反转录获得cDNA。采用SYBR-Green法行荧光定量PCR。大鼠eIF2α引物正义链序列:5′-GGACAAATGGAAGTATGGGATG-3′,反义链序列5′-CAAGAGAGAGCCAGTGTAATGC-3′。大鼠mTOR引物正义链序列: 5′-ATCCAGACCCTGACCCAAAC-3′,反义链序列:5′-TCCACCCACTTCCTCATCTC-3′。c-myc引物正义链序列:5′-TGTCCGTTCAAGCAGATGAG-3′,反义链序列:5′-GGGTCAGTTTATGCACCAGA-3′。反应条件:预变性95 ℃ 3 min,95 ℃变性5 s,60 ℃退火15 s,72 ℃延伸15 s,扩增40个循环;运用熔解曲线程序以鉴定扩增产物的特异性。数据采用相对定量的ΔCt法处理,以β-肌动蛋白对mTOR、eIF2α和c-myc mRNA进行标准化分析。
1.5 免疫印迹法测定p-mTOR、mTOR、p-eIF2α、eIF2α、c-myc蛋白的表达
取PASMC,加入预冷PBS洗涤3次;充分吸尽残余液体,加入100 ∶1配置的蛋白裂解液及蛋白酶抑制剂,摇床摇匀置于冰上裂解30 min;刮取细胞碎片,于4 ℃以12 000×g离心30 min;取上清液进行蛋白定量;加入相同体积的2×SDS-上样缓冲液,100 ℃煮沸10 min;再超声破碎细胞10 s。取40 μg蛋白样品,10%SDS-PAGE电泳1.5 h;200 mA转移90 min至PVDF薄膜;封闭液中封闭1 h;加入一抗,mTOR、p-mTOR、eIF2α、p-eIF2α及c-myc抗体(稀释比均1 ∶1 000)4 ℃孵育过夜;洗膜3次,10 min/次;加入碱性磷酸酶标记的抗IgG抗体(1 ∶5 000)室温孵育1 h;显色液显色,半定量分析显影条带。
1.6 统计学处理
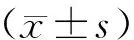
示,多组比较采用单因素方差分析,进一步两两比较采用LSD-t检验。以P<0.05表示差异有统计学意义。
2 结果
2.1 各组细胞增殖率的比较
与常氧组相比,低氧组细胞增殖率明显升高(P<0.05);与低氧组相比,低氧+STS(5、10、20 ng/mL)细胞增殖率呈浓度依赖性降低(P<0.05),尤其药物浓度达20 ng/mL时,细胞增殖水平明显降低。与常氧组相比,常氧+STS(5、10 ng/mL)细胞增殖水平无明显降低(P>0.05),但浓度达20 ng/mL时,细胞增殖水平显著下降(P<0.05),考虑为细胞毒性作用,故选用10 ng/mL STS用于后续实验。见图1。

a:P<0.05,与常氧组比较;b:P<0.05,与低氧组比较
2.2 各组细胞mTOR、eIF2α、c-myc mRNA的表达
实时荧光定量PCR结果显示,与常氧组相比,低氧组mTOR、eIF2α和c-myc mRNA相对表达量明显升高(P<0.05),低氧+STS组3种mRNA相对表达量较低氧组明显降低(P<0.05);由此表明,STS处理对于PASMC的mTOR、eIF2α、c-myc mRNA表达有显著抑制作用。见图2。

a:P<0.05,与常氧组比较;b:P<0.05,与低氧组比较
2.3 各组细胞中mTOR、p-mTOR、eIF2α、p-eIF2α、c-myc蛋白的表达
免疫印迹结果显示,与常氧组相比,低氧组细胞中p-mTOR、mTOR、p-eIF2α、eIF2α和c-myc蛋白表达均显著增加(P<0.05);与低氧组相比,低氧+STS组和低氧+RAM组细胞中p-mTOR、mTOR、p-eIF2α、eIF2α和c-myc蛋白相对表达量均明显降低(P<0.05)。低氧+STS组与低氧+RAM组间各蛋白表达均无明显差异(P>0.05)。由此表明,STS干预能够抑制PASMC中mTOR、eIF2α、c-myc的表达,与雷帕霉素的效果类似,见图3。

a:P<0.05,与常氧组比较;b:P<0.05,与低氧组比较
3 讨论
丹参酮ⅡA作为丹参中的一种提取成分,其水溶性STS在临床中多用于治疗心血管疾病,如高血压、动脉粥样硬化等[9]。丹参酮ⅡA具有抑制血小板黏附、聚集,抗血栓作用,还具有抗动脉粥样硬化、抗心肌缺氧、改善血管平滑肌功能等作用[10]。目前认为肺动脉高压发病与远端肺动脉血管中层的PASMC异常增殖导致的肺血管重塑有关[1]。Jiang等[11]发现STS干预慢性低氧性肺动脉高压大鼠模型,能够抑制PASMC增殖,改善肺血管重塑,降低肺动脉压力;Wang等[12]通过构建低氧性肺动脉高压大鼠和野百合碱诱导肺动脉高压模型大鼠,并予STS干预,结果发现远端肺动脉平滑肌经典瞬时受体电位蛋白(TRPC)1、6表达下调,而平滑肌细胞内基础钙离子浓度及钙池操纵性钙内流增加,导致PASMC增殖及迁移抑制,且右心室收缩压、右心室平均压、右室壁厚度与左室壁+室间隔厚度之比均下降,肺血管重塑明显改善。上述结果表明,STS能够改善肺血管重塑,降低肺动脉压力,对肺动脉高压具有治疗作用。本研究结果显示,与常氧组相比,低氧组细胞增殖水平显著升高,说明细胞低氧模型构建成功。与常氧组相比,STS+低氧组细胞增殖水平降低,由此表明,通过构建细胞缺氧模型,发现低氧可诱导大鼠PASMC增殖,而STS能够抑制其增殖。
mTOR是一种丝氨酸/苏氨酸激酶,在外源性信号(丝裂原、营养、能量)刺激下,具有调控细胞代谢、生长、增殖及生存的作用[13]。mTOR有两种不同的复合体,即mTORC1和mTORC2。mTORC1是细胞生长增殖的主要激活物,可通过磷酸化活化p70s6激酶1(S6K1)与4E结合蛋白1(4E-BP1),进一步激活核糖体蛋白6和eIF2E,促进蛋白质合成及细胞增殖[14-15]。关于mTOR信号通路功能的相关研究主要集中在肿瘤领域[16]。也有文献报道在特发性肺动脉高压患者和动物肺动脉高压模型中,mTOR具有促进PASMC增殖的作用[17-18]。另有研究显示在低氧诱导的肺动脉高压模型大鼠及低氧诱导的PASMC模型中,mTOR明显活化,呈过表达,且eIF2α、c-myc也呈高表达;再通过雷帕霉素和siRNA敲除mTOR及eIF2α处理PASMC可抑制PASMC增殖及c-myc表达[6]。本研究通过细胞低氧模型检测mTOR mRNA及蛋白表达,结果显示低氧诱导体外培养的PASMC中mTOR活化。由此提示,mTOR在PASMC增殖中过度活化,这可能是低氧性肺动脉高压肺血管重塑的机制之一。为进一步证实STS是否具有抑制mTOR活性的作用,本研究设计了低氧+雷帕霉素组作为阳性对照,结果显示STS与雷帕霉干预后mTOR表达无显著差异。因此,本研究揭示STS可通过降低mTOR表达,进而抑制PASMC增殖。
本研究结果提示,eIF2α作为mTOR的下游靶分子,可能在低氧性肺动脉高压的PASMC增殖过程中发挥重要的调节作用。给予STS处理并以雷帕霉素作阳性对照后发现,STS能够抑制PASMC增殖的同时,还减少了p-eIF2α的表达。当然,除了eIF2α,其他起始延长因子eIF也与mTOR信号通路相关,如mTOR结合eIF3可以促进s6k的活化[15, 19];因此,是否还有其他eIF参与还有待进一步研究。c-myc活化是血管平滑肌细胞增殖的起始之一,血管损伤时其表达异常[20]。本研究中,低氧诱导PASMC中c-myc表达上调,而STS通过抑制mTOR或eIF2α进一步下调c-myc的表达。综上所述,丹参酮可以抑制PASMC的增殖,其机制可能是通过抑制低氧诱导的mTOR/eIF2α信号通路,进一步抑制c-myc的表达而发挥作用。
[ 1 ] Sakao S, Tatsumi K. Vascular remodeling in pulmonary arterial hypertension: multiple cancer-like pathways and possible treatment modalities[J]. Int J Cardiol, 2011, 147(1):4-12.
[ 2 ] Raghavan A, Zhou G, Zhou Q, et al. Hypoxia-induced pulmonary arterial smooth muscle cell proliferation is controlled by forkhead box M1[J]. Am J Respir Cell Mol Biol, 2012, 46(4):431-436.
[ 3 ] de Jesus Perez V, Yuan K, Alastalo TP, et al. Targeting the Wnt signaling pathways in pulmonary arterial hypertension[J]. Drug Discov Today, 2014, 19(8): 1270-1276.
[ 4 ] Christopher L, Michael R, Zhong J, et al. The interaction of endothelin-1 and TGF-β1mediates vascular cell remodeling[J]. PLoS One, 2013, 8(8): e73399.
[ 5 ] Karelina K, Liu Y, Alzate-Correa D, et al. Mitogen and stress-activated kinases 1/2 regulate ischemia-induced hippocampal progenitor cell proliferation and neurogenesis[J]. Neuroscience, 2015, 285: 292-302.
[ 6 ] Wang A, Li X, Yang Y, et al. A critical role of the mTOR/eIF2α pathway in hypoxia-induced pulmonary hypertension[J]. PLoS One, 2015, 10(6): e0130806.
[ 7 ] Zheng L, Liu M, Wei M, et al. Tanshinone ⅡA attenuates hypoxic pulmonary hypertension via modulating KV currents[J]. Respir Physiol Neurobiol, 2015, 205: 120-128.
[ 8 ] Wang J, Lu W, Wang W, et al. Promising therapeutic effects of sodium tanshinone ⅡA sulfonate towards pulmonary arterial hypertension in patients[J]. J Thorac Dis, 2013, 5(2): 169-172.
[ 9 ] Xu S, Liu P. Tanshinone Ⅱ-A: new perspectives for old remedies[J]. Expert Opin Ther Pat, 2013, 23(2): 149-153.
[10] Gao S, Liu Z, Li H, et al. Cardiovascular actions and therapeutic potential of tanshinone ⅡA[J]. Atherosclerosis, 2012, 220(1): 3-10.
[11] Jiang Q, Lu W, Yang K, et al. Sodium tanshinone ⅡA sulfonate inhibits hypoxia-induced enhancement of SOCE in pulmonary arterial smooth muscle cells via the PKG-PPAR-γ signaling axis[J]. Am J Physiol Cell Physiol, 2016, 311(1): C136-C149.
[12] Wang J, Jiang Q, Wan L, et al. Sodium tanshinone ⅡA sulfonate inhibits canonical transient receptor potential expression in pulmonary arterial smooth muscle from pulmonary hypertensive rats[J]. Am J Respir Cell Mol Biol, 2013, 48(1): 125-134.
[13] Laplante M, Sabatini DM. mTOR signaling in growth control and disease[J]. Cell, 2012, 149(2): 274-293.
[14] Liu T, Yacoub R, Taliaferrosmith LD, et al. Combinatorial effects of lapatinib and rapamycin in triple-negative breast cancer cells[J]. Mol Cancer Ther, 2011, 10(8): 1460-1469.
[15] Eckerdt F, Beauchamp E, Bell J, et al. Regulatory effects of a Mnk2-eIF4E feedback loop during mTORC1 targeting of human medulloblastoma cells[J]. Oncotarget, 2014, 5(18): 8442-8451.
[16] Evangelisti C, Ricci F, Tazzari P, et al. Targeted inhibition of mTORC1 and mTORC2 by active-site mTOR inhibitors has cytotoxic effects in t-cell acute lymphoblastic leukemia[J]. Leukemia, 2011, 25(5): 781-791.
[17] Wang W, Liu J, Ma A, et al. mTORC1 is involved in hypoxia-induced pulmonary hypertension through the activation of Notch3[J]. J Cell Physiol, 2014, 229(12): 2117-2125.
[18] Houssaini A, Abid S, Mouraret N, et al. Rapamycin reverses pulmonary artery smooth muscle cell proliferation in pulmonary hypertension[J]. Am J Respir Cell Mol Biol, 2013, 48(5): 568-577.
[19] Ahlemann M, Zeidler R, Lang S, et al. Carcinoma-associated eIF3i overexpression facilitates mTOR-dependent growth transformation[J]. Mol Carcinog, 2006, 45(12): 957-967.
[20] Sun LQ, Cairns MJ, Gerlach WL, et al. Suppression of smooth muscle cell proliferation by a c-myc RNA-cleaving deoxyribozyme[J]. J Biol Chem, 1999, 274(24): 17236-17241.
