腺苷衍生物差向异构体YZG-330和YZG-331的中枢抑制作用比较研究
2018-06-08杨婉琪贾少博李栩琳周晓伟岳正刚朱承根石建功张建军
杨婉琪,贾少博,李栩琳,张 雨,周晓伟,岳正刚,朱承根,石建功,张建军
(中国医学科学院北京协和医学院药物研究所药理室,新药作用机制研究和药效评价北京市重点实验室,北京 100050)
差向异构体是指在含有2个或2个以上的四面体型手性中心的分子中,只有1个不对称原子构型不同的非对映异构体。差向异构体之间呈现的生物活性往往存在一定的差异,如差向异构体钩藤碱和异钩藤碱由于肝肠首过效应的差异在降血压作用上存在差异[1]。天麻作为一种中草药,具有治疗头痛、偏头痛、头晕、癫痫、小儿抽搐、痉挛等传统功效[2]。通过与本所植化室石建功研究员课题组合作, 从天麻中提取分离所得到具有强镇静催眠作用的有效成分N6-取代腺苷衍生物,本实验室已经发现其具有很强的镇静催眠作用[3-4]。以此作为先导化合物,经结构修饰得到差向异构体YZG-330(R型)和YZG-331(S型),结构见Fig 1。中枢抑制类药物包括全身麻醉药、镇静药、镇痛药及抗惊厥药。γ-氨基丁酸(γ-aminobutyric acid,GABA)是脑内最重要的抑制性神经递质,谷氨酸(glutamic acid,Glu)是GABA的合成底物,其含量与GABA密切相关[5]。本文对YZG-330和YZG-331 的中枢抑制活性进行评价和比较, 初步研究了其对脑内GABA和Glu的影响,探讨两者可能的作用机制,选择效果更好的结构,为其进一步开发成镇静类药物奠定基础。
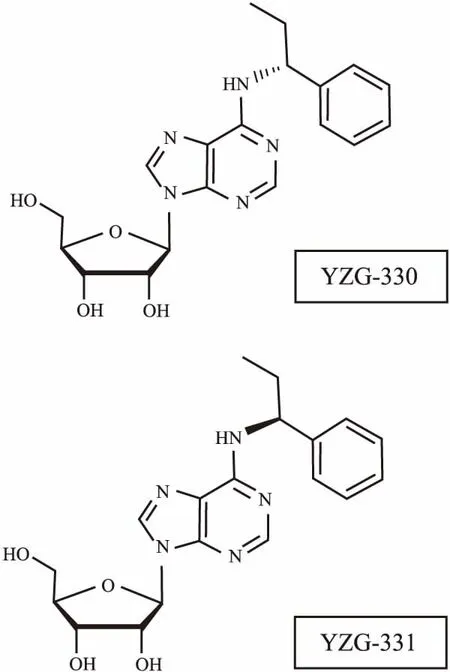
Fig 1 Chemical structure of YZG-330(A) and YZG-331(B)
1 材料与方法
1.1实验动物ICR小鼠,♂,购于北京斯贝福动物技术有限公司,体质量(20~22) g, 动物生产许可证编号:SCXK(京)2016-0002。实验前,动物适应环境3 d以上,自由进食和饮水,环境温度保持在25 ℃。
1.2药品与试剂差向异构体YZG-330和YZG-331由北京协和医学院药物研究所石建功教授课题组合成;地西泮片剂(批号20100903,北京益民药业有限公司),用0.1 g·L-1CMC-Na溶液配成相应浓度,用CMC-Na溶液作为溶剂对照。GABA、Glu、戊巴比妥钠均为Sigma公司产品;甲醇(色谱纯)购自北京化工厂;其他分析纯试剂均购自北京化学试剂公司。
1.3仪器Super Maze动物行为分析系统(XR-Xmaze),购于上海欣软信息科技有限公司;离心机(3-18KS),购于德国SIGMA公司;高效液相色谱泵(LC-10A),购于日本岛津公司;电化学检测器(LC-4C),购于美国BAS公司;色谱柱 (Diamonsil®C18,150 mm×4.6 mm, 5 μm),购自北京迪马科技有限公司;超声波细胞粉碎机(JY-96),购于宁波新芝生物科技股份有限公司;酶标仪(MQX200), 购于美国BioTek公司。
1.4自主活动实验[6-7]♂ICR小鼠,分为8组,每组10只,分别为:溶剂对照组、地西泮组(5 mg·kg-1)、YZG-330组(0.125、0.5、2 mg·kg-1)、YZG-331组(1.25、5、20 mg·kg-1)。分别灌胃给予溶剂对照及化合物溶液15 min后,将待测小鼠放入不透明的单个方形自主活动箱内,活动箱大小为50 cm×50 cm×40 cm,连续拍摄动物在随后10 min内的活动情况,分析统计其自主活动的路程。
1.5协同阈上剂量戊巴比妥钠诱导小鼠翻正反射消失实验[8]♂ICR小鼠,分为8组,每组8只,分别为:溶剂对照组、地西泮组(5 mg·kg-1)、YZG-330组(0.125、0.5、2 mg·kg-1)、YZG-331组(5、10、20 mg·kg-1)。分别灌胃给予溶剂对照、地西泮或YZG化合物,15 min后,腹腔注射阈上剂量戊巴比妥钠 (38 mg·kg-1),入睡指标为翻正反射消失1 min以上,小鼠的入睡潜伏期为从注射药物开始至小鼠翻正反射消失的时间,小鼠的睡眠持续时间为小鼠翻正反射消失至恢复的时间。
1.6协同阈上剂量戊巴比妥钠诱导小鼠翻正反射再消失实验♂ICR小鼠,分为8组,分别为:溶剂对照组、地西泮组(2 mg·kg-1)、YZG-330组(0.125、0.5、2 mg·kg-1)、YZG-331组(5、10、20 mg·kg-1)。腹腔注射戊巴比妥钠溶液(38 mg·kg-1),入睡指标为翻正反射消失1 min以上,待动物翻正反射恢复,立刻灌胃给予溶剂对照或各组待测化合物,观察动物行为,记录翻正反射再次消失的数量,计算各组动物的翻正反射再消失率。
1.7高效液相-电化学法(HPLC-ECD)检测化合物YZGs对脑组织内GABA和Glu含量的影响[9]♂ICR小鼠随机分为3组,溶剂对照组、YZG-330(2 mg·kg-1)组、YZG-331(40 mg·kg-1)组,每组10只。灌胃给予CMC-Na溶液或化合物YZG-331后,将其置于安静环境中,给药15 min后脱颈椎取脑,冰上分离大脑皮层和下丘脑,称重。组织中按1 ∶10(W/V)的比例加入预冷的0.6 mol·L-1高氯酸溶液,利用超声波细胞粉碎机制备匀浆,4℃、10 000×g离心20 min。取上清液与其1/2体积的缓冲溶液(柠檬酸钾20 mmol·L-1、EDTA·2Na 2 mmol·L-1、磷酸氢二钾300 mmol·L-1)混合均匀,4℃、10 000×g离心20 min。取上清液,按1 ∶2的比例加入OPA衍生化试剂,冰上反应2 min后进样检测。根据混合标准品,计算组织内神经递质的含量,得到YZG化合物相对于溶剂对照组引起的含量变化率。检测条件:流速1.2 mL·min-1;检测灵敏度500 nA;电化学检测器工作站电压0.6 V。
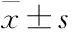
2 结果
2.1YZG-330及YZG-331对小鼠的自主活动有抑制作用如Fig 2所示,灌胃给药后15~25 min内,与溶剂对照组相比,地西泮(5 mg·kg-1)对小鼠自主活动的抑制率为39.0% (P<0.01);YZG-330 (0.125、0.5、2 mg·kg-1)对小鼠自主活动的抑制率分别为29.4% (P<0.05)、57.0% (P<0.01)和76.5% (P<0.01);YZG-331 (1.25、5、20 mg·kg-1)对小鼠自主活动的抑制率分别为25.3% (P<0.05)、40.2% (P<0.01) 和71.8% (P<0.01),均有较明显的量效关系。YZG-330和YZG-331抑制自主活动的等效剂量相差十倍左右,YZG-330对自主活动的抑制作用强于YZG-331。
2.2YZG-330及YZG-331对戊巴比妥钠诱导的小鼠睡眠有延长作用如Fig 3所示,溶剂对照组腹腔注射给予戊巴比妥钠(38 mg·kg-1)后的入睡潜伏期及睡眠时间分别为(9.1±0.67) min和(51.3±3.2)min。与溶剂对照组相比,地西泮能够明显缩短入睡潜伏期,并能明显延长睡眠持续时间。化合物YZG-330 (0.125、0.5、2 mg·kg-1) 对入睡潜伏期的缩短率分别为30.7% (P<0.05)、53.0% (P<0.01)、52.5% (P<0.01);化合物YZG-331(5、10、20 mg·kg-1)对入睡潜伏期的缩短率分别为45.3% (P<0.01)、50.0% (P<0.01)、56.3% (P<0.01)。YZG-330 (0.125、0.5、2 mg·kg-1) 对于睡眠持续时间的延长作用表现明显,延长率分别为46.9% (P<0.01)、96.7% (P<0.01)、234.6% (P<0.01);YZG-331 (5、10、20 mg·kg-1)对睡眠时间的延长率分别为8.6%、37.4% (P<0.01)、73.0% (P<0.01)。YZG化合物对睡眠潜伏期的缩短均无剂量依赖性,在剂量相差十倍时缩短率相近;对睡眠时间的延长YZG-330 (2 mg·kg-1)明显强于YZG-331 (20 mg·kg-1)。
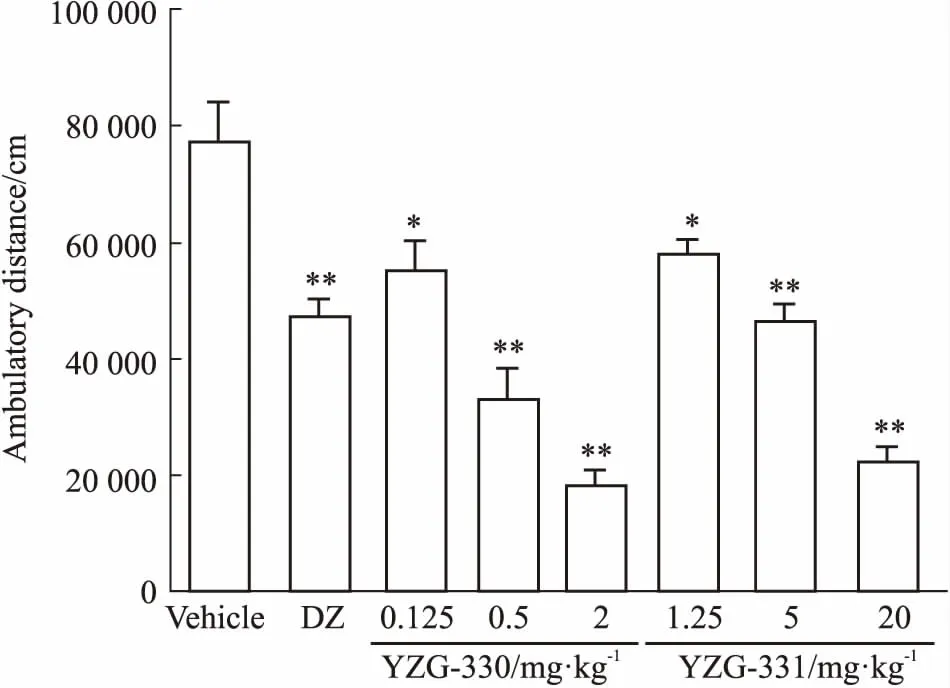
Fig 2 Effects of YZG-330 and YZG-331 on spontaneouslocomotor activities in n=10)
Mice were orally administered with YZG-330, YZG-331, vehicle or diazepam, and the ambulatory distance was calculated for 10 min.*P<0.05,**P<0.01vsvehicle group.
2.3YZG-330及YZG-331促进戊巴比妥钠诱导睡眠小鼠觉醒后的再入睡由于戊巴比妥钠经肝药酶代谢,若YZG化合物对肝药酶有抑制作用,戊巴比妥钠引起的睡眠时间会延长。为排除这种可能性,我们进行了觉醒后再入睡实验。如Tab 1所示,小鼠经戊巴比妥钠诱导的翻正反射消失,待翻正反射恢复后,灌胃给予溶剂对照,小鼠再入睡率为0,灌胃给予地西泮(2 mg ·kg-1)可使87% (P<0.01)的小鼠再入睡,灌胃给予YZG-330 (0.125、0.5、2 mg·kg-1)分别可使25%、50%、62.5% (P<0.05)的小鼠再次入睡,灌胃给予YZG-331 (5、10、20 mg·kg-1)分别可使25%、75% (P<0.01)、87.5% (P<0.01)的小鼠再次翻正反射消失。结果表明,这两个受试物本身具有镇静催眠作用,不通过抑制肝药酶活性延长睡眠时间,YZG-330的起效剂量远低于YZG-331。
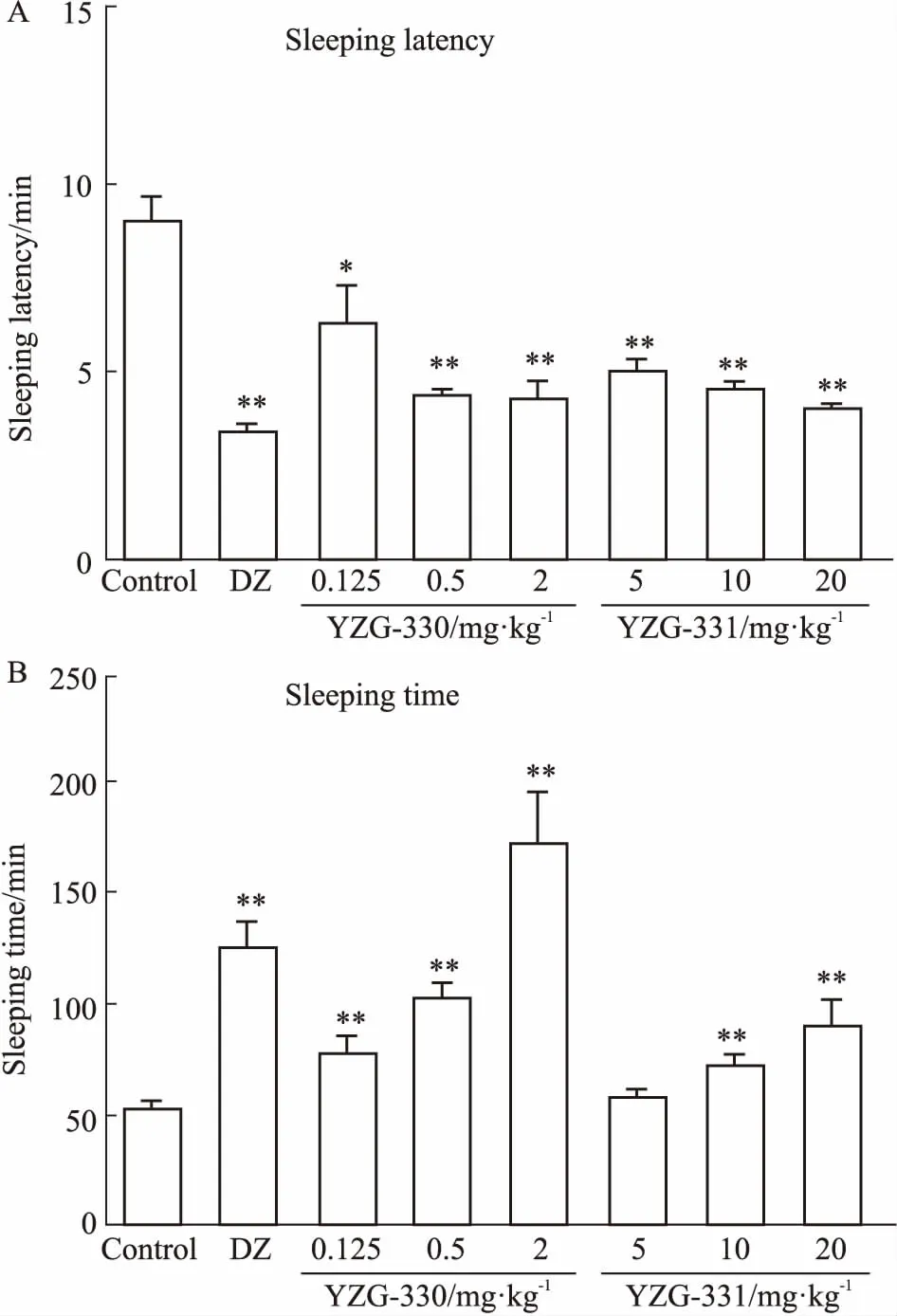
Fig 3 Effects of YZG-330 and YZG-331 ononset(A) and duration(B) of sleeping in sodiumpentobarbital-treated n=10)
The sleep latency and sleeping time were assessed after administration of diazepam (5 mg·kg-1), YZG-330 (0.125, 0.5, 2 mg·kg-1) and YZG-331 (5, 10, 20 mg·kg-1).*P<0.05,**P<0.01vsvehicle group, tested by one way ANOVA.

Tab 1 Effects of YZG-330 and YZG-331 on sleep re-onset in micetreated by sodium pentobarbital (38 mg·kg-1, n=10)
*P<0.05,**P<0.01vsvehicle group
2.4YZG-330及YZG-331对小鼠脑内GABA和Glu水平的影响氨基酸类神经递质GABA是脑内主要的抑制性递质,Glu是GABA的前体物质。HPLC-ECD法测得的Glu和GABA水平如Fig 4所示,与溶剂对照组相比,YZG-330(2 mg·kg-1)对下丘脑和皮层中GABA和Glu水平无明显影响。YZG-331 (40 mg·kg-1)可明显升高下丘脑和皮层中GABA含量,升高率分别为17.6%和19.5%。
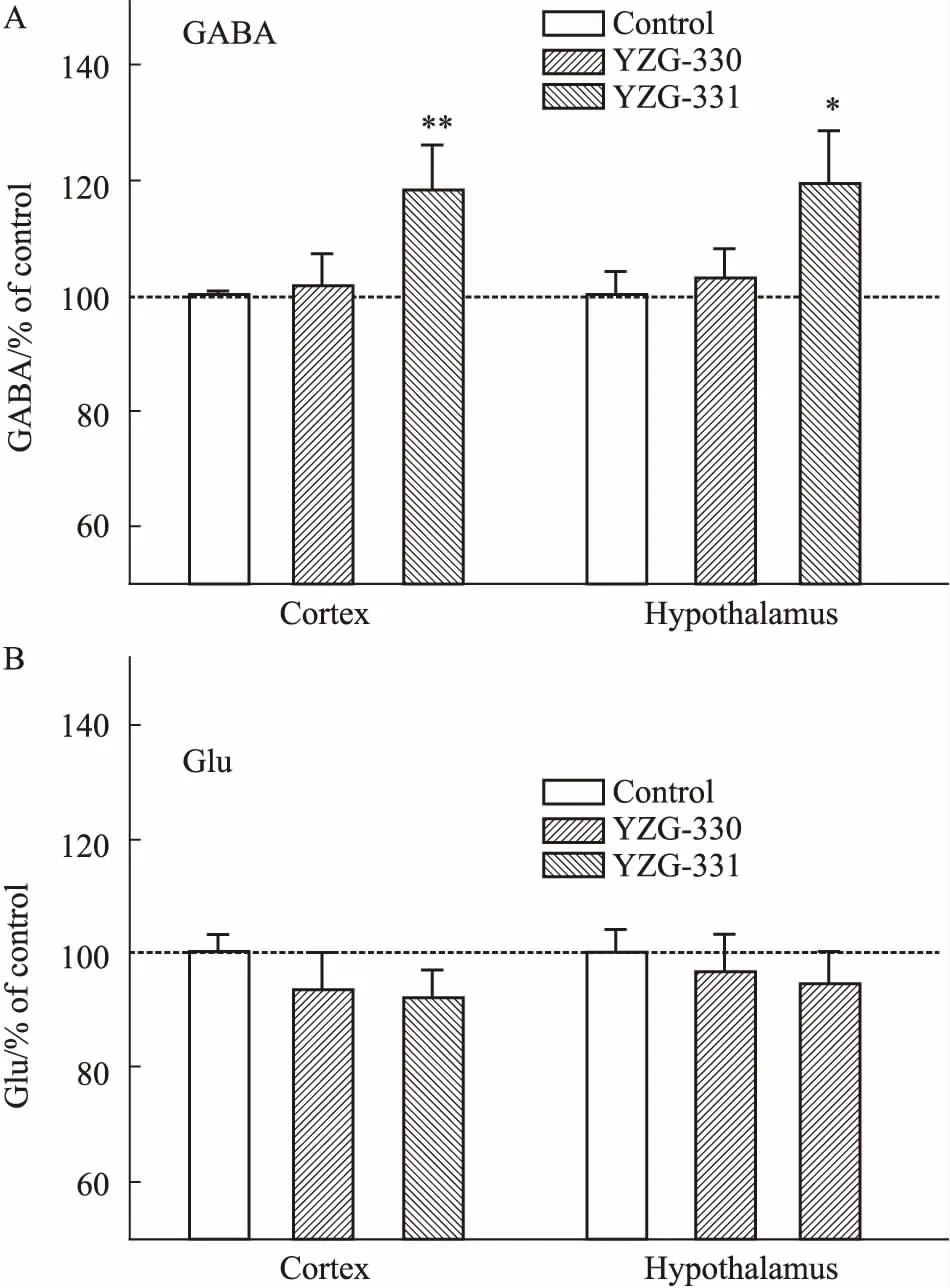
Fig 4 Effects of YZGs on concentrations of GABA(A) andGlu(B) in different mouse brain n=10)
Mice were injected with YZG-330 (2 mg·kg-1) or YZG-331 (40 mg·kg-1), and brain tissue homogenate was prepared after 15 min treatment. The neurotransmitters contents were measured by HPLC-ECD with OPA pre-column derivatization.*P<0.05,**P<0.01vscontrol group.
3 讨论
自主活动实验常用来评价药物对中枢神经系统影响,是神经药理学研究中常用的方法之一。动物的自主活动参数常用来反映中枢神经系统的功能状态,兴奋时自主活动距离增加,抑制时活动距离减少[10-11]。为了评价YZG-330和YZG-331对小鼠的镇静作用,我们记录分析了小鼠的自主活动,结果显示,YZG-330和YZG-331均能明显的抑制小鼠的自主活动,这两种化合物均具有中枢抑制作用,YZG-330 (2 mg·kg-1)与YZG-331 (20 mg·kg-1)对自主活动的抑制率相近。
实验结果表明,差向异构体YZG-330和YZG-331均能够明显延长阈上剂量戊巴比妥钠诱导的睡眠持续时间。动物实验中,深度的中枢抑制会使动物失去清醒,同时伴有肌张力消失和翻正反射消失,翻正反射消失超过1 min 即为睡眠[9]。协同阈上剂量戊巴比妥钠实验常用于评价具有中枢抑制作用的化合物,入睡潜伏期为小鼠翻正反射消失的潜伏期,睡眠时间为翻正反射消失持续时间。由于戊巴比妥钠经肝药酶代谢,因此对肝药酶有抑制作用的化合物可通过抑制戊巴比妥钠的代谢,使翻正反射持续时间延长。当动物被阈上剂量戊巴比妥钠诱导出现的翻正消失恢复后,能够使动物翻正反射再次消失1 min以上的化合物,被认为有中枢抑制作用。为排除YZG化合物因抑制戊巴比妥钠代谢而使协同睡眠时间延长的可能,我们进行了协同再入睡实验。结果表明,YZG-330 和YZG-331均有中枢抑制作用。
GABA是脑内最重要的抑制性神经递质。下丘脑腹外侧视前区(ventrolateral preoptic area, VLPO)是睡眠调节的关键区域之一,含有的抑制性GABA能神经元可产生抑制性神经递质GABA[12]。VLPO区的GABA能神经元最终投射到大脑皮层[13-14],Glu是GABA的合成底物,其含量与GABA密切相关。因此,我们选取重要的抑制性中枢下丘脑和主要投射区域大脑皮层对GABA和Glu含量进行测定。在分别灌胃给予小鼠YZG-330和YZG-331后,对其神经递质进行检测,结果发现,这两种化合物引起的皮层和下丘脑的GABA、Glu变化并不完全一致。YZG-331 (40 mg·kg-1)可以引起小鼠下丘脑和皮层中GABA的明显上升,这可能是该化合物引起中枢抑制作用的原因之一。YZG-330 (2 mg·kg-1)对GABA和Glu的含量均无明显影响。提示差向异构体YZGs产生中枢抑制作用的机制可能存在一定的差异。由于神经递质代谢过程较为复杂,涉及到多种酶和转运体,因此,YZG-330及YZG-331对氨基酸类神经递质的影响,以及该影响是否与其中枢抑制作用相关,还需要进行大量的后续研究。
综上所述,差向异构体YZG-330和YZG-331均具有强效的中枢抑制作用,YZG-330的抑制作用强于YZG-331。其对脑内神经递质GABA和Glu的影响既存在相似点,也存在差异,具体引起中枢抑制作用的机制可能存在差异,仍需进一步探讨。
(致谢:本实验在中国医学科学院药物研究所张建军课题组实验室完成。感谢本所石建功研究员提供YZG化合物,感谢刘伟、朱宏亮、于凤婷、方金玉在行为学实验中的帮助。)
[1] Wang X, Zheng M, Liu J, et al. Differences of first-pass effect in the liver and intestine contribute to the stereoselective pharmacokinetics of rhynchophylline and isorhynchophylline epimers in rats[J].JEthnopharmacol, 2017,209: 175-83.
[2] Zhan H D, Zhou H Y, Sui Y P, et al. The rhizome of Gastrodia elata Blume-an ethnopharmacological review[J].JEthnopharmacol, 2016,189: 361-85.
[3] Li M, Kang R, Jia S, et al. Sedative and hypnotic activity of N 6-(3-methoxyl-4-hydroxybenzyl) adenine riboside (B2), an adenosine analog[J].PharmacolBiochemBehav, 2014,117: 151-6.
[4] Shi Y, Dong J W, Tang L N, et al. N 6-(3-methoxyl-4-hydroxybenzyl) adenine riboside induces sedative and hypnotic effects via GAD enzyme activation in mice[J].PharmacolBiochemBehav, 2014,126:146-51.
[5] Hong Z Y, Huang Z L, Qu W M, et al. An adenosine A2A receptor agonist induces sleep by increasing GABA release in the tuberomammillary nucleus to inhibit histaminergic systems in rats[J].JNeurochem, 2005,92(6): 1542-9.
[6] 李 伟, 张建军. 腺苷类似物 WS090501 的镇静, 催眠和抗惊厥作用[J]. 药学学报, 2011,46(6): 742-6.
[6] Li W, Zhang J J. Sedative, hypnotic and anticonvulsive effects of an adenosine analogue WS090501[J].ActaPharmSin, 2011,46(6): 742-6.
[7] 赵施施, 张科学, 包素红, 等. 丙泊酚对幼小鼠自主活动和学习记忆行为的影响[J]. 中国药理学通报, 2013,29(2): 198-201.
[7] Zhao S S, Zhang K X, Bao S H, et al. Effects of propofol on spontaneous motor activity and learning behaviors in juvenile mice[J].ChinPharmacolBull, 2013,29(2): 198-201.
[8] Tabatabai S A, Zavareh E R, Reyhanfard H, et al. Evaluation of anxiolytic, sedative-hypnotic and amnesic effects of novel 2-phenoxy phenyl-1, 3, 4-oxadizole derivatives using experimental models[J].IranJPharmRes, 2015,14(Suppl): 51.
[9] 董静文, 史 源, 唐丽娜, 等. 化合物 H1208 镇静催眠作用研究[J]. 药学学报, 2014,49(6): 869-74.
[9] Dong J W, Shi Y, Tang L N, et al. Evaluation of the sedative and hypnotic effects of H1208[J].ActaPharmSin, 2014,49(6): 869-74.
[10] Xu S Y, Bian R L, Chen X. Methodology of Pharmacological Experiment[M]. People’s Medical Publishing House, 2002: 1346-9.
[11] 王晓冲, 董静文, 赵香玉, 等. 化合物 H057 镇静催眠作用评价[J]. 中国药理学通报, 2016,32(5): 638-42.
[11] Wang X C,Dong J W, Zhao X Y, et al. Evaluation of the sedative and hypnotic effects of H057[J].ChinPharmacolBull, 2016,32(5): 638-42.
[12] Kupfer D J, Reynolds C F. Management of insomnia[J].NEnglJMed, 1997,336(5): 341-6.
[13] Saper C B. Organization of cerebral cortical afferent systems in the rat. II. Magnocellular basal nucleus[J].JCompNeurol, 1984,222(3): 313-42.
[14] Haas H, Panula P. The role of histamine and the tuberomamillary nucleus in the nervous system[J].NatRevNeurosci, 2003,4(2): 121-30.
