快速溶剂萃取-气相色谱质谱法快速测定茶叶中7种拟除虫菊酯农残
2018-06-07
(北京吉天仪器有限公司,北京 100015)
1 前言
茶叶作为天然绿色的健康饮品深受国内外消费者的喜爱。然而茶叶中的农药残留对人类的身体健康存在潜在威胁。因此茶叶中农残检测一直是国内外食品监管部门的监测重点。拟除虫菊酯是一类能防治多种害虫的广谱杀虫剂,对昆虫具有强烈的触杀作用,因其高效低毒,在茶叶、蔬菜、水果种植中使用广泛[1,2]。茶叶中农残提取,常用的传统方法有索氏提取[3]、振荡提取[4]、超声波提取[5]、微波辅助萃取(MAE)[6-8]等,这些方法自动化程度低,溶剂消耗量大,处理时间长。茶叶中农残分析方法,常用的有气相色谱-质谱法(GC-MS)[9,10]、气相色谱-串联质谱法(GC-MS/MS)[11],液相色谱-质谱法(LC-MS)[12]、液相色谱-串联质谱法(LC-MS/MS)[13,14]等。本实验选用的分析方法为GC-MS。
快速溶剂萃取(APLE)是近几年国内发展较快的有机分析萃取技术,具有溶剂用量少,萃取时间短,萃取效率高等突出优点,已在环境、药物、食品和聚合物工业等领域得到广泛应用[15,16]。由于茶叶含有大量色素、生物碱及酚类化合物等脂溶性物质,若不经过净化它们会在分析中形成干扰,降低分析仪器的灵敏度和使用寿命,从而影响最终分析结果,因此,样品萃取后净化处理是十分必要的。本实验中,样品经APLE、dSPE净化、过0.45μm有机滤膜后,直接进GC-MS进行分析。实验对影响提取效率的预热时间、热平衡时间、静态萃取时间、萃取温度这些参数进行了优化选择,在优化后的参数下实验结果良好。该方法自动化程度高,萃取效率高、净化效果好、精密度好、分析快速非常适合大批量茶叶中7种拟除虫菊酯的日常检测工作。
2 材料与方法
2.1 仪器与试剂
仪器:APLE-3500快速溶剂萃取仪(北京吉天仪器有限公司);GCMS-QP2010SE气相色谱-质谱仪(日本岛津);Rxi®-5MS(30 m×0.25mm ×0.25μm) 色谱柱;TMS-200超级恒温混匀仪(杭州奥盛仪器有限公司);3-18R高速离心机(恒诺仪器);98-1-B型电子调温电热套(天津市泰斯特仪器有限公司)。分散固相萃取纯化管(dSPE:150mg MgSO4,50mg C18,7.5mg GCB,2mL)CNW®。
试剂:标准物质联苯菊酯、甲氰菊酯、三氟氯氰菊酯、氯菊酯、氟氰戊菊酯、氰戊菊酯、溴氰菊酯,购自农业部环境保护科研监测所,浓度均为100 μg/mL。正己烷(色谱纯);丙酮(色谱纯);0.45μm的有机滤膜(尼龙)。
样品:实验用茶叶(市售)样品经粉碎机粉碎后,混匀,密封,常温下保存,备用。
2.2 溶液配制
储备溶液的配制:准确移取100μg/mL 的7种拟除虫菊酯单标溶液,用正己烷分别配制成10μg/mL的标准储备溶液,然后将7种10μg/mL的拟除虫菊酯标准溶液配成1μg/mL的混合储备溶液。
工作溶液的配制:将1μg/mL的7种拟除虫菊酯混合储备溶液用正己烷分别配制成0.02μg/mL、0.05μg/mL、0.1μg/mL、0.25μg/mL、0.5μg/mL的混合标准工作溶液。
样品溶液的配制:准确称取茶叶样品1.0000g(精确至0.0001),硅藻土0.5000g,石英砂2.000g,混合均匀后装入11mL萃取池中(池底装有1片纤维滤纸和0.5600g硅藻土)。样品装填完毕后置于APLE-3500萃取(萃取条件见表1)。萃取液经水浴蒸干后用2mL正己烷复溶混匀,取出1mL于分散固相萃取纯化管中,混匀仪混匀5min、离心机离心5min后,取上清液经0.45μm的有机滤膜过滤后,供GC-MS分析。

表1 APLE-3500萃取条件
2.3 GC分析条件
进样口温度270.0℃;进样方式为不分流。色谱升温程序见表2。离子源温度250℃,四极杆150℃,连接口温度为280℃,EI电压70eV,溶剂延迟10min。离子选择模式为SIM模式分段扫描,7种分析物的定性离子定量离子选择见表3。 7种拟除虫菊酯分离情况良好,见图1。

表2 GC柱温箱升温程序

表3 7种拟除虫菊酯定量离子和定性离子

图1 浓度为0.2μg/mL的7种拟除虫菊酯GC-MS图
3 结果与讨论
3.1 APLE萃取条件优化
3.1.1 萃取温度
据报道[17],提高温度能极大地减弱由范德华力、氢键、溶质分子和样品基体活性位置的偶极吸引力所引起的溶质与基体之间的强的相互作用力。加速了溶质分子的解析动力学过程,减小解析过程所需的活化能,降低溶剂的粘度,因而减小溶剂进入样品基体的阻滞,增加了溶剂进入样品基体的扩散,使溶剂溶解待测物的容量增加,从而提高萃取效率。然而,温度过高可能导致某些目标物的热降解,从而导致回收率降低。本实验在确定其他提取因素的前提下,以萃取温度为变量,选择80℃、100℃、120℃和140℃ 4个温度进行提取效果分析,结果见图2。
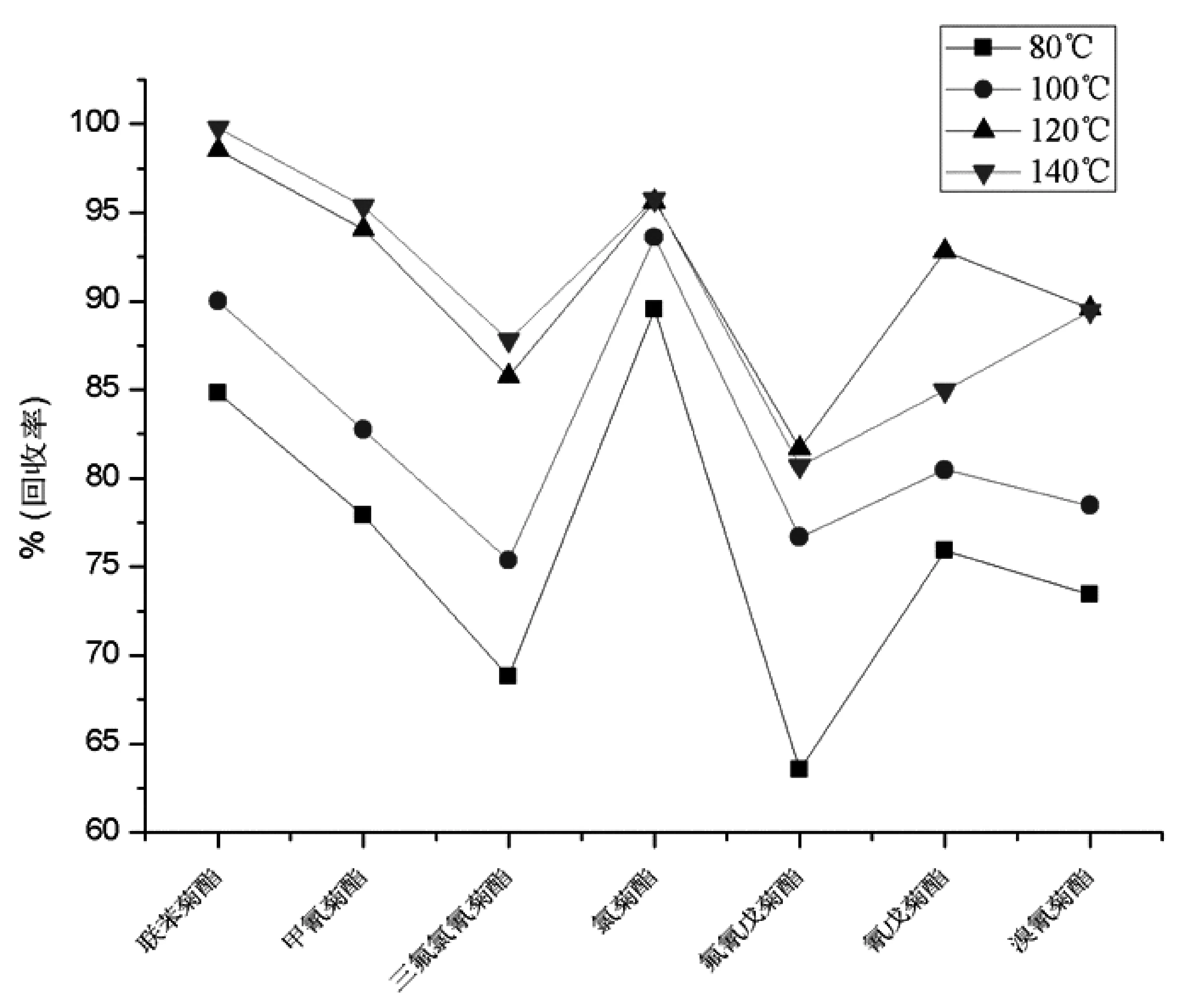
图2 不同温度下7种目标的加标回收率
由考察结果可知,从80℃到100℃,多数物质的回收率没有显著升高,在140℃时的回收率与120℃的回收率相比,除了氰戊菊酯回收率降低较明显之外,其他6种菊酯回收率差别不大。可能的原因是温度高于140℃时,热降解作用对氰戊菊酯有影响。因此,选取120℃作为萃取茶叶中7种拟除虫菊酯的最佳温度。
3.1.2 预热时间
在APLE萃取过程中,预热过程是在萃取池进入加热炉之后加载溶剂之前,目的是通过预热减小萃取池及样品基质与加热炉之间的温差,从而缩短加载溶剂之后的热平衡时间,缩短萃取等待时间。本实验在确定其他提取因素的前提下,以预热时间为变量,考察了预热30s,120s,180s 3个时间进行提取效率分析,结果如图3。由图3可知,预热时间对提取效率的影响不明显,3个时间7种目标物的回收率差别不大,这主要原因可能是萃取过程中只要热平衡时间及静态萃取时间是足够的,预热时间对萃取效果影响不大。从缩短整个萃取过程考虑,选取30s为茶叶中7种拟除虫菊酯萃取的最佳预热时间。

图3 不同预热时间下7种目标物的加标回收率
3.1.3 热平衡时间
热平衡过程是当溶剂加入到萃取池之后,整个萃取池达到设定萃取温度的热传递过程,若时间过短,萃取池内溶剂不能达到设定的最佳萃取溶度,萃取溶剂的粘度和渗透能力达不到最好的条件,影响萃取效率。时间过长可能会导致目标物一定程度的分解或降解,从而导致提取效率降低。本实验在其他条件一定的前提下,考察了热平衡3min、5min、7min 3个时间的加标回收率,进行萃取效果分析,结果如图4。当热平衡时间为3min 时7种目标物的回收率明显偏低,7min与5min相比7种目标的回收率略有下降。原因主要是因为当热平衡时间较短时,溶剂未能达到设温度,导致溶剂不能很好的渗透到样品基质内部,分析物析出较慢,导致回收率较低;热平衡时间过长时,又可能导致热降解从而回收率降低。因此选取5min为最佳的热平衡时间。

图4 不同热平衡时间下7种目标物的加标回收率
3.1.4 静态萃取时间
静态萃取时间是影响萃取效率的重要因素之一,时间过短不利于溶剂更好的渗透到基质分子内部造成提取效率不高,时间过长又有可能造成目标物的不同程度的分解。确定其他条件,本实验考察了热平衡2min、5min、7min 3个时间进行提取效率分析,结果如图5。静态萃取2min时7种目标物的回收率均能满足方法的需求,因此选取静态萃取2min为最佳的静态萃取时间。

图5 不同静态萃取时间条件下7种目标物的加标回收率
3.2 基质效应的考察
由于茶叶基质的复杂性,萃取液虽然经过分散固相萃取纯化管的净化,仍然存在一定的基质效应。本实验将7种拟除虫菊酯标准物质用正己烷配制成0.25μg/mL的混合标准溶液进样分析(峰面积为A),与空白基质中标准物质的峰面积(B)比较得出基质效应的大小。定义基质效应为(B-A)/A*100%。结果如表4。

表4 7种拟除虫菊酯在茶叶基质中的基质效应(n=3)
由考察结果可知,7种分析物的基质效应绝对值均小于等于12.2%,表明该实验方法有效去除了基质干扰,基质效应较小。
3.3 方法定量性考察
3.3.1 方法重复性
取浓度为0.25μg/mL 的7种拟除虫菊酯的混合标准溶液,分别连续进样6针,考察仪器的重复性,结果见表5。方法具有良好的重复性。

表5 7种拟除虫菊酯标准溶液的仪器重复性(n=6)
3.3.2 方法的检出限、定量限及线性
采用空白基质配制一系列的标准工作液,以7种拟除虫菊酯的定量离子峰面积为纵坐标,相应的质量浓度(μg/g)为横坐标,进行线性回归计算,得到线性方程、线性范围和相关系数;以信噪比S/N≥3确定检出限(LOD),S/N≥10 确定定量限(LOQ)。结果如表6 所示,方法在0.02~1μg/g(0.02、0.05、0.1、0.25 、0.5、1μg/g)范围内线性关系良好,线性相关系数(r)≥0.9993。

表6 7种拟除虫菊酯线性方程、线性范围、相关系数、检出限和定量限
3.3.3 方法的回收率及精密度
在基质空白中添加7种拟除虫菊酯标准物质,添加浓度水平为100ng/g、250ng/g、500ng/g。每个添加浓度平行测定6次,计算回收率及相对标准偏差,结果如表7。由表7可知,方法的回收率为84.3~102.9%,精密度≤5.5%。结果表明,该方法能够满足实际样品的测定。

表7 7种拟除虫菊酯加标回收率及RSD(n=6)
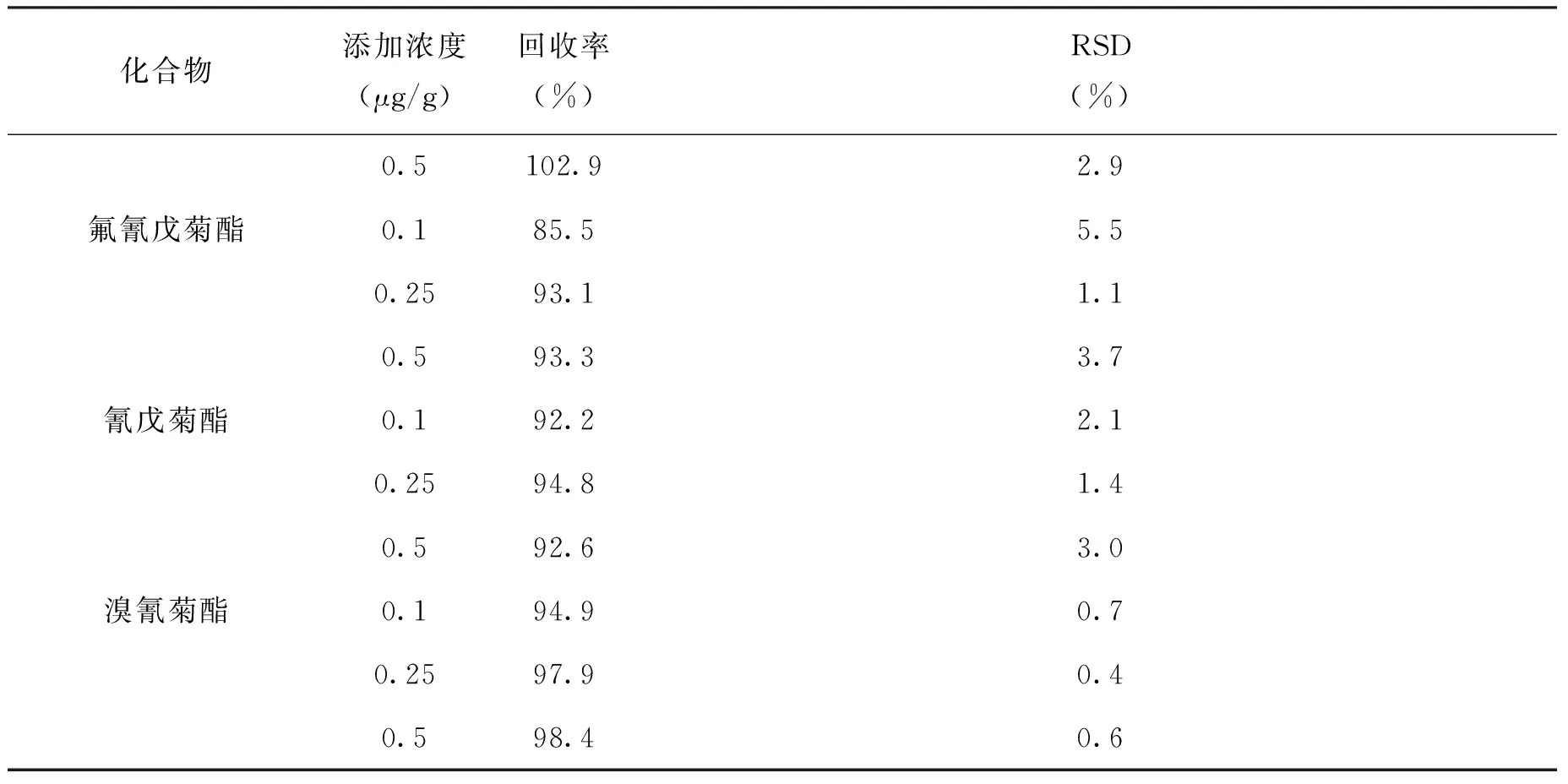
续表7
3.4 样品分析
应用本方法测定了4种茶叶实际样品,分别是1#-铁观音、2#-绿茶、3#-绿茶、4#-红茶。测定结果如表8所示。绿茶中均检出了联苯菊酯,红茶中检出了联苯菊酯、甲氰菊酯和三氟氯氰菊酯。4#-红茶GC-MS实际分析分段扫描色谱图见图6。

表8 实际样品中7种拟除虫菊酯检测结果

续表8
注:ND为未检出

图6 4#-红茶GC-MS测定色谱图
4 结论
实验采用快速溶剂萃取结合气质联用技术(APLE-GC/MS),建立了茶叶中7种拟除虫菊酯的检测方法,并对影响APLE萃取效果的因素进行了优化考察。结果表明,当萃取温度为120℃、预热时间30s、热平衡5min、静态萃取2min时,7种拟除虫菊酯的加标回收率均很好的达到了分析方法的要求。该方法提取效率高,稳定性好,操作简便。尤其是APLE的高效快捷萃取结合分散固相萃取纯化管净化,大大缩短了整个分析过程所用的时间,十分适合茶叶中7种拟除虫菊酯的日常检测。
[1] 李红,陈广平,常建,等.气相色谱法测定茶叶中多种拟除虫菊酯农药残留[J].农业科技与装备,2010,(1): 19-21.
[2] 金戈辉,焦阳,李太平,等.相色谱法测定水果、蔬菜中多种拟除虫菊酯类农药残留[J].检验检疫科学,2008,18(4): 41-43.
[3] 汤桦,陈大舟,冯洁,等.高分辨同位素稀释质谱法测定亚太区域比对茶叶样品中的农药残留[J].化学通报,2010,(25): 920-926.
[4] 冯洁,汤桦,陈大舟,等.茶叶中9种有机氯和拟除虫菊酯农药残留的前处理方法研究[J].分析测试学报,2010,(29):1041-1047.
[5] 林子俺,龚巧燕,林旭聪.超声波提取-高效液相色谱测定茶叶中拟除虫菊酯农药残留[J].光谱实验室,2007,24(4):675-678.
[6] 古小玲.茶叶中农药残留检测技术概述[J].茶叶科学技术,2007,(03): 1-5.
[7] Consuelo Pizarro.Microwave assisted extraction combined with dispersive liquid-liquid microextraction as a sensitive sample preparation method for the determination of haloanisoles and halophenols in cork stoppers and oak barrel sawdust [J].Food chemistry,2012,132: 2202-2210.
[8] Che Guoqiang,Cao Pengying,Liu Renjiang.A multi-residue method for fast determination of pesticides in tea by ultra-performance liquid chromatography-electrospray tandem mass spectrometry combined with modified QuEChERS sample preparation procedure[J].Food chemistry,2011,125: 1406-1411.
[10] Huang Z Q,Li Y J,Chen B.Simultaneous determination of 102 pesticide residues in Chinese teas by gas chromatography-mass spectrometry [J].J Chromatogr B,2007,853: 154-162.
[11] Zhu Pan,Miao Hong,Du Juan,Zou Jianhong,Zhang Guowen,Zhao Yunfeng,Wu Yongning.Organochlorine Pesticides and Pyrethroids in Chinese Tea by Screening and Confirmatory Detection Using GC-NCI-MS and GC-MS/MS[J].J Agric Food Chem,2014,62: 7092-7100.
[12] Cody R B,Wu Z.Analysis of Tea by Using HPLC/Time-of Flight Mass Spectrometry[J].LC GC North America,2004,22(2)(ResearchGate).
[13] Liu Xue,Guan Wenbi,Hao Xianghong,Wu Xiaoli,Ma Yongqiang,Pan Canping.Pesticide Multi-Residue Analysis in Tea Using d-SPE Sample Cleanup with Graphene Mixed with Primary Secondary Amine and Graphitized Carbon Black Prior to LC-MS/MS[J].Chromatographia,2014,77: 31-37.
[14] Kanrar Bappaditya,Mandal Sudeb,Bhattacharyya Anjan.Validation and uncertainty analysis of a multiresidue method for 42 pesticides in made tea,tea infusion and spent leaves using ethyl acetate extraction and liquid chromatography-tandem mass spectrometry[J].J Chromatogr A,2010,1217: 1926-1933.
[15] 刘鑫,孔维恒,陈璟涵,等.国产快速溶剂萃取GC/MS法测定土壤中有机氯农药[J].分析仪器,2017,(4):147-155.
[16] 刘鑫,刘萤,马俊勃,等.大豆中大豆油不同提取方法的比较研究[J].分析仪器,2017,(5):150-154.
[17] Pitzer K S et al.Thermodynamics.2nd ed,Mc Graw-Hill,New York,1961.
