6种绿化树种的气孔特性与臭氧剂量的响应关系
2018-06-07冯兆忠袁相洋代碌碌徐彦森
李 品,冯兆忠,*,尚 博,袁相洋,代碌碌,徐彦森
1 中国科学院生态环境研究中心 城市与区域生态国家重点实验室,北京 100085 2 中国科学院大学资源环境学院,北京 101408
地表臭氧(O3)主要由氮氧化物(NOx)和挥发性有机化合物(VOCs)等前体物经光化学反应生成,是一种具有极强氧化毒性作用的二次污染物和重要的温室气体[1]。随着我国工业化与城市化进程的加快,NOx和VOCs等前体物显著增加[2],地表O3浓度也不断升高。根据环保部网站监测数据显示,O3正在成为我国主要城市夏季的首要空气污染物,其中夏季小时平均O3浓度高达300nmol/mol以上,年均最大O3浓度达到60nmol/mol[3- 4],远超过敏感树种的受害临界负荷[5],对树木生长和森林生态系统服务功能产生严重威胁[6]。
城市树木在维持城市生态平衡,改善和缓解城市生态环境问题等方面起着无可替代的重要作用。但随着O3浓度的升高,研究发现暴露在O3下的树木出现一系列的伤害表征,如叶片出现缺绿斑、变黄、早衰、脱落等可见伤害症状[7- 9],光合速率降低[10- 12],气孔反应滞后甚至失灵[13- 14],水分消耗量增加[14- 15],树木生物量降低[16],改变生物量分配格局[11]和树木对病虫害以及环境胁迫的抵御能力[17],从而降低城市树木作为“碳汇”和“清洁工”改善生态环境问题的潜力[18- 19]。
植物气孔是进行光合作用和蒸腾作用等气体交换的重要调控器官,其气孔特征(数量、密度、开度、大小等)的变化体现了对环境变化及逆境胁迫响应与适应的结果。O3作为逆境胁迫因子,通过气孔进入植物体内,气孔特征决定了O3的进入量[20],也是评价O3对植物伤害的关键因素[21]。目前,高浓度O3对城市绿化树种的叶片气孔数量特征影响的研究有一些报道[22- 25],得出有差异的结论:高浓度O3处理显著降低叶片气孔开度和大小,但对气孔密度没有显著影响[22, 24]或者增加了气孔密度[23, 25]。以上研究都是基于单个树种单一O3升高浓度的熏蒸结果,由于基于不同的树种、O3浓度和实验持续期,很难评价O3对植物气孔特征的影响以及对植物产生的定量伤害。目前,根据不同浓度梯度的O3与植物生理指标、生物量、产量、可见伤害症状等建立剂量响应关系[16, 26],从而定量评价O3对植物的伤害,是有效可行的方法。考虑到树木生产缓慢,若干年后收获生物量来评估在实际过程中很难实现。而根据生理指标,特别是敏感性的指标——气孔特征,进行相应的O3剂量关系研究,尚未见报道。本实验选取的6种树种,作为城市行道木、风景园林绿化、防护林体系构成在北方地区广泛栽种。通过研究不同O3浓度胁迫对这6种城市绿化树种叶片气孔的影响效应,并根据O3浓度梯度下气孔特征指标的响应,建立O3浓度与气孔指标的剂量关系,以期为地表O3污染下筛选抗污染的树种及保护城市绿化树木少受O3伤害提供科学依据。
1 材料与方法
1.1 试验区概况
实验区位于北京市延庆区延庆镇唐家堡村(40°45′N, 115°97′E),在北京市区的东北方向,属大陆性季风气候,是温带与中温带、半干旱与半湿润带的过渡连带。气候冬冷夏凉,年平均气温10.2℃,夏季平均气温22—25℃,年降水量567mm,年平均日照2800h。
1.2 实验设计
实验选用6种城市绿化树种的一年生幼苗:2种不同基因型的杨树‘546’(Populusdeltoidescv. ‘55/56’ ×P.deltoidescv. ‘Imperial’)和‘107’(P.euramericanacv. ‘74/76’)、白蜡(Fraxinuschinensis)、法桐(Platanusorientalis)、洋槐(Robiniapseudoacacia)、国槐(Sophorajaponica)。2016年4月10日将长势较为一致的幼苗统一移入20L的圆形花盆中,用当地土壤与购买的草炭土按体积比3∶1混匀后装盆作为栽培基质。待移植两周后,选择树高和基径相差不大的幼苗,移入开顶式气室(OTCs)中,每间隔1—2d浇水,以适应气室内环境。10d后进行O3熏蒸处理。
本实验在15个OTC中进行O3熏气,OTC为高3.0m,边长1.0m的正八面柱体。实验共设5个处理:CF(过滤大气,charcoal filtered ambient air,[O3]<40nmol/mol),NF(环境大气[O3])、NF20(NF+20nmol/mol[O3])、NF40(NF+40nmol/mol[O3])、NF60(NF+60nmol/mol [O3])。每个处理有3个OTC重复,每个OTC内每种树5—6盆,并随机分布。实验期间各个罩子的O3浓度由美国热电公司49i臭氧分析仪监测(Model 49i; Thermo Scientific, Franklin, MA, USA),熏气时间从2016年6月26日到9月30日,持续96d,每天熏气时间为10h(08:00—18:00),阴雨天停止熏气。每个OTC外面和内部的温度和湿度由CR1000数据记录器监测(Campbell Scientific, North Logan, Utah, USA),每5min记录一次。在整个熏气期间,OTC内部的温度比外面环境平均高1.7℃,湿度平均低4.5%。分别于8月中上旬(生长旺期)和9月中下旬(生长末期),分两次进行取样测定指标。所有树种在取样时的实验期间小时O3浓度超过40nmol/mol的累计值(AOT40,the accumulated hourly mean O3concentration over a threshold of 40nmol/mol)详见表1。
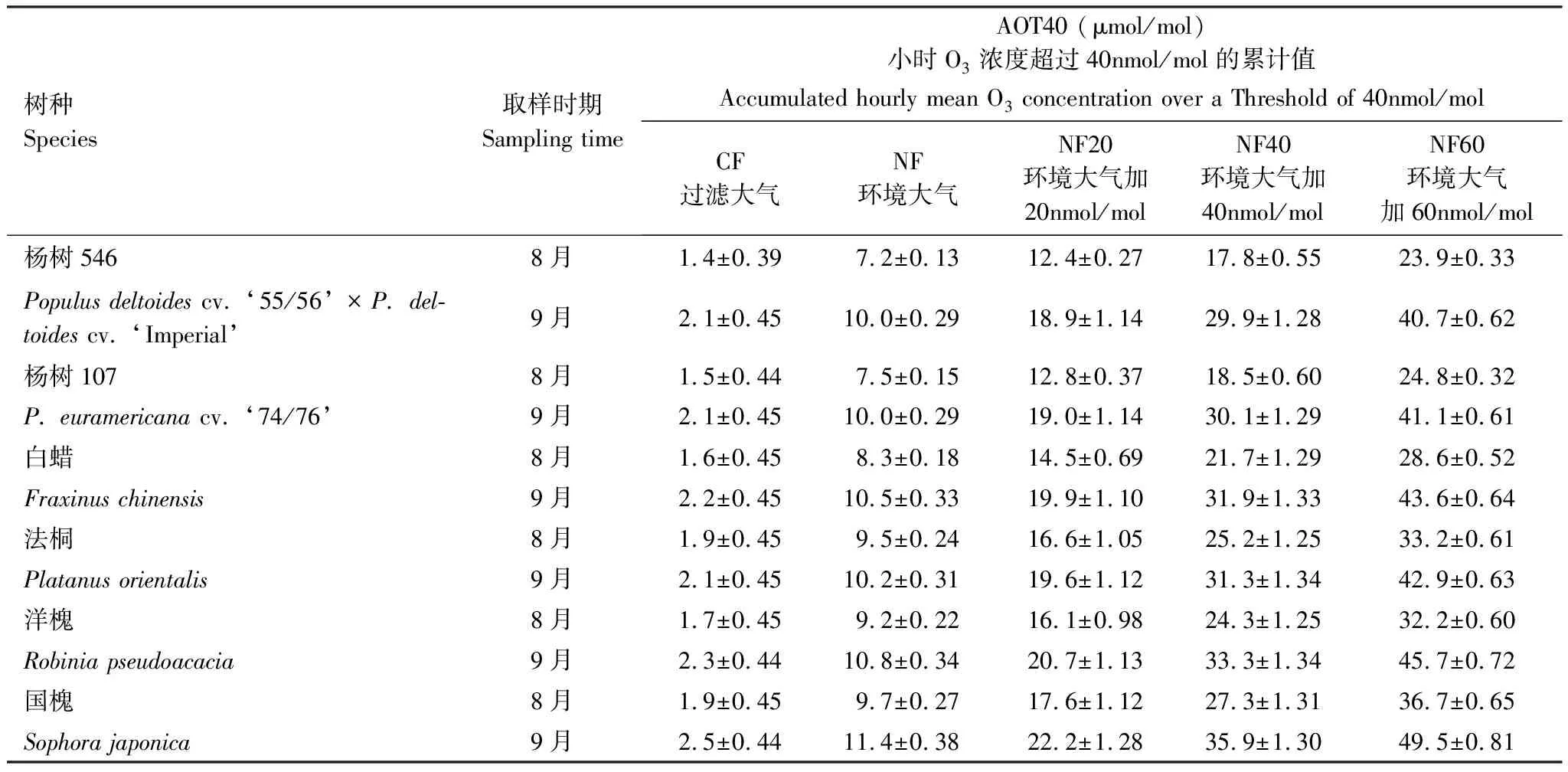
表1 6种树种2次取样时的AOT40值
1.3 指标测定
在8月中上旬(生长旺期)和9月中下旬(生长末期)两个时间段,分别在每个OTC中选择每种树苗3盆,于9:00—11:00间采集中上部(从顶端数第5—8片)阳生叶片,用指甲油印迹法进行取样:轻拭叶片表面灰尘,选择叶片远轴面中部靠近叶脉部位,均匀涂上无色指甲油,将其自然晾干,用镊子撕下已干的指甲油薄膜层,制作装片进行显微镜观察和测量[27- 28]。
用Dino-Lite AM7013MZT4(R4)显微镜照相仪拍照,用DinoCapture 2.0软件计算每幅图片上选定的1mm2视野面积中的气孔个数(单位面积植物叶片包含的气孔数目),即为气孔密度(气孔数/mm2)。随机选取每幅图片上完整清晰的10个气孔,用测微尺测量气孔长度、宽度,气孔长度为平行于气孔器的最长值,气孔宽度为垂直于气孔器的最宽值。计算气孔开度(气孔开度=πab,其中a表示1/2气孔长度,b表示1/2气孔宽度)和气孔大小(气孔大小=气孔长度×气孔宽度),然后取10个气孔的平均值作为这幅图片上气孔特征的值。
1.4 数据分析
实验数据按OTC为重复单元(n=3)。运用SPSS 18.0软件进行统计分析,选择Tukey′s Honestly Significant Difference (HSD) 检验法分析被测指标在不同O3浓度之间的差异,并选择一般线性模型(General Linear Model)将O3处理、采样时间与树种进行多因素方差分析。文中数据为平均值±标准差(Mean±SD)。运用Sigmaplot 10.0绘制气孔特征指标与AOT40的线性关系图(普通最小二乘法),并用Spearman′s相关关系检验线性关系的显著性。图中实线代表线性拟合关系显著(P<0.05),虚线代表不显著(P>0.05)。
2 结果与分析
2.1 O3浓度升高对气孔密度的影响
三因素方差分析结果表明(表2),O3处理、树种之间以及O3和树种的交互作用对气孔密度的影响均有显著性差异;采样时期对气孔密度的影响不显著(P=0.1498),但采样时期与树种的交互作用对气孔密度的影响是显著的。具体来讲,随着O3浓度的升高,6种树种的气孔密度在两个时期均呈显著的线性下降趋势(P<0.05),且8月份的下降斜率均大于9月份(表3和图1)。与CF相比,O3浓度升高至NF20已引起6种树的气孔密度普遍降低(图2);NF60处理下杨树546、杨树107、白蜡、法桐、洋槐和国槐的气孔密度与CF相比在生长旺期(8月份)分别降低26%、41%、39%、55%、43%和22%,在生长末期(9月份)分别降低14%、31%、35%、50%、40%和14%(图2)。其中,杨树546和法桐的气孔密度在两个采样时期呈现显著差异(P<0.001),在未受O3熏蒸的CF中,杨树546和法桐的气孔密度随着生长进入末期分别下降17%和14%(图2);并且杨树546出现O3与采样时期的交互作用。
表2O3处理、采样时间与树种的交互作用对气孔密度、气孔开度和气孔大小的影响的方差分析
Table2ANOVAresults(Pvalues)formaineffectsandinteractionsofO3treatment(CF, NF, NF20, NF40, and NF60),samplingtime(August and September)andsixtreespeciesonstomataldensity,stomatalapertureandstomatalsize
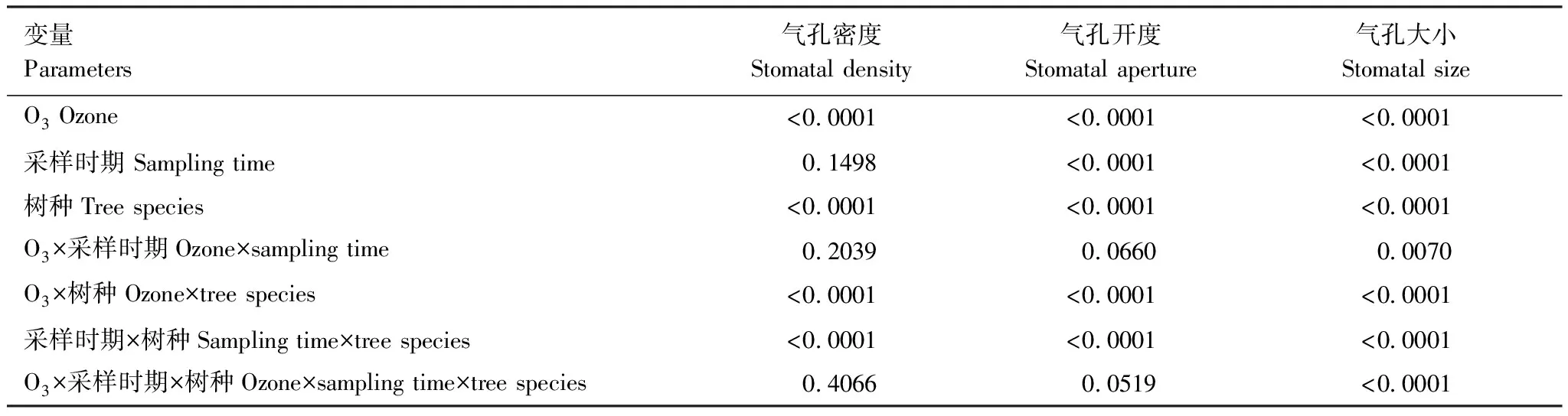
变量 Parameters气孔密度Stomatal density气孔开度Stomatal aperture气孔大小Stomatal sizeO3 Ozone<0.0001<0.0001<0.0001采样时期 Sampling time0.1498<0.0001<0.0001树种Tree species<0.0001<0.0001<0.0001O3×采样时期Ozone×sampling time0.20390.06600.0070O3×树种Ozone×tree species<0.0001<0.0001<0.0001采样时期×树种Sampling time×tree species<0.0001<0.0001<0.0001O3×采样时期×树种Ozone×sampling time×tree species0.40660.0519<0.0001
2.2 O3浓度升高对气孔开度的影响
方差分析结果表明,O3处理、树种之间、采样时期均显著影响了气孔开度,其中O3处理与树种之间、采样时期与树种之间表现出显著的交互作用(表2)。随着O3浓度的升高,6种树种的气孔开度在两个时期均呈现显著的线性下降趋势(P<0.05),且8月份的下降斜率大于9月份的(表3和图3)。具体来看(图4),O3处理显著影响了每种树种的气孔开度,但采样时期仅对杨树546和白蜡呈显著影响;并且在白蜡、法桐和国槐中出现O3与采样时期的交互作用。与CF相比,O3浓度为环境浓度(即NF,AOT40在8.3—11.4μmol/mol之间,表1)时,白蜡、法桐、洋槐和国槐的气孔开度已显著降低(图2)。
2.3 O3浓度升高对气孔大小的影响
三因素方差分析结果表明(表2),O3处理、树种之间、采样时期以及两两交互作用、三个因素交互作用对6种树种的气孔大小均有极显著的影响(P<0.01,表2)。从图5中可知,随着O3浓度升高,所有6种树种在2个时期的气孔大小均呈现显著线性下降(除了杨树两个基因型品种546和107在9月份的趋势不显著外),同样8月份的下降斜率均大于9月份(表3和图5)。O3处理、采样时期以及二者的交互作用对杨树546、白蜡、法桐和国槐的气孔大小有显著影响,但杨树107和洋槐的气孔大小仅受O3处理的影响(图6)。
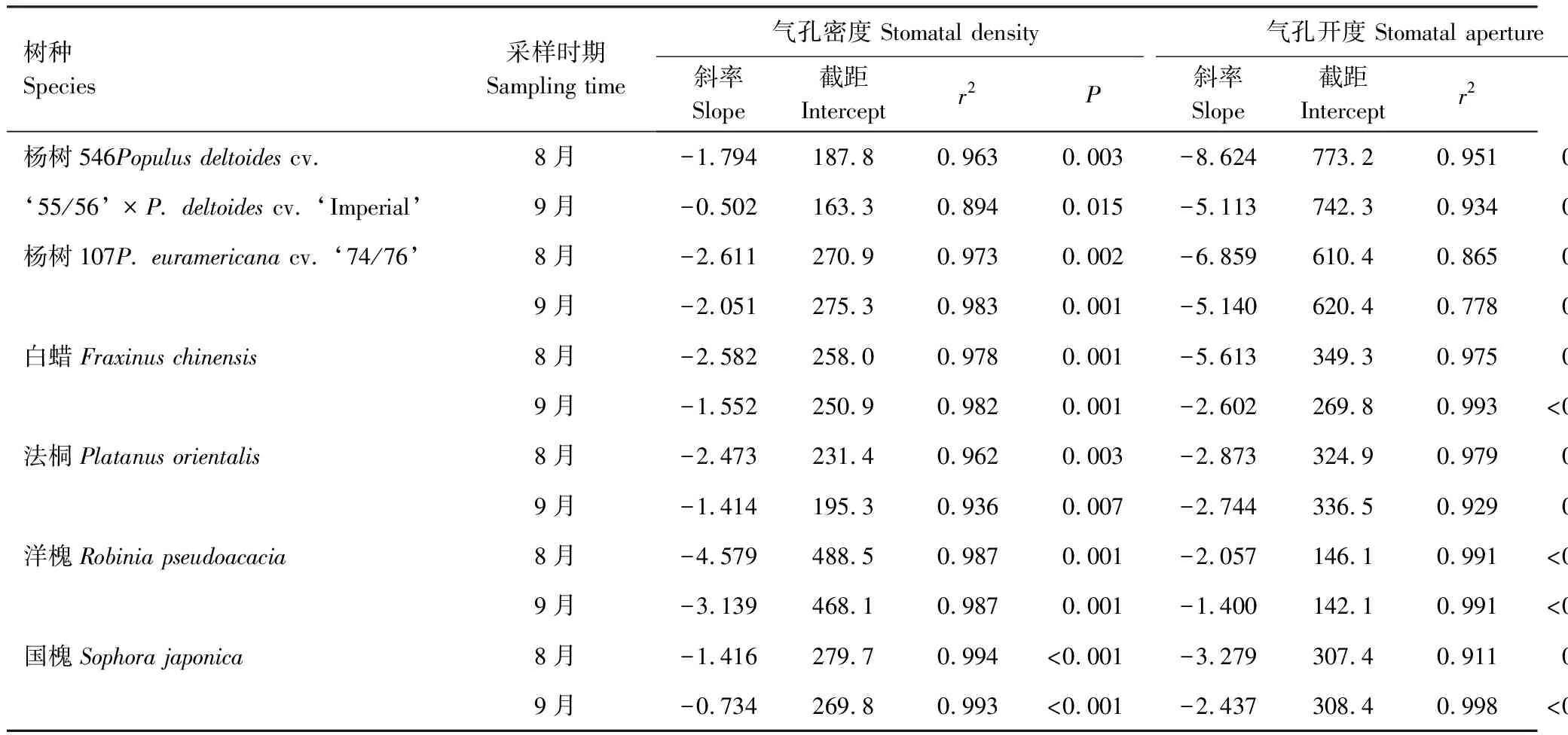
表3 不同O3处理下6种树种2个时期的气孔密度、气孔开度、气孔大小与AOT40的线性关系
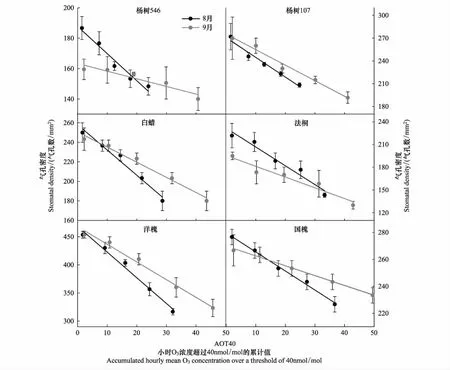
图1 不同O3处理下6种树种在2个采样时期的气孔密度的变化Fig.1 Ozone exposure-response relationships with stomatal density for six tree species at two sampling times (August and September)
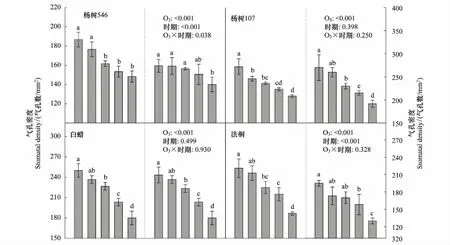
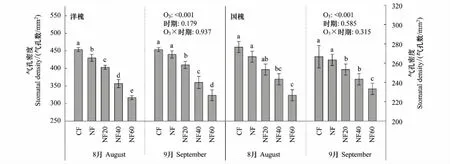
图2 不同O3处理下6种树种2个采样时期的气孔密度差异比较Fig.2 The six tree species comparison of stomatal density (mean±S.D., n=3) across different O3 treatments at two sampling times (August and September)不同小写字母间表示差异显著
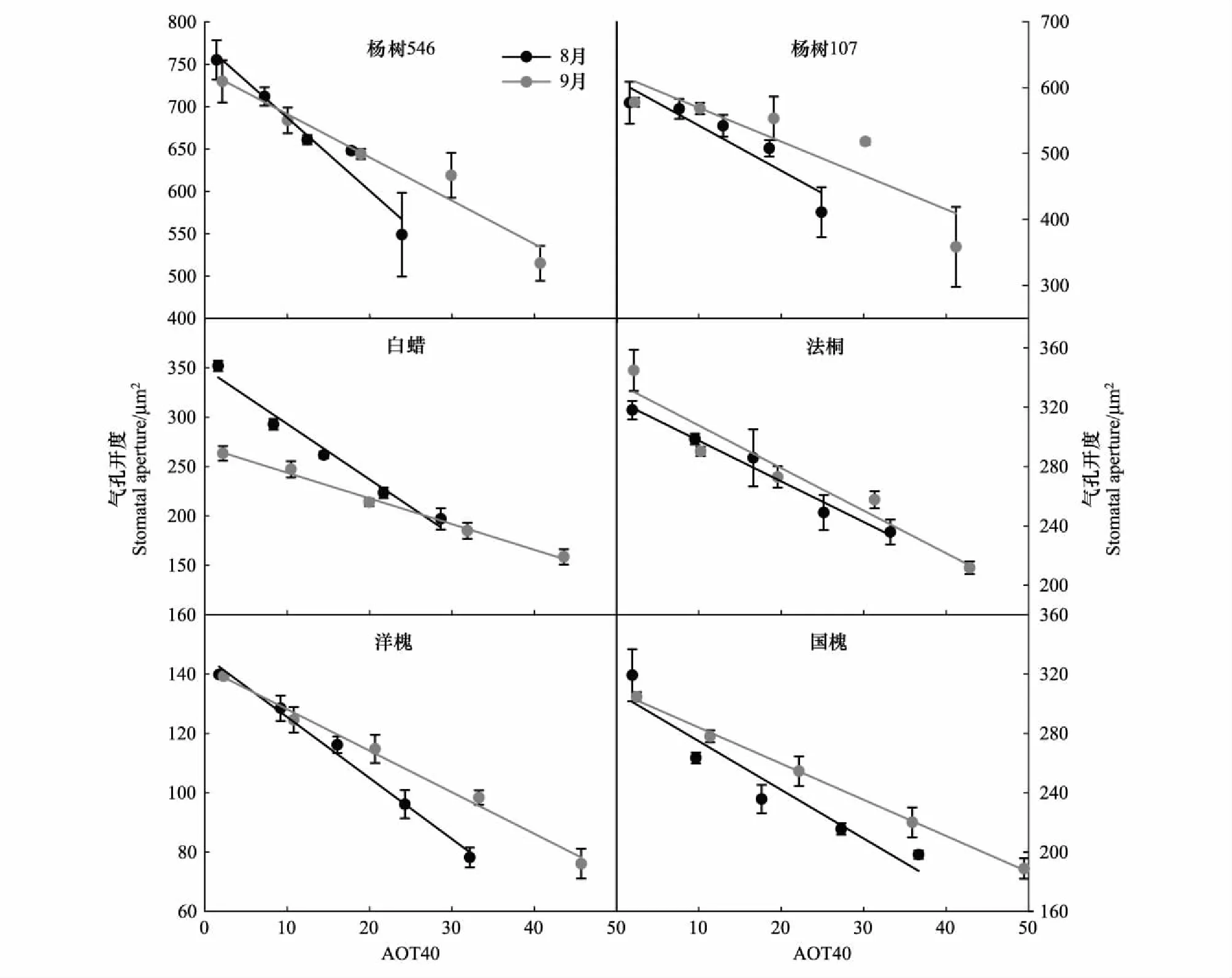
图3 不同O3处理下6种树种在2个采样时期的气孔开度的变化Fig.3 Ozone exposure-response relationships with stomatal aperture for six tree species at two sampling times (August and September)
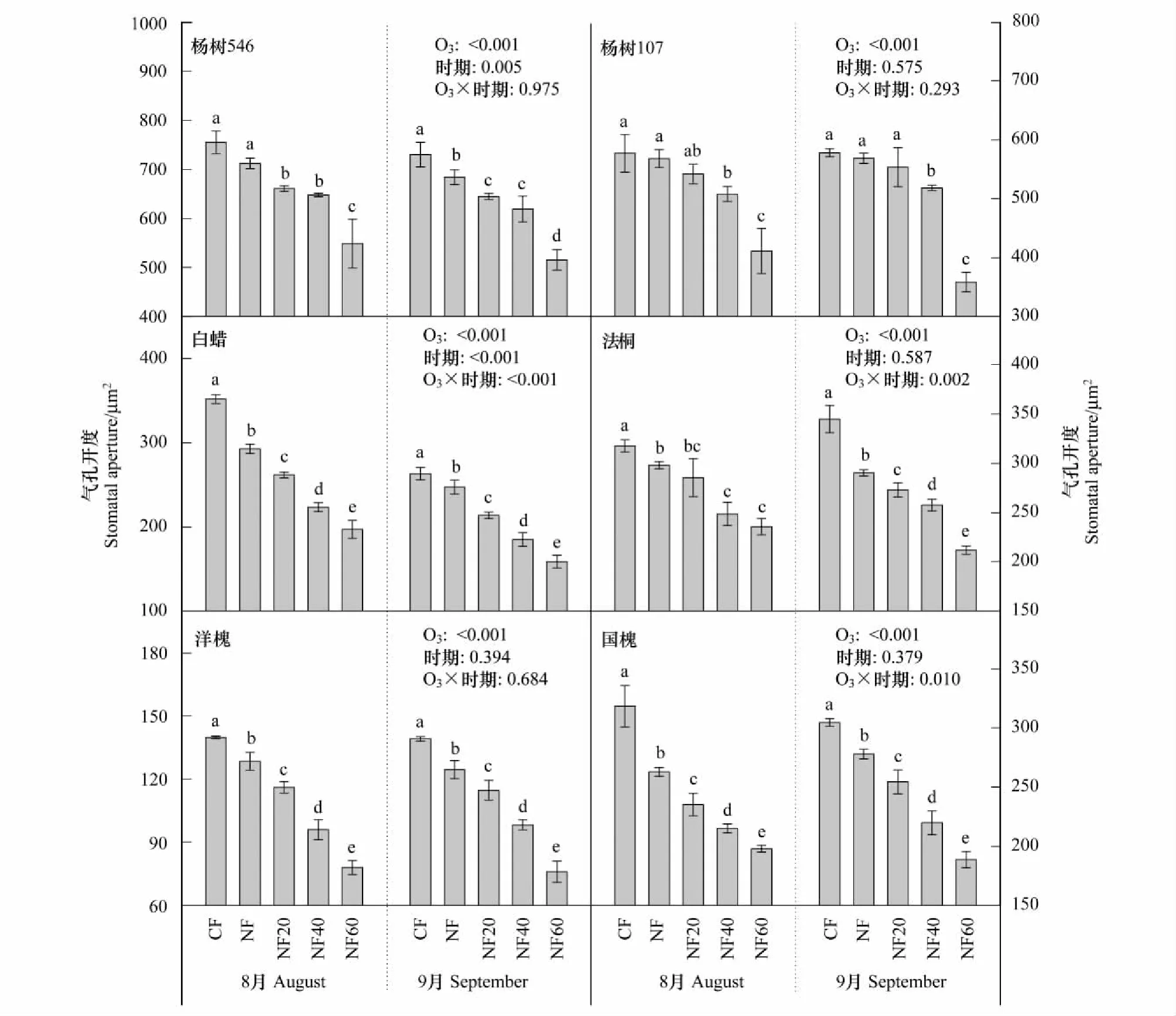
图4 不同O3处理下6种树种2个采样时期的气孔开度差异比较Fig.4 The six tree species comparison of stomatal aperture (mean±S.D., n=3) across different O3 treatments at two sampling times (August and September). Different lowercase letters denote significant difference among the bars in each panel
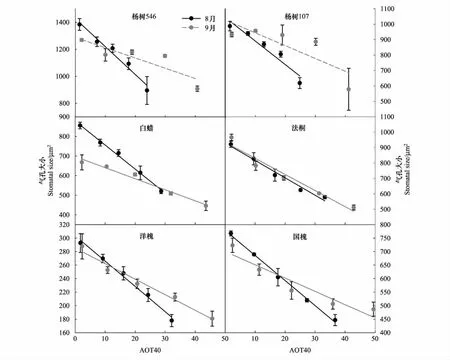
图5 不同O3处理下6种树种在2个采样时期气孔大小的变化Fig.5 Ozone exposure-response relationships with stomatal size for six tree species at two sampling times (August and September)
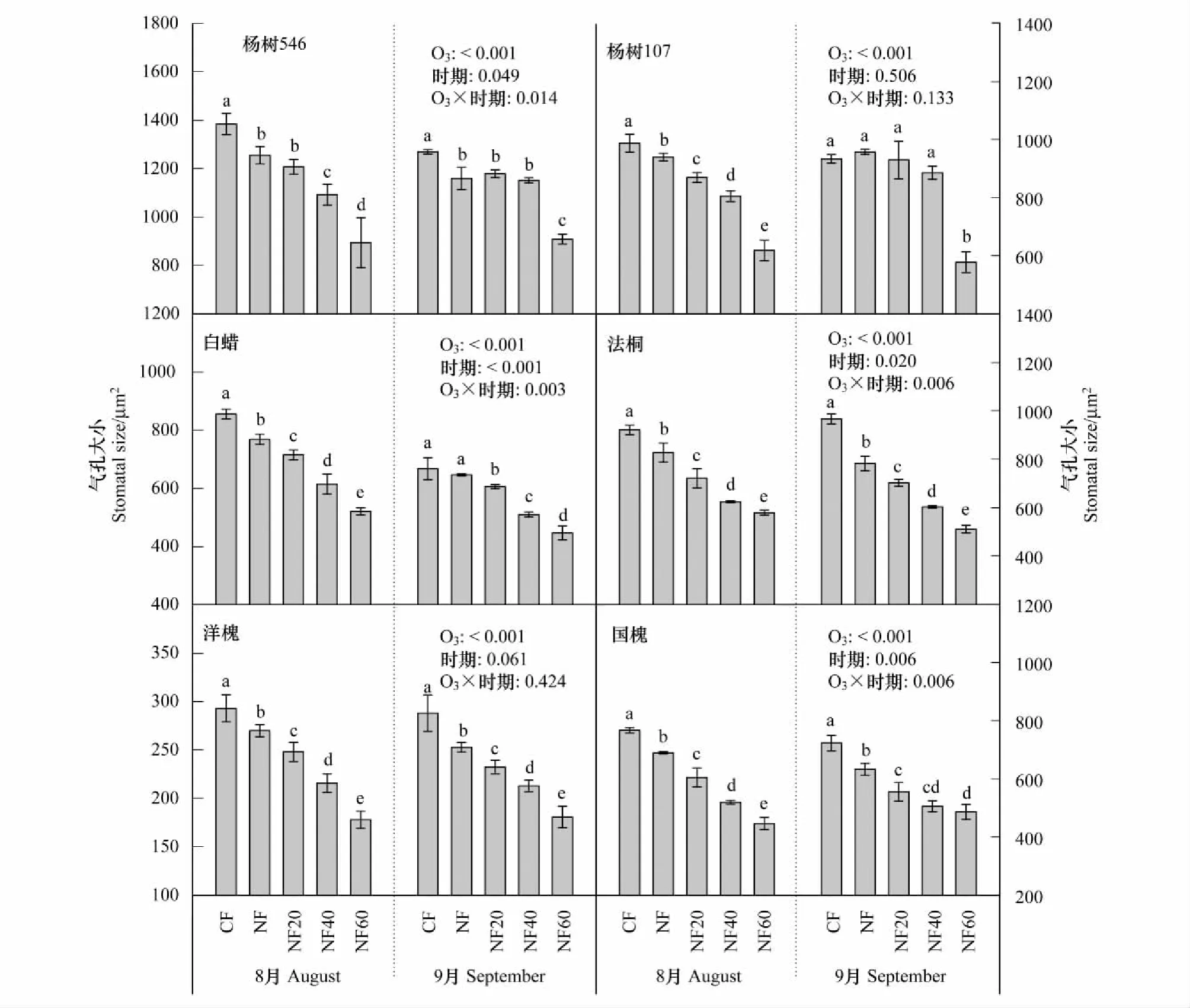
图6 不同O3处理下6种树种2个采样时期气孔大小的差异比较Fig.6 The six tree species comparison of stomatal size (mean±S.D., n=3) across different O3 treatments at two sampling times (August and September). Different lowercase letters denote significant difference among the bars in each panel
3 讨论
植物叶片上的气孔数量、大小和功能等属性对环境变化十分敏感[29- 30]。O3对植物的影响是一个累积的过程,随着时间的延长,O3胁迫对叶片气孔属性的损害会不断加深[31- 32]。本研究发现,随着O3浓度的不断增加和熏蒸时间的持续,6种树种叶片气孔密度、开度和大小都不同程度的显著减小。这些都表明O3胁迫对这些树种叶片气孔影响具有累积效应。当O3累积吸收量超过自身解毒和修复能力时,气孔结构受损,发育受到影响[25],导致气孔密度、开度和大小呈现显著变化。气孔数变少、气孔变小,开张度变小,很可能是植物为了适应不断升高的O3环境而迅速做出的反应(驯化作用)。虽然这些变化不利于植物吸收CO2进行光合作用固定生物量,但这可能是植物在胁迫环境下把更多资源分配给维持性存活而不是生长性存活的一种权衡(trade-off)策略,也即在高浓度O3胁迫下抑制了气孔的生长发育。
本研究中O3胁迫减少气孔密度,与前人的研究结果不一致。徐文铎等[22]对4年生银杏叶片研究发现,高浓度O3使气孔密度下降,但未达到显著水平(P>0.05);李梅等[24]发现高浓度O3熏蒸下1年生水蜡叶片的气孔密度变化不显著;文志等[23]发现O3胁迫62天和110天,1年生元宝枫叶片的气孔密度都显著增加。付伟等[25]发现高浓度O3熏蒸显著增加了4年生黄檗叶片的气孔密度。相关研究结果存在较大差异,可能与受O3熏蒸的时间和浓度影响、树种、以及叶发育阶段有关。在叶片形态学上,气孔产生和形成是在叶片发育早期[33- 34],O3浓度变化对处于发育早起叶片的气孔数量影响较大,成年叶片气孔数目除受环境因素影响外,还受遗传基因的控制。目前以上研究都是基于人工控制OTC中的短期观测O3增加对气孔参数的影响,这不一定反应植物在长期进化过程中对环境胁迫的适应。对于4年生的银杏成年叶片来说,即使成年叶片气孔数量基本形成,O3胁迫仍在一定程度上使气孔数量和密度有所下降[22],这可能是由于高浓度O3伤害了气孔器细胞,也破坏表皮细胞的发生,因此气孔数量和密度有所降低[22]。因此,开展长期的实验有助于研究叶片生长发育阶段下气孔参数对O3浓度增加的响应这一较复杂的问题。
气孔大小、气孔开度决定了进入植物体内O3的量。气孔越大,开度越大,O3进入量越多。本研究中O3胁迫减少了气孔开度和气孔大小,与前人的研究结果一致[11, 22- 25, 35]。但也有结果发现,由于O3导致气孔反应滞后(sluggishness)甚至失灵[21, 35- 36],使气孔面对胁迫时无法快速做出应激性的关闭反应来减少O3摄入量,从而降低O3对自身的伤害。这与不同树种对O3敏感性差异有关,相对敏感的树种很可能在相同的O3浓度下自身的解毒防御系统已经崩溃,保卫细胞作用失效从而使气孔无法关闭,增大了气孔开度。本研究的6种树种在持续的不同O3浓度熏蒸下气孔开度都减小,并随着O3剂量的增加,减小增加,这可能是气孔对环境做出的一种适应调节反应。
本研究发现O3处理与树种之间、采样时期与树种之间在气孔密度、开度和大小属性间都存在显著交互效应(表2)。由于每种树种固有的气孔属性本身有很大差别(见图2、4、6中CF的对照数值);并且随着生长期的持续,固有气孔属性会随着环境变化和内在物候期而发生变化[29- 30],因此表现出树种与采样时期之间存在显著交互效应。另外,树种对O3的敏感性具有种属特异性[7, 9, 26],越敏感的树种会越早做出生理生态(光合生理、水分生理等)的响应变化[26];本研究设置了5种O3浓度梯度,从每种树种的AOT40值来看(表1),这6种树种的敏感性排序从高到低为:杨树546>杨树107>法桐>白蜡>洋槐>国槐,这与其他研究中的敏感性结果一致[9, 12, 16]。因此,随着O3浓度的升高,不同敏感性树种的气孔属性做出响应的时间和O3剂量不同,表现出树种与O3处理(不同浓度)之间存在显著交互效应。
本研究仅对气孔特征指标与O3剂量之间的线性关系进行了分析, 进一步对其他生理指标(如光合作用特征和抗氧化系统等)进行定量化分析将是今后研究的重点[26]。植物既可以短期调节气孔开闭又可以长期控制气孔发育来适应环境的变化。O3对植物的累积性以及植物对O3胁迫的适应性,使得评价O3胁迫对不同敏感性植物以及植物不同发育阶段的气孔运动,从而最终评价O3对不同植物的影响和危害变得具有挑战性,也将是今后开展多年长期实验研究的必要性所在。
4 结论
(1)6种城市绿化树木的气孔特征指标对O3浓度升高极为敏感,随着O3浓度的升高,6种树种的气孔密度、开度和大小出现不同程度的显著降低。
(2)树种与O3处理之间,以及树种与采样时间之间产生显著性的交互影响,可能与不同树种之间的气孔特征存在显著差异,以及生长旺期与末期叶片不同的气孔发育阶段有关。
(3)本研究为深入研究环境变化背景下城市植物的叶组织结构和功能在适应地表O3污染方面提供理论证据。
参考文献(References):
[1] Wang T, Xue L K, Brimblecombe P, Lam Y F, Li L, Zhang L. Ozone pollution in China: a review of concentrations, meteorological influences, chemical precursors, and effects. Science of the Total Environment, 2017, 575: 1582- 1596.
[2] Liu X J, Zhang Y, Han W X, Tang A H, Shen J L, Cui Z L, Vitousek P, Erisman J W, Goulding K, Christie P, Fangmeier A, Zhang F S. Enhanced nitrogen deposition over China. Nature, 2013, 494(7438): 459- 462.
[3] Chen W, Tang H Z, Zhao H M. Diurnal, weekly and monthly spatial variations of air pollutants and air quality of Beijing. Atmospheric Environment, 2015, 119: 21- 34.
[4] Feng Z Z, Hu E Z, Wang X K, Jiang L J, Liu X J. Ground-level O3pollution and its impacts on food crops in China: a review. Environmental Pollution, 2015, 199: 42- 48.
[5] Novak K, Skelly J M, Schaub M, Kräuchi N, Hug C, Landolt W, Bleuler P. Ozone air pollution and foliar injury development on native plants of Switzerland. Environmental Pollution, 2003, 125(1): 41- 52.
[6] Ren W, Tian H Q, Tao B, Chappelka A, Sun G, Lu C Q, Liu M L, Chen G S, Xu X F. Impacts of tropospheric ozone and climate change on net primary productivity and net carbon exchange of China′s forest ecosystems. Global Ecology and Biogeography, 2011, 20(3): 391- 406.
[7] Zhang W W, Feng Z Z, Wang X K, Niu J F. Responses of native broadleaved woody species to elevated ozone in subtropical China. Environmental Pollution, 2012, 163: 149- 157.
[8] Feng Z Z, Sun J S, Wan W X, Hu E Z, Calatayud V. Evidence of widespread ozone-induced visible injury on plants in Beijing, China. Environmental Pollution, 2014, 193: 296- 301.
[9] Li P, Calatayud V, Gao F, Uddling J, Feng Z Z. Differences in ozone sensitivity among woody species are related to leaf morphology and antioxidant levels. Tree Physiology, 2016, 36(9): 1105- 1116.
[10] Feng Z Z, Zeng H Q, Wang X K, Zheng Q W, Feng Z W. Sensitivity ofMetasequoiaglyptostroboidesto ozone stress. Photosynthetica, 2008, 46(3): 463- 465.
[11] Wittig V E, Ainsworth E A, Naidu S L, Karnosky D F, Long S P. Quantifying the impact of current and future tropospheric ozone on tree biomass, growth, physiology and biochemistry: a quantitative meta-analysis. Global Change Biology, 2009, 15(2): 396- 424.
[12] Gao F, Calatayud V, García-Breijo F, Reig-Armiana J, Feng Z Z. Effects of elevated ozone on physiological, anatomical and ultrastructural characteristics of four common urban tree species in China. Ecological Indicators, 2016, 67: 367- 379.
[13] Nikula S, Percy K, Oksanen E, Holopainen T, Manninen S. Effects of elevated ozone on growth and foliar traits of European and hybrid aspen. Boreal Environment Research, 2009, 14(SA): 29- 47.
[14] Sun G E, McLaughlin S B, Porter J H, Uddling J, Mulholland P J, Adams M B, Pederson N. Interactive influences of ozone and climate on streamflow of forested watersheds. Global Change Biology, 2012, 18(11): 3395- 3409.
[15] Uddling J, Teclaw R M, Pregitzer K S, Ellsworth D S. Leaf and canopy conductance in aspen and aspen-birch forests under free-air enrichment of carbon dioxide and ozone. Tree Physiology, 2009, 29(11): 1367- 1380.
[16] Hu E Z, Gao F, Xin Y, Jia H X, Li K H, Hu J J, Feng Z Z. Concentration-and flux-based ozone dose-response relationships for five poplar clones grown in North China. Environmental Pollution, 2015, 207: 21- 30.
[17] Krupa S, McGrath M T, Andersen C P, Booker F L, Burkey K O, Chappelka A, Chevone B I, Pell E J, Zilinskas B A. Ambient ozone and plant health. Plant Disease, 2001, 85(1): 4- 12.
[18] Sitch S, Cox PM, Collins WJ, Huntingford C. Indirect radiative forcing of climate change through ozone effects on the land-carbon sink. Nature, 2007, 448(7155): 791- 794.
[19] Ainsworth E A, Yendrek C R, Sitch S, Collins W J, Emberson L D. The effects of tropospheric ozone on net primary productivity and implications for climate change. Annual Review of Plant Biology, 2013, 63: 637- 661.
[20] 任巍, 田汉勤. 臭氧污染与陆地生态系统生产力. 植物生态学报, 2007, 31(2): 219- 230.
[21] Hoshika Y, Omasa K, Paoletti E. Both ozone exposure and soil water stress are able to induce stomatal sluggishness. Environmental and Experimental Botany, 2013, 88: 19- 23.
[22] 徐文铎, 齐淑艳, 何兴元, 陈玮, 赵桂玲, 周园. 大气中CO2、O3浓度升高对银杏成年叶片气孔数量特征的影响. 生态学杂志, 2008, 27(7): 1059- 1063.
[23] 文志, 王丽, 王效科, 李丽, 崔健. O3和干旱胁迫对元宝枫叶片气孔特征的复合影响. 生态学杂志, 2014, 33(3): 560- 566.
[24] 李梅, 徐胜, 张恒庆, 何兴元, 陈玮, 赵诣, 李波. 高浓度O3对水蜡叶表皮气孔及其叶组织结构特征的影响. 生态学杂志, 2014, 33(1): 53- 58.
[25] 付伟, 邓莉兰, 徐胜, 何兴元, 陈玮, 赵诣, 张娜, 苏丽丽. 臭氧对黄檗幼苗叶片可见伤害及气孔特征的影响. 东北林业大学学报, 2015, 43(2): 14- 18.
[26] 辛月, 高峰, 冯兆忠. 不同基因型杨树的光合特征与臭氧剂量的响应关系. 环境科学, 2016, 37(6): 2359- 2367.
[27] 刘明智, 努尔巴衣·阿布都沙力克, 潘晓玲. 指甲油涂抹撕取法制取植物叶气孔装片. 生物学通报, 2005, 40(10): 44- 44.
[28] Tricker P J, Trewin H, Kull O, Clarkson G J J, Eensalu E, Tallis M J, Colella A, Doncaster C P, Sabatti M, Taylor G. Stomatal conductance and not stomatal density determines the long-term reduction in leaf transpiration of poplar in elevated CO2. Oecologia, 2005, 143(4): 652- 660.
[29] 郑淑霞, 上官周平. 近70年黄土高原3种植物叶片气孔特征参数比较. 植物资源与环境学报, 2005, 14(1): 1- 5.
[30] 郑淑霞, 上官周平. 辽东栎叶片气孔密度及δ13C值的时空变异. 林业科学, 2005, 41(2): 30- 36.
[31] Asensi-Fabado A, García-Breijo F J, Reig-Armiana J. Ozone-induced reductions in below-ground biomass: an anatomical approach in potato. Plant, Cell & Environment, 2010, 33(7): 1070- 1083.
[32] Giacomo B, Forino L M C, Tagliasacchi A M, Bernardi R, Durante M. Ozone damage and tolerance in leaves of two poplar genotypes. Caryologia, 2010, 63(4): 422- 434.
[33] Gay A P, Hurd R G. The influence of light on stomatal density in the tomato. New Phytologist, 1975, 75(1): 37- 46.
[34] Schoch P G, Zinsou C, Sibi M. Dependence of the stomatal index on environmental factors during stomatal differentiation in leaves ofVignasinensisL. I. Effect of light intensity. Journal of Experimental Botany, 1980, 31(5): 1211- 1216.
[35] Hoshika Y, Carriero G, Feng Z Z, Zhang Y L, Paoletti E. Determinants of stomatal sluggishness in ozone-exposed deciduous tree species. Science of the Total Environment, 2014, 481: 453- 458.
[36] Paoletti E, Grulke N E. Ozone exposure and stomatal sluggishness in different plant physiognomic classes. Environmental Pollution, 2010, 158: 2664- 2671.
