基于诺丽叶片愈伤组织的细胞悬浮系的建立
2018-06-07张正雪蓝增全吴田
张正雪 蓝增全 吴田
(1. 西南林业大学环境科学与工程学院,昆明 650224;2. 西南林业大学园林学院,昆明 650224)
诺丽是一种常绿的热带多年生阔叶小乔木或灌木,由英文名Noni翻译而来,别名海巴戟、诺尼[1]、四季果[2]等,是巴戟天属茜草科植物,拉丁名为Morinda citrifoliaL,发源于南太平洋岛屿[3],因其对温度的特殊需求,生境较为苛刻,故而在全球的分布较为狭窄。主要分布于大溪地、夏威夷、印度尼西亚、菲律宾、以及我国的海南岛、西沙群岛[4]和台湾岛、云南西双版纳[5]等。诺丽叶含有很多生化成分,有比较强的抗氧化能力[6],主要是抗氧化剂和生物类黄酮,如萜烯类化合物[7-11]和黄酮甙类等[7]。2009年张伟敏等[12]实验证明了诺丽叶片具有降血压血糖和抗氧化的能力。
近年来,研究者们通过建立藏红花的细胞悬浮系获得了藏红花素[13],通过建立喜树[14]和新疆雪莲[15]等植物的细胞悬浮系,也分别获得了喜树碱[16]和黄酮[15]。国内目前对诺丽的使用主要是诺丽果,而对诺丽叶片的使用几乎没有,实际上叶片中富含一些抗氧化剂和生物类黄酮类物质。因此,在本课题组前期对诺丽的不同外植体(根、茎、叶)进行了愈伤组织诱导[17-19]的基础上,本实验拟通过探索MS液体培养基的激素组成、初始接种量以及在细胞悬浮培养过程中pH值的变化、悬浮细胞生长曲线、细胞活力、细胞形态和细胞存活率等参数,确定继代周期,完成诺丽叶片细胞悬浮体系的建立,以为后续诺丽叶片中次生代谢物的诱导奠定基础。
1 材料与方法
1.1 材料
本实验所用材料为淡黄色、质地疏松的愈伤组织。参照前人诺丽叶片愈伤组织诱导的方法,以实验室培养的诺丽无菌苗叶片为外植体进行诱导和继代的愈伤组织,愈伤组织诱导培养基为:MS + 0.1 mg/L 6-BA(6-苄氨基嘌呤)+ 2.0 mg/L 2,4-D(2,4氯化苯氧乙酸);愈伤组织继代培养基为:MS+2.0 mg/L NAA(a-萘乙酸)+0.1 mg/L KT(激动素)[19]。
1.2 方法
1.2.1 诺丽叶片细胞悬浮培养的液体培养基 以愈伤组织诱导和继代的培养基配方为参考,以MS为基本培养基,每1 000 mL培养基附加激素(激素组合和浓度见表1)、蔗糖3%、pH 5.8、分装、121℃下灭菌20 min。
悬浮细胞培养过程中,每2 d取两瓶悬浮细胞培养液测定一次细胞鲜重,生长量以湿细胞鲜重计。取2 mL 培养液,4℃下5 000 r/min离心5 min,弃去上清液,称量底部沉淀细胞鲜重。细胞生长速度以比生长速率计,比生长速率(d-1)=(培养结束时细胞鲜重-接种细胞鲜重)/接种细胞鲜重/培养天数。
1.2.2 诺丽叶片细胞悬浮培养过程 选取继代培养后淡黄色、分散性好、生长良好的愈伤组织,在超净工作台上用镊子将其夹碎,转接于MS液体培养基中,每250 mL的培养瓶中加入液体培养基50 mL。实验设计1.5 g、2.5 g、3 g、4 g这4个不同初始接种量,接种完成后,置于转速110 r/min、温度(25±2)℃的摇床上进行暗培养。分别观察愈伤组织在液体中的生长变化状况,进行统计、比较、筛选。每隔7 d继代培养1次,继代时除去大块愈伤组织,培养液按照与新鲜培养液1:2的比例进行混合再培养。筛选分散度好、较均匀、生长快的细胞作为母细胞,多次继代后得到性能良好、稳定的悬浮细胞系。
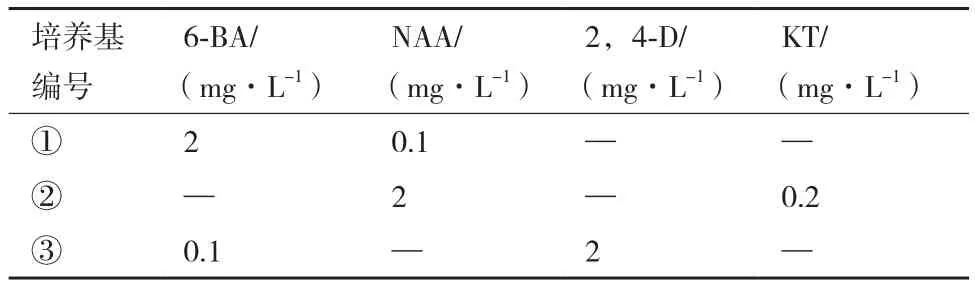
表1 不同激素组合和浓度培养基
1.2.3 培养液pH值的测定 每2 d测定一次培养液的pH值,用PHS-3CW型数显酸度计测定培养液pH。每次使用前,先用预先配制好的标准试剂校准,以确保仪器测量值的准确性。3瓶分别测量,测量数据取平均值,以培养时间为横坐标,pH值为纵坐标,绘制诺丽叶片细胞悬浮液pH变化曲线。
1.2.4 细胞悬浮生长曲线的测定 测定pH值的同时用血球计数板法检测悬浮培养液中的细胞数,记录其生长情况。从初次培养时开始,在其培养过程中,每2 d取3瓶悬浮细胞培养液,先用0.25% 的果胶酶对细胞团处理,让悬浮培养的细胞呈游离单细胞,便于细胞计数,再进行细胞数量的多次检测,取平均值作为最优数据记录。以培养时间为横坐标,悬浮细胞数量为纵坐标,绘制诺丽叶片悬浮细胞生长曲线。
1.2.5 TTC法测定细胞活力 用TTC法[20]测定细胞活力,以掌握细胞各时期的活力以便于后续实验的开展和对悬浮系的利用。
1.2.6 细胞形态的观察 每2 d进行一次细胞生长与变化情况的观察。采用观察培养的活细胞的倒置显微镜(40×)进行观察,拍照记录细胞的生长变化情况。
1.2.7 悬浮细胞存活率的测定 悬浮细胞培养结束后,先配制0.1% 酚藏花红溶液。检查时将经0.25%的果胶酶处理过的悬浮细胞取一滴放在载玻片上,滴一滴0.1% 酚藏花红溶液,盖上盖玻片,在低倍镜下,随机计数上、下、左、右、中5个视野内的细胞总数和被染成红色的细胞数,红色细胞为死细胞,按以下公式计算细胞存活率:悬浮细胞存活率(%)=[(细胞总数-死亡细胞数)/悬浮细胞总数]×100%。
1.2.8 细胞平板培养 为了检测悬浮细胞的活性,用培养皿分装固体MS培养基,将稳定的悬浮细胞培养液涂布在该培养基上进行平板培养,涂布后密封培养皿并将其置于温度(25±2)℃条件下暗培养。
2 结果
2.1 诺丽叶片悬浮细胞在不同液体培养基中的生长情况
经测定、计算可得到诺丽叶片悬浮细胞在3种液体培养基中的细胞生长速度(图1)。诺丽叶片悬浮细胞在3种液体培养基的细胞生长速度有所不同,且差异显著,悬浮细胞在MS+2.0 mg/L NAA+0.2 mg/L KT培养基中比生长速率显著高于其它两种培养基。在培养基MS+2.0 mg/L 6-BA +0.1 mg/LNAA中细胞比生长速率为0.0398/d;在培养基MS+2.0 mg/L NAA+0.2 mg/L KT 中悬浮细胞比生长速率为0.0753/d;在培养基MS+2.0 mg/L 2,4-D+0.1 mg/L 6-BA中比生长速率仅有0.026/d。因此,选定MS+2.0 mg/L NAA+0.2 mg/L KT作为诺丽叶片悬浮培养的MS液体培养基。
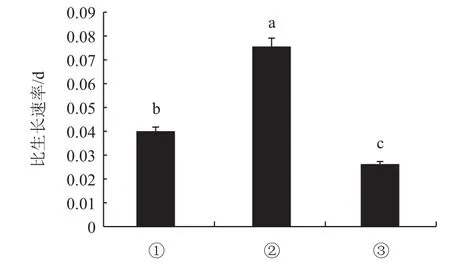
图1 3种不同液体培养基中诺丽叶片悬浮细胞的比生长速率
2.2 不同初始接种量对诺丽叶片悬浮细胞生长的影响
实验设计4个初始接种量,不同初始接种量下细胞生长速率不同(图2):在液体培养基中,初始接种量为1.5-3 g/50 mL,随着接种量的增加,悬浮细胞的比生长速率成递增趋势,继续增加接种量至4 g/50 mL细胞的比生长速率开始下降,同时褐变现象严重,可能是因为接种量的增加,培养到中后期时培养基里的营养物质消耗过多,造成培养细胞营养缺乏而死亡。因此,选定3 g/50 mL为适宜初始接种量。

图2 不同初始接种量下细胞的生长情况
2.3 培养液pH值的测定
pH是影响细胞生长的因子,培养基的pH可以改变营养元素的离子化状态,进而影响细胞新陈代谢活性。诺丽叶片细胞悬浮液的pH变化呈先下降后上升逐渐平稳下降趋势(图3),由初始的pH 5.8在第4天下降到最低4.21,后逐渐升高,到14-16 d恢复到5.8,之后逐渐趋于平稳。前期的pH值下降与后期的pH值上升,这可能与细胞培养液中各种离子的不等量吸收以及细胞在新陈代谢中释放的物质酸碱性有关。根据培养液pH值的这种变化情况,可初步确定诺丽叶片细胞悬浮培养液的最佳继代周期为22 d左右。
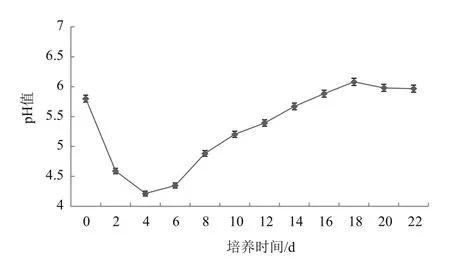
图3 诺丽叶片悬浮细胞培养液pH值变化情况
2.4 诺丽叶片悬浮细胞生长曲线
在附加2 .0 mg/L NAA和0.2 mg/L KT的MS培养基中进行诺丽叶片细胞悬浮培养。初始接种量为3 g/50 mL。通过定期测定细胞数量,可以了解细胞的生长状况(图4):诺丽叶片细胞悬浮培养的生长曲线成“S”型,接种后6 d为滞后期,这可能是细胞尚未适应新的生长环境;随后的6-14 d进入对数生长期,此时细胞细胞分裂活跃,生长加快,增长迅速;之后在14-26 d时进入直线生长期,是细胞增殖、生长和发育最明显的时期,细胞数量在26 d时达到最大值11.76×105个/mL。26 d后细胞数量下降,进入较长的生长静止期(26-30 d)。因此,结合与诺丽叶片细胞在悬浮培养的过程中的pH值的变化情况,可确定最佳继代培养时间是22-26 d。
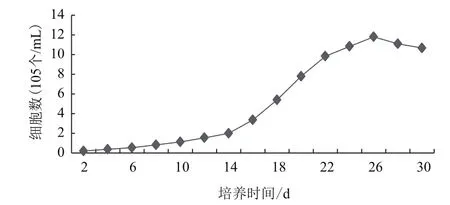
图4 诺丽叶片细胞悬浮培养生长曲线图
2.5 诺丽叶片悬浮细胞的活力曲线
对诺丽悬浮细胞活力曲线进行测定,细胞新陈代谢越旺盛其OD值越高(图5),且细胞呈深红色。以叶片为外植体的悬浮细胞,刚接入培养基诺丽细胞活力OD值在0.9,随着培养天数的增加OD值在21 d达到1.8,随后平稳。
综上,细胞悬浮生长曲线、悬浮液pH值、细胞活力曲线之间存在一定对应关系。诺丽叶片细胞悬浮培养液细胞生长曲线在14-22 d进入直线生长期,而此时悬浮液的pH值在5.67-5.97,用细胞存活力在第18 d 细胞活力值最大OD485=1.8,对应了细胞生长曲线与pH,此时期细胞悬浮液生长状态较好。
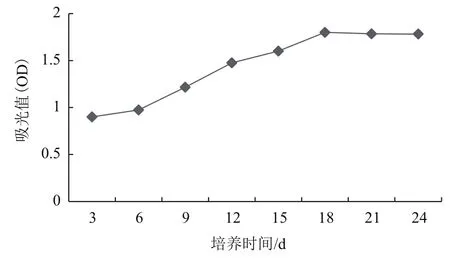
图5 诺丽叶片悬浮细胞活力测定
2.6 诺丽叶片悬浮细胞形态观察
悬浮细胞在倒置显微镜的观察下,细胞不同时期的生长变化情况不同(图6)。初代细胞悬浮液中,大量细胞聚集,形成细胞团(图6-A);第3代开始出现明显变化,形成杆状细胞(图6-B);第5代时有少量圆细胞形成,大量细胞有形成圆细胞的趋势(图6-C);随着继代次数的增加逐渐呈20-30个左右的小细胞聚集体,第6代后呈较规则的圆球体,细胞核明显(图6-D)。说明随着继代次数的增加,细胞悬浮体系逐步趋于稳定。
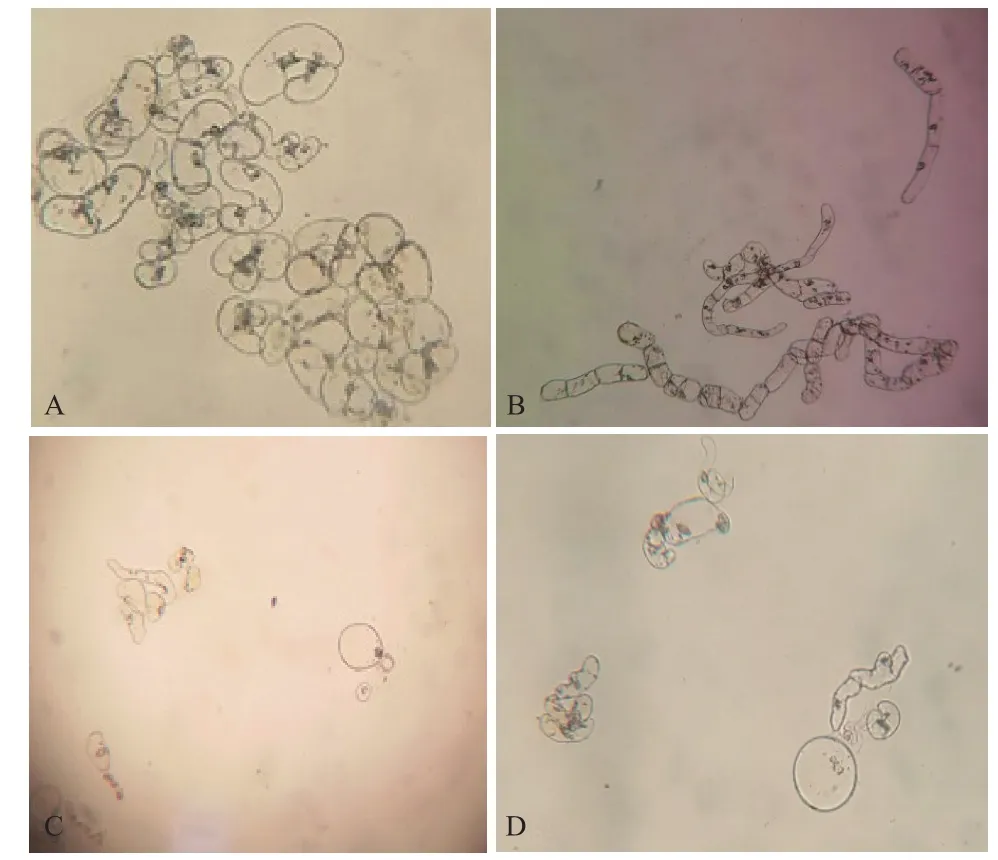
图6 诺丽叶片悬浮细胞40×显微镜下形态变化图
2.7 悬浮细胞存活率的测定
细胞悬浮培养在继代5-8次以后,形成稳定的悬浮培养液,将培养结束的稳定悬浮培养液进行细胞存活力测定,染色后活细胞无色,死亡细胞呈红色(图7),以叶片为外植体的细胞悬浮培养存活力达77.9%。
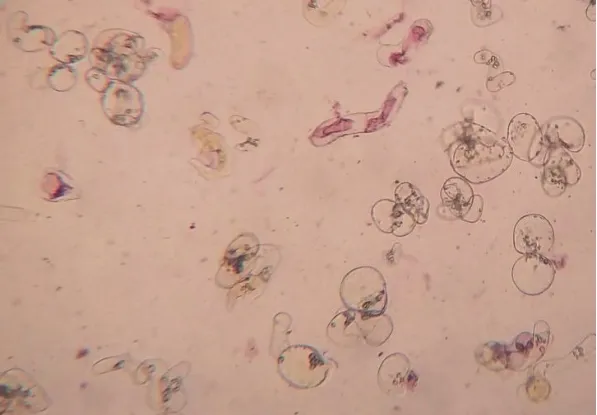
图7 诺丽悬浮细胞染色后活细胞和死细胞
2.8 细胞平板培养
细胞平板培养中,暗培养下15 d左右开始形成愈伤组织(图8-A),23 d左右大量增殖(图8-B),两实验表明诺丽叶片悬浮培养中细胞存活率高。
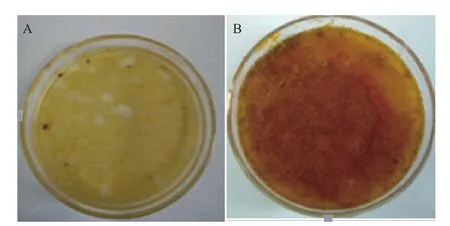
图8 平板培养产生的愈伤组织
3 讨论
通过对实验的观察记录分析得知,虽然不同的激素组合对悬浮细胞比生长速率的影响不同,但每个组合的培养基中细胞都在生长。本实验中,NAA和KT搭配对细胞增殖的促进效果比较好,而2,4-D和6-BA 组合的培养基中细胞的比生长速率不太理想。前人研究表明,在适宜浓度下2,4-D和6-BA对悬浮系中细胞增殖大多有促进作用,前人在西洋参细胞悬浮系的液体培养基中使用了1.0 mg/L 2,4-D[21],在黄芩细胞悬浮培养中使用了0.2 mg/L 2,4-D[22]。笔者认为在诺丽叶片愈伤组织细胞悬浮系中,在确定NAA和KT对细胞增殖起积极作用的同时,合适浓度的2,4-D可能也对其起促进作用。
细胞悬浮系的培养具有获得次生代谢物的同时不伤害植物本身的优点,本研究对诺丽叶片进行细胞悬浮培养研究,获得了稳定诺丽叶片细胞悬浮培养液,稳定的诺丽细胞悬浮培养液可再生愈伤组织及外植体,以及建立诺丽细胞悬浮培养动力学模型,同时鉴于诺丽叶片本身所含有的生物类黄酮和蒽醌类物质的药用价值[12],后续将通过诺丽叶片细胞悬浮系对其二者进行诱导,研究者使用TDZ(噻苯隆)在银杏细胞悬浮培养体系中诱导细胞二萜类化合物的产生[23],在黄芩细胞悬浮培养中加入2,4-D和6-BA时,黄芩苷的积累量最大[22]。本课题组在后续的实验中,拟在悬浮系中加入2,4-D,6-BA 和TDZ,并对浓度梯度进行探索,对诺丽叶片中的萜烯类物质进行诱导和富集。
4 结论
实验以诺丽叶片为外植体,基于课题组诺丽叶片愈伤组织诱导方法建立了稳定的诺丽叶片细胞悬浮体系。实验中诺丽叶片细胞悬浮培养的最优培养基为:MS+2.0 mg/L NAA+0.2 mg/L KT。在该培养基中进行悬浮培养时悬浮细胞比生长速率为0.0753 d-1;实验中最佳接种量为60 g/L,此时细胞生长速率达到最大;对细胞悬浮培养过程中各个指标的监测结果表明最佳继代周期为22-26 d;实验最终形成的稳定细胞悬浮培养液的细胞存活率为77.9%。
[1]李法营, 蓝增全, 刘昌芬, 等. 诺丽研究进展(—)——国内外研究进展[J]. 安徽农业科学, 2009, 37(32):15819-15821.
[2]刘杰. 诺丽传奇[J]. 知识经济. 2007, 3:78-79.
[3]邢诒旺, 符懋修, 李承武, 等. 海巴戟的种子结构及发芽试验[J]. 海南大学学报:自然科学版, 2007, 25(2):156-162.
[4]向红琼, 冯志新. 粗皮侧耳粗毒素的杀线虫活性及其基本特性[J]. 中国农业科学, 2002, 35(11):1349-1355.
[5]杨焱, 刘昌芬, 李海泉, 等. 海巴戟研究进展及开发应用建议[J]. 热带农业科技, 2009, 32(4):23-29.
[6]West BJ, Tani H, Palu AK, et al. Safety tests and antinutrient analyses of noni(Morinda citrifoliaL.)leaf[J]. Journal of the Science of Food and Agriculture, 2007, 87:2583-2588.
[7]Sang S, Cheng X, Zhu N, et al. Flavonol glycosides and novel iridoid glycoside from the leaves ofMorinda ci-rifolia[J]. Journal of Agricultural and Food Chemistry, 2001a, 49:4478-4481.
[8]Sang S, Cheng X, Zhu N, et al. Iridoid glycosides from the leaves ofMorinda citrifolia[J]. Journal of Natural Products, 2001b, 64 :799-800.
[9]Sang S, He K, Liu G, et al. A new unusual iridoid with inhibition of activator protein-1(AP-1)from the leaves ofMorinda citri foliaL.[J]. Organic Letters, 2001 c, 3:1307-1309.
[10]Sang S, He K, Liu G, et al. Citrifolinin A, a new unusual iridoid with inhibition of activator protein-1(AP-1)from the leaves of noni(Morinda citrifoliaL.)[J]. Tetrahedron Letters, 2001d,42:1823-1825.
[11]Sang S, Liu G, He K, et al. New unusual iridoids from the leaves of noni(Morinda citrifoliaL.)show inhibit-ory effect on ultrsaviolet B-induced transcriptional activator protein-1(AP-1)activity[J]. Bioorganic and Medicinal Chemistry, 2003, 11 :2499-2502.
[12]张伟敏, 符文英, 李楠, 等. 诺丽叶化学成分与提取物抗氧化性质研究[J]. 浙江大学学报:农业与生命科学版, 2009, 35(5):543-548.
[13]陈书安, 王晓东, 袁晓凡, 等. 藏红花细胞悬浮培养体系的建立和优化[J]. 生物技术通报, 2010(7):157-160.
[14]刘菲, 彭克勤, 彭志红, 等. 喜树细胞悬浮培养体系的建立[J].湖南农业大学学报:自然科学版, 2010, 36(5):528-530.
[15]武利勤, 郭顺星, 肖培根 . 新疆雪莲细胞悬浮系的建立和黄酮类活性成分的产生[J]. 中国中药杂志, 2005, 30(13):965-967.
[16]董妍玲, 潘学武. Cu2+诱导刺激对喜树悬浮培养细胞喜树碱生物合成的影响[J]. 安徽农业科学, 2010, 38(23):12457-12459.
[17]谢江, 吴田, 张婷婷, 等. 海滨木巴戟愈伤组织诱导及植株再生[J]. 江苏农业科学, 2012, 40(6):47-48, 130.
[18]潘晓晴, 吴田, 蓝增全, 等. 诺丽茎段的离体再生[J]. 东北林业大学学报, 2014, (42)8:20-24.
[19]黄奥丹, 蓝增全, 吴田. 诺丽叶片的离体再生[J]. 广西植物,2017, 37(6):749-756.
[20]何国维, 李伟光, 王瑞雪, 等. 利用 2, 3, 5-三苯基氯化四氮唑(TTC)测定细胞活力的方法与应用[J]. 军事医学, 2014, 38(5):388-391.
[21]闫静辉, 张小兵, 李亚璞, 等. 西洋参悬浮细胞系的建立及其生长特性的研究[J]. 河北省科学院学报, 2005, 22(4):23-26.
[22]顾长海, 张东向, 刘丽杰, 等. 几种物理因素对黄芩细胞悬浮系生长与黄芩苷含量变化的影响[J]. 齐齐哈尔大学学报,2014, 30(4):67-70.
[23]沈小钟, 莫小路, 曾庆钱, 等. TDZ 对银杏悬浮细胞生长及次生代谢物的影响[J]. 江苏农业科学, 2013, 41(11):48-51.
