多菌灵降解菌的生物学特性及降解能力研究
2018-06-07陈锐孙晓宇邓媛路鹏鹏赵玲侠瞿佳沈卫荣
陈锐 孙晓宇 邓媛 路鹏鹏 赵玲侠 瞿佳 沈卫荣
(陕西省微生物研究所,西安 710043)
农业生产中化学农药的不科学施用以及连作土壤自净化能力的降低,致使农产品及农业用地的土壤农药残留问题日益突出[1-2]。残留农药对生态环境[3]及人类身体健康[4]产生了巨大威胁。多菌灵是一种氨基甲酸甲酯类杀菌剂,过量使用不仅会改变土壤中的微生物群落结构[5],还会对土壤中的无脊椎动物造成影响[6],有研究表明多菌灵对人生殖细胞、神经细胞有毒害作用[7-8]。利用微生物的生命代谢活动,从土壤中筛选能够有效降解特定农药的微生物菌株[9-10],将其制备成降解菌剂,可在短时有效降低土壤中农药残留的水平,使土壤恢复健康状态[11]。目前已有很多文献报道筛选获得摇瓶发酵高效降解多菌灵的菌株,但这些菌株在盆栽及田间实验中降解效果不佳。分析其原因可能与菌株耐受土壤复杂的生境有关。本研究通过唯一碳源平板筛选法,从长期使用多菌灵的棚室土壤中筛选出高效分解利用多菌灵的降解菌株,该菌可以在较宽泛的条件下生存,对环境条件耐受度高,以该菌作为出发菌株,或能解决土壤中残留农药多菌灵的问题。
1.1 材料
采集土壤样本于陕西省大荔县埝桥乡东埝村(N34°49'30″,E109°51'52″,海拔 357 m)菜农长期使用多菌灵的棚室,采用5点采样法,采样后将土壤样本均匀混合。
1.2 方法
1.2.1 多菌灵降解菌的分离 细菌无机盐培养基:NH4NO31.0 g,MgSO4·7H2O 0.5 g,(NH4)2SO40.5 g,KH2PO40.5 g,NaCl 0.5 g,K2HPO41.5 g,酵母提取物0.05 g。平板筛选实验用多菌灵为四川国光50%可湿性粉剂,待灭菌细菌无机盐固体培养基冷却至60℃后加入50%多菌灵(碳源终浓度0.2%)。采用梯度稀释法将土壤样本涂布于平板上,28℃培养3 d,待平板长出单菌后,进行2次划线纯化,选择单菌落,LB増菌,甘油低温保藏。
1.2.2 多菌灵降解菌的筛选 采用紫外分光光度法对筛选出的菌株进行多菌灵农药降解菌的初步筛选。将多菌灵加入100 mL无机盐培养基中(终浓度100 mg/L),接入菌液100 μL,设3个重复,以无菌发酵液及水加入多菌灵(终浓度100 mg/L)作为平行对照,28℃,180 r/min培养,每48 h、72 h及120 h分别取发酵液1 mL测定多菌灵残留浓度。标准试剂购自沈阳化工研究院(含量大于99.5%),方法参照文献[12],如果样品的多菌灵浓度过高则需用稀盐酸进行稀释。
1.2.3 多菌灵降解菌的形态及生化鉴定 对多菌灵降解率在30%以上的菌株进行种属鉴定。取菌株在LB平板上划线,28℃培养48 h,观察其菌落形态,取菌体涂片进行革兰氏染色鉴定。生理生化鉴定部分参照文献[13],菌株等进行明胶、接触酶、七叶苷检测,利用康泰微生物鉴定分析系统的BIOKONT20E平板对邻硝基苯半乳糖苷(ONPG)、色氨酸(TDA)、密二糖(MEL)、阿拉伯糖(ARA)、硝酸盐(NO2)、氧化酶(OX)等20项生理生化指标进行检测,检测后与数据库进行比对。
1.2.4 多菌灵降解菌的生长特性
1.2.4.1 菌株生长曲线 取保藏菌种转接斜面,28℃培养18 h复壮,接入LB液体培养基摇菌管中,28℃,180 r/min培养16 h,至对数生长期。100 mL LB培养基,按照1%接种,定时从摇瓶中取样,测定在600 nm波长处的吸光值,绘制生长曲线图。
1.2.4.2 菌株生长pH范围 取LB液体培养基100 mL 15瓶,分别调节其pH为 3.0,3.5,4,4.5,5,5.5,6,6.5,7,7.5,8,8.5,9,9.5及10,按照1%接种,28℃ 180 r/min培养28 h,从每个瓶内取样,测定培养基在600 nm波长处的吸光值。
1.2.4.3 菌株生长温度范围 取LB液体培养基100 mL 9瓶,按照1%接种,分别调节培养温度为15℃,20℃,25℃,28℃,30℃,32℃,37℃,40℃,45℃,180 r/min培养28 h,从每个瓶内取样,测定培养基在600 nm波长处的吸光值。
1.2.4.4 菌株耐盐范围 取LB液体培养基100 mL 5瓶,按照1%接种,分别调节培养基含盐量为1%,2%,3%,4%和5%,28℃,180 r/min培养28 h,从每个瓶内取样,测定培养基在600 nm波长处的吸光值。
1.2.4.5 菌株耐受其他农药检测 活的菌株在土壤中能否定殖与其是否在土壤复杂环境中耐受多重不利因素有关,因此检测该菌株对百菌清(青岛奥的斯),氯氰菊酯(中保杀虫),啶虫脒(深圳诺普信),腐霉利(江西禾益化工),吡虫啉(淄博新农基比巧)及氧化乐果6种农药的耐受能力,待灭菌LB固体培养基冷却至60℃后加入农药(药物终浓度0.2%),混合均匀,倾制平板。在农药平板上划线,28℃ 培养72 h,观察菌株在平板上的生长。
1.2.5 多菌灵降解菌的16S rDNA序列鉴定 取保藏菌种转接斜面,28℃培养18 h复壮,接入LB液体培养基摇菌管中,28℃,180 r/min培养16 h,吸取菌液1 mL转入EP管,10 000 r/min离心1 min,除去菌液。依照细菌基因组提取试剂盒(TIANamp Bacteria DNA kit DP302)说明方法提取菌体全基因组DNA。选择保守区M13序列,引物序列如下所示:27F:5'-AGA GTT TGA TCC TGG CTC A-3';1492R:5'-G GTT ACC TTG TTA CGA CTT-3'。PCR扩增16S rDNA,72℃延伸,退火温度58℃,1%琼脂糖电泳检测,回收扩增产物测序。测序结果利用Blast软件在GenBank数据库中进行比对,用系统发育树软件ClustalX及MEGA5.1构建分类系统发育树。
1.2.6 多菌灵降解菌的Biolog微孔板鉴定 将获得的纯培养菌种划线至平板培养基上,28℃培养24 h,待其形成直径1-3 mm的单克隆。使用Biolog鉴定系统,MicroPlates微孔板:Biolog GEN III MicroPlates(Biolog Catalog No.1030), 接 种 液:IF-A(Biolog Catalog No.72401),试验方法参照说明书,对菌株进行进一步鉴定。
1.2.7 小麦苍白杆菌WNP-3对多菌灵的降解率测定 称取多菌灵纯品0.005 g,加入50 mL无机盐培养基中(终浓度为100 mg/L),接入对数生长期的菌液 50 μL,28℃、180 r/min 培养 24、72、120 h,设置3个重复及无菌发酵液作为对照。将带菌体的发酵液转入250 mL三角瓶,用50 mL二氯甲烷震荡萃取1.5 h,转入分液漏斗,取下层有机相,上层水相转入三角瓶,萃取3次。将有机相合并,加入无水硫酸钠,再转入250 mL烧瓶,56℃旋转负压蒸发至干,加入1 mL稀盐酸(1+11)溶解,分三次加入流动相洗涤,定容至10 mL[14]。配制0.02 mol/L磷酸钠缓冲液(pH6.8):1.38 g磷酸二氢钠和1.41 g磷酸氢二钠溶于900 mL水中,用磷酸调pH至6.8,定容至1L。HPLC检测:色谱柱依利特C18柱,粒径5 μm,流动相:磷酸钠缓冲液+乙腈(80∶20),流速:1 mL/min,检测波长:286 nm,进样量:10 μL,柱温:25℃。
2 结果
2.1 多菌灵降解菌的分离
经选择性梯度稀释平板培养,分离获得60株可耐受200 mg/L多菌灵的细菌菌株。平板筛选出的菌株为耐受农药的自养型菌株或以农药作为唯一碳源生长的化能异养型菌株,其农药的利用率也有差异,需要对菌株降解能力进行进一步验证。
2.2 多菌灵降解菌的筛选
经初步筛选获得12株可利用多菌灵作为唯一碳源生长的细菌菌株。其中WNP-3的降解效果稳定、表现最佳。48、72及120 h后测定的多菌灵残留浓度如表1所示,与空白对照相比,其中WNP-3有比较明显的降解农药的能力,120 h时降解率达到42.1%,与空白对照的自然降解率21.5%及21.8%有显著差异(图1,P<0.01),因此WNP-3可有效降解多菌灵。
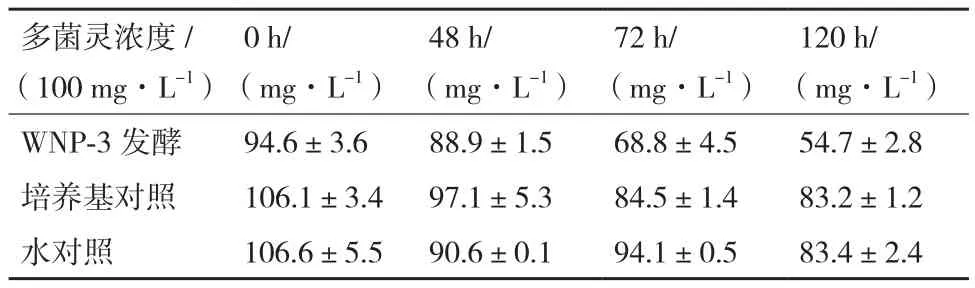
表1 发酵48、72及120 h后多菌灵的残留浓度
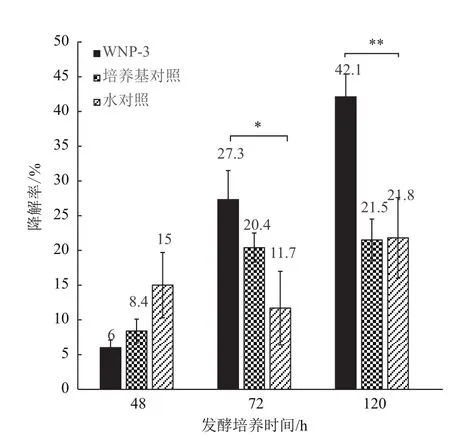
图1 发酵48、72及120 h后多菌灵的降解率
使用△A=[A281nm-(A278nm+A290nm)/2]进行校正得到△A,以△A为横轴,以浓度C为纵轴绘制标准曲线。将标准曲线的线性关系进行最小二乘法线性回归,得到方程Y=0.311 8X+0.000 2,其相关系数R2=0.996 4,说明本实验线性范围在0.008 3-0.05 mg/L之间,线性关系良好,灵敏度较高。使用这一公式需要所有发酵液均需约2 000倍稀释才能在检测有效范围内,虽然增加了稀释可能带来的误差,但可快速简便的筛选出对多菌灵有高效降解功能的菌株。
2.3 多菌灵降解菌的形态及生化鉴定
多菌灵降解菌WNP-3菌落乳白色,湿润,在营养琼脂上的菌落无色。为革兰氏阴性菌,具平行边和圆端的杆菌。菌株WNP-3的生理生化检测结果如表2所示,经数据库比对,显示该菌为小麦苍白杆菌(Ochrobactrum tritici)。
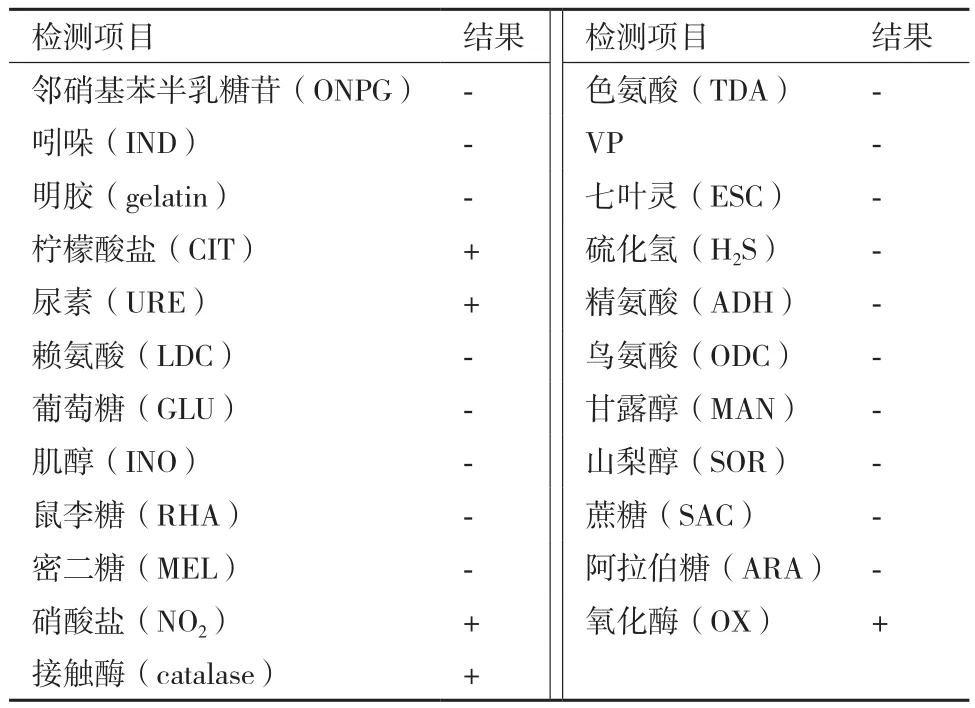
表2 菌株WNP-3的生理生化检测
2.4 多菌灵降解菌的生长特性
该菌以1%接种量接种,28℃,180 r/min培养,于16 h进入对数生长期,大约在28 h进入平台期,平台期可一直维持至48 h(图2)。该菌在pH 4-9,培养温度25-32℃,NaCl浓度 1%-3%内均可正常生长,可以分别在浓度为0.2%的百菌清、氯氰菊酯、啶虫脒、腐霉利、吡虫啉及氧化乐果6种农药平板上生长,对农药具有一定耐受性,较为适于棚室连作土壤酸化、盐渍化及棚室内温差环境。
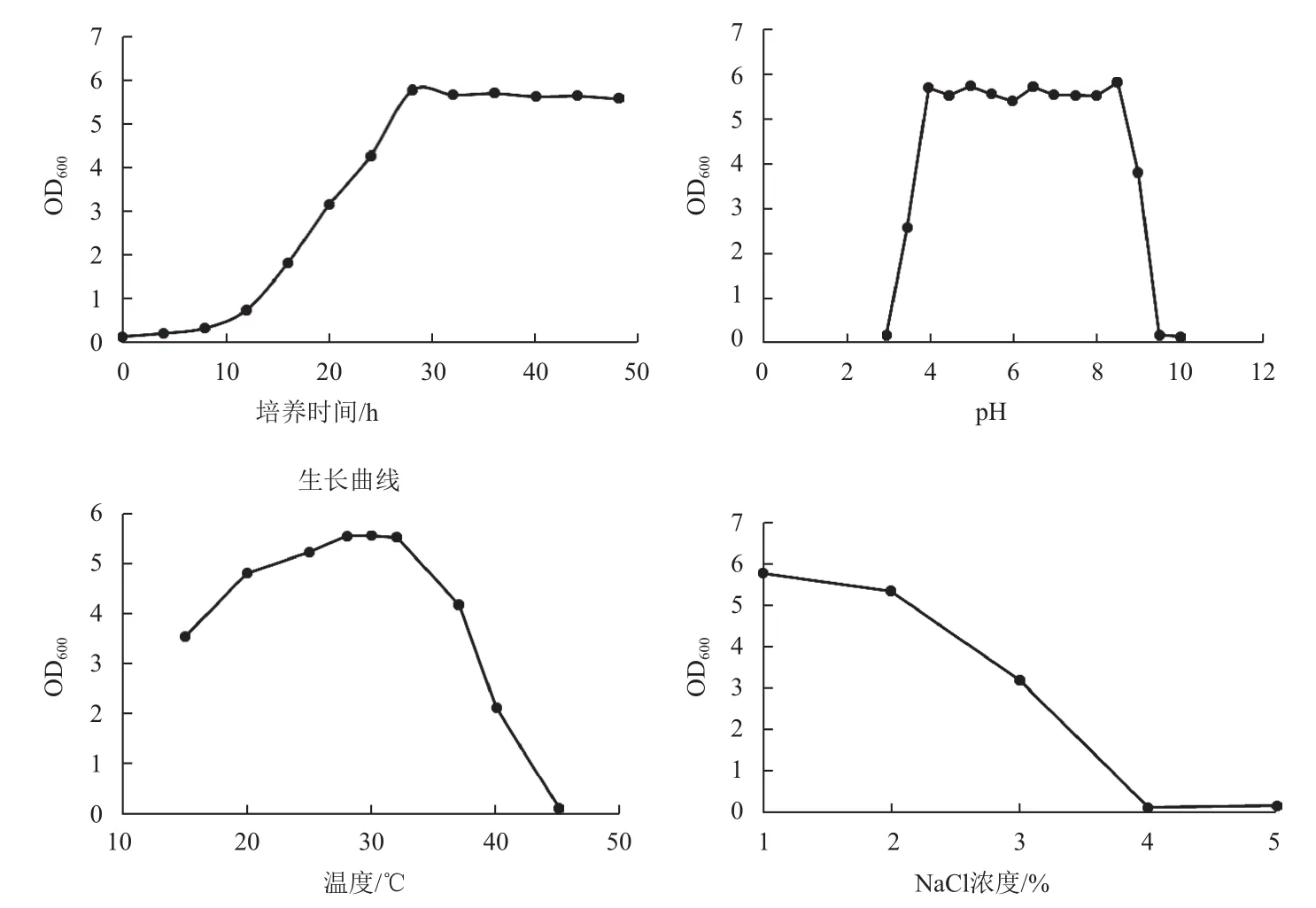
图2 WNP-3菌株生长特性
2.5 多菌灵降解菌的16S rDNA序列鉴定
经16S rDNA基因扩增,测序后经GenBank比对,用系统发育树软件ClustalX及MEGA5.1构建系统发育树(图3),系统发育树显示该菌可能为苍白杆菌属菌株(Ochrobactrumsp.)。将该序列提交基因GenBank,登录号为:MG457705。
2.6 多菌灵降解菌的Biolog微孔板鉴定
使用Biolog GENⅢ微孔板对部分纯化菌株进行种属鉴定。读板显示PROB为0.535,Sim为0.535,Dist为6.934,经Biolog板鉴定获得WNP-3菌种为小麦苍白杆菌(Ochrobactrum tritici)。
2.7 小麦苍白杆菌WNP-3对多菌灵的降解率测定
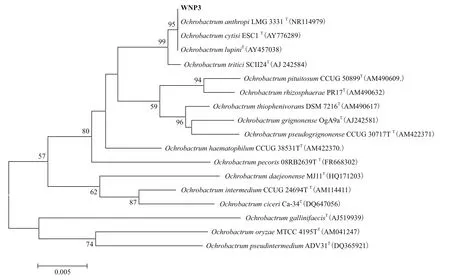
图3 WNP-3与模式菌株建树
HPLC法测定的多菌灵残留浓度如图4所示,72 h苍白杆菌对多菌灵降解率38%,与无菌对照具显著差异(P<0.01)。120 h空白对照的降解率为28%,苍白杆菌发酵液对多菌灵的降解率为61%,具有显著差异(P<0.01)。因此可以断定,WNP-3是能够以多菌灵作为唯一碳源并进行有效降解的细菌菌株。

图4 HPLC法测定多菌灵降解率
3 讨论
农药的广泛应用为提高作物产量、降低作物病虫害及杂草的产生作出了巨大的贡献。但是农药污染带来的生态环境破坏及对人类健康的影响问题也日益突出。施入农田的农药部分可以转化或降解,其他则经历许多不同的途径进入环境,或进入土壤、或被植物吸收、或挥发进入大气或进入地表、地下水[15]。许多研究结果都表明,农药对土壤微生物的间接和直接作用会进而影响植物生长和土壤肥力。农药对土壤生物学有许多有害的影响,包括土壤中微生物数量和遗传性状的变化[16]、土壤酶活性的变化[17]土壤氮平衡的改变[18]。据文献报道,多菌灵在土壤中,连续7次,间隔9 d重复施用多菌灵后,产生了显著积累(P<0.05),并能导致土壤产生遗传毒性[19]。土壤细菌、硝化菌及放线菌发生先抑制后恢复的变化;而土壤真菌则始终受到抑制[20]。多菌灵对土壤蔗糖酶、过氧化氢酶、磷酸酶活性表现出抑制作用,土壤纤维素酶、脲酶活性则随多菌灵浓度的增加有显著的激活作用[21]。尽管非生物降解在许多情况下起着部分作用,但微生物对农药的降解通常是最重要和最主要的过程[22]。采用微生物法降解土壤中残留的化学农药对于降低农药对生态产生的负面影响、恢复土壤微生物种群及土壤活力等具有重要意义[23-24]。据报道多菌灵在土壤中的消解动态均符合一级动力学方程,原始沉积量与施药量、施药次数密切相关[25]。
目前发现的对多菌灵具有降解能力的微生物包括肠杆菌(Enterobactersp.)[26]、球菌属(Paracoccussp.)[27]、分支杆菌(Mycobacteriumsp.)[28]、木霉(Trichoderma)[29]、短芽孢杆菌(Brevibacillus borstelensis)、白浅灰链霉菌(Streptomyces albogriseolus)[30]、枯草芽孢杆菌(Bacillus subtilis)[31]、假单胞菌(Pseudomonassp.)[32]、红平红球菌(Rhodococcus erythropolis)[33]、类诺卡氏属(Nocardioidessp.)[34]、罗尔斯通氏菌(Ral stoniasp.)[35]及短小芽孢杆菌(Bacillus pumilus)[36]等,涵盖了细菌、真菌及放线菌,其中以变形菌纲微生物居多。部分菌株属于条件性致病菌株,如肺炎克雷伯氏(Klebsiellasp.)[37],不适合开展应用型研究。林秀报道其课题组分离获得一株红平红球菌XJ_D,将其接种在600 mg/L 多菌灵的无机盐培养基中,11 d时多菌灵的降解率达99.0%[38],但该菌降解82%的土壤多菌灵(200 mg/L)需要条件为23-28℃,土壤含水量60%-80%,15 d。此外,龚芬芬等[39]从分支杆菌中获得多菌灵水解酶基因(mheI),该基因片段大小729 bp,表达大小为24.3 kD的蛋白,该蛋白可将多菌灵水解成为,因此单独将该基因进行克隆表达无法解决多菌灵开环降解的目的。王一奇等[40]报道多菌灵经假单胞菌属作用生成2-氨基苯并咪唑,快速羟基化生成2-羟基苯并咪唑,继续开环裂解生成邻苯二胺,然后加氧脱氮生成邻苯二酚,直至最后分解成二氧化碳和水。该菌株对多菌灵的降解属于矿化作用,是较为理想的污染降解方式。但该菌株最佳降解能力为50 mg/L 多菌灵。受棚室环境条件及生产作业的影响,在棚室土壤环境中,存在其他各种类型的农药残留,其土壤pH、温度及土壤盐分也发生着周期性变化。然而目前在多菌灵降解菌研究中,对于活菌耐受其他类型农药的研究尚不多见,部分研究报道的菌株发挥生物学作用的条件也较为苛刻,因此需要筛选可满足粗放条件的降解菌株。
4 结论
本研究采用唯一碳源法,从长期连作棚室中筛选获得12株可利用多菌灵作为唯一碳源生长的多菌灵降解菌。其中WNP-3表现出最佳的降解特性。该菌为革兰氏阴性菌,具平行边和圆端的杆菌。通过生理生化、Biolog微孔板鉴定法确定菌株WNP-3为小麦苍白杆菌,结果与16S rDNA得到的结果相一致。经HPLC测定,WNP-3在无机盐培养基中,28℃、180 r/min培养120 h的条件下,对100 mg/L多菌灵的降解率达到61%。该菌在pH 4-9,NaCl浓度 1%-3%内均可正常生长,对6种常用农药具有一定耐受性,较为适于棚室连作土壤酸化、盐渍化及棚室内温差环境。
[1]Wang L, Jia H, Liu X, et al. Historical contamination and ecological risk of organochlorine pesticides in sediment core in northeastern Chinese river[J]. Ecotoxicology and Environmental Safety, 2013,93:112-120.
[2]Cheng HX, Li XH, Wang YP, et al. Profile of organochlorine pesticides in soil cores from some hotspot areas of Beijing,China[J]. Bulletin of Environmental Contamination and Toxicology, 2011, 87(2):175-179.
[3]Jänsch S, Frampton GK, Römbke J, et al. Effects of pesticides on soil invertebrates in model ecosystem and field studies:A review and comparison with laboratory toxicity data[J]. Environmental Toxicology and Chemistry, 2006, 25(9):2490-2501.
[4]Damalas CA, Eleftherohorinos IG. Pesticide exposure, safety issues,and risk assessment indicators[J]. International Journal of Environmental Research and Public Health, 2011, 8(5):1402-1419.
[5]Yan H, Wang D, Dong B, et al. Dissipation of carbendazim and chloramphenicol alone and in combination and their effects on soil fungal:bacterial ratios and soil enzyme activities[J].Chemosphere, 2011, 84(5):634-641.
[6]Van Gestel CAM. Validation of earthworm toxicity tests by comparison with field studies:A review of benomyl, carbendazim,carbofuran, and carbaryl[J]. Ecotoxicology and Environmental Safety, 1992, 23(2):221-236.
[7]Zhou J, Xiong K, Yang Y, et al. Deleterious effects of benomyl and carbendazim on human placental trophoblast cells[J].Reproductive Toxicology, 2015, 51:64-71.
[8]Uludag B, Tarlaci S, Yuceyar N, et al. A transient dysfunction of the neuromuscular junction due to carbendazim intoxication[J].Journal of Neurology, Neurosurgery & Psychiatry, 2001, 70(4):563.
[9]Yu H, Tang H, Zhu X, et al. Molecular mechanism of nicotine degradation by a newly isolated strain,Ochrobactrumsp. strain SJY1[J]. Applied and Environmental Microbiology, 2015, 81(1):272-281.
[10]Hu G, Zhao Y, Liu B, et al. Isolation of an indigenous imidaclopriddegrading bacterium and imidacloprid bioremediation under simulatedin situandex situconditions[J]. Journal of Microbiology & Biotechnology, 2013, 23(11):1617-1626.
[11]Aparicio J, Solá MZ, Benimeli CS, et al. Versatility ofStreptomycessp. M7 to bioremediate soils co-contaminated with Cr(VI)and lindane[J]. Ecotoxicology and Environmental Safety, 2015,116:34-39.
[12]赵春, 李水清. 湖北太湖港农场主要农产品中甲基硫菌灵及多菌灵的残留分析[J]. 长江大学学报:自然科学版, 2015,21:43-46.
[13]Goodfellow M, Kämpfer P, Busse HJ, et al. Bergey's Manual of Systematic Bacteriology[M]. New York:Springer, 2012.
[14]卜伟. 二氯甲烷萃取-HPLC法测定水中的多菌灵[J]. 环境与技术, 2005, 28(12):149-150.
[15]Alvarez A, Saez JM, Davila Costa JS, et al. Actinobacteria:Current research and perspectives for bioremediation of pesticides and heavy metals[J]. Chemosphere, 2017, 166:41-62.
[16]Medo J, Maková J, Kovácsová S, et al. Effect of Dursban 480 EC(chlorpyrifos)and Talstar 10 EC(bifenthrin)on the physiological and genetic diversity of microorganisms in soil[J].Journal of Environmental Science and Health, Part B, 2015, 50(12):871-883.
[17]Raju MN, Venkateswarlu K. Effect of repeated applications of buprofezin and acephate on soil cellulases, amylase, and invertase[J]. Environmental Monitoring and Assessment, 2014,186(10):6319-6325.
[18]Srinivasulu M, Jaffer Mohiddin G, Subramanyam K, et al. Effect of insecticides alone and in combination with fungicides on nitrification and phosphatase activity in two groundnut(Arachis hypogeaeL. )soils[J]. Environmental Geochemistry and Health, 2012, 34(3):365-374.
[19]王少云. 多菌灵、百菌清、毒死蜱在大棚黄瓜和土壤中的残留特征及其对土壤遗传毒性的影响[D]. 杭州:浙江大学,2015.
[20]张桂山. 多菌灵、吠喃丹对湖南红壤土微生物和酶活性的效应及多菌灵降解细菌的分离鉴定与降解性研究[D]. 杭州:浙江大学, 2004.
[21]冯燕燕, 蔡继红, 侯振安, 等. 多菌灵对新疆灰漠土壤中六种酶活性的影响[J]. 石河子大学学报:自然科学版, 2009,04:413-418.
[22]Chowdhury A, Pradhan S, Saha M, et al. Impact of pesticides on soil microbiological parameters and possible bioremediation strategies[J]. Indian Journal of Microbiology, 2008, 48(1):114-127.
[23]Cycoń M, Mrozik A, Piotrowska-Seget Z. Bioaugmentation as a strategy for the remediation of pesticide-polluted soil:A review[J]. Chemosphere, 2017, 172:52-71.
[24]Chen S, Yang L, Hu M, et al. Biodegradation of fenvalerate and 3-phenoxybenzoic acid by a novelStenotrophomonassp. strain ZSS-01 and its use in bioremediation of contaminated soils[J].Applied Microbiology and Biotechnology, 2011, 90(2):755-767.
[25]刘双双, 杨仁斌, 陈海平, 等. 多菌灵在水稻及土壤中的消解动态和残留规律研究[J]. 农业环境科学学报, 2012, 02:357-361.
[26]Cycoń M, Wójcik M, Piotrowska-Seget Z. Biodegradation kinetics of the benzimidazole fungicide thiophanate-methyl by bacteria isolated from loamy sand soil[J]. Biodegradation, 2011, 22(3):573-583.
[27]Xiao W, Wang H, Li T, et al. Bioremediation of Cd and carbendazim co-contaminated soil by Cd-hyperaccumulatorSedum alfrediiassociated with carbendazim-degrading bacterial strains[J]. Environ Sci Pollut Res Int, 2013, 20(1):380-389.
[28]Zhang Y, Wang H, Wang X, et al. Identification of the key amino acid sites of the carbendazim hydrolase(MheI)from a novel carbendazim-degrading strainMycobacteriumsp. SD-4[J]. J Hazard Mater, 2017, 5(331):55-62.
[29]田连生, 陈菲. 多菌灵降解菌T8-2的分离及其降解条件研究[J]. 江苏农业科学, 2008(6):271-274.
[30]Arya R, Sharma AK. Bioremediation of carbendazim, a benzimidazole fungicide usingBrevibacillus borstelensisandStreptomyces albogriseolustogether[J]. Curr Pharm Biotechnol, 2015;17(2):185-189.
[31]Salunkhe VP, Sawant IS, Banerjee K, et al. Kinetics of degradation of carbendazim byB. subtilisstrains:possibility of in situ detoxification[J]. Environ Monit Assess . 2014, 186(12):8599-8610.
[32]Fang H, Wang Y, Gao C, et al. Isolation and characterization ofPseudomonas sp.CBW capable of degrading carbendazim[J].Biodegradation, 2010, 21:939-946.
[33]Zhang X, Huang Y, Harvey PR, et al. Isolation and characterization of carbendazim-degradingRhodococcus erythropolisdjl-11[J]. PLoS One, 2013, 8(10):e74810.
[34]Pandey G, Dorrian SJ, et al. Cloning and biochemical characterization of a novel carbendazim(methyl-1H-benzimidazol-2-ylcarbamate)-hydrolyzing esterase from the newly isolatedNocardioides sp.strain SG-4G and its potential for use in enzymatic bioremediation[J]. Applied and Environmental Microbiology,2010, 76(9):2940-2945.
[35]Zhang GS, Jia X M, Cheng TF, et al. Isolation and characterization of a new carbendazim-degradingRalstoniasp. strain[J]. World Journal of Microbiology & Biotechnology, 2005, 21(3):265-269.
[36]Zhang L, Qiao X, Ma L. Influence of environmental factors on degradation of carbendazim byBacillus pumilusstrain NY97-1[J]. International Journal of Environment and Pollution, 2009,38:309-317.
[37]Alvarado-Gutiérrez ML, Ruiz-Ordaz N, Galíndez-Mayer J, et al.Kinetics of carbendazim degradation in a horizontal tubular biofilm reactor[J]. Bioprocess Biosyst Eng, 2017, 40(4):519-528.
[38]林秀, 侯振安, 赵思峰, 等. 多菌灵降解菌XJ-D的分离鉴定及特性研究[J]. 中国农学通报, 2011, 27(16):220-226.
[39]龚芬芬. 多菌灵降解菌的分离鉴定、生物学特性及多菌灵水解酶基因的克隆和表达研究[D]. 南京:南京农业大学,2010:41-50.
[40]王一奇. 多菌灵降解菌Pseudomonassp. CBW的分离、鉴定及其降解特性与降解机理[D]. 杭州:浙江大学.
