槲皮素通过影响Nrf2-Keap1信号通路减缓镉中毒大鼠的生殖机能损伤
2018-06-07周厚继王佳美李美琦杨淑华何剑斌
何 刘,李 慧,周厚继,佟 翠,王佳美,李美琦,杨淑华*,何剑斌*
(1.沈阳农业大学畜牧兽医学院,沈阳110866;2.四川省凉山州盐源县职业技术中学校,凉山615700)
镉(Cd)是广泛存在于环境中的一种重金属污染物。自然界中,Cd主要以硫化镉的形式与硫化锌矿石伴生,是锌矿石开采时的副产品。工业化重金属污染,化石燃料等人类活动都会影响Cd存在[1-2]。同时,Cd广泛应用于电镀、油漆、防腐、塑料稳定剂、电触头材料等。一旦被机体吸收,Cd将长期存在于人和动物体内,影响到多种器官,包括肾、心、肝、大脑等组织器官[3-5]。另有许多报道证实,雄性生殖系统对Cd极其敏感,睾丸内低浓度的Cd就有可能引起雄性动物生殖机能障碍。Cd能够诱导成年雄性大鼠出现明显的睾丸损伤、精子质量下降、生殖细胞凋亡甚至不育,人类男性生殖机能同样会受到Cd的影响。Cd致睾丸毒性是由氧化应激和炎性作用引起的[6-7]。
槲皮素(QE)等一些天然黄酮类化合物对人和动物健康的作用是近年来人们研究的热点[8]。含有丰富QE的蔬菜有紫生菜、洋葱、大葱、藕、油豆角、西蓝花等[9]。含QE的水果有苹果、沙棘、柑橘等[10]。QE是一种抗氧化剂,已经证明具有非常强大的抑制氧化应激和细胞保护作用[11],能够有效清除体内自由基,预防心血管疾病,保护肝免受损伤,而且QE可能直接跨越大脑-血液屏障对神经系统产生保护作用。Nrf2-Keap1信号通路是机体内重要的抗氧化通路。Nrf2(Nu-clear erythroid related factor2)是调节Ⅱ相解毒酶和抗氧化相关的重要核转录因子,可通过与抗氧化反应原件ARE(antioxidant response element)结合诱导相关抗氧化基因的表达,从而增强机体抗氧化应激和抗氧化损伤的能力,而Kelch样环氧氯丙烷相关蛋白Keap1(Kelch-like ECH-associated protein-1)与Nrf2结合时会抑制Nrf2的转录。已经有研究表明在肝、肺等器官,QE能够激活Nrf2信号通路并增加其表达发挥抗氧化作用[12-13],但是对于QE在睾丸组织发挥抗氧化作用的研究有限。
因此,鉴于以上几点原因,本研究探索QE是否可以减轻Cd致雄性大鼠生殖系统损伤及在此过程Nrf2-Keap1信号通路发挥的作用,为QE的优化利用提供一定的理论基础。
1 材料与方法
1.1 试验动物与饲养管理
试验动物为3月龄SPF级成年雄性Wistar大鼠32只,体重为(295±10)g,购于山东济南朋悦实验动物繁育有限公司。大鼠在SPF级标准试验舍内分笼饲养,室内温度相对恒定,为(22±1) ℃,相对湿度为(50±1)%,每天12 h光照/黑暗交替。自由采食饲料,自由饮水。
1.2 试剂
CdCl2购于国药集团化学试剂有限公司,QE购于美国Sigma公司。BCA蛋白定量试剂盒、丙二醛(MDA)检测试剂盒、过氧化氢(H2O2)检测试剂盒、还原型谷胱甘肽(GSH)检测试剂盒、总超氧化物歧化酶(T-SOD)检测试剂盒、谷胱甘肽过氧化物酶(GSH-Px)检测试剂盒、过氧化氢酶(CAT)试剂盒、睾酮(T)酶联免疫法吸附测定试剂盒均购于南京建成生物工程研究所。总RNA提取试剂盒与反转录试剂盒购于日本TaKaRa公司,抗体全部购于美国Abcam公司。
1.3 仪器与设备
SW-CJ-1G超净工作台(江苏净通净化设备有限公司);海尔BCD-649WE双开门冰箱(青岛海尔集团);AB104-S电子天平(瑞士METTLER TOLEDO);PCR反应扩增仪(BIO公司);FR980凝胶成像系统(上海复日科技有限公司);DYY-6C型稳压稳流电泳仪(北京六一生物科技有限公司);H6-1微型电泳槽(上海精益有机玻璃制品仪器厂);DNR Bio Imaging Systems化学发光凝胶成像系统(以色列)。
1.4 动物分组与处理
适应环境1周后,将32只 Wistar大鼠随机平均分为4组,每组8只。第Ⅰ组为对照组,每天以生理盐水[0.5 mL·(kg·d)-1生理盐水]灌胃;第Ⅱ组为Cd组,每天以CdCl2[5 mg·(kg·d)-1]溶液灌胃;第Ⅲ组为QE组,每天以QE[15 mg·(kg·d)-1]悬液灌胃;第Ⅳ组为Cd+QE[5 mg·(kg·d)-1CdCl2+15 mg·(kg·d)-1QE],每天给予CdCl2溶液和QE悬液。CdCl2溶于生理盐水成CdCl2溶液,QE溶于甘油∶生理盐水=3∶2的溶液中成均匀悬液,连续灌胃1个月。镉使用剂量参考A. Alkhedaide等[14]的研究结果,QE使用剂量参考C. Unsal等[15]的研究结果。
1.5 样品采集与处理
对Wistar大鼠连续灌胃1个月,停止灌胃以后禁食禁水1 d,采集样品进行测定。首先记录大鼠的体重,接下来使用乙醚对大鼠进行麻醉,使用5 mL注射器进行心脏采血,然后使用4 ℃离心机对血液进行离心,获得血清,用于睾酮检测试验。大鼠脱颈处死,取出睾丸及附睾并称重,双侧附睾立即放入3 mL 37 ℃预热的生理盐水中,将其剪碎,孵育20 min,用于检测精液品质。取大鼠一侧睾丸放入4%多聚甲醛内固定,另一侧睾丸取一部分(300 mg左右)进行精确称重,加入适量预冷的生理盐水[组织质量(g)∶生理盐水(mL)=1∶9 ]研磨成组织匀浆,3 000×g 4 ℃条件下离心10 min,取上清待用。其余睾丸立即放入液氮快速降温,然后转移到-80 ℃ 超低温冰箱保存。
1.6 检测指标及方法
1.6.1 脏器系数测定 脏器系数=脏器质量(mg)/大鼠体重(g)。
1.6.2 精液品质的检测 包括精子活率、精子总数和精子畸形率的检测。
1.6.2.1 测定精子活率:将两侧附睾放入预热好的的37 ℃生理盐水中,剪碎。放入恒温水浴锅中孵育20 min,孵育好之后混匀,滴加到预热过的细胞计数板上,调节显微镜,在高倍镜下找到活动的精子,计数其中200个精子中的活动精子数,计算精子活率。
1.6.2.2 精子总数的检测:完成精子活率测定后,将剩余上述精子悬液迅速转移到60 ℃水浴锅中5~10 min诱导精子失活,然后滴加到计数板上,调节显微镜,用红细胞计数法计算精子数。
1.6.2.3 精子畸形率的检测:使用苏木素染色法制备精子图片,在高倍镜下观察1 000个精子中精子的畸形数量,计算精子畸形率。畸形精子主要分为头部畸形和尾部畸形,有无头精子、双头精子、无尾精子、双尾精子等。
1.6.3 睾丸组织病理学检测 将大鼠的一侧睾丸固定在4%多聚甲醛中,24 h后常规制片,HE染色。染色后,覆盖载玻片,在恒温培养箱干燥后于光学显微镜下进行观察。
1.6.4 抗氧化功能变化检测 使用BCA蛋白检测法对新鲜10%组织匀浆样品进行蛋白质定量。抗氧化状态的检测基于大鼠睾丸组织MDA、H2O2和GSH的含量变化及T-SOD、GSH-Px和CAT的活性变化,以上指标的测定均使用商业试剂盒,严格按照试剂盒说明书进行操作。
1.6.5 血清睾酮水平检测 使用睾酮ELISA试剂盒检测血清中睾酮水平的变化,严格按照试剂盒说明书进行操作。
1.6.6 基因转录检测 根据总RNA提取试剂盒商业说明书提取睾丸组织总RNA。通过实时荧光定量PCR技术检测睾丸组织Nrf2、GSH-Px、NQO1、Keap1、γ-GCS和HO-1基因转录情况。以260/280 nm的OD值确定总RNA的纯度。β-actin为内参基因。使用2-ΔΔCt法计算数据。PCR引物如表1所示。这些引物由中国上海生工研究所有限公司合成。
1.6.7 Weatern blot检测 称重睾丸组织100 mg,与0.99 mL RIPA裂解物、0.01 mL蛋白酶抑制剂PMSF混合。4 ℃,12 000×g离心5 min取上清液转移到新的无酶离心管中。蛋白质浓度使用BCA试剂盒定量。使用12%SDS-PAGE分离蛋白质(每个样品50 μg),通过电泳转移到PVDF膜上。将膜浸泡在5%脱脂奶粉中,在37 ℃恒温振荡器中封闭2 h后,将膜分别浸泡于Nrf-2(1∶1 000稀释),HO-1(1∶2 000稀释),Keap-1(1∶1 000稀释),GSH-Px(1∶1 000稀释),NQO-1(1∶1 000稀释)和β-actin(1∶2 000稀释)稀释过的一抗中进行孵育,4 ℃过夜。第2天,膜用PBST冲洗3次后,使用辣根过氧化物酶(HRP)标记的二抗(1∶4 000稀释)在常温下孵育1 h。最后,用PBST冲洗3次后,使用ECL化学发光溶液曝光这些膜。 使用DNR生物成像系统显示条带的相对强度。

表1 各目的基因引物序列Table 1 The primers seqence of the target genes
1.7 数据统计分析
2 结 果
2.1 大鼠睾丸及附睾脏器系数
由表2可知,与对照组相比,Cd组大鼠的睾丸与附睾的脏器系数极显著降低(P<0.01),QE组大鼠睾丸及附睾的脏器系数显著升高(P<0.05)。Cd+QE组脏器系数高于Cd组,差异极显著(P<0.01)。
2.2 大鼠精液品质
由表3可知,与对照组相比,Cd组大鼠的精子总数、精子活率明显降低,精子畸形率升高趋势明显,差异极显著(P<0.01);QE组与对照组相比,大鼠的精子总数、精子活率及精子畸形率无显著差异。Cd+QE组大鼠的精子活率、精子总数与Cd组相比较,极显著升高(P<0.01),畸形率极显著下降(P<0.01)。

表2 大鼠睾丸和附睾的脏器系数Table 2 The testis and epididymis coefficients in rats mg·g-1
*表示与对照组相比差异显著P<0.05,**表示与对照组相比差异极显著P<0.01;#代表与Cd组相比差异显著P<0.05,##表示与Cd组比较差异极显著P<0.01,下同
*represents significant difference compared with the control group atP<0.05,**represents significant difference compared with the control group atP<0.01;#represents significant difference compared with the Cd group atP<0.05,##represents significant difference compared with the Cd group atP<0.01, the same as below

表3 大鼠精液品质Table 3 The semen quality in rats
2.3 组织病理学变化
图1展示的是Wistar大鼠睾丸组织HE染色的结果,图1A为对照组,大鼠睾丸组织中无明显脱落的生殖细胞,生精上皮生殖细胞排列规则有序;图1B为Cd组,生精小管结构较紊乱、不规则,生精上皮细胞脱落情况严重且分层不明显,如黑色箭头所示。图1C为QE组,大鼠睾丸生精小管结构清晰,生精上皮生殖细胞排列有序,无脱落的生精细胞。图1D为Cd+QE组,有部分生精上皮细胞损伤脱落,如黑色箭头所示,生精小管结构清晰,各级生精细胞排列基本整齐。
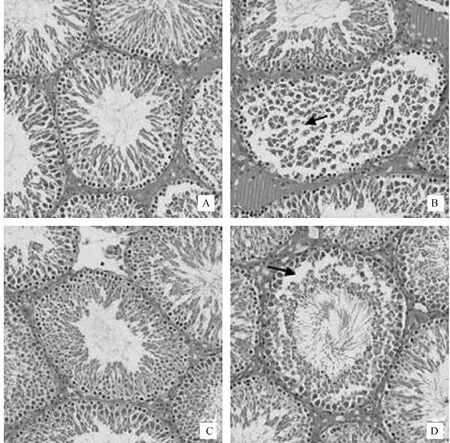
A.对照组;B. Cd组;C. QE组;D. Cd+QE组A. Testicular tissue of rats in the control group; B. Testicular tissue of rats in the Cd group; C. Testicular tissue of rats in the QE group; D. Testicular tissue of rats in the Cd+QE group图1 大鼠睾丸组织显微结构(200×)Fig.1 Photomicrographs of testicular tissue(200×)
2.4 睾酮含量测定
与对照组血清中睾酮含量[(9.38±0.77)ng·mL-1]相比,Cd组血清中睾酮含量[(8.49±0.60)ng·mL-1]明显降低(P<0.01),QE组睾酮含量[(11.45±0.70)ng·mL-1]极显著增多(P<0.01),Cd+QE组与Cd组相比,睾酮含量[(9.30±0.83)ng·mL-1]明显增加,差异显著(P<0.05)。
2.5 大鼠睾丸组织抗氧化功能变化
由表4可知,与对照组相比,Cd组MDA和H2O2含量极显著升高(P<0.01),且GSH含量极显著降低(P<0.01);QE组MDA和H2O2含量极显著降低(P<0.01),且GSH含量极显著升高(P<0.01)。与Cd相比,Cd+QE组MDA和H2O2含量极显著降低(P<0.01),GSH含量显著升高(P<0.05)。
与对照组相比,Cd组T-SOD、CAT、GSH-Px活性极显著降低(P<0.01),QE组T-SOD、CAT酶活性极显著升高(P<0.01),GSH-Px酶活性显著升高(P<0.05);与Cd组相比,Cd+QE组T-SOD、CAT、GSH-Px酶活性极显著升高(P<0.01)。

表4 大鼠睾丸组织抗氧化功能的变化Table 4 Changes of antioxidant function of testicular tissue in rats
2.6 相关基因转录情况
Nrf2-Keap1信号通路相关基因转录情况如图2所示。与对照组相比,Cd组Nrf2和γ-GCS基因转录量极显著下降(P<0.01),HO-1、NQO1、GSH-Px下降趋势显著(P<0.05),而Keap1基因转录量明显上升(P<0.01);与对照组相比,QE组Nrf2、HO-1、NQO1、GSH-Px基因转录量显著上升(P<0.05),γ-GCS转录量极显著上升(P<0.01),而Keap1基因转录量显著下降(P<0.05)。与Cd组相比,Cd+QE组Nrf2基因转录量极显著上升(P<0.01),HO-1、NQO1、γ-GCS、GSH-Px转录量显著上升(P<0.05),而Keap1基因转录量显著下降(P<0.05)。
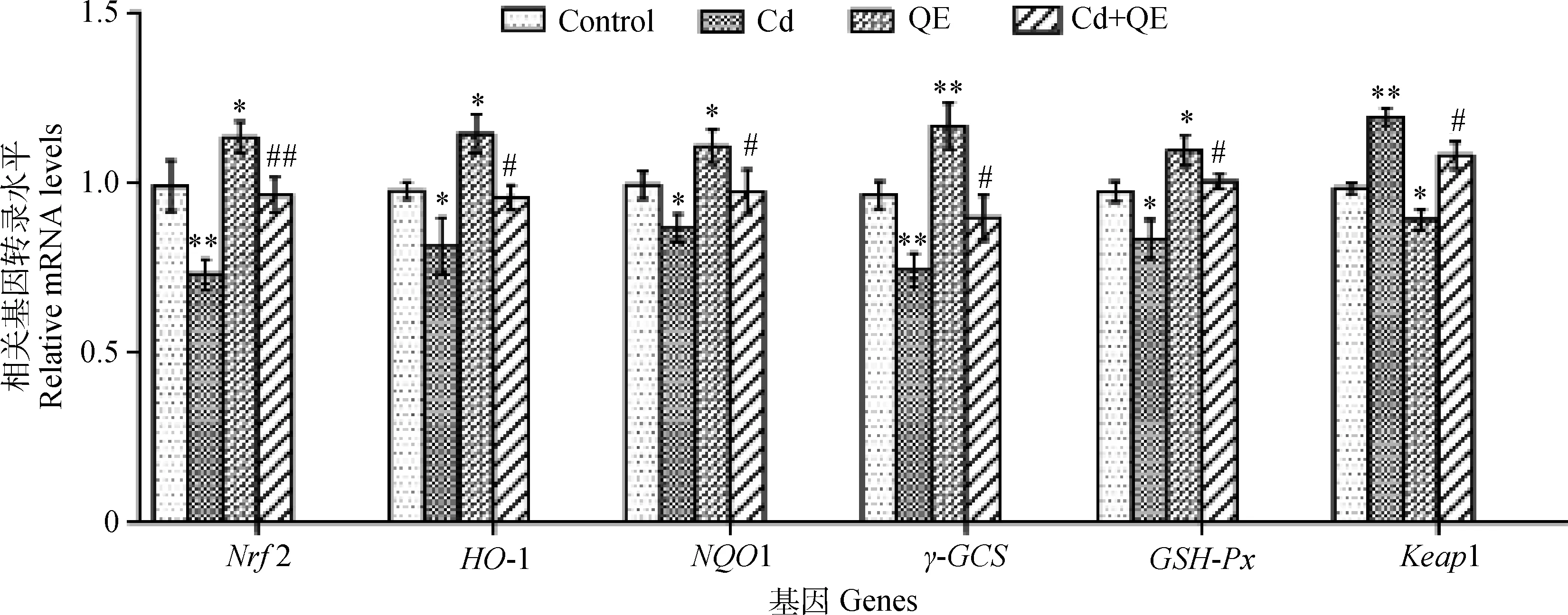
图2 大鼠睾丸组织中Nrf2-Keap1信号通路相关基因相对转录量Fig.2 Relative transcription of genes of Nrf2-Keap1 signaling pathway in testis
2.7 相关蛋白质表达情况
各组大鼠睾丸组织中Nrf2相关基因的蛋白表达量如图3所示。与对照组相比,Cd组Nrf2、NQO1、GSH-Px蛋白表达量极显著下降(P<0.01),γ-GCS、HO-1蛋白表达量显著下降(P<0.05)、而Keap1蛋白表达量极显著上升(P<0.01);与对照组相比,QE组Nrf2和GSH-Px表达量显著上升(P<0.05),HO-1、NQO1、γ-GCS蛋白量极显著上升(P<0.01),而Keap1蛋白表达量极显著下降(P<0.01)。与Cd组相比,Cd+QE组Nrf2和NQO1蛋白表达量极显著上升(P<0.01)、HO-1、γ-GCS、GSH-Px表达量显著上升(P<0.05),而Keap1蛋白表达量显著下降(P<0.05)。
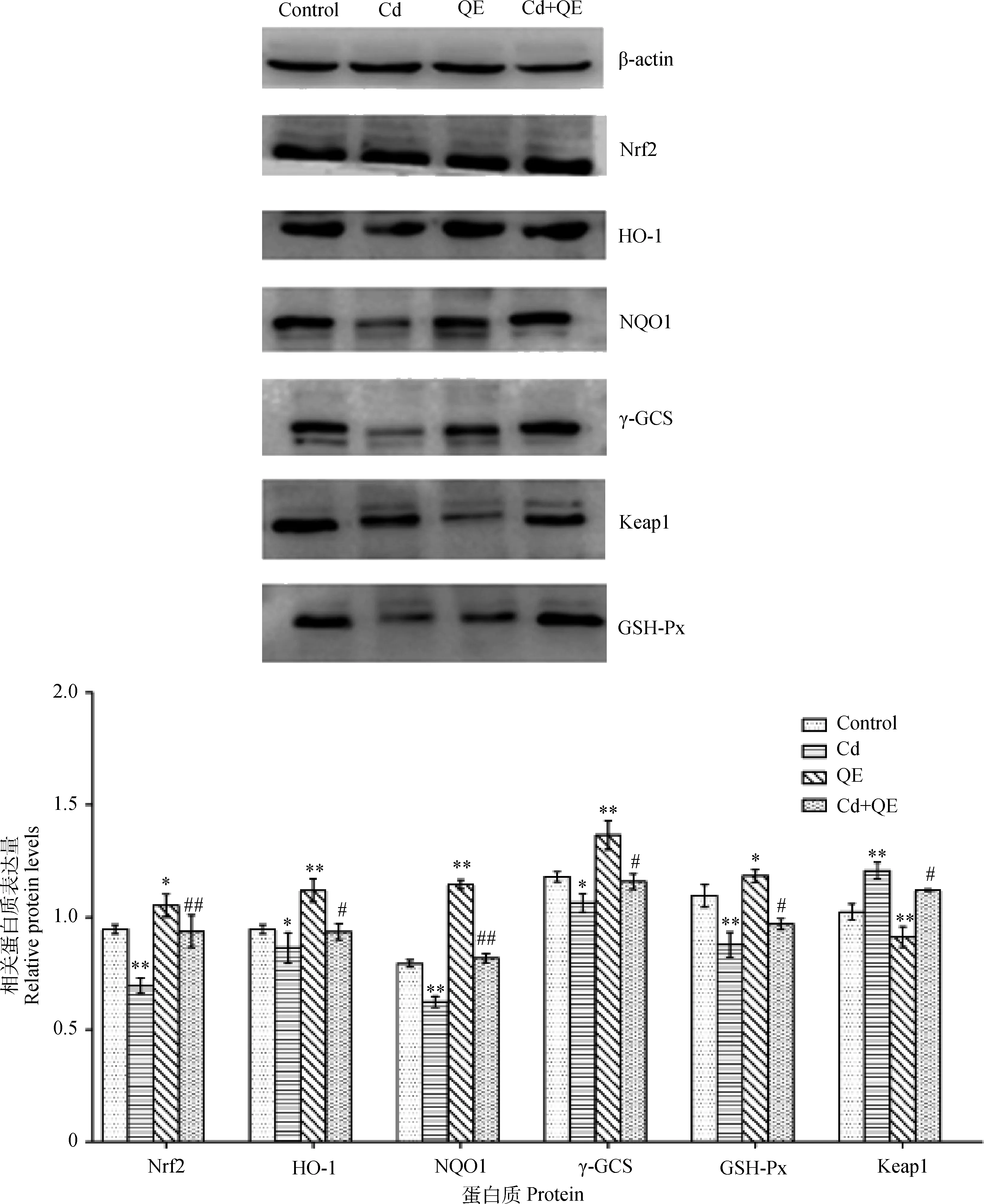
图3 大鼠睾丸组织中Nrf2-Keap1信号通路相关蛋白质表达量Fig.3 Relative expression of Nrf2-Keap1 signal pathway-related protein in testis of rats
3 讨 论
Cd可以抑制细胞线粒体呼吸链的功能并产生O2-和H2O2等物质,这些产物可以与质膜上不饱和脂肪酸的双键进行反应,导致细胞脂质过氧化损伤和氧化应激损伤,这是Cd致睾丸产生毒性的重要原因。MDA是脂质过氧化的产物,是氧化损伤常用的指标之一[16-18]。在本研究中,Cd组大鼠睾丸组织中H2O2和MDA的表达增加显著,表明Cd引起大鼠睾丸组织过氧化损伤,这与S. H. Yang等[19]的研究结果一致。观察到Cd暴露后大鼠睾丸及附睾脏器系数显著降低,这可能是Cd引起睾丸萎缩的结果。精子质量下降,正常生精结构遭到破坏,生殖细胞脱落严重,睾酮分泌量明显下降,这些表明Cd已经对睾丸的生殖功能造成了严重的损伤。QE可以保护细胞免受氧化应激和炎性反应的损伤[20],本研究中联合应用QE的大鼠与Cd暴露的大鼠相比睾丸组织中H2O2和MDA的含量显著降低,睾丸及附睾脏器系数显著增加,精子质量及睾酮分泌量明显得到改善,这表明QE对Cd致大鼠睾丸的氧化损伤起到了一定的保护作用。
当机体受到病原体、重金属、氮氧化合物或其他内外环境因素刺激时,会产生大量活性氧自由基,从而发生氧化应激[21-22]。机体生成氧化物的速度大于其清除速度时,氧化系统和抗氧化剂体系之间的平衡遭到破坏。体内抗氧化系统包括抗氧化酶系统[23-24],如SOD、CAT和GSH-Px等,以及非酶系统如GSH等。GSH-Px催化GSH和H2O2还原反应,以防止细胞内的脂质过氧化和氧化应激。GSH是一种重要的抗氧化剂和自由基清除剂,可直接结合重金属或氧自由基,或间接结合GSH-Px,从而将有害物质转化为无害物质保护身体。本研究发现,Cd组SOD、CAT和GSH-Px活性以及GSH含量明显下降,说明Cd致大鼠睾丸抗氧化体系失衡,降低其正常抗氧化能力。QE可通过抗氧化应激和抗凋亡对机体的Cd毒性发挥多功能保护作用[25],本试验中QE干预后,SOD、CAT和GSH-Px活性和GSH含量与Cd组相比均显著升高,此时机体抗氧化系统能力增强,发挥强大的抗氧化作用。
Nrf2是调节Ⅱ相解毒酶和抗氧化相关的重要转录因子,可抵抗细胞氧化应激[26-27]。在生理条件下,细胞质中结合蛋白Keap1与Nrf2结合在一起并抑制Nrf2的激活[28]。当发生氧化应激时,Nrf2和Keap1分离,随后,Nrf2与抗氧化反应元件ARE结合,Nrf2被激活,进而调节与细胞保护相关抗氧化等基因的表达,包括HO-1、GSH-Px、γ-GCS和NQO1等[19],促进机体发挥抗氧化功能。本研究结果表明Cd减少了Nrf2的表达,抑制其激活,并降低HO-1、GSH-Px、γ-GCS和NQO1基因mRNA和蛋白质的相对表达,从而加重机体的氧化损伤,这与Nazimabashir等[29]的研究结果相同,而睾丸组织中的Keap1 mRNA和蛋白质表达增加同样也是Cd抑制Nrf2激活的表现。应用QE后,睾丸中Nrf2及相关基因表达水平明显升高,而Keap1水平显著降低,这与Cd产生的作用相反,表明QE能促进Nrf2的激活,上调抗氧化基因的表达,通过Nrf2-Keap1这条抗氧化通路有效保护机体免受Cd引起的睾丸损伤和氧化应激。综上,QE可以调节Nrf2-Keap1途径对Cd诱导的大鼠睾丸损伤起保护作用。然而,QE通过激活Nrf2途径抗氧化的具体机制尚不清楚,需要进一步研究。
4 结 论
Cd暴露使睾丸组织抗氧化能力减弱,氧化应激产生增加,引起雄性生殖机能障碍,QE保护睾丸组织维持正常的结构和功能,提高抗氧化酶的活性且通过激活Nrf2-Keap1信号通路增强抗氧化物质抗氧化的能力从而对Cd中毒大鼠的生殖机能起强大的保护作用。
参考文献(References):
[1] LIU Y, SU C, ZHANG H, et al. Interaction of soil heavy metal pollution with industrialisation and the landscape pattern in Taiyuan city, China[J].PLoSOne, 2014, 9(9): e105798.
[2] LIN Y P, TENG T P, CHANG T K. Multivariate analysis of soil heavy metal pollution and landscape pattern in Changhua county in Taiwan[J].LandscUrbanPlan, 2002, 62(1): 19-35.
[3] AMAMOU F, NEMMICHE S, MEZIANE R K, et al. Protective effect of olive oil and colocynth oil against cadmium-induced oxidative stress in the liver of Wistar rats[J].FoodChemToxicol, 2015, 78: 177-184.

[5] 袁 燕, 孙 娅, 江辰阳, 等. 镉对大鼠大脑皮质神经细胞Bcl-2, Bax和Caspase-3 mRNA转录的影响[J]. 中国兽医学报, 2012, 32(11): 1725-1729.
YUAN Y, SUN Y, JIANG C Y, et al. Influence of cadmium on Bcl-2, Bax and Caspase-3 mRNA transcription in rat’s primary cultured cerebral cortical neurons[J].ChineseJournalofVeterinaryScience, 2012, 32(11): 1725-1729. (in Chinese)
[6] LI R Y, LUO X, LI L B, et al. The protective effects of melatonin against oxidative stress and inflammation induced by acute cadmium exposure in mice testis[J].BiolTraceElemRes, 2016, 170(1): 152-164.
[7] ERBOGA M, KANTER M, AKTAS C, et al. Anti-apoptotic and anti-oxidant effects of caffeic acid phenethyl ester on cadmium-induced testicular toxicity in Rats[J].BiolTraceElemRes, 2016, 171(1): 176-184.
[8] 刘艳丰, 唐淑珍, 张文举, 等. 沙棘叶黄酮对阿勒泰羊生长性能、屠宰性能和血清生化指标的影响[J]. 畜牧兽医学报, 2014, 45(12): 1981-1987.
LIU Y F, TANG S Z, ZHANG W J, et al. Effects of flavonoids of sea buckthorn leaves on growth performance, slaughter performance and serum biochemical indexes of Altay sheep[J].ActaVeterinariaetZootechnicaSinica, 2014, 45(12): 1981-1987. (in Chinese)
[9] 郭长江, 徐 静, 韦京豫, 等. 我国常见蔬菜类黄酮物质的含量[J]. 营养学报, 2009, 31(2): 185-190.
GUO C J, XU J, WEI J Y, et al. Flavonoid contents of common vegetables in China[J].ActaNutrimentaSinica, 2009, 31(2): 185-190. (in Chinese)
[10] GAO W N, PU L L, WEI J Y, et al. Comparison of dietary intakes of myricetin, quercetin, kaempferol, apigenin and luteolin from vegetables and fruits in Chinese adults from four different regions[J].ActaNutrimentaSinica, 2014, 36(6): 559-564.
高蔚娜, 蒲玲玲, 韦京豫, 等. 中国四地区成人蔬菜和水果中杨梅黄酮、槲皮素、坎二菲醇、芹菜配基和玉米黄酮摄入量的比较[J]. 营养学报, 2014, 36(6): 559-564. (in English)
[11] 王 敏, 刘保林, 国旭丹. 槲皮素及其代谢物抑制氧化应激与炎症[J]. 食品科学, 2013, 34(15): 256-260.
WANG M, LIU B L, GUO X D. Quercetin and one of its metabolites inhibit reactive oxygen-species and inflammation[J].FoodScience, 2013, 34(15): 256-260. (in Chinese)
[12] 申永春, 杨 婷, 文富强, 等. 槲皮素对香烟暴露大鼠肺组织氧化应激和Nrf2表达的影响[J]. 西部医学, 2011, 23(11): 2071-2073.
SHEN Y C, YANG T, WEN F Q, et al. The effect of quercetin on oxidative stress and Nrt2 expression in cigarette smoke exposed rat lungs[J].MedicalJournalofWestChina, 2011, 23(11): 2071-2073. (in Chinese)
[13] 魏彩冰, 周莲娣, 张育珍, 等. 槲皮素通过核因子E2相关因子/抗氧化应答元件(Nrf2/ARE)信号通路发挥对免疫性肝损伤的保护作用[J]. 细胞与分子免疫学杂志, 2017, 33(3): 300-304.
WEI C B, ZHOU L D, ZHANG Y Z, et al. Protective effect of quercetin against immunological liver injury through activating Nrf2/ARE signaling pathway[J].ChineseJournalofCellularandMolecularImmunology, 2017, 33(3): 300-304. (in Chinese)
[14] ALKHEDAIDE A, ALSHEHRI Z S, SABRY A, et al. Protective effect of grape seed extract against cadmium-induced testicular dysfunction[J].MolMedRep, 2016, 13(4): 3101-3109.
[15] UNSAL C, KANTER M, AKTAS C, et al. Role of quercetin in cadmium-induced oxidative stress, neuronal damage, and apoptosis in rats[J].ToxicolIndHealth, 2015, 31(12): 1106-1115.
[16] STOHS S J, BAGCHI D, HASSOUN E, et al. Oxidative mechanisms in the toxicity of chromium and cadmium ions[J].JEnvironPatholToxicolOncol, 2001, 20(2): 77-88.
[17] VACA C E, WILHELM J, HARMS-RINGDAHL M. Interaction of lipid peroxidation products with DNA. A review[J].MutatRes/RevGenetToxicol, 1988, 195(2): 137-149.
[18] 卞建春, 路 浩, 梅 莉, 等. 铅镉联合染毒对大鼠大脑皮质神经细胞的氧化损伤及NAC的保护效应[J]. 中国兽医科学, 2008, 38(9): 805-809.
BIAN J C, LU H, MEI L, et al. Lipid peroxidation and protective effect of NAC on lead and/or cadmium in cerebral cortical neurons of rats[J].ChineseVeterinaryScience, 2008, 38(9): 805-809. (in Chinese)
[19] YANG S H, LONG M, YU L H, et al. Sulforaphane prevents testicular damage in kunming mice exposed to cadmium via activation of Nrf2/ARE signaling pathways[J].IntJMolSci, 2016, 17(10): 1703.
[20] 高蔚娜, 郭长江, 韦京豫, 等. 槲皮素对氧化应激大鼠肝细胞的保护作用[J]. 中国临床营养杂志, 2007, 15(4): 209-213.
GAO W N, GUO C J, WEI J Y, et al. Protective effects of quercetin on primary cultured rat hepatocytes against oxidative stress[J].ChineseJournalofClinicalNutrition, 2007, 15(4): 209-213. (in Chinese)
[21] 刘 连, 徐园园, 许 洁, 等. 氟对大鼠自由基、氧化应激及超微结构影响[J]. 中国公共卫生, 2009, 25(9): 1114-1116.
LIU L, XU Y Y, XU J, et al. Effect of fluoride on free radical, oxidative stress and ultrastructure of liver in rats[J].ChineseJournalofPublicHealth, 2009, 25(9): 1114-1116. (in Chinese)
[22] 叶煦亭, 沙继宏, 周 雍. 镉离子诱发的氧自由基对肝细胞损伤及钙离子分布的影响[J]. 中华预防医学杂志, 2000, 34(4): 256.
YE X T, SHA J H, ZHOU Y. Effect of oxygen free radical induced by cadmium ion on hepatocyte injury and distribution of calcium[J].ChineseJournalofPreventiveMedicine, 2000, 34(4): 256. (in Chinese)
[23] 张克烽, 张子平, 陈 芸, 等. 动物抗氧化系统中主要抗氧化酶基因的研究进展[J]. 动物学杂志, 2007, 42(2): 153-160.
ZHANG K F, ZHANG Z P, CHEN Y, et al. Antioxidant defense system in animals[J].ChineseJournalofZoology, 2007, 42(2): 153-160. (in Chinese)
[24] 方春华, 乔 琨, 刘智禹, 等. 海洋生物中抗氧化酶的研究进展[J]. 渔业研究, 2016, 38(4): 331-342.
FANG C H, QIAO K, LIU Z Y, et al. The research progress of antioxidant enzymes in marine organisms[J].JournalofFisheriesResearch, 2016, 38(4): 331-342. (in Chinese)
[25] NNA V U, UJAH G A, MOHAMED M, et al. Cadmium chloride-induced testicular toxicity in male wistar rats; prophylactic effect of quercetin, and assessment of testicular recovery following cadmium chloride withdrawal[J].BiomedPharmacother, 2017, 94: 109-123.
[26] SYKIOTIS G P, HABEOS I G, SAMUELSON A V, et al. The role of the antioxidant and longevity-promoting Nrf2 pathway in metabolic regulation[J].CurrOpinClinNutrMetabCare, 2011, 14(1): 41-48.
[27] 李 全, 张 源, 梁跃伟, 等. Nrf2抗氧化应激保护内皮细胞损伤的研究进展[J]. 昆明理工大学学报: 自然科学版, 2017, 42(2): 77-81.
LI Q, ZHANG Y, LIANG Y W, et al. Research progress of Nrf2 regulate oxidative stress in vascular endothelial cells[J].JournalofKunmingUniversityofScienceandTechnology(NaturalScienceEdition), 2017, 42(2): 77-81. (in Chinese)
[28] LIU Z P, XIANG Y Q, SUN G H. The KCTD family of proteins: structure, function, disease relevance[J].CellBiosci, 2013, 3: 45.
[29] NAZIMABASHIR, MANOHARAN V, MILTONPRABU S. Cadmium induced cardiac oxidative stress in rats and its attenuation by GSP through the activation of Nrf2 signaling pathway[J].ChemBiolInteract, 2015, 242: 179-193.
