下肢动脉硬化闭塞症患者颅内/外动脉狭窄的特点及危险因素
2018-06-07赵莹莹武珊珊陈珺丁永芹高凤玲张伟赵静洁李继梅
赵莹莹,武珊珊,陈珺,丁永芹,高凤玲,张伟,赵静洁,李继梅
经颅多普勒超声(transcranial Doppler,TCD)现已成为筛查和评估颅内外血管病变的重要手段,并在外科手术前评估围手术期卒中风险中发挥重要作用。动脉粥样硬化是一种全身性的血管疾病,可累及不同部位的动脉,目前有研究认为下肢动脉硬化闭塞症(peripheral artery disease,PAD)可能是缺血性卒中以及颈动脉狭窄的危险因素[1]。既往研究多集中在PAD与颅外段颈动脉狭窄闭塞之间的关系,而颅内动脉狭窄同样是发生缺血性脑血管病的潜在风险。流行病学研究显示美国人群中颅外动脉粥样硬化发生率较高,而亚裔人群中颅内动脉粥样硬化发病率较高[2]。本研究回顾性分析国人PAD患者颅内和颅外动脉狭窄情况,分析与之相关的危险因素以及其对围手术期卒中风险的影响。
1 研究对象和方法
1.1 研究对象和资料收集 本研究为回顾性分析,连续纳入2016年7月-2017年7月在首都医科大学附属北京友谊医院血管外科住院并同时行TCD检查的PAD患者。PAD诊断标准如下:①年龄>40岁;②有PAD临床表现;③缺血肢体远端动脉搏动减弱或消失;④彩色多普勒超声、计算机断层扫描血管造影(computed tomography angiography,CTA)、磁共振血管成像(magnetic resonance angiography,M R A)和数字减影血管造影(d i g i t a l subraction angiography,DSA)等影像学检查显示相应动脉的狭窄或闭塞[3]。
回顾性收集PAD患者的性别、年龄、既往史(包括症状性脑梗死、无症状性腔隙性脑梗死、高血压、糖尿病、高脂血症、冠状动脉粥样硬化性心脏病、吸烟等)、临床症状、手术信息以及TCD检查结果。PAD临床症状根据Fontaine分类分为Ⅰ期无症状,Ⅱ期间歇性跛行,Ⅲ期静息痛,Ⅳ期足趾溃疡、坏疽[3]。本研究中将Ⅰ期和Ⅱ期合并为轻症组,Ⅲ期和Ⅳ期合并为重症组。
TCD对颅内外各血管狭窄的判断标准参照高山等编著的《经颅多普勒超声的诊断技术与临床应用》[4]。颅外段血管狭窄由颈部血管超声和TCD同时证实。颅外血管包括双侧锁骨下动脉、椎动脉起始部、颈总动脉、颈内动脉和颈外动脉;颅内血管包括基底动脉、双侧椎动脉颅内段、颈内动脉虹吸部、大脑中动脉、大脑前动脉和大脑后动脉。动脉狭窄程度分为无狭窄、轻中度狭窄(<70%)、重度狭窄或闭塞(≥70%)。围手术期卒中指发生在术中和术后30 d内的卒中[5]。
1.2 分组和比较 分别将患者按照是否存在颅内动脉狭窄、是否存在颅外动脉狭窄、是否存在颅内或颅外动脉重度狭窄或闭塞3种标准分组,比较组间PAD症状的差异。另外,采用二元Logistic回归分析PAD患者合并颅内/外动脉狭窄的危险因素。
1.3 统计分析方法 统计学分析采用SPSS 22.0软件,计量资料符合正态分布,以()表示,计数资料以率表示,两组间比较用卡方检验。PAD患者合并颅内/外动脉狭窄的危险因素评估采用二元Logistic回归分析,分别以合并颅外动脉狭窄、合并颅内动脉狭窄、合并颅内外动脉重度狭窄作为因变量,以性别、年龄、高血压、糖尿病、高脂血症、冠状动脉粥样硬化性心脏病、吸烟、无症状性腔隙性脑梗死、症状性脑梗死作为自变量,其中年龄作为连续变量进入模型,计算各危险因素的比值比(odds ratio,OR)和95%可信区间(confidence interval,CI)。以P<0.05为结果有统计学意义。
2 结果
2.1 一般资料 研究共纳入155例PAD患者,年龄44~91岁,平均(69.3±10.2)岁,男性109例,女性46例。PAD合并颅内和(或)颅外动脉狭窄共99例(63.9%),其中PAD合并颅外段动脉狭窄66例(42.6%),合并颅内段动脉狭窄67例(43.2%);PAD合并单纯颅外段动脉狭窄32例(20.6%),合并单纯颅内段动脉狭窄33例(21.3%),合并颅内外段动脉同时狭窄34例(21.9%)。PAD合并颅外段动脉重度狭窄或闭塞27例(17.4%),合并颅内段动脉重度狭窄或闭塞4例(2.6%)。
2.2 PAD严重程度与颅内/外动脉狭窄的关系与无颅内动脉狭窄患者(88例)相比,PAD合并颅内动脉狭窄(67例)更容易发生下肢静息痛或坏疽,差异有统计学意义。合并颅外段动脉狭窄的患者,症状严重程度与无颅外段动脉狭窄者相比无显著差异。合并重度颅内/外动脉狭窄的患者与无重度颅内/外动脉狭窄者相比,PAD的严重程度也无显著差异(表1)。
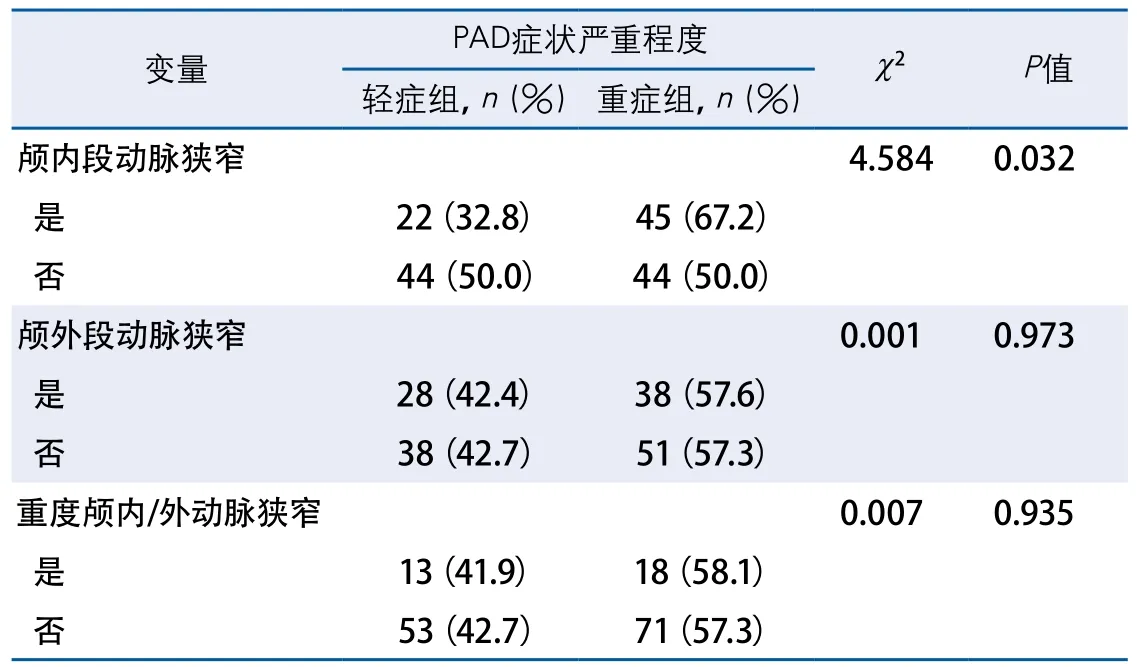
表1 PAD严重程度与颅内外动脉狭窄的关系
2.3 PAD合并颅外段动脉狭窄与围手术期卒中的关系 本研究中有115例患者行手术治疗,其中111例行介入手术治疗,4例行搭桥术治疗。行手术治疗的颅外段动脉重度狭窄患者共23例,4例发生围手术期卒中;行手术治疗的非颅外段动脉狭窄的患者有92例,仅1例发生围手术期卒中,两组差异有统计学意义(17.4% vs 1.1%,P=0.006)。
2.4 PAD患者合并颅内/外动脉狭窄的危险因素 多因素分析显示,年龄和吸烟是PAD合并颅外段动脉狭窄的独立危险因素。糖尿病是PAD合并颅内段动脉狭窄的独立危险因素。吸烟是PAD合并颅内/外段动脉重度狭窄的独立危险因素(表2)。
3 讨论
既往研究发现,症状性动脉粥样硬化性血管病患者中约有15.9%同时存在多个部位的血管病变。PAD患者同时合并脑血管病发生率15%,合并心血管病事件发生率为28.8%,合并并不同程度无症状性颈动脉狭窄发生率约22.1%~43%[6-9]。这种多部位同时存在动脉粥样硬化性血管病的患者通常提示预后不良[7]。本研究同时纳入了颅内和颅外所有大动脉狭窄情况,结果提示PAD合并颅内和(或)颅外动脉狭窄发生率为63.9%,并且颅外动脉狭窄和颅内动脉狭窄的比例相当(43.2% vs 42.6%)。
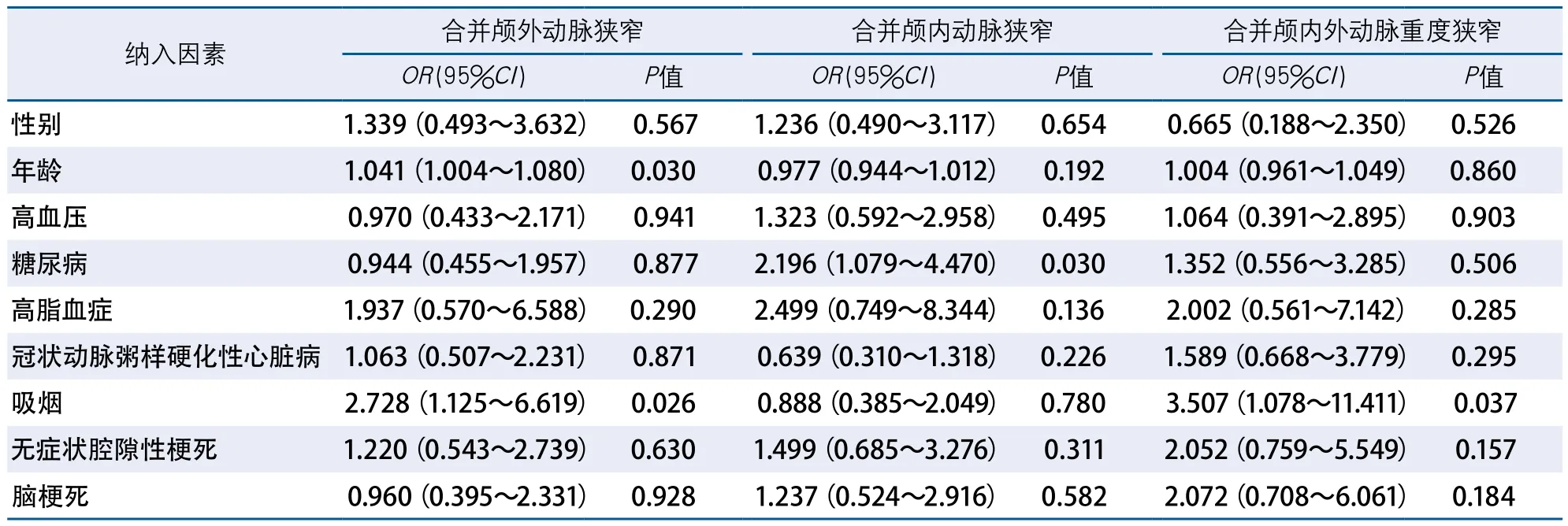
表2 PAD患者合并颅内/外动脉狭窄的危险因素
作为动脉粥样硬化性疾病,PAD和颅内/外动脉狭窄拥有相同的危险因素,包括高血压、糖尿病、高脂血症、吸烟等。然而国内外对PAD合并无症状性颈动脉狭窄危险因素的报道结果各异。Fabio Marsico等[9]认为年龄、吸烟、糖尿病、高血压、血脂水平、踝/肱指数(anklebrachial index,ABI)等常见危险因素在PAD合并颈动脉狭窄组和单纯PAD组中无显著差异。而Woo-Sung Yun等[10]认为年龄大于65岁和冠状动脉粥样硬化性心脏病是PAD合并重度颈动脉狭窄的预测因子。国内有学者发现吸烟、冠状动脉粥样硬化性心脏病、高血压是PAD合并无症状性颈动脉狭窄的危险因素,而年龄、高血压、高胆固醇血症是合并重度颈动脉狭窄的危险因素[8,11]。本研究分别对PAD合并颅内段动脉狭窄、合并颅外段动脉狭窄以及同时合并颅内外动脉狭窄的危险因素进行分析发现:年龄和吸烟是PAD合并颅外段动脉狭窄的危险因素;糖尿病是PAD合并颅内段动脉狭窄的危险因素;吸烟是PAD合并颅内/外动脉重度狭窄的危险因素。
有研究者认为PAD症状严重程度与颈动脉狭窄严重程度呈正相关,而有的则持不同观点[7,12]。本研究中轻中度与重度颈动脉狭窄患者相比,PAD临床表现并无显著差异,PAD轻症患者同样存在颈动脉狭窄风险,提示单从PAD临床表现判断颈动脉狭窄严重程度并不可靠。本研究中还检测了颅内段动脉,发现PAD合并颅内动脉狭窄患者更容易发生严重下肢缺血症状,如静息痛或坏疽,说明颅内动脉狭窄在PAD患者中不容忽视。
颈动脉狭窄是围手术期卒中的重要原因[13]。本研究也证实了PAD合并颅外段动脉重度狭窄或闭塞与围手术期卒中的发生密切相关。PAD伴发的颈动脉不稳定斑块所产生的炎症反应可能是PAD患者卒中高发的病理生理机制[14]。因此,多数学者认为术前常规进行颈动脉超声的筛查至关重要。
颅内动脉狭窄患者同样具有卒中风险,单纯颈动脉超声检查并不能覆盖全部脑动脉。TCD检查不仅可以取得与超声相似的颈部血管检查结果,更可以探测颅内大动脉的血流情况,并从一定程度上判断血管狭窄程度。TCD对脑血管的检测具有简便、经济、无创、快速、可重复性强的特点,可以作为术前筛查高危风险患者的重要检查方法。
本研究纳入的病例数较少,另外,回顾性研究并非所有患者颅内/外血管狭窄均经CTA或MRA证实。未来还应进行设计良好的前瞻性研究分析PAD与脑血管病的相关性。
[1]ARAKI Y,KUMAKURA H,KANAI H,et al.Prevalence and risk factors for cerebral infarction and carotid artery stenosis in peripheral arterial disease[J]. Atherosclerosis,2012,223(2):473-477.
[2]KIM B J,KIM J S. Ischemic stroke subtype classification:an Asian viewpoint[J]. J Stroke,2014,16(1):8-17.
[3]中华医学会外科学分会血管外科学组. 下肢动脉硬化闭塞症诊治指南[J/OL]. 中华普通外科学文献(电子版). 2016,10(1):1-18. http://www.pwwxcma.com/Admin/UploadFile/Issue/zma34bu3.pdf. DOI:10.3877/cma.j.issn.1674-0793.2016.01.001.
[4]高山,黄家星. 经颅多普勒超声(TCD)的诊断技术与临床应用[M]. 北京:中国协和医科大学出版社,2004:53-141.
[5]NG P Y,NG A K,SUBRAMANIAM B,et al.Association of Preoperatively Diagnosed Patent Foramen Ovale With Perioperative Ischemic Stroke[J]. JAMA,2018,319(5):452-462.
[6]RATANAKORN D,KEANDOUNGCHUN J,TEGELER C H. Coexistent extra- and intracranial stenosis,cervical atherosclerosis,and abnormal ankle brachial index in acute ischemic stroke[J].J Stroke Cerebrovasc Dis,2012,21(8):782-789.
[7]RAZZOUK L,ROCKMAN C B,PATEL M R,et al. Co-existence of vascular disease in different arterial beds:Peripheral artery disease and carotid artery stenosis--Data from Life Line Screening[J].Atherosclerosis,2015,241(2):687-691.
[8]宋希涛,刘暴,刘昌伟等. 下肢动脉硬化闭塞症合并无症状颈动脉狭窄发生率及危险因素分析[J]. 中华医学杂志,2016,96(2):126-128.
[9]MARSICO F,RUGGIERO D,PARENTE A,et al.Prevalence and severity of asymptomatic coronary and carotid artery disease in patients with lower limbs arterial disease[J]. Atherosclerosis,2013,228(2):386-389.
[10]YUN W S,RHO Y N,PARK U J,et al. Prevalence of asymptomatic critical carotid artery stenosis in Korean patients with chronic atherosclerotic lower extremity ischemia:is a screening carotid duplex ultrasonography worthwhile? [J]J Korean Med Sci,2010,25(8):1167-1170.
[11]张华,潘仲杰,赵奇,等. 下肢动脉硬化闭塞症合并无症状性颈动脉狭窄229例[J]. 中华普通外科杂志,2014,29(8):607-609.
[12]MIRSHARIFI R,KARIMIAN F,FARAHMAND M R,et al. Asymptomatic carotid artery stenosis in patients with severe peripheral vascular diseases[J].J Res Med Sci,2009,14(2):117-122.
[13]WIPPER S,STOBEROK K,ATLIHAN G,et al.Screening of carotid arteries before surgery:when does preoperative duplex ultrasound make sense? [J].Der Chirurg,2014,85(7):616-621.
[14]SIRICO G,SPADERA L,DE LAURENTIS M,et al. Carotid artery disease and stroke in patients with peripheral arterial disease. The role of inflammation[J]. Monaldi Arch Chest Dis,2009,72(1):10-17.
