黄地安消胶囊调控磷脂酰基醇3-激酶/蛋白激酶B信号通路减轻GK大鼠血管病变损伤程度的研究
2018-06-07韩利平郭明飞高家荣姜辉方朝晖单莉姜楠楠
韩利平,郭明飞,高家荣,,姜辉,方朝晖,单莉,姜楠楠
(1.安徽中医药大学研究生院,安徽 合肥 230038; 2.安徽中医药大学第一附属医院、国家中医药管理局中药制剂三级实验室,安徽 合肥 230031)
糖尿病(Diabetes Mellitus,DM)是一种以高血糖为临床特征的代谢性疾病[1],其中2型糖尿病(Type 2 diabetes mellitus,T2DM)占其发病率的90%以上[2]。糖尿病血管病变以平滑肌细胞、纤维肌细胞的异常增殖所致的血管中膜增厚,外膜纤维化与钙化为其病理学特征,是T2DM的主要并发症之一。黄地安消胶囊为国家中医临床研究基地(重点研究病种:糖尿病)的特色中药制剂,对T2DM血管病变具有很好的防治作用[3-4]。有研究表明磷脂酰基醇3-激酶/蛋白激酶B(PI3K/Akt)信号通路在T2DM血管病变过程中发挥重要的调控作用[5]。本实验以自发性T2DM大鼠为模型,观察黄地安消胶囊对PI3K/Akt号通路的调控作用,以期阐明黄地安消胶囊对糖尿病血管病变发挥防治作用的可能作用机制。
1 材料与方法
1.1动物SPF级雄性GK大鼠,60只,5月龄,体质量(200±20)g,购自于上海斯莱克斯实验动物有限责任公司,许可证号:SCXK(沪)2012-0002。Wistar大鼠10只,SPF级,雄性,5月龄,体质量(200±20)g,购自于安徽医科大学实验动物中心,许可证号:SCXK(皖)2011-002。实验动物伦理学符合安徽中医药大学实验动物伦理委员会要求。
1.2药品与试剂盐酸二甲双胍片(上海上药信谊药厂有限公司,生产批号48160302);参芪降糖颗粒(鲁南厚普制药有限公司,生产批号00115257);黄地安消胶囊处方:葛根、生地、麦冬、枇杷叶、黄连、三七,以上所有药材均由安徽中医药大学第一附属医院提供,并经李立华主任中药师鉴定,上述药材符合2015版《中国药典》一部,药材和饮片项下的性状鉴别标准;Nω-硝基L精氨酸甲酯(Nω-nitro-L-arginine methyester,L-NAME,Sigma公司,生产批号N5751-10);Revert Aid RT Reverse Transcription Kit(美国thermo有限公司);SYBR®Green PCR Master Mix(美国thermo有限公司)。
1.3主要仪器GA-3型血糖仪(长沙三诺生物传感股份有限公司),CX5PRO型全自动生化分析仪(美国Beckman公司),7500 FAST型Real-time PCR仪(美国ABI公司)。
1.4方法GK大鼠适应性饲养1周后,以随机血糖>11.1 mmol·L-1作为T2DM的判断标准[6-7],选取符合标准的GK大鼠。按随机数字表法分为模型组、参芪降糖颗粒组(1.08 g·kg-1)、二甲双胍组(0.72 g·kg-1)、黄地安消胶囊高、中、低剂量组,每组10只,另取10只Wistar大鼠作为健康组。参芪降糖颗粒和二甲双胍组成人每日给药剂量分别为(3.00 g和2.00 g),根据人鼠体表面积换算比例,按临床等效剂量的4倍给药,分别为(1.08 g·kg-1和0.72 g·kg-1)。根据黄地安消胶囊处方比例,成人每日需生药量51 g,根据人鼠体表面积换算比例,计算得出大鼠每日所需生药量为4.59 g·kg-1,处方浸膏得率为33%,计算得出大鼠每日所需浸膏量为1.51 g·kg-1,按临床等效剂量的8、4、2倍,设置黄地安消胶囊高、中、低剂量组,给药浸膏量分别为12.00 g·kg-1、6.00 g·kg-1和3.00 g·kg-1。除健康组外,其余各组均以浓度为0.1 g·kg-1L-NAME加入到饮用水中联合高脂饲料饲养的方法进行造模,连续6周[8-9],健康组给予相同溶媒,并喂饲普通饲料。造模第一天按上述剂量灌胃给药,每天1次,连续6周,健康组和模型组给予等量溶媒。
1.5检测指标与方法
1.5.1一般形态学观察 观察各组大鼠精神、活动状态、皮毛色泽、饮食量、体重及死亡等情况。
1.5.2空腹血糖(FBG)检测 分别于造模第0周、2周、4周、6周,各组大鼠禁食12 h,用酒精清洁消毒尾部皮肤,采血针刺破尾静脉血管,将尾静脉血滴入血糖仪中,检测其FBG。
1.5.3血清生化指标检测 第6周末次给药后,禁食12 h,腹腔注射3.50%的水合氯醛麻醉大鼠,腹主动脉取血,室温静置2 h后,离心分离血清,检测血胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白(LDL)、高密度脂蛋白(HLDL)、氧化低密度脂蛋白(ox-LDL)的含量。
1.5.4腹主动脉病理组织学检查 分离大鼠腹主动脉,置于10%的甲醛溶液中,采用HE染色观察大鼠腹主动脉病理组织学损伤程度,Masson染色观察大鼠腹主动脉胶原纤维变化情况,Verhoeff染色观察大鼠腹主动脉弹力纤维变化情况。
1.5.5腹主动脉PI3K、PTEN、TRIB3、Akt、HIF-1α、VEGF mRNA的表达 取100 mg大鼠腹主动脉组织,采用TRIzol 法抽提总RNA,42 ℃水浴1 h,经逆转录合成第一链cDNA。取cDNA 2.5 μL,加入2×qPCR Mix 12.5 μL,正向逆向引物各1 μL,去离子水8 μL,总体系25 μL。反应条件为:95 ℃ 1 min,95 ℃ 15 s及60 ℃ 60 s,40个循环。结果采用相对定量法进行分析,目的基因mRNA相对表达量=2-ΔΔCt。各引物序列如表1所示。

表1 引物序列基因
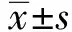
2 结果
2.1一般形态学观察健康组大鼠精神状态良好,活泼好动,毛色光亮,饮食饮水量正常;模型组大鼠行动迟缓、反应迟钝,毛色发黄、蓬松无光泽,饮食饮水量明显增加,体重增加缓慢[10];与模型组比较,黄地安消胶囊各剂量组、参芪降糖颗粒和二甲双胍组精神状态、活动度、毛色、饮食饮水量等情况具有不同程度的改善。实验期间,模型组有2只大鼠死亡,其他各组大鼠无死亡。
2.2各组大鼠FBG比较与健康组相比,模型组大鼠2周、4周、6周时,血清FBG水平均显著升高(P<0.01);与模型组相比,黄地安消胶囊高、中剂量组(12.00 g·kg-1、6.00 g·kg-1)4周、6周时,可显著降低FBG水平(P<0.05或P<0.01),黄地安消胶囊低剂量组(3.00 g·kg-1)6周时可显著降低FBG水平。结果见表2。
2.3血清生化指标比较与健康组比较,模型组大鼠血清TC、TG、LDL-C、ox-LDL水平均明显上升(P<0.01),HDL-C水平显著下降(P<0.01)。与模型组比较,黄地安消胶囊高、中剂量组(12.00 g·kg-1、6.00 g·kg-1)血清TC、TG、LDL-C、ox-LDL均显著下降(P<0.05或P<0.01),HDL-C水平显著上升(P<0.05或P<0.01);黄地安消胶囊低剂量组(3.00 g·kg-1)仅血清ox-LDL水平下降,差异有统计学意义(P<0.05),其他指标如血清TC、TG、LDL-C水平虽有所下降,HDL-C水平虽有所上升,但均差异无统计学意义(P>0.05)。结果见表3。
2.4腹主动脉HE染色观察病理损伤HE染色显示,健康组大鼠腹主动脉血管内皮细胞平行排列,内膜光滑平整;模型组大鼠腹主动脉血管内皮细胞排列紊乱、肿胀脱落,内膜断裂不平整,血管平滑肌细胞肥大,血管中膜厚度明显增加。经黄地安消胶囊药物干预6周后,各组大鼠腹主动脉病理损伤程度明显改善,结果见图1。

表2 黄地安消胶囊对GK大鼠FBG的影响
注:与健康组比较,aP<0.01;与模型组比较,bP<0.05,cP<0.01
2.5腹主动脉Masson染色观察胶原纤维变化Masson染色重点观察胶原纤维变化情况,以蓝色为阳性表达。健康组大鼠腹主动脉管壁胶原纤维分布均匀,相邻细胞的胶原纤维网完好,血管周围有少量蓝染胶原纤维,纤维化程度轻;模型组大鼠腹主动脉胶原纤维明显增多,粗大胶原纤维相互连接为团块状,排列紊乱,分布不匀,管周纤维化明显;与模型组比较,各给药组胶原纤维化明显好转,仅黄地安消胶囊低剂量组(3.00 g·kg-1)效果不太明显,管周有部分蓝染纤维,结果如图2所示。
2.6腹主动脉Verhoeff染色观察弹力纤维变化Verhoeff染色重点观察弹力纤维变化情况,以蓝黑色或黑色为阳性表达。健康组大鼠腹主动脉弹力纤维分布均匀、整齐,完整无断裂,呈蓝黑色或黑色;模型组大鼠腹主动脉弹力纤维分布不均匀,排列紊乱、疏松,可见明显断裂;与模型组比较,黄地安消胶囊各剂量组大鼠腹主动脉弹力纤维排列分布相对均匀整齐,有少量断裂,参芪降糖组大鼠腹主动脉弹力纤维排列均匀、整齐,断裂不明显;二甲双胍组大鼠腹主动脉弹力纤维排列欠均匀整齐,可见明显断裂,结果如图3所示。
2.7腹主动脉各指标mRNA表达量与健康组比较,模型组大鼠腹主动脉TRIB3、PTEN mRNA水平均显著下降(P<0.01),PI3K、Akt 、HIF-1α、VEGF mRNA水平明显上升(P<0.01)。与模型组比较,黄地安消胶囊高、中剂量组(12.00 g·kg-1、6.00 g·kg-1)腹主动脉TRIB3、PTEN mRNA水平均显著上升(P<0.05或P<0.01),PI3K、Akt 、HIF-1α、VEGF mRNA水平明显下降(P<0.05或P<0.01);黄地安消胶囊低剂量组(3.00 g·kg-1)虽然TRIB3、PTEN mRNA水平有所上升,PI3K、Akt、HIF-1α、VEGF mRNA有所下降,但均差异无统计学意义(P>0.05)。结果见表4。
3 讨论
糖尿病在中医中被称为“消渴病”,主要病变部位在肺、胃、肾三处,“阴津亏耗,燥热偏盛,进而热灼津亏血瘀”为其主要病机,“益气、养阴、活血”为其主要治则。黄地安消胶囊由黄连、生地、三七等六味药物组成,方中黄连清热燥湿,生地清热生津、凉血,三七活血化瘀,麦冬、葛根补阴津亏损,枇杷叶清降肺胃之气,诸药合用共凑清热润燥、养阴生津、活血之功效,临床疗效确切。
糖尿病血管病变是糖尿病的主要并发症之一,主要表现为胶原合成的增加、血管壁的逐渐增厚、弹性纤维减少、血管僵硬度增加[11]。因此,血管壁中膜的厚度,胶原、弹性纤维的含量代表了糖尿病血管病变的严重程度。本实验研究发现,给予黄地安消胶囊干预6周后,黄地安消胶囊组大鼠腹主动脉中膜厚度下降,胶原含量减少,弹性纤维的含量增加,说明黄地安消胶囊可有效的抑制糖尿病血管病变的发生与发展。

表3 黄地安消胶囊对GK大鼠血清生化指标的影响
注:与健康组比较,aP<0.01;与模型组比较,bP<0.01,cP<0.05

表4 各组GK大鼠PI3K、TRIB3、PTEN、PI3KP85a、Akt 、HIF-1α、VEGF mRNA的表达
注:与健康组比较,aP<0.01;与模型组比较,bP<0.01,cP<0.05
动脉粥样硬化是糖尿病血管病变的病理基础,高血脂是导致动脉粥样硬化的直接原因[12]。研究认为血管病变与血液中TC、TG、LDL、HLDL、ox-LDL的含量相关,尤其与HLDL、LDL和ox-LDL的含量联系更为密切[13-15],治疗与防止动脉粥样硬化的关键在于降低TC、TG、LDL、ox-LDL的含量,升高HLDL的含量。本实验研究发现,黄地安消胶囊能显著降低血清TC、TG、LDL和ox-LDL水平,升高HLDL水平(P<0.05或P<0.01)。
PI3K/Akt信号通路属于磷脂酞肌醇信号通路系统,在机体新陈代谢、细胞生长增殖、迁移和凋亡等生物学过程中发挥重要的调控作用[16]。在T2DM的发病过程中,持续的高血糖可激活PI3K/Akt信号通路[17],催化PIP2转化为PIP3,诱导Akt活化[18],从而促进下游靶基因缺氧诱导因子(HIF-1α)的表达[19]。HIF-1α含量的增加又可刺激VEGF的表达,从而引起血管内皮细胞和肌细胞的异常增殖,导致糖尿病血管病变的发生与发展[20-21]。PTEN和TRIB3是调控PI3K/Akt信号通路的重要分子,PTEN可使PIP3去磷酸化,抑制PI3K的磷酸化作用[22],TRIB3可与Akt结合,抑制Akt活化[23],阻断通路下游靶基因的活化,从而对糖尿病血管病变的发生、发展发挥抑制作用。本研究发现,黄地安消胶囊组高、中剂量组(12.00 g·kg-1、6.00 g·kg-1)大鼠腹主动脉TRIB3、PTEN mRNA含量显著上升(P<0.05或P<0.01),Akt、VEGF和HIF-1α mRNA含量显著下降(P<0.05或P<0.01),说明黄地安消胶囊通过调控PI3K/Akt信号通路对T2DM血管病变发挥防治作用。
综上,黄地安消胶囊对T2DM血管病变具有一定的防治作用,其机制调控可能与PI3K/Akt信号通路、改善糖脂代谢有关。

[1] ZHU J,XU J,CHEN Y,et al.Cross-cultural adaption and psychometric properties of the Chinese version of the Diabetes Behavior Rating Scale:a pilot study[J].Sci China Life Sci,2018,61(3):310-317.
[2] SCHERNTHANER G,JARVIS S,LOTAN C,et al.Advances in the management of cardiovascular risk for patients with type 2 diabetes:perspectives from the academy for cardiovascular risk,outcomes and safety studies in type 2 diabetes[J].Therapeutics and Clinical Risk Management,2017,13:69-79.
[3] 崔李群,方朝晖.黄地安消胶囊治疗肺热津伤型2型糖尿病的疗效观察[J].中医药临床杂志,2016,26(6):551-552.
[4] 张军.黄地安消胶囊联合胰岛素治疗肺热津伤证2型糖尿病疗效观察[J].中医药临床杂志,2017,29(1):104-106.
[5] 杨启悦,张帅,谢春光,等.参芪复方防治糖尿病大血管病变机制研究[J].中草药,2014,45(8):1179-1183.
[6] 董思圻,高秀娟,李继安,等.十子代平方对T2DM GK大鼠糖代谢及α-萄糖普酶的影响[J].临床合理用药杂志,2016,9(16):54-56.
[7] 周雪梅,董玉山,喇孝瑾,等.五子降糖方对T2DM大鼠血糖、C-P及DPP-4活性影响的实验研究[J].天津中医药大学学报,2016,35(6):390-394.
[8] CHEN YC,TINAGAKI T,FUJII Y,et al.Chronic intermittent hypoxia accelerates coronary microcirculatory dysfunction in insulin-resistant Goto-Kakizaki rats[J].Am J Physiol Regul Integr Comp Physiol,2016,311(2):R426-439.
[9] TIDJANE N,HACHEM A,ZAID Y,et al.A primary role for kinin B1 receptor in inflammation,organ damage,and lethal thrombosis in a rat model of septic shock in diabetes[J].PMC,2015,13(1):40-52.
[10] 胡雅国,张利棕,邓九零,等.氧化应激在血糖波动加速GK大鼠糖尿病肾病发病过程中的作用[J].中国糖尿病杂志,2015,23(12):1106-1110.
[11] 呼永河,侯君,郑德志,等.参芪复方对糖尿病模型大鼠血管病变的保护作用及机制[J].中国中西医结合杂志,2014,34(9):1078-1085.
[12] 董晓柳,朱丽霞,徐士军.普罗布考联合瑞舒伐他汀对脑梗死合并糖尿病患者颈动脉粥样硬化斑块、血脂及炎症因子的影响[J].中国动脉硬化杂志,2016,24(2):177-181.
[13] CHA SA,PARK YM,YUN JS,et al.A comparison of effects of DPP-4 inhibitor and SGLT2 inhibitor on lipid profile in patients with type 2 diabetes[J].Lipids in Health and Disease,2017,16(1):58.
[14] YIN Y,QI F,SONG Z,et al.Ferulic acid combined with astragaloside IV protects against vascular endothelial dysfunction in diabetic rats[J].Bioscience Trends,2014,8(4):217-226.
[15] 李梦,蔡荣林,孙旭,等.针刺对冠状动脉粥样硬化性心脏病模型大鼠血脂水平及CD 40 L、基质金属蛋白酶-9表达的影响[J].针刺研究,2013,38(2):123-128.
[16] ZHANG SY,LI XB,HOU SG,et al.Cedrol induces autophagy and apoptotic cell death in A549 non-small cell lung carcinoma cells through the P13K/Akt signaling pathway,the loss of mitochondrial transmembrane potential and the generation of ROS[J].Int J Mol Med,2016,38(1):291-299.
[17] 王景尚,孙明月,黄烨,等.α-硫辛酸对血糖波动状态下2型糖尿病大鼠血管内皮细胞功能及PI3K/Akt/GSK 3-β通路的影响[J].中国全科医学,2017,20(24):2965-2971.
[18] SINGH R.Central role of PI3K-SYK interaction in fibrinogen-induced lamellipodia and filopodia formation in platelets[J].FEBS Open Bio,2016,6(12):1285-1296.
[19] XIAO Y,PENG H,HONG C,et al.PDGF promotes the warburg effect in pulmonary arterial smooth muscle cells via activation of the PI3K/AKT/mTOR/HIF-1α signaling pathway[J].Cell Physiol Biochem,2017,42(4):1603-1613.
[20] CHEN MC,HSU WL,CHANG WL,et al.Antiangiogenic activity of phthalides-enriched Angelica Sinensis extract by suppressing WSB-1/pVHL/HIF-1α /VEGF signaling in bladder cancer[J].Sci Rep,2017,7(1):5376.
[21] KIM MH,JEONG YJ,CHO HJ,et al.Delphinidin inhibits angiogenesis through the suppression of HIF-1α and VEGF expression in A549 lung cancer cells[J].Oncol Rep,2017,37(2):777-784.
[22] SHAIK AB,RAO GK,KUMAR GB,et al.Design,synthesis and biological evaluation of novel pyrazolochalcones as potential modulators of PI3K/Akt/mTOR pathway and inducers of apoptosis in breast cancer cells[J].Eur J Med Chem,2017,139:305-324.
[23] LI K,WANG F,CAO WB,et al.TRIB3 promotes APL progression through stabilization of the oncoprotein PML-RARα and inhibition of p53-mediated senescence[J].Cancer Cell,2017,31(5):697-710.
