陆生蜗牛文石方解石化过程及其碳同位素组成变化高温实验
2018-06-07李成龙盛雪芬季峻峰
李成龙,盛雪芬*,鲍 睿,罗 铃,季峻峰
(1.南京大学 地球科学与工程学院,江苏 南京 210023;2.南京大学 表生地球化学教育部重点实验室,江苏 南京 210023)
0 引 言
陆生蜗牛种类丰富,广泛分布于全球不同气候带和不同地形地貌区。蜗牛活动范围小,主要以植物或土壤腐殖质为食,因此,其壳体碳酸盐同位素可以记录当地环境信息[1-6]。蜗牛壳体可以在陆地沉积物中保存几万甚至数百万年,多见于黄土分布区[7-13]、石灰岩地区[14]以及许多考古遗址区[5,15],故常被用于古环境和古气候的重建。
相较于氧同位素组成影响因素的复杂性,蜗牛壳体碳同位素组成来源则较为简单。一般情况下,蜗牛壳体碳同位素组成主要受控于所食用有机碳同位素组成[16-17],因此,蜗牛壳体碳同位素组成常被用于重建当地植被类型(C3、CAM、C4)的组成[1-5],进而能够反映古环境的干旱程度[18-19]。然而,在陆生蜗牛化石大量保存的黄土沉积序列中,蜗牛壳体文石会在一定层位开始部分转变为方解石[20],该过程会导致其稳定同位素组成发生变化[21],进而影响古气候重建。
国内外对于文石方解石化过程的研究多集中于样品研磨过程中文石方解石含量变化、溶液中矿物沉积后水体和矿物的稳定同位素分馏、高温高压下文石方解石化重建P(压力)-T(温度)-t(时间)界线等方面[22-27],而对于文石方解石固相转变中碳同位素组成变化的机理还不清晰。文石是高压稳定相矿物,方解石是高温稳定相矿物[22],因此,温度升高会促使文石方解石化;理论上,在蜗牛壳体沉积过程中,随着埋藏深度的增加,压力会逐渐上升,导致壳体文石方解石化不易发生[28]。然而在陕西洛川地区和甘肃西峰地区黄土剖面研究中发现[20],蜗牛壳体文石方解石化出现在L5层和L6层之间。干态沉积环境条件下,文石方解石化的速率相当缓慢,因此,时间可能是导致文石相变的主要因素,同时温度也是影响文石相变的主要因素[29]。由于蜗牛壳体文石方解石化现象比较常见,所以对利用壳体碳同位素重建古环境有着明显影响。基于此,本文对陆生蜗牛Achatinafulica壳体文石进行不同温度的高温实验,同时通过不同加热时间的设定来探讨生物成因文石方解石化过程及其对碳同位素组成的影响,从而为利用蜗牛壳体碳同位素组成进行古环境重建提供基础数据。

图1 陆生蜗牛Achatina fulicaFig.1 Achatina Fulica Land Snail
1 实验步骤与分析方法
实验采用陆生腹足类褐云玛瑙螺Achatinafulica(图1)的壳体矿物为研究对象。将选定样品用去离子水清洗后,用酒精浸泡12 h,然后用超声波清洗0.5 h,去除附着有机质和一些残留肉体,在40 ℃的烘箱中烘干;进而将整个壳体置于玛瑙研钵中磨碎,通过100目(孔径为0.150 mm)筛筛分样品,取一半粉末样品放入玻璃试管密封后,置于干燥皿中待用,另一半样品在室温下加入10%的双氧水浸泡约48 h,以彻底除去壳体附着的有机质,40 ℃烘干后置于干燥皿中待用。
高温实验在温控箱式马弗炉(上海精宏SXL-1016型温控箱式马弗炉)中进行,温度设置从200 ℃到600 ℃,时间设置从1 h到8 h,升温速率为10 ℃·min-1。室温时,放入样品,升温至设定温度(仪器温度波动为±3 ℃),按照设定时长加热运行。降温时,所有实验都采用仪器预设速率,降温到室温后打开舱门,取出样品。
矿物含量(质量分数,下同)利用X射线衍射进行确定,采用日本理学Rigaku Dmax-Rapid Ⅱ型点光源面探测器X射线衍射仪进行测试。仪器的工作条件为:靶材为Mo(Mo-Kα波长为0.71 Å),功率为4 500 W,准直管入射线束斑直径为0.1 mm,样品管直径为0.5 mm,无背景样品管,曝光时间为9 min。利用Jade 6.0软件计算文石和方解石特征峰的峰面积比值,从而得到矿物含量。其表达式为
FC=IC/(IA+IC)×100%
(1)
式中:FC为方解石在样品中所占的相对含量;IA和IC分别为文石和方解石特征峰的峰面积,其中文石选取111面,方解石选取104面[30];方解石和文石含量之和为100%。
最新研究表明,生物碳酸盐上有机质的存在对矿物鉴定没有影响[31],因此,矿物定量数据不会受到有机质的影响。
所有样品的碳同位素组成均由Picarro G2131-i CO2碳同位素分析仪通过磷酸法反应而测得,仪器的工作原理为激光光谱扫描光腔衰荡技术(WS-CRDS),其中原始样品测试3次,蜗牛壳体重、轻同位素丰度比值(13C/12C)用相对于国际标准物质PDB的千分偏差表示。其中,实验室采用的标准样品为NBS-18,仪器碳同位素组成的测试精度优于0.3‰。
2 结果分析与讨论
2.1 文石方解石化过程中方解石含量变化
X射线衍射图谱(图2)显示,随着温度从200 ℃升高到600 ℃,文石111面特征峰的峰强和峰高相对减少,而新生成的方解石104面特征峰的峰强和峰高相对增加。其中,300 ℃开始出现方解石的特征峰,进而得出方解石含量随着温度升高而增加。

104面为方解石特征峰;111面为文石特征峰;2θ为衍射角图2 不同加热温度下蜗牛壳体X射线衍射图谱Fig.2 XRD Patterns of Snail Shell in Different Heating Temperatures
根据实验结果(表1),温度在200 ℃时,加热300 min后,无论是否采用双氧水处理的样品方解石含量均为0,表明即使加热时间较长,壳体文石仍未发生方解石化。但从300 ℃开始,方解石含量随着温度的变化如下:300 ℃时,从60 min到300 min,文石均没有向方解石转变,但360 min以后,有少量的文石向方解石转变[图3(a)];400 ℃时,60 min开始,未采用双氧水处理的样品中就有69.8%的文石开始转变成方解石,并且大体上随着时间增加,方解石含量也有所增加[图3(b)];500 ℃和600 ℃时,从60 min开始,文石就可以完全转变成方解石[图3(c)、(d)]。由此可见,生物成因的文石方解石化在300 ℃就已经开始,这与无机成因的文石方解石化所需要的450 ℃相比[32],相变温度有所降低,这种差异性可能是生物成因的文石具有明显的晶体取向,以及有机质和无机CaCO3结合等引起矿物结构上的差异造成的[33]。
通过对比图3(a)、(b)以及图4中温度为300 ℃和400 ℃的数据,可以发现是否采用双氧水处理对方解石含量产生一定的影响。未采用双氧水处理的样品方解石含量比采用双氧水处理的样品普遍要低。双氧水处理会减少或去除壳体有机质,因此,有机质的存在阻碍文石方解石化过程。
从图3、4可以看出,温度是蜗牛壳体发生文石方解石化的主导因素,时间也会影响矿物相转变。结果表明,加热形成的方解石含量随着加热时间增加而增加,但矿物含量的定量方法存在5%的误差,导致部分样品中的方解石含量并没有出现随着时间的增加呈现线性增加的趋势(图3)。由此可见,短时间条件下文石方解石化过程中,温度起着更为重要的作用(图4)。200 ℃时,温度较低,很难达到有机质分解和文石方解石化所需要的能量,从而导致矿物的生长速率和成核速率都较低;500 ℃和600 ℃时,文石方解石化过程中缺少成核过程[23]。其次,相对温度而言,时间对方解石含量变化影响不大(图4)。结合张刚生等的差热数据[34],合浦珠母贝的有机质分解温度峰值为315 ℃~433 ℃;根据本次实验也可以发现,该温度范围内刚好是蜗牛文石方解石化明显阶段。由此可以推断,有机质在矿物发生相变的过程中优先分解并吸收能量,从而使得矿物吸收的能量降低,进而文石方解石化过程减弱,在这个过程中有机质起到保护作用[35]。同时,由于生物碳酸盐常常存在微量元素(Mg、Sr等), 其含量也会影响文石方解石化。微量元素含量越高,越会抑制文石方解石化[36],从而提高蜗牛壳体文石方解石化过程的温度并延迟所需时间。

表1 不同加热温度和时间下碳同位素组成Tab.1 Carbon Isotope Compositions in Different Heating Temperatures and Time
注:编号以A开头的为未采用双氧水处理的样品,编号以B开头的为采用双氧水处理的样品。

图3 方解石含量随加热时间的变化趋势Fig.3 Variation Trends of Contents of Calcite with Heating Time
2.2 高温加热后碳同位素组成变化规律
原始的和通过双氧水处理的样品碳同位素组成均为-6.7‰(表2),表明有机质存在与否,对于测试原始壳体碳酸盐的碳同位素组成没有影响。从图5、6可以看出:200 ℃时,样品碳同位素组成相较于原始样品偏负0.2‰;300 ℃时,样品碳同位素组成相较于原始样品变化为-0.3‰~0.3‰;400 ℃时,样品碳同位素组成相较于原始样品变化为-0.4‰~-0.1‰;500 ℃时,样品碳同位素组成相较于原始样品变化为-0.9‰~-0.5‰;600 ℃时,样品碳同位素组成相较于原始样品变化为-1.1‰~-0.4‰。由此可见,随着温度增加,加热样品的碳同位素组成偏负更明显。另外,有机质也会对碳同位素组成产生较小的影响(图6、7),引起碳同位素分馏值变化规律不一致。随着温度的升高,加热后样品的碳同位素分馏值呈现偏负的趋势。

表2 原始样品碳同位素组成Tab.2 Carbon Isotope Compositions of Original Samples
样品碳同位素组成与方解石含量无关。虽然整体上方解石含量的增加会导致碳同位素组成偏负,然而温度在500 ℃和600 ℃时(图5、6),即便文石已完全转变为方解石,碳同位素组成随着加热时间的变化仍在继续下降,说明碳同位素组成与方解石含量无关,此时碳同位素组成变化并不是矿物相变过程导致的,可能是壳体CaCO3与空气中其他碳源发生碳同位素交换有关。根据Staudigel等的研究[21],真空条件下对文石质的石笋进行加热,转变成方解石的样品碳同位素组成相比较于原始样品碳同位素组成的变化在仪器误差范围内,进一步说明矿物相变过程不会发生碳同位素分馏。
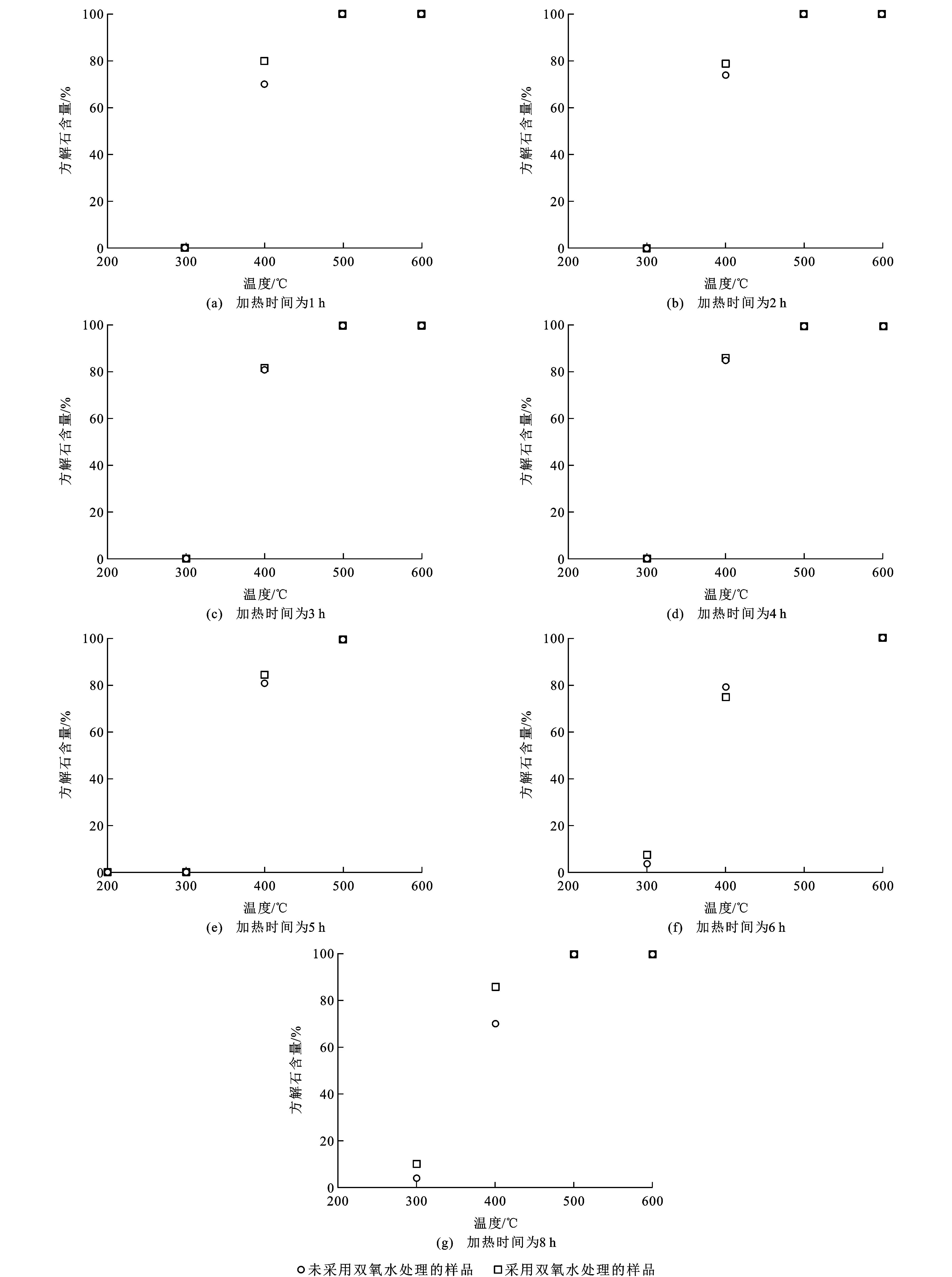
图4 方解石含量随加热温度的变化趋势Fig.4 Variation Trends of Contents of Calcite with Heating Temperatures
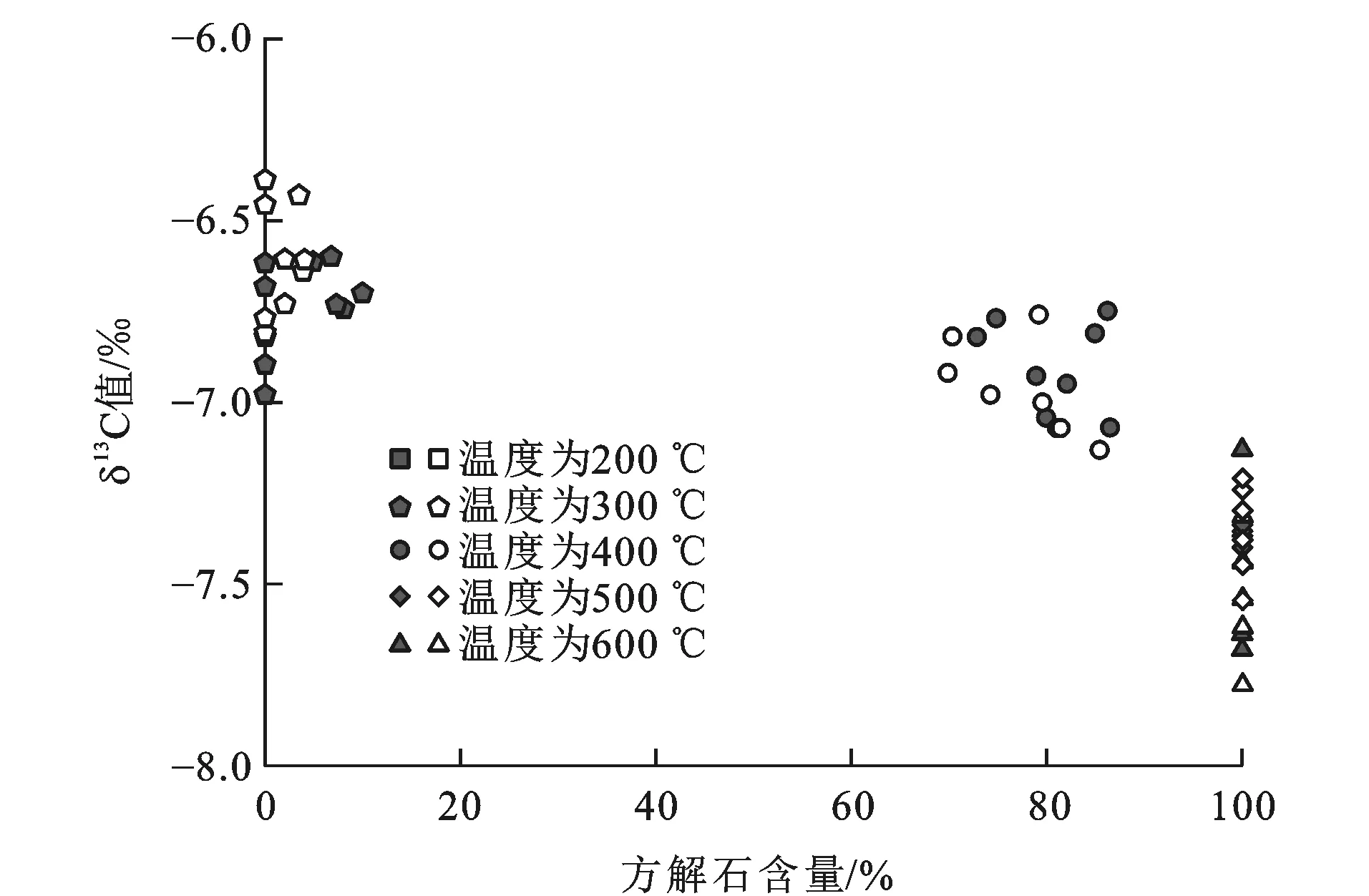
空心图例为未采用双氧水处理的样品,实心图例为采用双氧水处理的样品图5 碳同位素组成随方解石含量的变化趋势Fig.5 Variation Trends of Carbon Isotope Compositions with Contents of Calcite
2.3 高温条件下碳同位素组成变化机制

图6 碳同位素组成随加热时间的变化趋势Fig.6 Variation Trends of Carbon Isotope Compositions with Heating Time
在空气条件下蜗牛壳体高温实验中,无论是否采用双氧水处理,加热后样品碳同位素组成与原始样品的分馏值为-1.1‰~0.3‰(图7),远大于测试仪器的精度(0.3‰)。由此推断,蜗牛壳体碳同位素在实验过程中发生了碳同位素交换反应。根据Staudigel等的研究[21],在CO2气体的背景(大气CO2碳同位素组成相比文石碳同位素组成偏负)下,对文石进行加热,在方解石化过程中造成样品碳同位素组成偏负。Xu等提取出实验期间(10月至12月)江苏南京地区大气CO2碳同位素组成,发现空气中的CO2碳同位素组成一天之内变化较为明显(-10‰~-8‰),同时对两年(2013年和2014年)数据取平均值,大气CO2碳同位素组成为-8.8‰[37]。将-8.8‰作为本次实验时大气CO2碳同位素组成,相比原始蜗牛壳体CaCO3碳同位素组成(-6.7‰)偏负,证实造成加热后的样品碳同位素组成偏负原因是矿物样品与空气中的CO2发生碳同位素交换反应。

对每组温度下的样品碳同位素组成进行平均,计算其与原始样品的碳同位素分馏值图7 加热前后碳同位素分馏值与温度之间的关系Fig.7 Relationship Between the Fractionation of Carbon Isotope Compositions and Temperature Before and After Heating
CaCO3与CO2碳同位素交换反应的过程为:当空气中的CO2受热,内部的C—O键断裂,断裂的C与壳体CaCO3同样断裂的C—O键中C发生了交换重组,同时各自断裂的O也会发生交换重组。由于CO2碳同位素组成相比原始样品偏负,所以新生的方解石碳同位素组成相比原始样品偏负。同时,化学键的断裂过程是吸热反应,当温度升高时,蜗牛壳体CaCO3和空气成分CO2的C—O键断裂速度加快,交换速率随之增大,交换程度就会增加,导致CaCO3碳同位素组成负偏移随温度升高而加强。理论上,CaCO3应该最终与空气CO2的碳氧同位素组成达到平衡,可能在本实验设置条件范围内未达到平衡,因而未观测到。而存在反应后CaCO3碳同位素组成比原始样品偏正的现象,可能是因为个别样品在空气中加热时CO2碳同位素组成出现偏正的波动。
由此可见,在没有外来碳源的条件(例如真空条件)下,蜗牛壳体CaCO3碳同位素组成不会随加热温度和时间的变化而变化,也不受文石同质多象转变程度的影响,但在空气条件下加热,与大气CO2存在碳同位素交换反应,会受到空气中CO2碳同位素组成的影响。因此,在利用文石类生物碳酸盐稳定同位素组成进行古气候重建时,需要进行矿物相的鉴定,同时考虑CaCO3矿物在保存过程中可能存在的同位素交换现象,避免碳同位素组成偏差导致的结果不准确。同时,对于地质埋藏的文石质样品来说,如果样品出现部分方解石化,也表明样品在埋藏过程中经历明显的烘烤加热事件,对于恢复地质上热事件也有所借鉴。
3 结 语
空气背景高温加热实验条件下,加热温度和时间均影响陆生蜗牛壳体文石方解石化过程。其中,温度是主要影响因素;双氧水处理也会对文石方解石化产生一定作用;同时,实验后样品碳同位素组成发生改变,随着温度上升和加热时间延长,加热后样品碳同位素组成降低,可能与空气中CO2进行了碳同位素交换反应。
南京大学潘宇观老师对于样品X射线衍射数据测试进行了指导,蔡元峰老师在X射线衍射数据处理上进行了指导,在此一并致谢。
参考文献:
References:
[1] STOTT L D.The Influence of Diet on the δ13C of Shell Carbon in the Pulmonate SnailHelixAspersa[J].Earth and Planetary Science Letters,2002,195(3/4):249-259.
[2] METREF S,ROUSSEAU D D,BENTALEB I,et al.Study of the Diet Effect on δ13C of Shell Carbonate of the Land SnailHelixAspersain Experimental Conditions[J].Earth and Planetary Science Letters,2003,211(3/4):381-393.
[3] BALAKRISHNAN M,YAPP C J,THELER J L,et al.Environmental Significance of13C/12C and18O/16O Ratios of Modern Land-snail Shells from the Southern Great Plains of North America[J].Quaternary Research,2005,63(1):15-30.
[4] YANES Y,ROMANEK C S,DELGADO A,et al.Oxygen and Carbon Stable Isotopes of Modern Land Snail Shells as Environmental Indicators from a Low-latitude Oceanic Island[J].Geochimica et Cosmochimica Acta,2009,73(14):4077-4099.
[5] PRENDERGAST A L,STEVENS R E,HILL E A,et al.Carbon Isotope Signatures from Land Snail Shells: Implications for Palaeovegetation Reconstruction in the Eastern Mediterranean[J].Quaternary International,2017,432:48-57.
[6] BAO R,SHENG X F,TENG H H,et al.Reliability of Shell Carbon Isotope Composition of Different Land Snail Species as a Climate Proxy:A Case Study in the Monsoon Region of China[J].Geochimica et Cosmochimica Acta,2018,228:42-61.
[7] 刘东生.黄土与环境[M].北京:科学出版社,1985.
LIU Dong-sheng.Loess and Environment[M].Beijing:Sceince Press,1985.
[8] ROUSSEAU D D.Statistical Analyses of Loess Molluscs for Paleoecological Reconstructions[J].Quaternary International,1990,7/8:81-89.
[9] WU N Q,ROUSSEAU D D,LIU T S,et al.Orbital Forcing of Terrestrial Mollusks and Climatic Changes from the Loess Plateau of China During the Past 350 ka[J].Journal of Geophysical Research:Atmospheres,2001,106(D17):20045-20054.
[10] MARCOLINI F,BIGAZZI G,BONADONNA F P,et al.Tephrochronology and Tephrostratigraphy of Two Pleistocene Continental Fossiliferous Successions from Central Italy[J].Journal of Quaternary Science,2003,18(6):545-556.
[11] LI F J,WU N Q,PEI Y P,et al.Wind-blown Origin of Dongwan Late Miocene-Pliocene Dust Sequence Documented by Land Snail Record in Western Chinese Loess Plateau[J].Geology,2006,34(5):405-408.
[12] WU N Q,CHEN X Y,ROUSSEAU D D,et al.Climatic Conditions Recorded by Terrestrial Mollusc Assemblages in the Chinese Loess Plateau During Marine Oxygen Isotope Stages 12-10[J].Quaternary Science Reviews,2007,26(13/14):1884-1896.
[13] LI F J,ROUSSEAU D D,WU N Q,et al.Late Neogene Evolution of the East Asian Monsoon Revealed by Terrestrial Mollusk Record in Western Chinese Loess Plateau:From Winter to Summer Dominated Sub-regime[J].Earth and Planetary Science Letters,2008,274(3/4):439-447.
[14] PREECE R C,DAY S P.Special Paper:Comparison of Post-glacial Molluscan and Vegetational Successions from a Radiocarbon-dated Tufa Sequence in Oxfordshire[J].Journal of Biogeography,1994,21(5):463-478.
[15] EVANS J G.Land Snails in Archaeology[M].Seminar Press,1972.
[16] 刘宗秀,顾兆炎,吴乃琴,等.食物控制的陆生蜗牛碳同位素组成[J].科学通报,2006,51(20):2410-2416.
LIU Zong-xiu,GU Zhao-yan,WU Nai-qin,et al.Diet Control on Carbon Isotopic Composition of Land Snail Shell Carbonate[J].Chinese Science Bulletin,2006,51(20):2410-2416.
[17] 朱莉莉,鲍 睿,盛雪芬.环境因素对蜗牛Achatinafulica壳体碳酸盐δ13C组成影响的实验研究[J].高校地质学报,2015,21(2):357-364.
ZHU Li-li,BAO Rui,SHENG Xue-fen.Experimental Study on the Effect of Environmental Factors on the Carbon Stable Isotope Composition of the SnailAchatinaFulicaShell Carbonate[J].Geological Journal of China Universities,2015,21(2):357-364.
[18] GOODFRIEND G A,MAGARITZ M.Palaeosols and Late Pleistocene Rainfall Fluctuations in the Negev Desert[J].Nature,1988,332:144-146.
[19] GOODFRIEND G A.Rainfall in the Negev Desert During the Middle Holocene,Based on13C of Organic Matter in Land Snail Shells[J].Quaternary Research,1990,34(2):186-197.
[20] 盛雪芬,陈 骏,蔡元峰,等.黄土沉积中蜗牛壳体矿物相转变现象[J].科学通报,2005,50(7):698-702.
SHENG Xue-fen,CHEN Jun,CAI Yuan-feng,et al.Aragonite-calcite Transformation in Fossil Snail Shells of Loess Sequences in Loess Plateau,Central China[J].Chinese Science Bulletin,2005,50(7):698-702.
[21] STAUDIGEL P T,SWART P K.Isotopic Behavior During the Aragonite-calcite Transition:Implications for Sample Preparation and Proxy Interpretation[J].Chemical Geology,2016,442:130-138.
[22] 周根陶,郑永飞.碳酸钙同质多象转变过程中氧同位素分馏的实验研究[J].地质学报,2001,75(2):267-276.
ZHOU Gen-tao,ZHENG Yong-fei.Experimental Studies of Oxygen Isotope Fractionation in the Polymorphic Transformation of CaCO3Minerals[J].Acta Geologica Sinica,2001,75(2):267-276.
[23] HUANG W L.Synthetic Polycrystalline Aragonite to Calcite Transformation Kinetics:Experiments at Pressures Close to the Equilibrium Boundary[J].Mineralogy and Petrology,2003,79(3/4):243-258.
[24] ZHOU G T,ZHENG Y F.An Experimental Study of Oxygen Isotope Fractionation Between Inorganically Precipitated Aragonite and Water at Low Temperatures[J].Geochimica et Cosmochimica Acta,2003,67(3):387-399.
[25] 付培歌,郑海飞.高温高压下文石和方解石的拉曼光谱研究[J].光谱学与光谱分析,2013,33(6):1557-1561.
FU Pei-ge,ZHENG Hai-fei.Raman Spectra of Aragonite and Calcite at High Temperature and High Pressure[J].Spectroscopy and Spectral Analysis,2013,33(6):1557-1561.
[26] LI T T,SUN F F,LI F C,et al.Effects of Dry Grinding on the Structure and Granularity of Calcite and Its Polymorphic Transformation into Aragonite[J].Powder Technology,2014,254:338-343.
[27] 万国坤,张刚生.机械力研磨引起的生物成因文石和方解石的低温可逆相变[J].矿物岩石,2014,34(2):8-12.
WAN Guo-kun,ZHANG Gang-sheng.Reversible Transformation Between Aragonite and Calcite Induced by Mechanical Milling at Low Temperature[J].Journal of Mineralogy and Petrology,2014,34(2):8-12.
[28] HACKER B R,RUBIE D C,KIRBY S H,et al.The Calcite→Aragonite Transformation in Low-Mg Marble:Equilibrium Relations,Transformation Mechanisms,and Rates[J].Journal of Geophysical Research B:Solid Earth,2005,DOI:10.1029/2004JB003302.
[29] LIN S J,HUANG W L.Polycrystalline Calcite to Aragonite Transformation Kinetics:Experiments in Synthetic Systems[J].Contributions to Mineralogy and Petrology,2004,147(5):604-614.
[30] SWART P K,JAMES N P,MALLINSON D,et al.10.Data Report:Carbonate Mineralogy of Sites Drilled During Leg 182[C]∥HINE A C,FEARY D A,MALONE M J.Proceedings of the Ocean Drilling Program:Scientific Results.College Station:Ocean Drilling Program,1998:1-14.
[31] SMITH A M,KEY J M M,HENDERSON Z E,et al.Pretreatment for Removal of Organic Material Is Not Necessary for X-ray-diffraction Determination of Mineralogy in Temperate Skeletal Carbonate[J].Journal of Sedimentary Research,2016,86(12):1425-1433.
[32] WARDECKI D,PRZENIOSLO R,BRUNELLI M.Internal Pressure in Annealed Biogenic Aragonite[J].CrystEngComm,2008,10(10):1450-1453.
[33] REN F Z,WAN X D,MA Z H,et al.Study on Microstructure and Thermodynamics of Nacre in Mussel Shell[J].Materials Chemistry and Physics,2009,114(1):367-370.
[34] 张刚生,贾太轩,丁世磊,等.合浦珠母贝珍珠层的差示扫描量热分析[J].宝石和宝石学杂志,2005,7(3):20-22.
ZHANG Gang-sheng,JIA Tai-xuan,DING Shi-lei,et al.Differential Scanning Calorimetry Analysis of Nacreous Layer from Bivalve Shells ofPinctadaMartensii[J].Journal of Gems and Gemology,2005,7(3):20-22.
[35] ANDRUS C F T,CROWE D E.Alteration of Otolith Aragonite:Effects of Prehistoric Cooking Methods on Otolith Chemistry[J].Journal of Archaeological Science,2002,29(3):291-299.
[36] LIU M,YUND R A.Transformation Kinetics of Polycrystalline Aragonite to Calcite:New Experimental Data,Modelling,and Implications[J].Contributions to Mineralogy and Petrology,1993,114(4):465-478.
[37] XU J P,LEE X H,XIAO W,et al.Interpreting the13C/12C Ratio of Carbon Dioxide in an Urban Airshed in the Yangtze River Delta,China[J].Atmospheric Chemistry and Physics,2017,17(5):3385-3399.
