子宫内膜癌组织中AIB1及Bcl-2蛋白的表达
2018-06-06王爱红庞秋霞成延萍赵菊梅魏晓丽
王爱红,刁 柯,庞秋霞*,成延萍,赵菊梅,魏晓丽
(1延安大学医学院医学实验中心,延安 716000;2延安市肿瘤防治研究重点实验室;3延安大学医学院;*通讯作者,E-mail:qiuxia-pang@sohu.com)
1 材料与方法
1.1 标本收集
收集2014-01~2017-07延安市人民医院及延安大学附属医院病理科临床资料完整的子宫内膜癌石蜡包埋组织36例,患者年龄21-79岁,平均(52.14±8.9)岁。其中病理分期:Ⅰ期10例,Ⅱ期14例,Ⅲ期8例,Ⅳ4例;组织学类型:腺癌29例,腺鳞癌7例;组织学分级:高分化15例,中分化13例,低分化8例。所有肿瘤患者术前均未接受过放疗、化疗或性激素治疗,同时选取同期因其他原因行子宫切除的正常子宫内膜组织15例作为对照组,年龄25-66岁,平均年龄(46.3±9.5)岁。作为阳性对照的2例乳腺癌石蜡包埋标本,来自延安大学附属医院病理科,均为浸润性导管癌Ⅲ级。
1.2 主要试剂
鼠抗人AIB1单克隆抗体[7]工作浓度1 ∶50;Bcl-2单克隆抗体工作浓度为1 ∶100,均购自北京中杉金桥生物技术有限公司。
1.3 免疫组化检测
将组织切片经二甲苯脱蜡,梯度乙醇脱水;在室温下孵育10 min,电炉煮沸法修复抗原,以PBS冲洗,加3%BSA封闭,室温条件下放置10 min;滴加相应一抗,4 ℃冰箱孵育过夜,PBS冲洗;滴加第二抗原,室温条件下孵育30 min,后用PBS冲洗;DAB显色,冲洗,苏木素对比染色,梯度酒精脱水、二甲苯透明、中性树胶封片。
1.4 结果判定
细胞核或细胞质出现棕黄色颗粒即判断为阳性细胞,无显色则为阴性结果。采用Sinicrope改良法以阳性信号所占的面积比例分级,<5%为(-),5%-25%为(+),25%-50%为(++),>50%为(+++)。
1.5 统计学分析
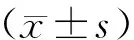
2 结果
2.1 AIB1蛋白和Bcl-2蛋白在正常子宫内膜及子宫内膜癌组织中的表达
子宫内膜癌患者和正常子宫内膜组织患者的年龄差异没有统计学意义(P>0.05)。免疫组化结果显示,AIB1、Bcl-2蛋白在子宫内膜癌的表达明显增加,可见细胞核或细胞质棕黄色颗粒明显增多(见图1、2)。15例正常子宫内膜组织中,2例增生期子宫内膜AIB1蛋白表达阳性,阳性率13.3%;36例子宫内膜癌中,17例AIB1表达阳性,阳性率47.2%,二者之间差异有统计学意义(χ2=5.20,P<0.05)。子宫内膜癌中Bcl-2蛋白的阳性表达率高于正常子宫内膜组织,差异有统计学意义(χ2=15.31,P<0.05,见表1)。
2.2 AIB1蛋白及Bcl-2蛋白表达与子宫内膜癌临床病理因素的关系
临床Ⅲ-Ⅳ期病例中AIB1的阳性表达率明显高于Ⅰ-Ⅱ期病例,差异具有统计学意义(χ2=5.57,P<0.05)。淋巴结转移组中AIB1的表达高于阴性组,差异具有统计学意义(χ2=5.71,P<0.05)。未发现不同肿瘤直径、组织学分级、病理类型、ER表达、PR表达间AIB1蛋白表达存在差异(均P>0.05)。腺癌组织Bcl-2蛋白的阳性率高于腺鳞癌组织,差异有统计学意义(P<0.05),未发现其他临床特征组别间的Bcl-2蛋白阳性率存在显著性差异(均P>0.05)。
表1AIB1、Bcl-2在子宫内膜癌及正常子宫内膜组织中的表达例(%)
Table1ExpressionofAIB1andBcl-2innormalendometriumandendometrialcarcinomacases(%)

组别nAIB1阳性Bcl-2阳性子宫内膜癌 3617(47.2)30(83.3)正常子宫内膜152(13.3)4(26.7)
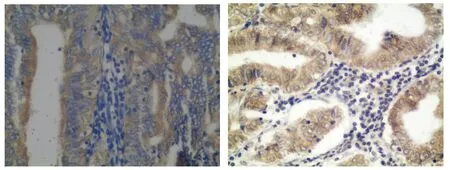
A. AIB1蛋白 B.Bcl-2蛋白图1 AIB1和Bcl-2在子宫内膜癌组织的阳性表达(SP法,×100)Figure 1 Positive expression of AIB1 and Bcl-2 in endometrial carcinoma tissues(SP,×100)
2.3 AIB1和Bcl-2相关性分析
经Spearman等级相关分析,子宫内膜癌中AIB1蛋白与Bcl-2蛋白的表达成正相关(r=0.303,P<0.05,见表3)。
3 讨论
AIB1属于p160家族,是一种多功能蛋白,已在乳腺癌、卵巢癌、宫颈癌等多种肿瘤中被检测到,证实了它和肿瘤的发生、发展、转移有关[8-11]。另有学者认为AIB1是索拉非尼、藤黄酸等药物抗肿瘤治疗的重要靶标,和肿瘤激素治疗的敏感性有关[12-15]。Balmer等[16]发现AIB1高表达使ER的作用增强,导致子宫内膜增生,促进肿瘤的发生。此外,AIB1的表达量和子宫内膜癌的预后不良相关,有可能影响激素治疗的敏感性。本研究结果显示,子宫内膜癌组织中AIB1表达高于对照子宫内膜组织,且AIB1表达阳性率和与淋巴结转移、临床分期相关,就印证了这一点。
表2子宫内膜癌中AIB1蛋白和Bcl-2蛋白表达的临床病理意义
Table2TherelationshipbetweentheexpressionofAIB1protein,Bcl-2proteinandclinicopathologicalfeaturesinendometrialcarcinoma

组别nAIB1Bcl-2阳性(例)阳性率(%)χ2P阳性(例)阳性率(%)χ2P 肿瘤直径0.1110.946-1.000 <2 cm9444.4888.9 2-5 cm18950.01583.3 >5 cm9444.4777.7 病理类型0.0660.7974.2910.038 腺癌291448.32689.7 腺鳞癌7342.9457.1 临床分期5.5720.0180.9000.343 Ⅰ-Ⅱ期24830.02187.5 Ⅲ-Ⅳ期12975.0975.0 组织学分级4.2610.119-1.000 Ⅰ级151066.71280.0 Ⅱ级13538.51184.6 Ⅲ级8225.0787.5 淋巴结转移5.7070.0170.3600.549 无16425.01487.5 有201365.01675.0 ER表达3.1840.0741.6590.198 阴性281139.32382.1 阳性8675.0887.5 PR表达1.7120.191-0.643 阴性251040.02080.0 阳性11763.61090.9
表3AIB1与Bcl-2在子宫内膜癌表达的相关性分析
Table3CorrelationbetweenAIB1andBcl-2expressioninendometrialcarcinoma
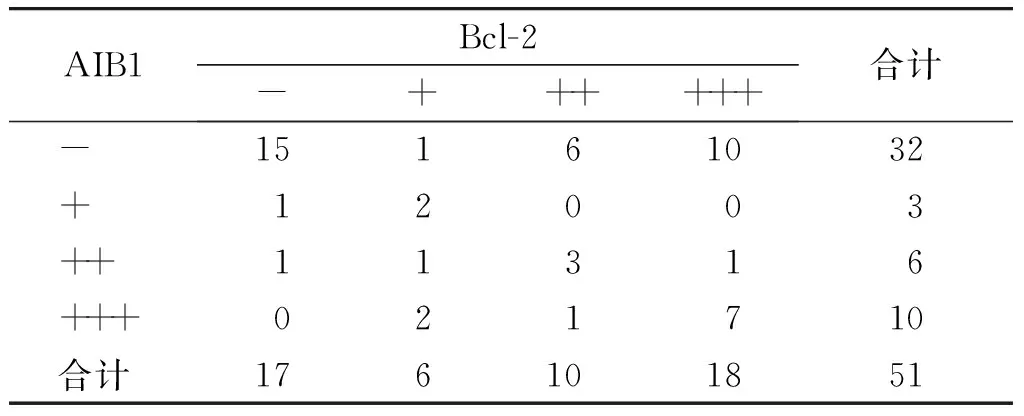
AIB1Bcl-2-++++++合计 -15161032 +12003 ++11316 +++021710 合计176101851
有研究认为,AIB1通过ErbB和Wnt/β-catenin通路促进癌症细胞增殖、生存和浸润[17]。对于雌激素敏感的肿瘤,如乳腺癌、子宫内膜癌、卵巢癌,ER途径在癌变过程中发挥重要作用[18,19]。张丽芳等[20]研究发现,子宫内膜癌组织中AIB1蛋白阳性表达率显著高于不典型增生内膜和正常子宫内膜组织,ER阳性子宫内膜癌组织中AIB1蛋白表达明显高于ER阴性组织,这与本研究的发现一致。
组织病理学研究发现,Bcl-2在子宫内膜非典型增生阶段表达较高,而在腺癌阶段表达率逐渐降低,表明在细胞异常增殖的早期即有Bcl-2基因机制的参与[21]。研究表明,玉米烯酮可通过Bcl-2家族和激酶依赖信号通路诱导子宫内膜间质细胞明显凋亡[22]。还有学者证明子宫内膜腺体表皮的孕激素受体和Bcl-2蛋白表达增高,形成促进凋亡和抑制凋亡的平衡,是引起绝经后子宫内膜萎缩的重要原因[23]。另有学者证实,沉默AIB1可以下调Bcl-2,Bcl-6和cyclin D3的表达,抑制B细胞非霍金淋巴瘤的发展[24]。某种程度上说明了AIB1和Bcl-2的相关性。
本文发现了AIB1和Bcl-2在子宫内膜组织中表达的相关性,两者或许协同作用促使子宫内膜癌的发生、发展,具体机制有待进一步研究。有学者报道肿瘤的抗孕激素治疗的内在机制是通过提高SMRT/AIB1平衡,进一步调控CCND1(cyclin D1)和MYC启动子的活性,选择性抑制孕激素受体A过表达[25]。另有研究发现,Bcl-2/Bax凋亡通路在雌激素诱导的子宫内膜增生中发挥重要作用[26]。此外,AIB1作为雌激素受体共活化物,与子宫内膜的不同生理周期有明显的关系。下一步,我们将增加样本量进一步证实AIB1蛋白表达与子宫内膜癌疗效、预后的关系,或开展相关的基础研究,以期明确AIB1是否可作为子宫内膜癌的潜在治疗靶点[27]。
参考文献:
[1] Song X, Zhang C, Zhao M,etal. Steroid receptor coactivator-3 (SRC-3/AIB1) as a novel therapeutic target in triple negative breast cancer and its inhibition with a phospho-bufalin prodrug[J].PLoS One, 2015,10(10):e0140011.
[2] Li L, Wei P, Zhang MH,etal.Roles of the AIB1 protein in the proliferation and transformation of human esophageal squamous cell carcinoma[J]. Genet Mol Res, 2015,14(3):10376-10383.
[3] Chen L, Wang C, Zhang X,etal. AIB1 genomic amplification predicts poor clinical outcomes in female glioma patients[J].J Cancer, 2016,7(14):2052-2060.
[4] Zhou BF, Wei JH, Chen ZH,etal. Identification and validation of AIB1 and EIF5A2 for noninvasive detection of bladder cancer in urine samples[J].Oncotarget, 2016,7(27):41703-41714.
[5] Bozkurt KK, Yalçn Y,E,etal.The role of immunohistochemical adrenomedullin and Bcl-2 expression in development of type-1 endometrial adenocarcinoma: Adrenomedullin expression in endometrium[J].Pathol Res Pract, 2016,212(5):450-455.
[6] 马艳霞,郭政.去甲肾上腺素对原代培养大鼠心肌细胞的凋亡率及相关蛋白的影响[J].山西医科大学学报,2017,48(12):1213-1217.
[7] 庞秋霞,彭晓东,郄明容,等.抗AIB1-N单克隆抗体的制备及鉴定[J].四川大学学报(医学版),2006,37(2):278-280.
[8] Mo P, Zhou Q, Guan L,etal.Amplified in breast cancer 1 promotes colorectal cancer progression through enhancing notch signaling[J].Oncogene,2015,34(30):3935-3945.
[9] Shi J, Liu W, Sui F,etal.Frequent amplification of AIB1, a critical oncogene modulating major signaling pathways, is associated with poor survival in gastric cancer[J]. Oncotarget, 2015,6(16):14344-14359.
[10] 曾会会,郑荣生,陶翠云.AIB1与上皮间质转化相关蛋白在浸润性乳腺癌中的表达及其相关性[J].临床肿瘤学杂志,2015,20(3):222-227.
[11] Han G, Xie S, Fang H,etal.The AIB1 gene polyglutamine repeat length polymorphism contributes to risk of epithelial ovarian cancer risk: a case-control study[J].Tumour Biol, 2015,36(1):371-374.
[12] 王逢会,庞秋霞,郭贤利,等.宫颈癌中AIB1蛋白的表达及其临床意义研究[J].延安大学学报(医学科学版),2017,15(3):5-6.
[13] Majaz S, Tong Z, Peng K,etal.Histone acetyl transferase GCN5 promotes human hepatocellular carcinoma progression by enhancing AIB1 expression[J].Cell Biosci,2016,6:47:1-13.
[14] Li M, Wang W, Dan Y,etal.Downregulation of amplified in breast cancer 1 contributes to the anti-tumor effects of sorafenib on human hepatocellular carcinoma[J].Oncotarget, 2016,7(20):29605-29619.
[15] Alkner S, Bendahl PO, Ehinger A,etal.Prior adjuvant tamoxifen treatment in breast cancer is linked to increased AIB1 and HER2 expression in metachronous contralateral breast cancer[J].PLoS One, 2016,11(3):e0150977.
[16] Balmer NN, Richer JK, Spoelstra NS,etal.Steroid receptor coactivator AIB1 in endometrial carcinoma, hyperplasia and normal endometrium: correlation with clinicopathologic parameters and biomarkers[J].Mod Pathol, 2006,19(12):1593-1605.
[17] You D, Zhao H, Wang Y,etal.Acetylation enhances the promoting role of AIB1 in breast cancer cell proliferation[J].Mol Cells, 2016,39(9):663-668.
[18] Wu RC,Qin J,Yi P,etal.Selective phosphorylations of the SRC-3/AIB1 coactivator integrate genomic reponses to multiple cellular signaling pathways[J].Mol Cell,2004,15(6):937-949.
[19] 王琴,李燕,唐利,等.子宫腺肌病患者子宫内膜组织中ER、PR、SRC-3表达变化及意义[J].山东医药,2015,55(24):37-39.
[20] 张丽芳,郭新华.子宫内膜癌组织核受体共激活因子SRC-1和SRC-3表达及意义[J].齐鲁医学杂志,2010,25(2):95-98.
[21] Wang Y, Jiang LL, Wu JF,etal.Protective effect of Honokiol against endometriosis in rats via attenuating Survivin and Bcl-2: A mechanistic study[J].Cell Mol Biol(Noisy-le-grand),2016,11;62(1):1-5.
[22] Hu J, Xu M, Dai Y,etal. Exploration of Bcl-2 family and caspases-dependent apoptotic signaling pathway in Zearalenone-treated mouse endometrial stromal cells[J].Biochem Biophys Res Commun,2016,476(4):553-559.
[23] Reis BF, Lima SM, Silva GM,etal. Effects of low dose of tibolone on steroid receptors and Bcl-2 on the postmenopausal endometrium[J]. Histol Histopathol,2016,31(6):629-634.
[24] Zhao Z, Zhang X, Wen L,etal. Steroid receptor coactivator-3 is a pivotal target of gambogic acid in B-cell Non-Hodgkin lymphoma and an inducer of histone H3 deacetylation[J].Eur J Pharmacol, 2016,789:46-59.
[25] Wargon V, Riggio M, Giulianelli S,etal.Progestin and antiprogestin responsiveness in breast cancer is driven by the PRA/PRB ratio via AIB1 or SMRT recruitment to the CCND1 and MYC promoters[J].Int J Cancer, 2015,136(11):2680-2692.
[26] Sahin E, Eraslan Sahin M, Dolanbay M,etal.Induction of apoptosis by metformin and progesterone in estrogen-induced endometrial hyperplasia in rats: involvement of the bcl-2 family proteins[J].Gynecol Endocrinol, 2017, 27:1-4.
[27] Song X, Chen J, Zhao M,etal. Development of potent small-molecule inhibitors to drug the undruggable steroid receptor coactivator-3[J].Proc Natl Acad Sci U S A, 2016,113(18):4970-4975.
