非阻塞性无精症患者血清miRNA表达谱分析研究*
2018-06-05赵文忠罗招凡傅文婷吴瑞珊
赵文忠,罗招凡,傅文婷,吴瑞珊,钟 安,周 雨
(1.广东省计划生育科学技术研究所国家卫计委男性生殖与遗传重点实验室,广州510600; 2.中山大学附属第七医院检验科,广东深圳 518017)
全世界约15%的育龄夫妇存在不育问题,其中男性因素导致的不育约占50%[1]。非阻塞性无精症是最常见的男性不育症类型,成年男性发病率约为 1%。在各种影响男性不育的因素中,遗传因素是导致不育的重要原因,有15%~30%的男性不育症是由遗传性因素引起的。目前研究较多的包括染色体异常、Y染色体微缺失及不育相关基因的突变和遗传多态性[2]。表观遗传学是研究DNA序列未发生变化但表型却发生可遗传改变的一门学科,其主要包括DNA甲基化、组蛋白修饰、非编码RNA调控等几个方面,表观遗传修饰在精子发生及受精过程中都起着非常重要的作用[3]。miRNA是一类可调节基因表达、调节生长发育、维持机体正常生理功能的重要非编码RNA。越来越多的研究表明, miRNA对于正常精子发生是必要的[4]。在本研究中,笔者选用 miRNA 表达谱的寡核苷酸芯片,利用其快速、平行、高通量的检测特点,对比分析了非阻塞性无精症患者和正常捐精者血清 miRNA 的表达水平,为进一步研究 miRNA 在非阻塞性无精症中的作用机制提供了坚实的基础。
1 资料与方法
1.1一般资料 非阻塞性无精症患者血清样品来源于广东省计划生育专科医院,经男科确诊为非阻塞性无精症患者;对照组为广东省人类精子库捐精且符合供精条件的健康男性血清标本。非阻塞性无精症诊断标准为在排除输精管道梗阻因素外,精液常规分析两次未发现精子的无精症。标本采集前经广东省计划生育专科伦理委员会同意,患者知情同意后进行。
1.2试剂 总RNA提取试剂为ThermoFisher公司的TRIzol;RNA纯化试剂为QIAGEN公司的miRNeasy mini kit;miRNA标记试剂为Exiqon公司的miRCURYTM Array Power Labeling kit;miRNA 表达谱的寡核苷酸芯片为Exiqon公司的miRCURYTM Array。
1.3方法
1.3.1血清采集 采集2 mL空腹外周血置于无抗凝剂试管中,室温放置30~60 min,使血液凝固,将上层血清小心转移到收集管中,置-80 ℃保存备用。
1.3.2RNA提取 取2例非阻塞性无精症患者血清和2例正常捐精者血清,采用试剂TRIzol提取血清总RNA,按照试剂miRNeasy mini kit说明书纯化RNA。然后,采用分光光度计NanoDrop ND-1000 检测RNA的量和纯度。
1.3.3miRNA标记 采用Exiqon公司的miRCURYTM Array PowerLabeling kit,按照操作说明书进行标记。
1.3.4miRNA芯片杂交 采用 miRCURYTM Array (16.0)试剂盒进行杂交, 于56 ℃杂交16~20 h,芯片在室温条件下晾干,分别用不同的缓冲液清洗2 min,1 000 r/min离心5 min ,待芯片干燥后立即扫描。
1.3.5miRNA芯片图像采集和分析 采用Axon GenePix 4000B microarray scanner扫描,GenePix proV6.0处理原始图像。用原始信号值减去该点的前景值得到每个探针的修正值,选取本次实验中在芯片修正值均大于或等于50的非对照探针,将这部分探针的修正值统计处理后,取其中值作为基准,对整张芯片的点做标准化处理。以Fold change不低于1.5,P值不低于0.05的标准来筛选差异表达的miRNA,并进行聚类分析。
1.3.6实时定量PCR验证 根据miRNA 微阵列芯片结果,选取5个Fold change较高的miRNA,采用 Mir-XTMmiRNA qRT-PCR SYBR®Kit进行实时定量PCR验证。取1.3.2提取RNA 2 μg,采用Mir-X miRNA First-Strand Synthesis Kit进行逆转录,逆转录引物为5′-GCT GTC AAC GAT ACG CTA CGT AAC GGC ATG ACA GTG-3′;以5S rRNA为内参基因。 其他按照试剂盒说明进行。本试验所采用的上游引物hsa-miR-483-3p:5′-ACT CCT CTC CTC CCG TCT T-3′;hsa-miR-194-3p:5′-AGT GGG GCT GCT GTT ATC TG-3′;hsa-miR-4275:5′-GCC CCA ATT ACC ACT TCT TTA-3′;hsa-miR-221-5p:5′-ACC TGG CAT ACA ATG TAG ATT T-3′;hsa-miR-1263:5′-TAC CCT GGC ATA CTG AGT AAA-3′;5S rRNA:5′-GTC TAC GGC CAT ACC ACC CTG AAC-3′。下游引物采用试剂盒中的3′引物:5′-GCT GTC AAC GAT ACG CTA CGT AA-3′。反应在96孔STEPONEPLUS(美国ABI)荧光PCR仪上进行扩增,每组设3个复孔。反应条件为:94 ℃预变性 10 s;94 ℃ 20 s,60 ℃ 20 s,共40个循环。反应结束由计算机自动计算得到各反应管循环阈值(threshold cycle,Ct),采用2-ΔΔCt法对基因表达进行相对定量分析。
1.3.7靶基因预测 采用3种在线软件 (miRBase Targets、TargetScan、DIANA-microT)对相应的 miRNA靶基因进行预测。
2 结 果
2.1RNA纯度与质量 分离的血清RNAOD260/280>1.7,质量大于10 ng,符合芯片分析的要求,纯度与质量分析见表1。

表1 NanoDrop ND-1000测定RNA质量
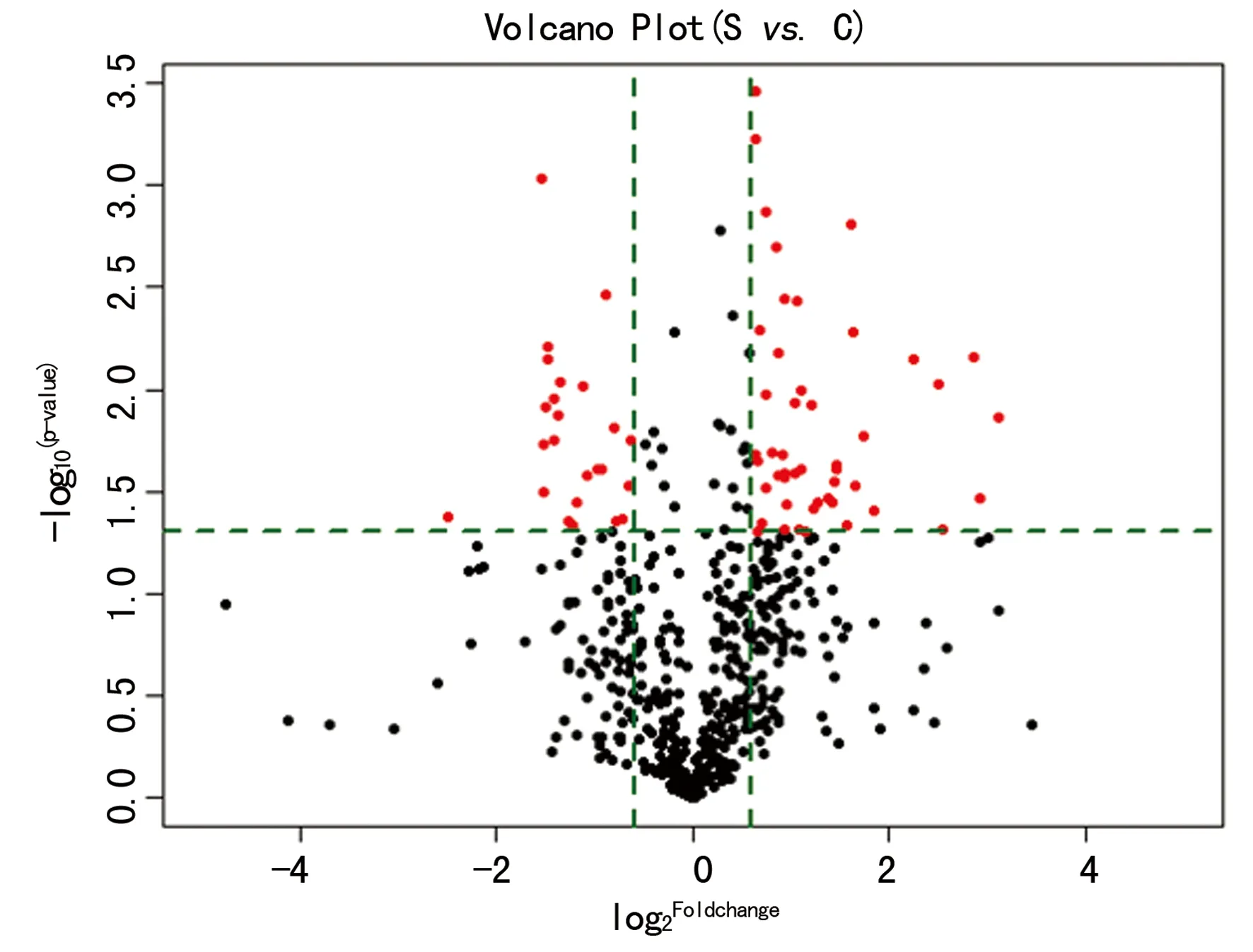
图1 非阻塞性无精症患者和正常捐精者
2.2非阻塞性无精症患者和正常捐精者血清中差异表达的miRNA 非阻塞性无精症患者和正常捐精者血清miRNAs表达微阵列经扫描和数据分析,共筛选出71个差异表达的miRNAs(图1、2),包括47个表达上调的 miRNAs和24个表达下调的 miRNAs,见表3、4。
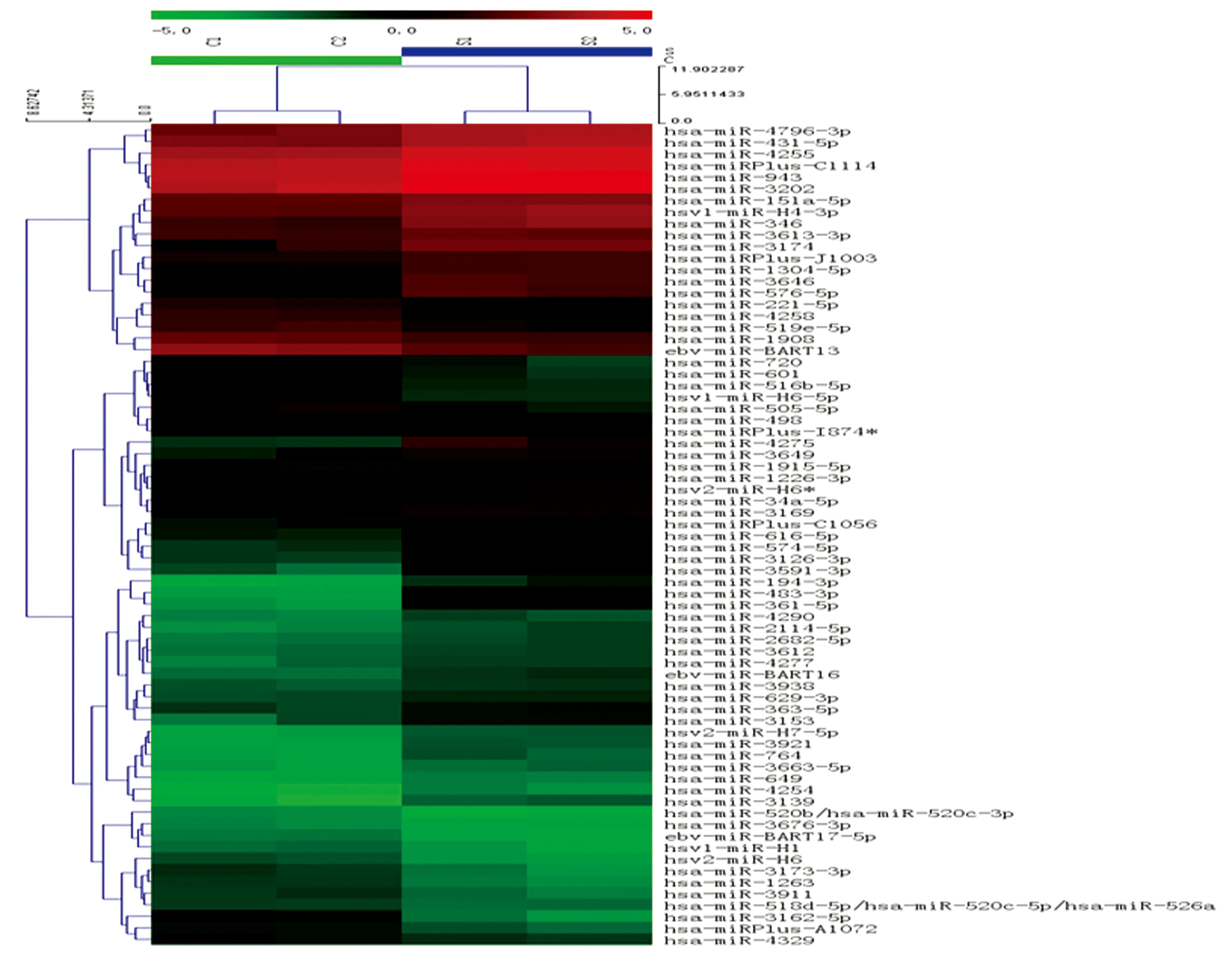
图2 非阻塞性无精症患者和正常捐精者血清中miRNA 表达谱聚类分析结果
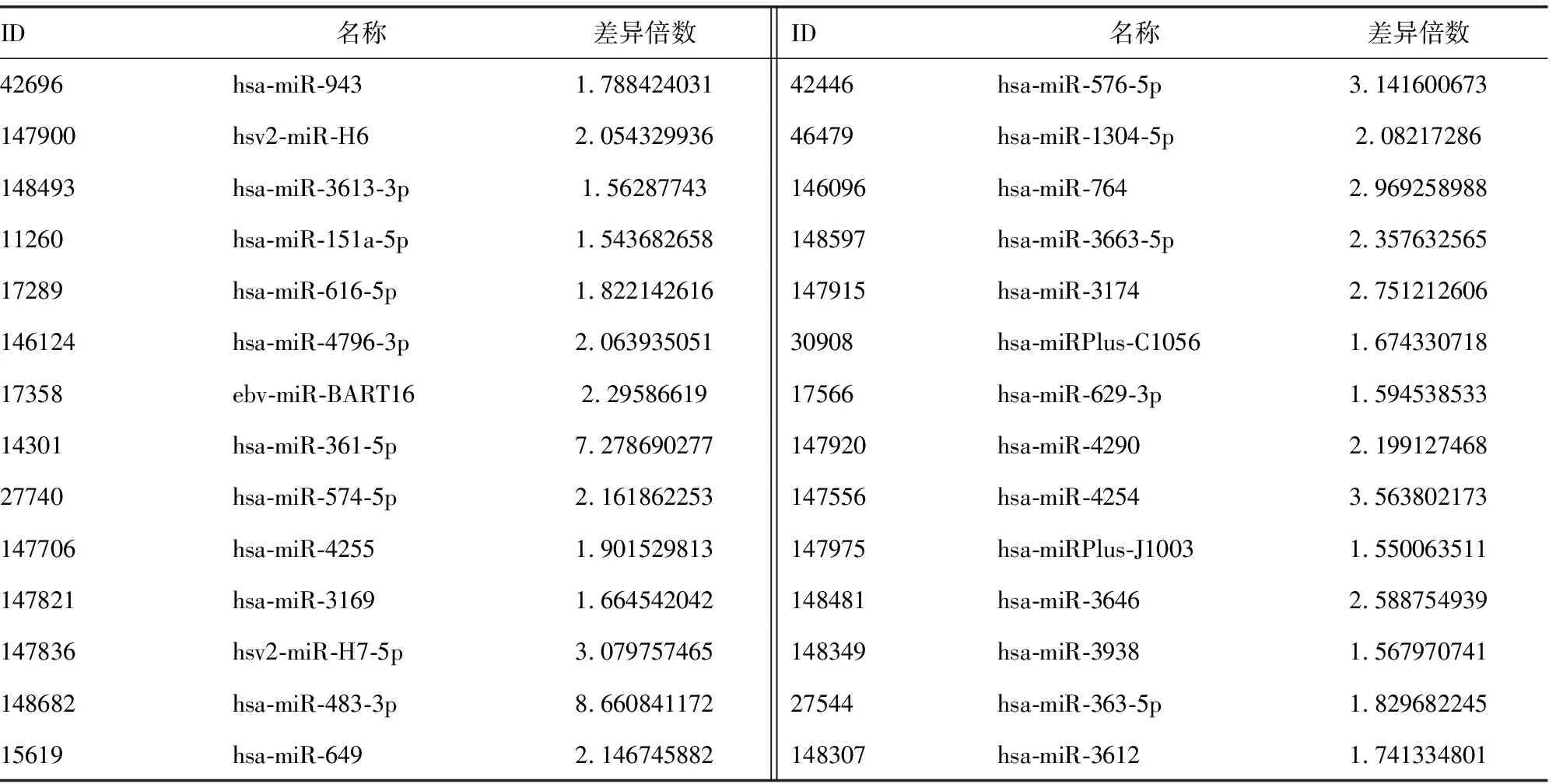
ID名称差异倍数ID名称差异倍数42696hsa-miR-9431.78842403142446hsa-miR-576-5p3.141600673147900hsv2-miR-H62.05432993646479hsa-miR-1304-5p2.08217286148493hsa-miR-3613-3p1.56287743146096hsa-miR-7642.96925898811260hsa-miR-151a-5p1.543682658148597hsa-miR-3663-5p2.35763256517289hsa-miR-616-5p1.822142616147915hsa-miR-31742.751212606146124hsa-miR-4796-3p2.06393505130908hsa-miRPlus-C10561.67433071817358ebv-miR-BART162.2958661917566hsa-miR-629-3p1.59453853314301hsa-miR-361-5p7.278690277147920hsa-miR-42902.19912746827740hsa-miR-574-5p2.161862253147556hsa-miR-42543.563802173147706hsa-miR-42551.901529813147975hsa-miRPlus-J10031.550063511147821hsa-miR-31691.664542042148481hsa-miR-36462.588754939147836hsv2-miR-H7-5p3.079757465148349hsa-miR-39381.567970741148682hsa-miR-483-3p8.66084117227544hsa-miR-363-5p1.82968224515619hsa-miR-6492.146745882148307hsa-miR-36121.741334801

续表3 上调的 miRNAs
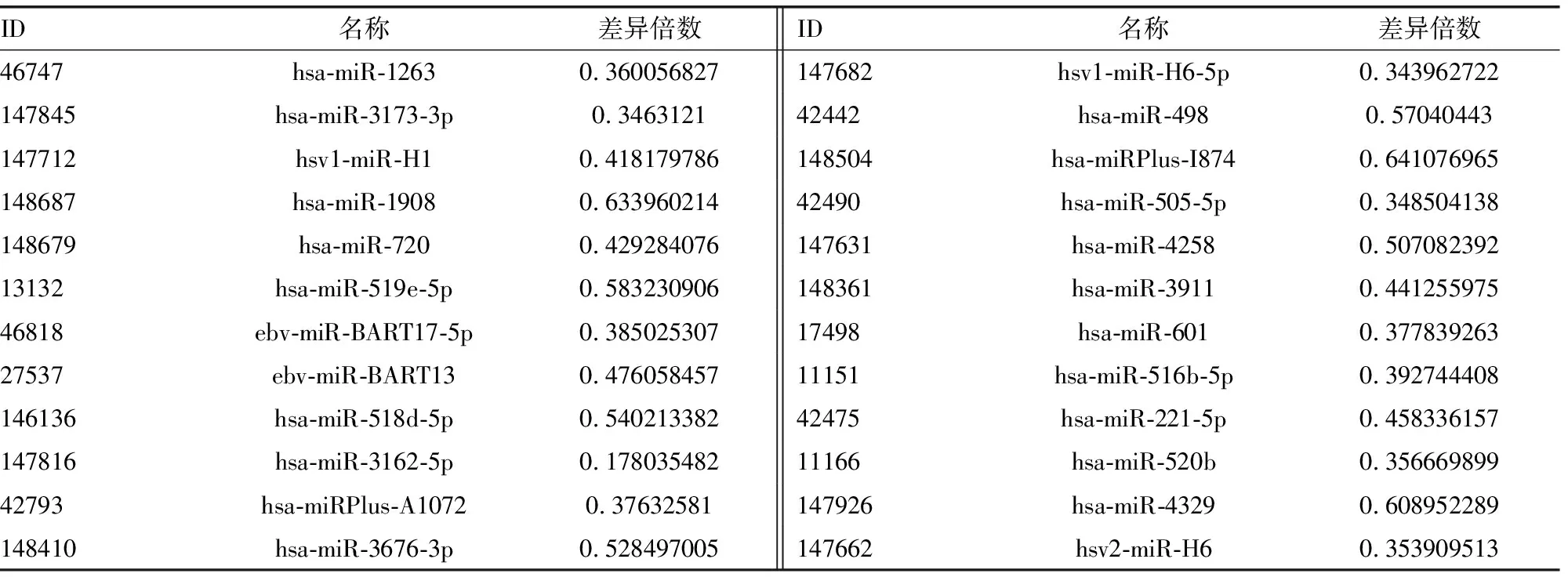
表4 下调的 miRNAs
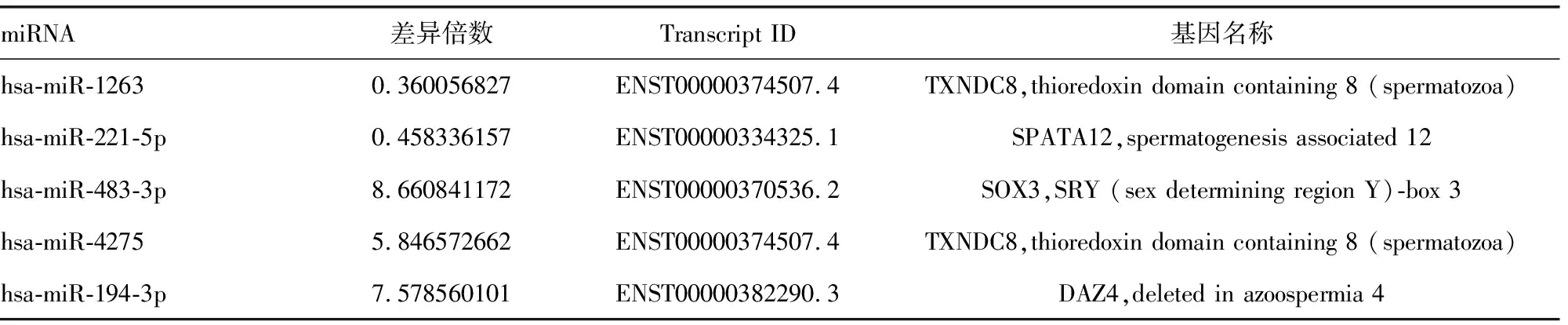
表5 受miRN调节的潜在靶基因
2.3差异表达miRNA的实时定量PCR验证结果 将芯片结果与实时定量PCR结果进行比较,结果显示在非阻塞性无精症患者和正常捐精者血清中 hsa-miR-483-3p、hsa-miR-194-3p、hsa-miR-4275表达增加,而hsa-miR-221-5p、hsa-miR-1263 表达降低,芯片与实时定量PCR检测到的差异miRNA表达一致,说明本研究芯片结果真实可靠,见图3。
2.4靶基因预测结果 采用3种在线软件(miRBase Targets、TargetScan、DIANA-microT)对相应的miRNA靶基因进行预测,可能的靶基因均与生精功能有关,见表5。

图3 定量 RQ-PCR 与芯片杂交结果比较
3 讨 论
miRNA广泛存在于各条染色体中,这些miRNA虽然只占人类基因总数的2%,却调控着人类全基因组中30%以上基因的表达。在哺乳动物细胞中,大多数miRNA是由基因间DNA序列编码,也有部分miRNA是由位于基因内含子的DNA序列编码。每个miRNA可能有多个靶基因,而多个miRNAs可调节同一个基因[5]。目前在人类细胞发现的miRNA共有上千种,人体内不同器官组织都具有各自独特的miRNA表达谱,miRNA在血液和尿液等体液中稳定存在,并与组织中的 miRNA相关,分析 miRNA在血液中的表达,能够了解机体组织状况,血清miRNA的表达改变能预示疾病的产生和转归[6]。在本研究中,采用miRCURYTM Array (v16.0)表达谱芯片,分析非阻塞性无精症患者和正常捐精者血清miRNAs,共筛选出71个差异表达的 miRNAs,包括 47个表达上调的miRNAs和24个表达下调的miRNAs。目前尚无法预知这些表达差异的miRNA中,哪些对精子生成有影响。在后续实验中,笔者将在增加样本量的基础上,进一步检测睾丸组织的miRNA表达,阐明这些miRNA在精子生成的作用和功能。
已有研究表明,miRNAs广泛参与精子发生的过程[4]。 BJORK等[7]研究表明,miR-18a可直接作用于热休克因子2(heat shock factor 2,HSF2),来控制精子发生过程中必需的基因的表达。LIAN等[8]研究显示,miR-383通过pRb信号通路使IRF1转录增强,导致精子生成受阻。LIU等[9]研究表明,miR-122可以通过调节TNP2的表达,从而影响精子正常形态的发育。MORITOKI等[10]发现MiR-135a有助于维持精原干细胞。YUAN等[11]研究表明,两个功能相关的miR-34b/c和miR-449a/b/c簇对于精子发生是必须的。笔者通过在线分析软件发现,差异性表达的miRNA 的潜在靶基因都与精子生成有关。hsa-miR-1263与精子特异的硫氧还蛋白域有关,hsa-miR-194-3p与DAZ基因有关,hsa-miR-221-5p与精子生成有关;hsa-miR-483-3p的潜在靶基因是SRY基因。
笔者分析了非阻塞性无精症患者和正常捐精者血清中 miRNA 表达,发现了多个存在显著差异性表达的 miRNA,并进行了初步验证及靶基因预测,为进一步研究 miRNA 与非阻塞性无精症发生、发展的关系提供了新的线索。
[1]THOMA M E,MCLAIN A C,LOUIS J F,et al.Prevalence of infertility in the united states as estimated by the current duration approach and a traditional constructed approach[J].Fertil Steril,2013,99(23):1324-1331.
[2]NETO F T,BACH P V,NAJARI B B,et al.Genetics of Male Infertility[J].Curr Urol Rep,2016,17(10):70.
[3]DADA R,KUMAR M,JESUDASAN R,et al.Epigenetics and its role in male infertility[J].J Assist Reprod Genet,2012,29(5):213-223.
[4]LUO L F,HOU C C,YANG W X.Small non-coding RNAs and their associated proteins in spermatogenesis[J].Gene,2015,578(2):141-157.
[5]KRUTOVSKIKH V A,HERCEG Z.Oncogenic microRNAs (OncomiRs) as a new class of cancer biomarkers[J].Bioessays,2010,32(10):894-904.
[6]刘芳腾,欧阳喜,张官平,等.循环miRNA在结直肠癌诊断中的应用价值[J].实用医学,2016,32(13):2241-2243.
[7]BJORK J K,SANDQVIST A,ELSING A N,et al.miR-18,a member of Oncomir-1,targets heat shock transcription factor 2 in spermatogenesis[J].Development,2010,137(35):3177-3184.
[8]LIAN J,TIAN H,LIU L,et al.Downregulation of microRNA-383 is associated with male infertility and promotes testicular embryonal carcinoma cell proliferation by targeting IRF1[J].Cell Death Dis,2010,1:94.
[9]LIU T,HUANG Y,LIU J,et al.MicroRNA-122 influences the development of sperm abnormalities from human induced pluripotent stem cells by regulating TNP2 expression[J].Stem Cells Dev,2013,22(12):1839-1850.
[10]MORITOKI Y,HAYASHI Y,MIZUNO F,et al.Expression proling of microRNA in cryptorchid testes:mir-135a contributes to the maintenance of spermatogonial stem cells by regulating FoxO1[J].J Urol,2014,191(21):1174-1180.
[11]YUAN S,TANG C,ZHANG Y,et al.mir-34b/c and mir-449a/b/c are required for spermatogenesis,but not for the frst cleavage division in mice[J].Biol Open,2015,4(5):212-223.
