低温胁迫下菊花叶片叶绿素荧光特性与抗氧化酶活性的变化
2018-06-05程祥飞聂林杰李永华
程祥飞,王 磊,聂林杰,李永华
(河南农业大学 林学院,河南 郑州 450002)
低温是影响园林植物观赏品质的重要环境因子。低温胁迫会导致植物光合器官受损,植物膜系统受到伤害、活性氧平衡被打破等。光合器官是植物对低温最敏感的部位之一,低温胁迫下植物光系统Ⅱ(PSⅡ)受损,光合电子传递受到抑制,光化学效率降低,产生过剩光能,破坏光合中心机构[1]。叶绿素荧光分析技术是近年来研究光合作用机制和探测光合生理状况的一种常用技术,已经应用于黄瓜[2](CucumissativusL.) 、方竹[3](Chimonobambusaquadrangularis)、辣椒[4](CapsicumannuumL.)等许多植物的胁迫鉴定中。低温条件下,活性氧(ROS)的产生不仅破坏植物膜系统结构,还影响植物光合系统功能,导致光抑制的产生[5]。植物的低温胁迫抗性与活性氧清除能力密切相关,低温胁迫下较高的抗氧化酶活性可起到保护PSⅡ的作用,在一定程度上减轻过剩光能引起的光抑制。
菊花为多年生草本花卉,在北方地区秋冬季节露地生产中经常会遭受低温胁迫,严重影响菊花产业的发展。目前在菊花抗寒性研究方面已有较多报道,郑路等[6]探讨了菊花营养特性与抗寒性的关系;许瑛等[7]比较了8个菊花品种的低温半致死温度及其抗寒性;王翠丽等[8]对9个菊花品种叶片脂肪酸组成及抗寒性进行评价,确定了9个菊花品种的半致死温度。有关低温胁迫下菊花叶绿素荧光动力学特征的研究报道较少。鉴于此,选用秋菊晚花品种金龙腾云为材料,通过不同时间的低温胁迫处理,探究秋菊叶绿素荧光特性及抗氧化酶活性对低温胁迫的响应,为菊花抗寒性生理研究提供理论基础。
1 材料和方法
1.1 材料
试验材料为秋菊晚花品种金龙腾云,由开封市园林菊花研究所提供。盆栽基质配方为V草炭∶V蛭石∶V珍珠岩=1∶1∶1。将生长健壮的菊花幼苗置于人工气候室中培养,温度(25±2)℃,空气湿度50%±5%,光照强度(36±3.6)μmol/(m2·s),光照时间为10 h/d,常规管理。待株高为(20±2)cm、叶片数为(13±1)时,将菊花植株进行低温处理。
1.2 试验设计
试验共设5个温度处理:16、8、4、-4、-8 ℃(16 ℃为菊花生长适宜温度,秋菊半致死温度在-8 ℃左右)。将材料分别置于不同温度条件下处理3、6、9、12 h,空气湿度为70%±5%,光照强度(36±3.6)μmol/(m2·s)。0 ℃以上处理的材料置于人工气候箱中,-4 ℃和-8 ℃处理的材料置于改装的冰柜(加装补光灯)中,以16 ℃为对照,重复3次。选取上数第4~5片健康的功能叶进行各项生理指标及叶绿素荧光参数的测定。
1.3 测定方法
1.3.1 生理指标的测定 叶绿素含量、可溶性糖含量、丙二醛(MDA)含量和抗氧化酶活性测定均参考李合生的方法[9]。
1.3.2 叶绿素荧光参数的测定 测定时选取每株受光相同、长势健康的叶片,用剪刀剪下,放入暗室中进行暗反应20 min。采用荧光成像仪FluorCam(Handy GFPCam FC 1000-H/GFP,Photon System Instuments,Czech)测定以下荧光参数:PSⅡ最大光能转换效率(Fv/Fm)、PSⅡ潜在活性(Fv/Fo)、光化学猝灭系数(qP)和非光化学猝灭系数(NPQ)。
1.4 数据处理
利用Microsoft Excel进行数据录入和作图,应用SPSS 22.0软件进行方差分析和相关性分析。
2 结果与分析
2.1 低温胁迫对菊花叶绿素含量和可溶性糖含量的影响
从表1可知,随着低温胁迫时间的延长,菊花叶片叶绿素a、叶绿素b、叶绿素a+b均呈现出下降的趋势,-4 ℃和-8 ℃低温处理下叶绿素含量的下降趋势更加明显。与对照组相比,低温下处理12 h 叶绿素a+b含量分别下降了14.6%、23.2%、45.7%和49.9%;8、4 ℃处理下,菊花叶片可溶性糖含量随处理时间的延长呈现上升的趋势,-4、-8 ℃处理下可溶性糖含量先升高后降低,处理9 h后达到峰值。与对照相比,低温下处理12 h菊花叶片可溶性糖含量分别增长16.5%、19.4%、19.7%和23.2%。
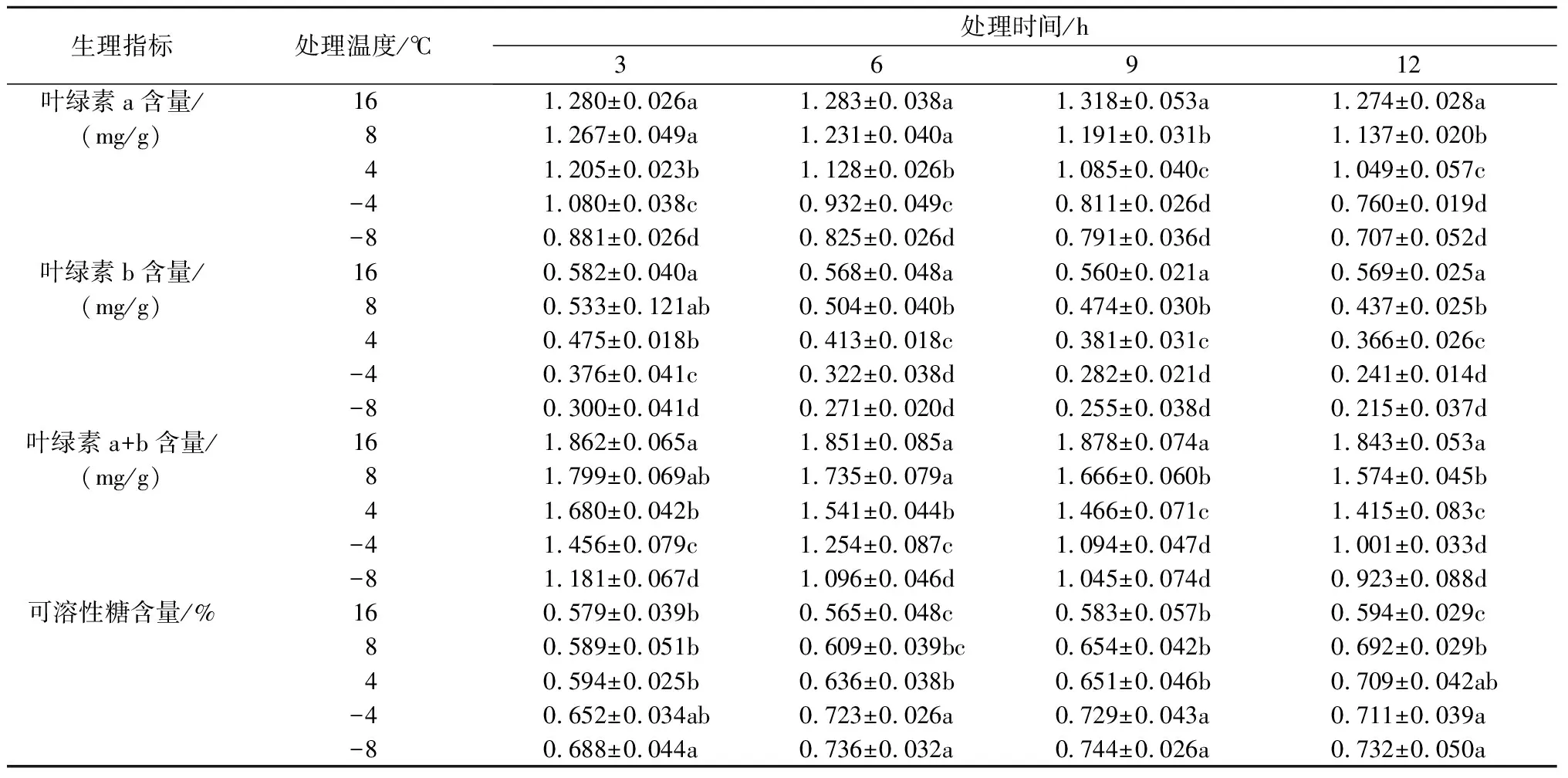
表1 低温胁迫对菊花叶片叶绿素含量和可溶性糖含量的影响
注:同列数据后不同小写字母表示处理间的差异显著(P<0.05)。
2.2 低温胁迫对菊花叶绿素荧光参数的影响
由图1可知,与对照组相比,菊花叶片Fv/Fm随处理温度降低呈现下降趋势,8 ℃和4 ℃处理组Fv/Fm值变化不明显,而-4 ℃和-8 ℃处理组Fv/Fm显著下降,处理12 h后降幅分别为17.9%和46.4%。同一时间下,-4 ℃和-8 ℃处理组降低幅度大,与对照差异显著。
Fv/Fo、qP的变化趋势与Fv/Fm相似,而NPQ则表现出不同的变化趋势。同一时间下,随着处理温度的降低,NPQ表现出先上升后下降的趋势,8 ℃处理组最高,随后明显下降。经过12 h处理,-8 ℃处理组NPQ几乎为零。随着处理时间的延长,-4 ℃和-8 ℃处理组NPQ呈显著下降趋势。
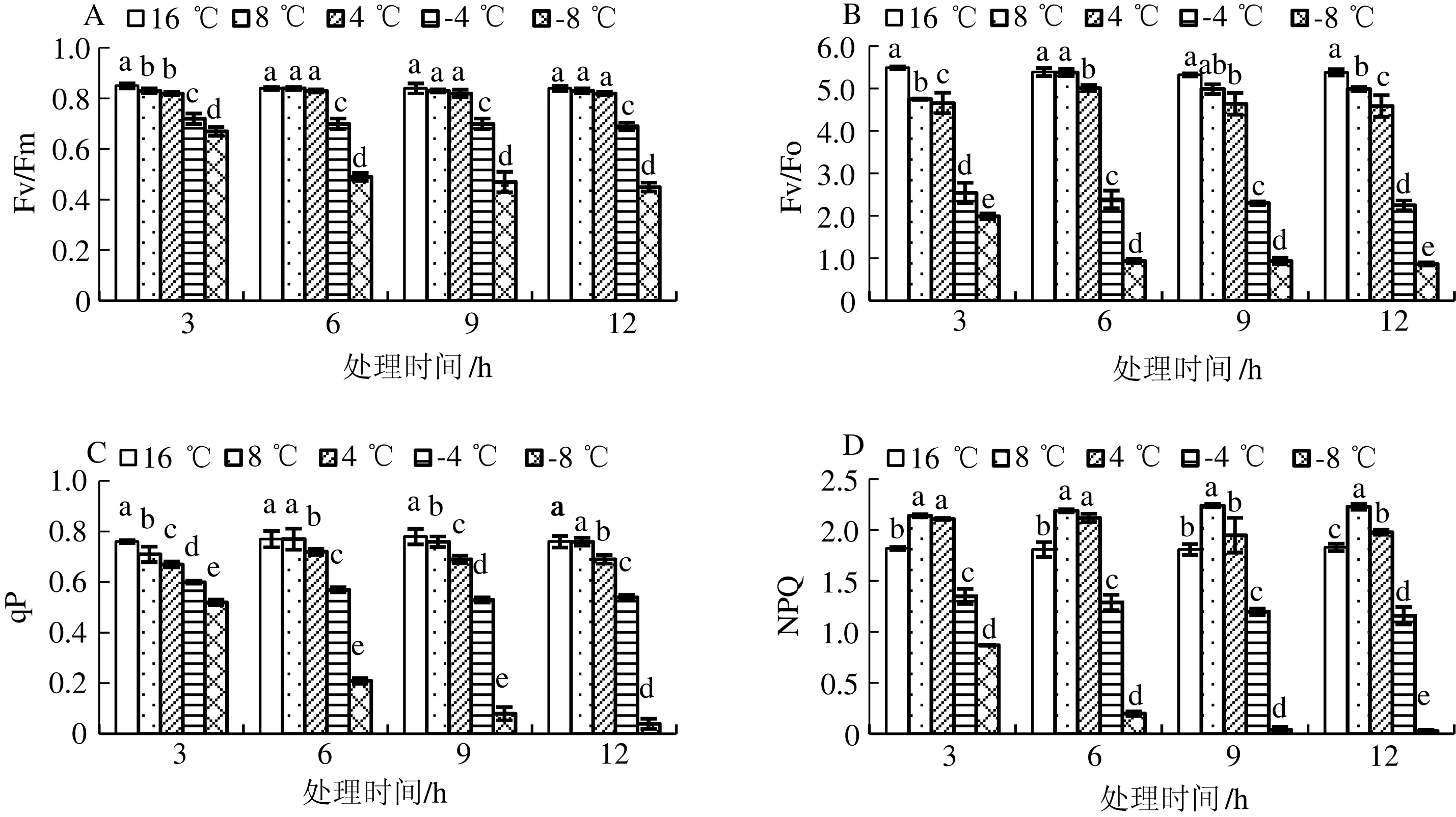
同一时间下不同小写字母表示处理间的差异显著(P<0.05),下图同
2.3 低温胁迫对菊花抗氧酶活性和MDA含量的影响
低温胁迫会影响菊花叶片SOD活性(图2A)。低温处理3 h菊花叶片SOD活性于对照组相比有显著升高;随着低温处理时间的延长,不同温度对SOD活性的影响出现差异。8 ℃和4 ℃处理组,菊花叶片抗氧化酶活性显著升高;而在-4 ℃和-8 ℃处理组,酶活性受抑制,处理12 h后酶活性低于对照组。POD活性与SOD活性的变化趋势相似,CAT活性则表现出不同的变化趋势。如图2C所示,8 ℃和4 ℃处理组处理12 h后,POD活性分别增长23.8%和33.8%,与对照相比差异显著。-4 ℃和-8 ℃处理组处理12 h后,POD活性分别下降17.7%和24.6%。8 ℃和4 ℃处理组处理3 h CAT活性略受抑制,随后活性逐渐上升;-4 ℃和-8 ℃处理组,CAT活性随处理时间的延长逐渐降低。由图2D所示,与对照相比,随着处理时间的延长菊花叶片MDA含量呈上升趋势。与16 ℃相比,8、4、-4、-8 ℃下处理12 h时,MDA含量分别增长11.9%、17.3%、54.2%和60.7%。
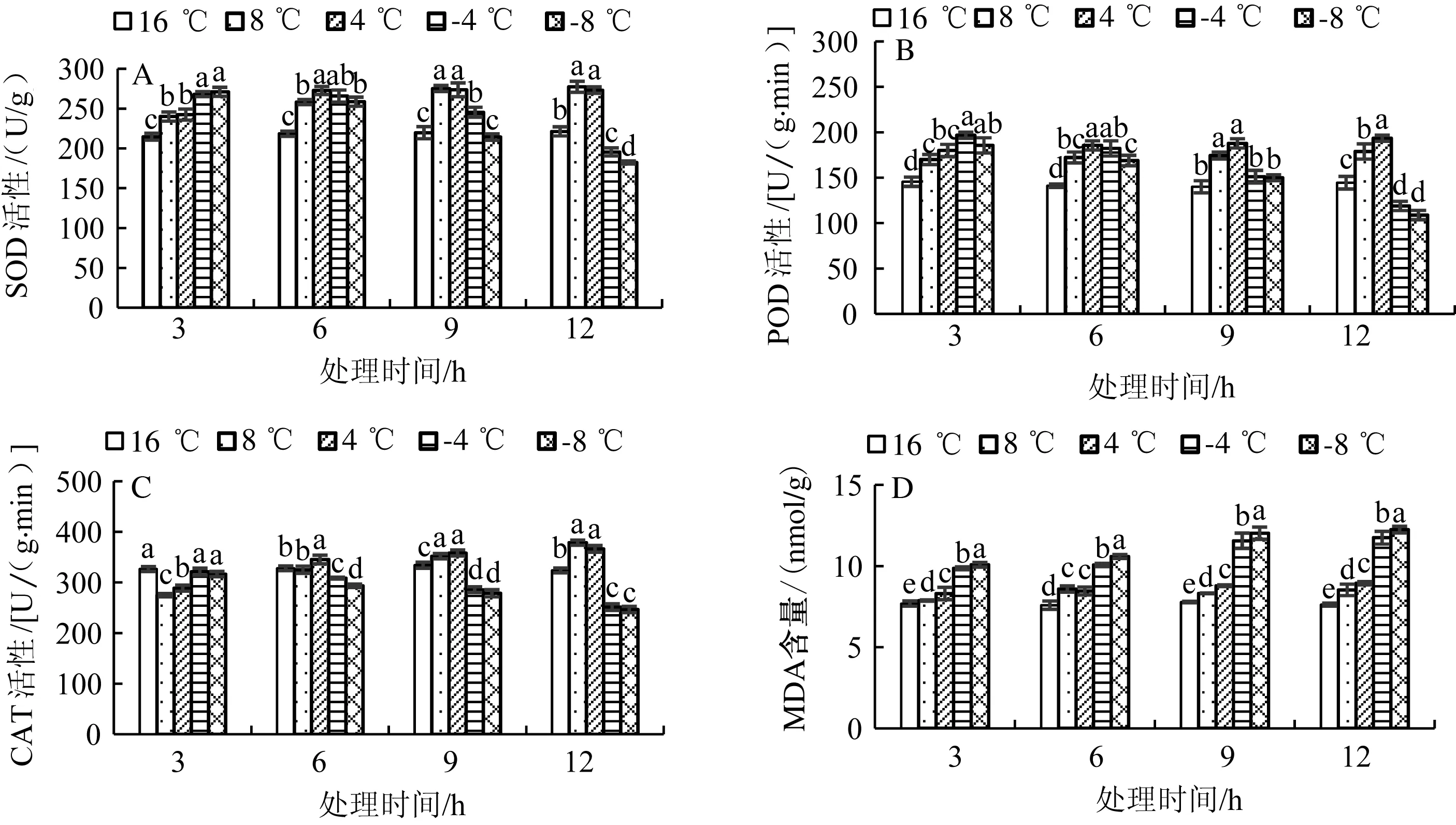
图2 低温胁迫对菊花抗氧化酶活性和MDA含量的影响
3 结论与讨论
叶绿素是植物进行光合作用时捕获光能的重要色素,逆境胁迫下叶绿素含量的高低是衡量植物抗逆性的重要指标[10]。本研究中菊花叶片叶绿素含量随着低温胁迫时间的延长呈现出降低的趋势,且随着温度的下降和处理时间的延长,叶绿素含量下降趋势更加明显。菊花叶绿素含量下降,捕获和利用光能能力下降,降低了光合机构遭受光破坏的风险,这可能利于菊花适应低温胁迫。可溶性糖是植物体重要的渗透调节物质,逆境胁迫下可溶性糖含量增加可以提高细胞液浓度,增强植物抵抗逆境的能力[11]。本试验中,在8、4 ℃胁迫下,菊花叶片可溶性糖含量随处理时间的延长呈现上升的趋势,而-4、-8 ℃胁迫下可溶性糖含量先升高,在处理9 h后呈现出降低的趋势,说明轻度低温胁迫下菊花可通过增加可溶性糖含量提高其抗寒性,而随着温度的下降,低温胁迫使可溶性糖合成受阻,甚至被水解而导致含量降低。PSⅡ活性的降低是植物光合作用降低的重要原因。通过对植物PSⅡ反应中心的荧光动力学测定,可深入细致地分析环境因子影响下植物叶片光合机构的变化。低温胁迫下方竹[3]、小麦[12]等叶片Fv/Fm、Fv/Fo和qP均呈现下降趋势,NPQ会增加。本试验中,8 ℃和4 ℃胁迫下处理3 h菊花叶片NPQ呈现出上升的趋势,短期低温胁迫下,菊花PSⅡ功能已受影响,菊花通过增加热耗散消耗过剩激发能,保护光合系统免受伤害。而-4、-8 ℃条件下Fv/Fm、Fv/Fo、qP和NPQ都表现出大幅度降低,-8 ℃处理12 h,qP、NPQ几乎为0,此时菊花叶片光合系统已受到严重的伤害,菊花几乎失去光合作用能力。
低温胁迫下植物体内产生大量的活性氧,破坏PSⅡ反应中心活性,对色素分子、蛋白质和类囊体膜有很大的破坏性[13]。王秀田等[12]发现低温胁迫会促进冬小麦叶片保持较高的SOD、POD活性,且在活性氧的清除过程中起到关键作用,能够有效减少MDA含量。杨伟等[14]也发现,0 ℃及其以上的轻度低温胁迫时,枇杷幼果、种子中的SOD、CAT和POD活性上升,MDA含量较低;但幼果、种子在0 ℃以下重度低温胁迫时,3种酶活性降低,MDA含量显著升高。本试验表明,在8、4 ℃低温胁迫下,处理3 h菊花叶片SOD、POD活性显著增加,而CAT活性在处理3 h表现出下降趋势,随后逐渐升高,菊花叶片中MDA含量也相对较低;而当菊花经过-4、-8 ℃低温处理后,SOD、POD活性均先上升而后迅速下降,在处理3 h时达到峰值,而CAT活性随着处理时间的延长呈现下降的趋势。轻度低温胁迫时,菊花植株产生应激反应,抗氧化酶活性上升,活性氧清除能力提高;而随着温度的降低,植株抗氧化酶活性大幅度下降,植株缓解活性氧伤害的能力丧失。低温胁迫下菊花通过提高可溶性糖含量和抗氧化酶活性、增加热耗散等生理响应机制来保护光合系统免受破坏,缓解低温伤害。随着温度的降低,超出了菊花自身耐受能力,自身调节能力受到限制,菊花已受到严重低温伤害。
参考文献:
[1] Liu Y,Zhao Z,Si J,etal.Brassinosteroids alleviate chilling-induced oxidative damage by enhancing antioxidant defense system in suspension cultured cells ofChorisporabungeana[J].Plant Growth Regul,2009,59(3):207-214.
[2] 张子山,杨程,高辉远,等.低温光抑制恢复过程中黄瓜叶片PSⅡ活性及其电子传递对PSⅠ的影响[J].应用生态学报,2012,23(4):1049-1054.
[3] 史世京,胡尚连,曹颖,等.冷冻胁迫下方竹抗氧化酶活性和叶绿素荧光特性[J].福建林学院学报,2013,33(1):38-42.
[4] 常静,郭磊,巩在武.低温弱光胁迫对辣椒叶片生理特性和光合特性的影响[J].江苏农业科学,2017,45(10):113-116.
[5] 刘鹏,孟庆伟,赵世杰,等.冷敏感植物的低温光抑制及其生化保护机制[J].植物生理学通讯,2001,37(1):36-82.
[6] 郑路,傅玉兰,陈树桃,等.菊花抗寒性与营养特性的研究[J].园艺学报,1994,21(2):185-188.
[7] 许瑛,陈发棣.菊花8个品种的低温半致死温度及其抗寒适应性[J].园艺学报,2008,35(4):559-564.
[8] 王翠丽,李永,崔洋,等.9个秋菊品种叶片脂肪酸组成及其抗寒性评价[J].西北农林科技大学学报,2014,42(11):61-68.
[9] 李合生,孙群,赵世杰,等.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[10] Strogonov B P.Structure and function of plant cells in saline habitats[M].New Yoke:Halsted Press,1973:78-83.
[11] 王毅,杨宏福.园艺植物冷害和抗冷性的研究——文献综述[J].园艺学报,1994,21(3):239-244.
[12] 王秀田,卢秋巍,苍晶,等.低温驯化对冬小麦叶绿素荧光特性及抗氧化酶活性的影响[J].植物生理学报,2016,52(12):1959-1969.
[13] 王以柔,刘鸿先,李平,等.在光照和黑暗条件下低温对水稻幼苗光合器官膜脂过氧化作用的影响[J].植物生理学报,1986,12(3):244-251.
[14] 杨伟,龚荣高,廖明安,等.低温胁迫对枇杷幼果抗氧化酶系统和组织结构的影响[J].西北农林科技大学学报,2016,44(4):195-202.
