种子引发对盐胁迫下向日葵种子萌发和幼苗生理特性的影响
2018-06-05张耀强李旭红郑喜清韩海军
邸 娜,张耀强,李旭红,郑喜清, 韩海军
(1.河套学院 农学系,内蒙古 巴彦淖尔 015000;2.北京新禾丰农化资料有限公司,北京 100020;3.巴彦淖尔市农牧业技术推广中心,内蒙古 巴彦淖尔 015000)
向日葵是我国种植的主要油料作物之一,由于其耐贫瘠、抗干旱,对土壤具有一定的脱盐作用,已成为开发盐碱地、生物治理盐渍化土壤的首选作物。但由于耐盐性有限,当土壤的盐碱度超过向日葵的忍耐范围时,种子萌发明显延迟、出苗率降低,呼吸作用受到损害,光合作用被抑制,导致植株的生长受到严重阻碍,产量下降,种仁含油量降低[1]。
种子引发,又称渗透调节,是一项控制种子缓慢吸水和逐步回干的种子处理技术[2-3]。种子引发可提高种子活力,在温度和水分胁迫等逆境条件下能显著缩短植物的萌发时间,提高发芽率和成苗率,提高幼苗整齐度[4-6]。尤其在逆境条件下,对种子进行引发可显著提高幼苗的耐逆性,如种子引发可增强大豆幼苗的耐旱性[7]和杂交水稻幼苗的耐盐性[8],这主要是由于种子引发增加了幼苗体内渗透调节物质的积累量, 提高了保护酶的活性。目前,关于种子引发对向日葵幼苗生长的影响研究还未见报道。为此,设置种子引发时间和引发剂浓度2种处理,研究盐胁迫条件下引发处理后向日葵的出苗情况及生理生化特性,进而为种子引发技术应用于向日葵生产提供一定的理论依据和技术指导。
1 材料和方法
1.1 试验材料
本试验选用食用向日葵品种LD3939作为供试材料。
1.2 试验方法
1.2.1 种子引发处理 对大小均匀、完整饱满的种子分别设置引发时间和引发剂浓度2组处理:(1)用100 mmol/L NaCl溶液,于25 ℃人工气候箱中分别对种子引发0、4、8、12、18、24、36、48 h;(2)分别用0、50、100、150、200、250、300 mmol/L NaCl溶液,于25 ℃人工气候箱中对种子引发12 h。引发处理后,用蒸馏水冲洗种子3遍,吸水纸吸干后室温下72 h晾干,每个处理重复3次。以未引发的种子作为对照。
1.2.2 盐胁迫处理 将充分洗净的干细河砂, 装入直径17 cm、高13 cm的花盆内,播种前每盆浇200 mL 100 mmol/L NaCl溶液,模拟盐胁迫条件,挑选饱满、均匀一致的种子,每盆均匀播种10粒,覆盖约2 cm干细河砂,再浇100 mL 100 mmol/L的NaCl溶液。播种后视干旱程度每次定量浇50 mL蒸馏水,浇透但水分不渗出,以保证各处理间盐胁迫条件不变。待幼苗生长至第10天每盆浇100 mL 1/2 Hoagland营养液。每个处理播种10盆,未引发种子作对照。
1.2.3 出苗过程检测 观察种子出苗过程,子叶出土视为出苗,统计各处理引发种子及未引发种子的出苗数和出苗时间,计算出苗率,出苗率=(出苗数/播种数)×100%。以出苗后能够正常生长,且15 d后仍存活的幼苗定义为成苗,计算成苗率,成苗率=(成苗数/播种数)×100%。
1.2.4 生理指标的测定 出苗后第20天,每个处理随机选取10株幼苗,取新鲜功能叶片混匀,参照高俊凤[9]和张景云等[10]的方法分别测定光合色素含量、细胞膜透性以及丙二醛和脯氨酸的含量。每个处理重复3次。
1.3 数据统计分析
用SPSS 17.0统计软件进行差异显著性分析,用Excel 2003进行图表制作。
2 结果与分析
2.1 种子引发对盐胁迫下向日葵出苗的影响
由表1可知,在盐胁迫条件下,向日葵的出苗时间随引发时间的延长和引发剂浓度的增加均呈现先减少后增加的趋势,但引发处理显著短于未引发处理(引发剂浓度为100 mmol/L处理除外)。其中,种子引发时间为12 h及引发剂浓度为150 mmol/L时,向日葵的出苗时间最短,分别为3.20 d和3.31 d,显著短于其他引发处理。在盐胁迫条件下,向日葵出苗率和成苗率随引发时间的延长和引发剂浓度的增加均表现为先增加后降低的趋势,除引发剂浓度300 mmol/L处理外,其他引发处理均显著高于未引发处理 。其中,种子引发12 h和引发剂浓度分别为100、150 mmol/L时出苗率均达100%,与其他处理差异显著,分别比未引发处理高45.62%和49.99%、49.99%;成苗率在种子引发12 h和引发剂浓度为150 mmol/L时均达93.10%,引发剂浓度为100 mmol/L时成苗率略低,为92.33%,与引发剂浓度为150 mmol/L时无显著差异。由以上结果可以看出,在盐胁迫条件下,除个别处理外,种子引发总体上可以显著提高向日葵的出苗率和成苗率,缩短出苗时间,缓解盐胁迫对种子萌发的抑制作用,提高种子萌发阶段向日葵的耐盐性。
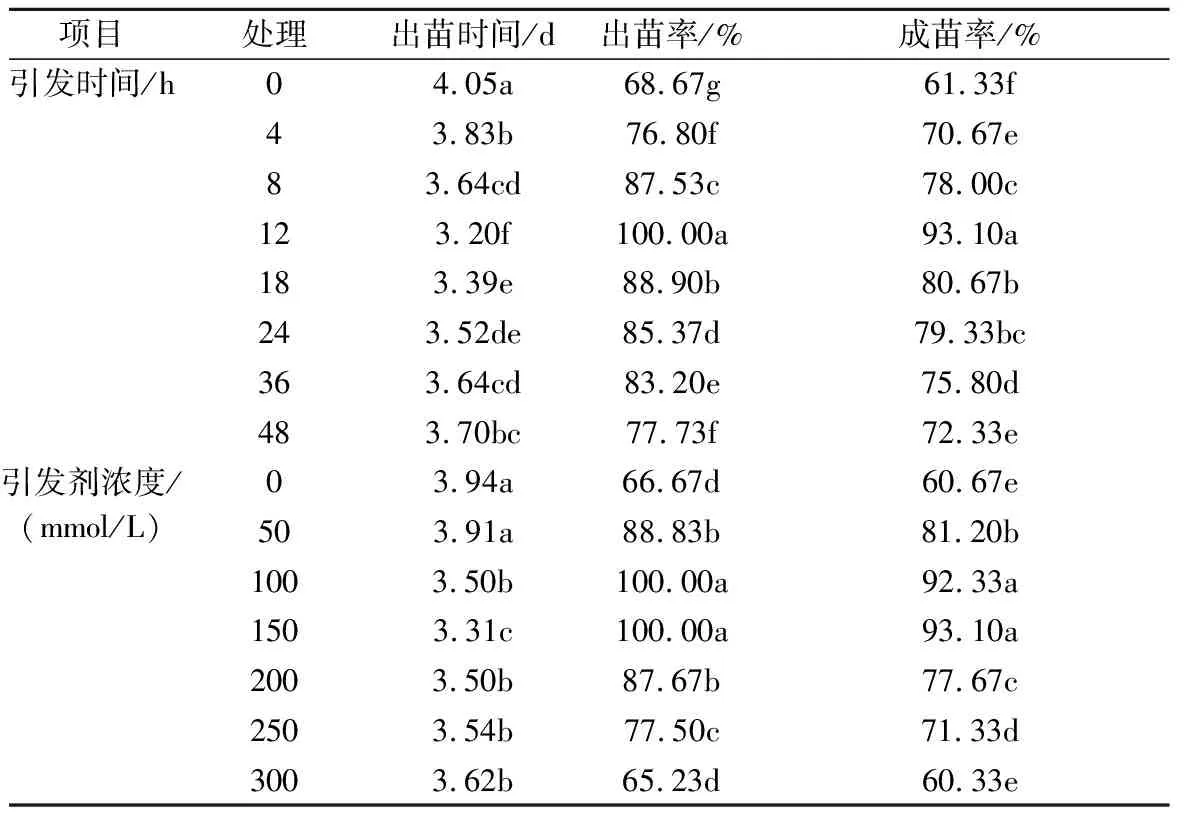
表1 种子引发处理对盐胁迫下向日葵出苗的影响
注:同列数据后不同小写字母表示不同处理间差异显著(P<0.05)。
2.2 种子引发对盐胁迫下向日葵幼苗光合色素含量的影响
由图1可知,在盐胁迫条件下,随着种子引发时间延长,叶绿素a、叶绿素b、叶绿素总量和色素总量呈相似的变化趋势,均表现为先升高再降低后趋于平缓,12 h时均达到最大值,分别为2.177 mg/g、1.257 mg/g、3.235 mg/g和3.592 mg/g,显著高于其他处理;引发时间超过12 h后色素含量显著下降,36 h后色素含量趋于稳定。
由图2可知,在盐胁迫条件下,随引发剂浓度增加色素含量显著增加,当引发剂浓度为100 mmol/L时,叶绿素a、叶绿素b、叶绿素总量和色素总量均达到最大值,分别为2.182 mg/g、0.873 mg/g、3.055 mg/g和3.458 mg/g,当引发剂浓度增加到150 mmol/L时,色素含量急剧下降,其后色素含量有少量增加并趋于平缓,但仍显著高于未引发处理。综上,种子引发处理可显著增加盐胁迫下向日葵幼苗光合色素的含量,减小盐胁迫条件下由于光合色素含量下降对向日葵幼苗光合效率的影响。
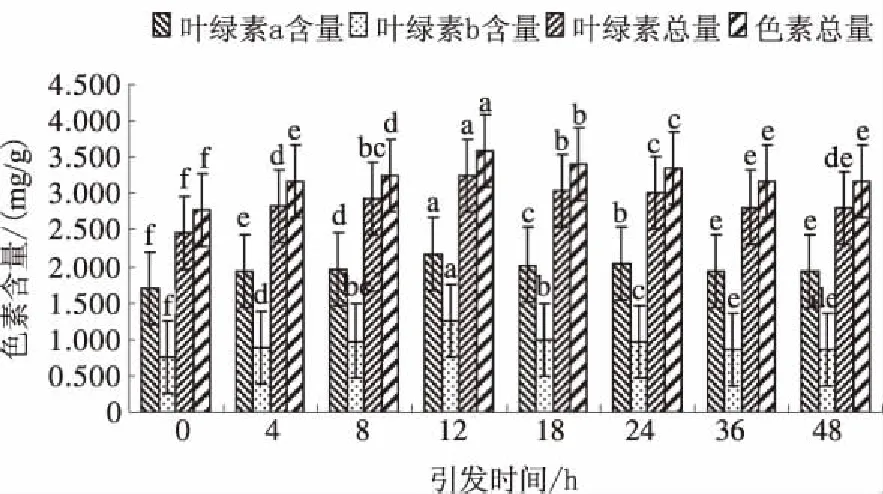
不同字母表示不同处理间差异显著(P<0.05),下同
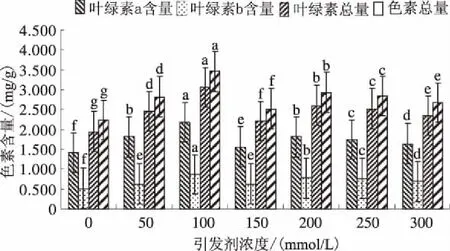
图2 引发剂浓度对盐胁迫下向日葵幼苗光合色素含量的影响
2.3 种子引发对盐胁迫下向日葵幼苗细胞膜相对透性的影响
由图3可知,在盐胁迫条件下,当种子引发时间低于12 h(≤12 h)时,随着引发时间延长向日葵幼苗的细胞膜相对透性迅速下降,显著低于未引发处理,当引发时间为12 h时,细胞膜相对透性最低,为12.24%,较未引发处理低28.21%;当引发时间超过12 h后,细胞膜相对透性急剧增加,当引发时间为24 h时,细胞膜相对透性增加到19.49%,较未引发处理高14.31%。
由图4可知,在盐胁迫条件下,随种子引发剂浓度增加向日葵幼苗的细胞膜相对透性呈现先降低后增加的趋势,当引发剂浓度分别为50 mmol/L和100 mmol/L时,细胞膜相对透性均显著低于未引发处理,分别降低26.36%和33.39%;当引发剂浓度≥150 mmol/L时,细胞膜相对透性持续增加,当引发剂浓度≥200 mmol/L时,细胞膜相对透性开始高于未引发处理,其中引发剂浓度为300 mmol/L时,细胞膜相对透性达38.21%,是未引发处理的2倍。因此,适当的种子引发可以有效抑制盐胁迫引起的细胞膜透性增加,其中尤以100 mmol/L NaCl引发12 h抑制效果最显著。
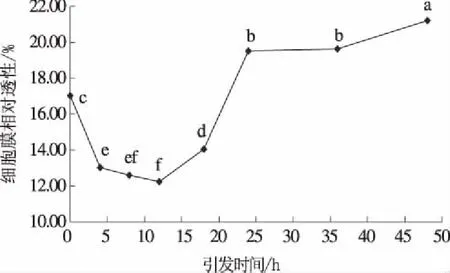
图3 引发时间对盐胁迫下向日葵幼苗细胞膜相对透性的影响
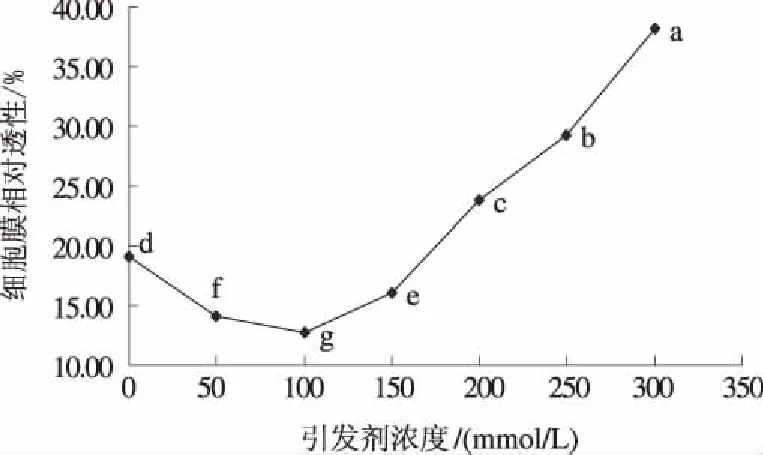
图4 引发剂浓度对盐胁迫下向日葵幼苗细胞膜相对透性的影响
2.4 种子引发对盐胁迫下向日葵幼苗丙二醛含量的影响
由图5可知,引发时间分别为4 h、8 h和12 h时,盐胁迫下向日葵幼苗MDA含量显著下降,分别为0.145 mmol/g、0.144 mmol/g和0.121 mmol/g,分别比未引发处理降低6.45%、7.10%和21.94%;当引发时间为18 h时,MDA含量急剧增加,达0.157 mmol/g,其后趋于稳定。
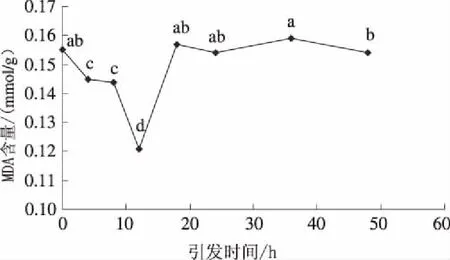
图5 引发时间对盐胁迫下向日葵幼苗丙二醛含量的影响
由图6可知,与未引发处理相比,盐胁迫下引发处理向日葵幼苗MDA含量显著降低,尤其引发剂浓度为100 mmol/L时,MDA含量最低,为0.166 mmol/g,较未引发处理降低29.96%。从以上结果来看,种子引发处理可缓解盐胁迫下细胞的膜脂过氧化作用,稳定细胞膜结构,维持细胞膜完整,提高细胞耐盐性。
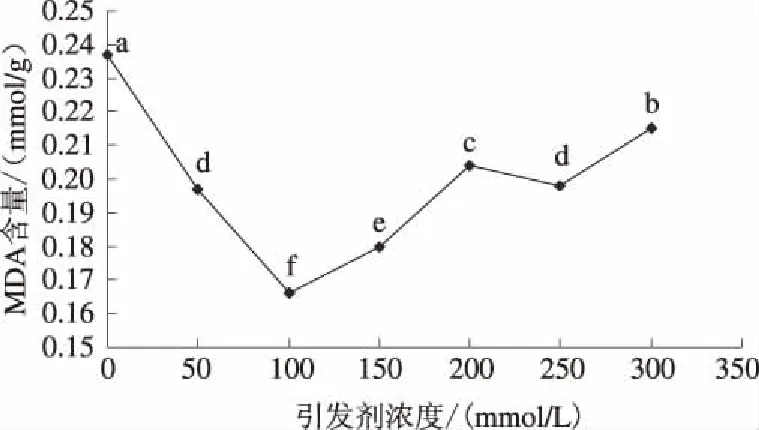
图6 引发剂浓度对盐胁迫下向日葵幼苗丙二醛含量的影响
2.5 种子引发对盐胁迫下向日葵幼苗脯氨酸含量的影响
由图7可知,种子引发4 h时,盐胁迫下向日葵幼苗脯氨酸含量与未引发处理无显著差异;引发8 h和12 h时,向日葵幼苗脯氨酸含量显著增加,分别达9.531 μg/g和9.966 μg/g,均显著高于未引发处理;其后随引发时间增加,脯氨酸积累量迅速下降,且均低于未引发处理。由图8可知,种子引发剂浓度≤150 mmol/L时,随引发剂浓度增加,盐胁迫下向日葵幼苗脯氨酸积累量持续增加,且均显著高于未引发处理,其中引发剂浓度为150 mmol/L时,脯氨酸积累量最高,达11.587 μg/g,为未引发处理的1.70倍;当引发剂浓度≥200 mmol/L时,向日葵幼苗的脯氨酸含量呈波动性下降,仅350 mmol/L处理与未引发处理无显著差异,其余2个处理仍显著高于未引发处理。由此可见,引发处理总体上可显著提高盐胁迫条件下向日葵幼苗的脯氨酸积累量,降低细胞水势,提高细胞的吸水和保水能力,从而增加向日葵幼苗对盐胁迫的抵抗能力。
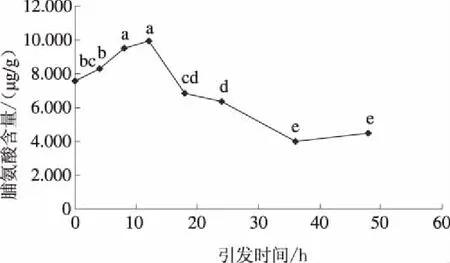
图7 引发时间对盐胁迫下向日葵幼苗脯氨酸含量的影响

图8 引发剂浓度对盐胁迫下向日葵幼苗脯氨酸含量的影响
3 结论与讨论
3.1 种子引发对盐胁迫下向日葵出苗的影响
盐胁迫对植物几乎所有重要的生命过程都会产生一定的影响,如影响种子的萌发出苗、幼苗的生长发育、植株的光合作用和呼吸作用等[11]。因此,土壤的含盐量是影响植物生长和作物产量的一个重要因素,盐浓度过高会导致植物减产乃至死亡。植物在高盐情况下能否生长,取决于植物种子是否能够萌发成苗。盐胁迫条件下,种子的多个发芽指标如发芽势、发芽率、发芽指数和活力指数等显著下降,种子萌发显著受到抑制[12-14]。利用种子引发技术在播种前进行种子处理,可缩短种子的出苗时间,提高幼苗的整齐度,增强种子和幼苗的抗逆性。种子引发技术作为一种提高植物耐逆性的有效手段,已普遍应用于多种作物的抗性栽培和育种中,如高粱[6,15-16]、玉米[17-19]、大豆[7,20-21]、小麦[22-23]、水稻[8,24]等。研究表明,相较于直接播种,种子引发处理可显著缩短盐胁迫下高粱[6]、玉米[17]、紫花苜蓿[25]的出苗时间,提高出苗率和成苗率,这与本研究的结果一致。本研究结果表明,引发时间为12 h和引发剂浓度为150 mmol/L时,向日葵出苗时间显著短于未引发处理,分别为3.20 d和3.31 d,出苗率、成苗率显著高于未引发处理,分别为100%、93.10%和100%、93.10%。因此,盐渍化土壤在播前对种子进行适当的引发处理,能够显著缩短出苗时间,提高出苗率和成苗率,增加作物存活率,降低盐胁迫下的苗期致死率。
3.2 种子引发对盐胁迫下向日葵幼苗光合色素含量的影响
植物光合作用以光合色素对光能的吸收、传递和转化为基础,其中叶绿素是植物最主要的光合色素。植物在盐胁迫下,叶绿体遭到破坏,导致叶绿素合成速度减慢,分解速度加快[26]。本研究中,盐胁迫下向日葵幼苗叶片中的叶绿素a、叶绿素b、叶绿素总量、光合色素总量,在种子引发时间为12 h 和引发剂浓度为100 mmol/L时达到最大,分别为2.177、1.257、3.235、3.592 mg/g和2.182、0.873、3.055、3.458 mg/g,均显著高于未引发处理,这与杨小环等[6]和杜锦等[17]研究结果一致。这说明种子引发处理可以缓解盐胁迫引起的植物光合色素含量降低,减轻盐胁迫对光合作用的影响,维持盐胁迫下植物正常的生长发育。
3.3 种子引发对盐胁迫下向日葵幼苗生理特性的影响
盐胁迫下植物体内自由基代谢平衡被打破,使自由基大量积累,生物膜发生膜脂过氧化作用,破坏了膜的完整性,使细胞膜透性增加[27]。MDA是膜脂过氧化的主要产物之一,通过测定MDA含量可间接衡量细胞膜脂过氧化程度[28]。本研究中,种子引发后细胞膜相对透性和MDA含量显著低于未引发处理,这与史雨刚等[22]和肖雪峰等[29]分别对盐胁迫下小麦和通关藤幼苗的生理特性研究结果一致。可能是因为引发处理促进了细胞膜的修复,增强了自由基的清除能力,降低了盐胁迫条件下膜脂过氧化作用,保持了细胞膜的完整性。
盐胁迫条件下,外界溶液渗透势较低,对植物细胞产生渗透胁迫,造成细胞吸水困难甚至失水。细胞为了维持正常的水分代谢,会主动积累渗透调节物质,其中脯氨酸是最普遍、最重要的一种有机渗透调节物质。本研究结果表明,不同的种子引发时间和引发剂浓度下,向日葵幼苗脯氨酸积累量显著高于对照,积累量最高分别达未引发处理的1.30倍和1.70倍。杨小环等[7]、阮松林等[8]、马金虎等[30]也得出相似结果。种子引发处理可以通过调节渗透调节物质的积累,来缓解盐胁迫对向日葵造成的水分胁迫,提高细胞的吸水和保水能力,增强向日葵对盐胁迫的抵抗能力。
参考文献:
[1] 王静.盐碱对黑龙江省向日葵生产的影响及高产栽培技术[J].哈尔滨师范大学自然科学学报,2012,28(6):62-65.
[2] Heydecker W,Coolbear P.Seed streatments for improved performance survey and attempted prognosis[J].Seed Sci Technol,1997,5:353-425.
[3] Bradford K J.Manipulation of seed water relations via osmotic priming to improve germination under stress conditions[J].Hort Sci,1986,21(5):1105-1112.
[4] Taylor A G,Klein D E.Solid matrix priming of seeds[J].Scientia Horticulturae,1988,37:1-11.
[5] Carpenter W J,Boucher J F.Priming improve high-temperature germination of pansy seed[J].Hort Science,1991,26:541-544.
[6] 杨小环,马金虎,郭数进,等.种子引发对盐胁迫下高粱种子萌发及幼苗生长的影响[J].中国生态农业学报,2011,19(1):103-109.
[7] 杨小环,王玉国,杨文秀,等.种子引发对水分胁迫下大豆幼苗生理特性的影响[J].中国生态农业学报,2009,17(6):1191-1195.
[8] 阮松林,薛庆中,王清华.种子引发对杂交水稻幼苗耐盐性的生理效应[J].中国农业科学,2003,36(4):463-468.
[9] 高俊凤.植物生理学实验指导[M].北京:高等教育出版社,2006:142-232.
[10] 张景云,白雅梅,缪南生,等.盐胁迫对不同耐盐性二倍体马铃薯叶片质膜透性、丙二醛和脯氨酸含量的影响[J].作物杂志,2013(4):75-80.
[11] 苏永全,吕迎春.盐分胁迫对植物的影响研究简述[J].甘肃农业科技,2007(3):23-27.
[12] 王永娟,周妍,徐明,等.盐胁迫对大豆种子萌发及矿质元素变化的影响[J].生态学杂志,2015,34(6):1565-1571.
[13] 卢艳敏,苏长青,李会芬.不同盐胁迫对白三叶种子萌发及幼苗生长的影响[J].草业学报,2013,22(4):123-129.
[14] 王东明,贾媛,崔继哲.盐胁迫对植物的影响及植物盐适应性研究进展[J].中国农学通报,2009,25(4):124-128.
[15] 管博,曹迪,于君宝.引发处理对甜高粱种子萌发阶段生理生态影响[J].生态学杂志,2014,33(4):982-988.
[16] 张飞,朱凯,王艳秋,等.种子引发对盐渍土壤条件下高粱芽苗生理特性的影响[J].干旱地区农业研究,2016,34(5):47-53.
[17] 杜锦,蒙雨莲,向春阳,等.种子引发对盐胁迫下玉米种子萌发及幼苗生长的影响[J].天津农学院学报,2012,19(1):1-6.
[18] 王芳,赛吾热尼沙·阿布都热西提,芦苇华,等.引发对甜玉米种子发芽和幼苗生长的影响[J].新疆农业大学学报,2009,32(2):37-40.
[19] Muhammad A,Mohammad T J,Khan B M,etal.Seed priming improves emergence and yield of soybean[J].Pal J Bot,2008,40(3):1169-1177.
[20] 杨雪桐,张永强,曹微,等.PEG 引发种子对大豆产量及主要农艺性状的影响[J].黑龙江八一农垦大学学报,2016,28(4):6-8.
[21] 王炜,史雨刚,王曙光.PEG 引发对老化大豆种子发芽及活力的影响[J].山西农业科学,2011,39(7):650-654.
[22] 史雨刚,孙黛珍,雷逢进,等.种子引发对NaCl胁迫下小麦幼苗生理特性的影响[J].核农学报,2011,25(2):342-347.
[23] 谢娟娜,路杨,房琴,等.种子引发对小麦抗盐及抗旱特性影响综述[J].中国生态农业学报,2016,24(8):1025-1034.
[24] 周小梅,赵运林,文彤,等.亚精胺引发对水分胁迫下水稻种子活力及幼苗生理特性的影响[J].核农学报,2013,27(2):247-252.
[25] 闵丹丹,潘佳,范燕,等.引发对种子萌发和幼苗生长特性的影响[J].草业科学,2016,33(9):1728-1738.
[26] 柯玉琴,潘廷国.NaCl胁迫对甘薯叶片叶绿体超微结构及一些酶活性的影响[J].植物生理学报,1999,25(3):229-233,315-316.
[27] Moran J F,Becana M,Iturbe-Ormaetxe I,etal.Drought induces oxidative stress in pea plants[J].Planta,1994, 94:346-352.
[28] Zhao X J,Han Y N,Cai L.Advances in reasearch on physiological and biochemical effects of NaCl stress on plant[J].Hubei Agricultural Sciences,2011,50(19):3897-3899.
[29] 肖雪峰,刘丽,郭巧生,等.种子引发对 NaCl 胁迫下通关藤种子萌发及幼苗生理特性的影响[J].中国中药杂志,2015,40(2):218-225.
[30] 马金虎,郭数进,王玉国,等.种子引发对盐胁迫下高粱幼苗生物量分配和渗透物质含量的影响[J].生态学杂志,2010,29(10):1950-1956.
