胶红酵母产类胡萝卜素固态发酵工艺
2018-05-31孙佳静李貌孙志洪唐志如张相鑫陈进超
孙佳静,李貌,孙志洪,唐志如,张相鑫,陈进超
胶红酵母产类胡萝卜素固态发酵工艺
孙佳静,李貌,孙志洪,唐志如,张相鑫,陈进超
(西南大学动物科技学院/生物饲料与分子营养实验室,重庆 400715)
【目的】优化胶红酵母固态发酵底物与发酵条件,提高类胡萝卜素产量,改善发酵产物营养价值,降低生产成本。【方法】选用胶红酵母TZR2014作为发酵菌种,采用Design-Expert软件的Mixture-Design设计固态发酵底物的配比,各底物原料的范围如下:麸皮50%—80%、豆粕6%—20%、玉米粉3%—15%、米糠2%—14%、玉米浆2%—10%、硫酸铵0.4%—2.5%、磷酸二氢钾0.05%—0.5%和硫酸镁0.03%—0.3%,通过固态发酵工艺生产类胡萝卜素,并根据类胡萝卜素的产量来确定最优的发酵底物。确定最适发酵底物配比后,利用L16(45)正交设计对发酵条件进行优化设计,各参数的范围如下:接种量5.0%—12.5%、发酵时间60.0—96.0 h、发酵温度26—32℃、pH 4.0—7.0、含水量60.0%—75.0%,根据试验结果确定胶红酵母产类胡萝卜素的最优发酵条件。研究优化的胶红酵母固态发酵工艺对发酵产物粗纤维、粗蛋白质、水分、粗脂肪、粗灰分、钙、磷和氨基酸等营养物质的影响。【结果】胶红酵母发酵产物中类胡萝卜素含量与固态发酵底物中麦麸的添加量呈显著负相关(=-0.336,=0.045),与发酵底物中玉米浆的添加量呈显著正相关(=0.344,=0.040),与发酵底物中米糠添加量为正相关(=0.329,=0.050)。发酵产物中胶红酵母活菌数与底物中豆粕含量呈显著正相关(=0.510,=0.001)。接种量、发酵温度、pH、底物含水量对胶红酵母活菌数均有极显著的影响(<0.01),但其中发酵温度对胶红酵母菌体数影响最大,其次是底物含水量,之后依次是接种量和pH。发酵时间、发酵温度和pH均显著影响发酵产物中类胡萝卜素含量(<0.05),其中发酵温度对发酵产物中类胡萝卜素含量影响最大,pH次之,发酵时间影响最小。经过发酵工艺的优化,发酵产物中类胡萝卜素产量提高到4 535 μg·kg-1,发酵产物中的活菌数为3.79×109CFU/g;发酵后粗纤维、粗蛋白质、粗灰分、苏氨酸、谷氨酸、脯氨酸含量均显著高于发酵前(<0.05),而组氨酸、水分、粗脂肪含量显著低于发酵前(<0.05)。【结论】胶红酵母固态发酵产类胡萝卜素底物的最佳配比为麦麸52.5%、豆粕20.0%、玉米粉3.00%、米糠14.0%、玉米浆10.0%、硫酸铵0.40%、磷酸二氢钾0.05%和硫酸镁0.04%;最佳发酵条件为菌液接种量5.0%、发酵时间72.0 h、发酵温度28.0℃、pH 6.0、底物含水量60.0%。经过优化胶红酵母发酵工艺,类胡萝卜素产量得到显著提高,并且发酵产物营养价值得到明显改善。
胶红酵母;固态发酵;类胡萝卜素;发酵底物;发酵条件
0 引言
【研究意义】类胡萝卜素是一类广泛存在于自然界中的有色多烯类化合物,主要包括β-类胡萝卜素、虾青素、叶黄素和番茄红素等。天然类胡萝卜素因其抗氧化、防癌、增强免疫力等保健作用受到越来越多人的青睐[1]。因此,开展胶红酵母产胡萝卜素研究具有重要意义。【前人研究进展】类胡萝卜素混合物和β-胡萝卜素都没有基因毒性,类胡萝卜素可以通过调节细胞信号和基因表达抵抗癌症[2],且可以抑制基因突变和抵抗环境诱导的基因毒性剂[3]。类胡萝卜素已被FAO和WHO定为A类营养色素,在50多个国家和地区获准作为营养、着色双重功用的食品添加剂,被广泛应用于保健食品及医药和化妆品工业[4]。目前,类胡萝卜素主要利用微生物和高等植物进行生产。从植物中提取天然类胡萝卜素不仅受地域条件、原料来源、提取效率等限制,而且生产成本较高。近年来,利用微生物生产类胡萝卜素受到越来越多的关注。生产类胡萝卜素的微生物主要包括三孢布拉霉()和红酵母类。三孢布拉霉虽然产率高,但发酵工艺较难调控,而且液态发酵普遍存在着生产工艺复杂、能耗高、环境污染大、成本高等缺点。胶红酵母是一种主要合成β-胡萝卜素的红酵母[5],其通过固态发酵生产类胡萝卜素的工艺与液态发酵法相比,具有能耗低、培养基简单、生产过程节水、操作简便易行等优点[6]。【本研究切入点】红酵母合成类胡萝卜素的效率受许多因素的影响,例如,培养基组成、发酵条件[7]。目前,有关利用胶红酵母进行固态发酵生产类胡萝卜素的研究较少。本研究选用胶红酵母作为发酵菌种,主要利用农业副产品麸皮,并辅以其他发酵原料作为固态发酵底物原料,旨在探究发酵底物原料(麸皮、豆粕、玉米粉、玉米浆、米糠、硫酸铵、磷酸氢二钾和硫酸镁等)配比和发酵条件(接种量、发酵温度、底物含水量、发酵时间和底物pH)对类胡萝卜素产量、胶红酵母活菌数和发酵产物营养价值的影响。【拟解决的关键问题】确定胶红酵母最优的发酵底物配比和发酵条件;制定高效生产类胡萝卜素的胶红酵母发酵工艺。
1 材料与方法
试验于2015—2016年在西南大学生物饲料与分子营养实验室进行。
1.1 主要仪器
双目生物显微镜(B203LEDR,重庆奥特光学仪器有限公司);高速冷冻离心机(ST 8,赛默飞世尔科技公司);台式低速离心机(TDZ4-WS,湘仪公司);涡旋仪(WH-3,上海沪西分析仪器有限公司);恒温培养箱(HH•BII•500-BS,上海跃进医疗器械厂);pH计(PHS-4C+,成都世纪方舟科技有限公司);高压蒸汽灭菌器(MJ-54A,施都凯仪器设备有限公司);数显恒温水浴锅(HH-8,常州国华电器有限公司);超纯水系统(SDLD-R,重庆市澳凯龙医疗器械研究有限公司);洁净工作台(SW-CJ-2D,苏净集团苏州安泰空气技术有限公司)。
1.2 试验材料
(1)菌种来源:重庆市北碚区柑桔研究所果园分离出的胶红酵母。该菌株已于2015年9月24日送至中国典型培养物保藏中心保藏,分类命名为胶红酵母TZR2014,保藏编号为CCTCC NO:M 2015574,保藏地址为武汉大学。菌落特征如下:菌落呈圆形、橙红色、隆起,胶质黏稠,边缘整齐,表面光滑,易于挑起。
(2)PDA培养基:称取马铃薯200 g、葡萄糖20 g、琼脂20 g,溶于1 000 mL水中,自然pH,115℃灭菌20 min。
(3)种子培养基:称取葡萄糖20 g、蛋白胨10 g、酵母提取物10 g,溶于1 000 mL自来水中,自然pH,115℃灭菌20 min。
1.3 胶红酵母固态发酵底物的优化
从满足胶红酵母生长必需的营养素以及经济性原则考虑,本研究选择麸皮、豆粕、玉米粉、玉米浆、米糠、硫酸铵、磷酸氢二钾和硫酸镁8种原料作为发酵底物,在借鉴前人研究基础上[8-9],采用Design-Expert软件中的Mixture Design设计固态发酵底物配比,各原料的范围如下:麸皮50%—80%、豆粕6%—20%、玉米粉3%—15%、米糠2%—14%、玉米浆2%—10%、硫酸铵0.4%—2.5%、磷酸二氢钾0.05%—0.5%和硫酸镁0.03%—0.3%。具体设计如表1所示。
取-80℃冻存的胶红酵母接种于PDA培养基上,28℃培养72 h,进行菌种的复苏。再取PDA培养基上的胶红酵母菌接种于种子培养基上,置于恒温振荡器中于200 r/min、28℃培养24 h,即得胶红酵母种子液。分别秤取按表1设计的36种发酵底物132 g,混匀,并将水分含量调节为65%,平均分成4份,其中1份做空白对照,另外3份作为一个处理的3次重复,用于排除培养基中原有的类胡萝卜素对试验的影响。置于250 mL三角瓶密封灭菌,待冷却后按发酵底物质量体积的5%接种。8层纱布密封后置于30℃培养箱培养72 h。
1.4 发酵条件优化
在获取最佳发酵底物配比的基础上,借鉴前人研究结果[10-11]设定接种量、发酵时间、发酵温度、发酵pH和发酵底物含水量的梯度(表2),并对以上5个参数进行L16(45)正交设计(表3)。
胶红酵母复苏以及得到种子液的步骤同上。称取上述研究得到的最优发酵底物16组,每组132 g,混匀,并将水分含量调节为65%,平均分成4份,其中一份做空白对照,然后置于250 mL三角瓶密封灭菌,按表3设置的固态发酵条件进行发酵,其中pH用氢氧化钠和盐酸进行调节。
1.5 胶红酵母固态发酵工艺优化对底物养分的影响
发酵底物以及发酵产物灭菌、混匀后,在60℃烘干、粉碎,用于测定样品中的水分、粗蛋白质、粗脂肪、粗纤维、粗灰分、无氮浸出物、钙、磷和氨基酸含量。
1.6 测定方法
(1)胶红酵母活菌数:取5 g发酵底物或产物置于锥形瓶内,在锥形瓶内加入100 mL 0.85%的生理盐水,置于恒温振荡器中于200 r/min振荡20 min,用血球计数板进行计数。
固态发酵产物含胶红酵母细胞数(y,CFU/g)的计算方法如下:
y={[(80个小方格内细胞个数)/80×400×104×稀释的倍数]×100}/5
(2)类胡萝卜素:测定过程主要参考杨文等[12]和王岁楼等[13]介绍的方法,并对部分操作步骤进行了改进。具体测定步骤如下:称取10 g样品并用50 mL 0.85%的生理盐水稀释,八层纱布过滤后菌液于 4 800 r/min下离心10 min。收集菌体,置于50℃恒温箱中烘干至恒重。称取干酵母0.1 g,加入3 mol·L-1的盐酸2.4 mL,静止1 h,转至沸水浴中加热4 min,迅速冷却,然后4 000 r/min离心10 min,弃上清液。水洗后再离心,重复2次,即得细胞碎片。在细胞碎片中加入4 mL丙酮溶液,室温漩涡振荡15 min后,4 000 r/min离心10 min,取上清液,重复浸提2次,所得上清液即为类胡萝卜素提取液。类胡萝卜素含量按下列公式计算:
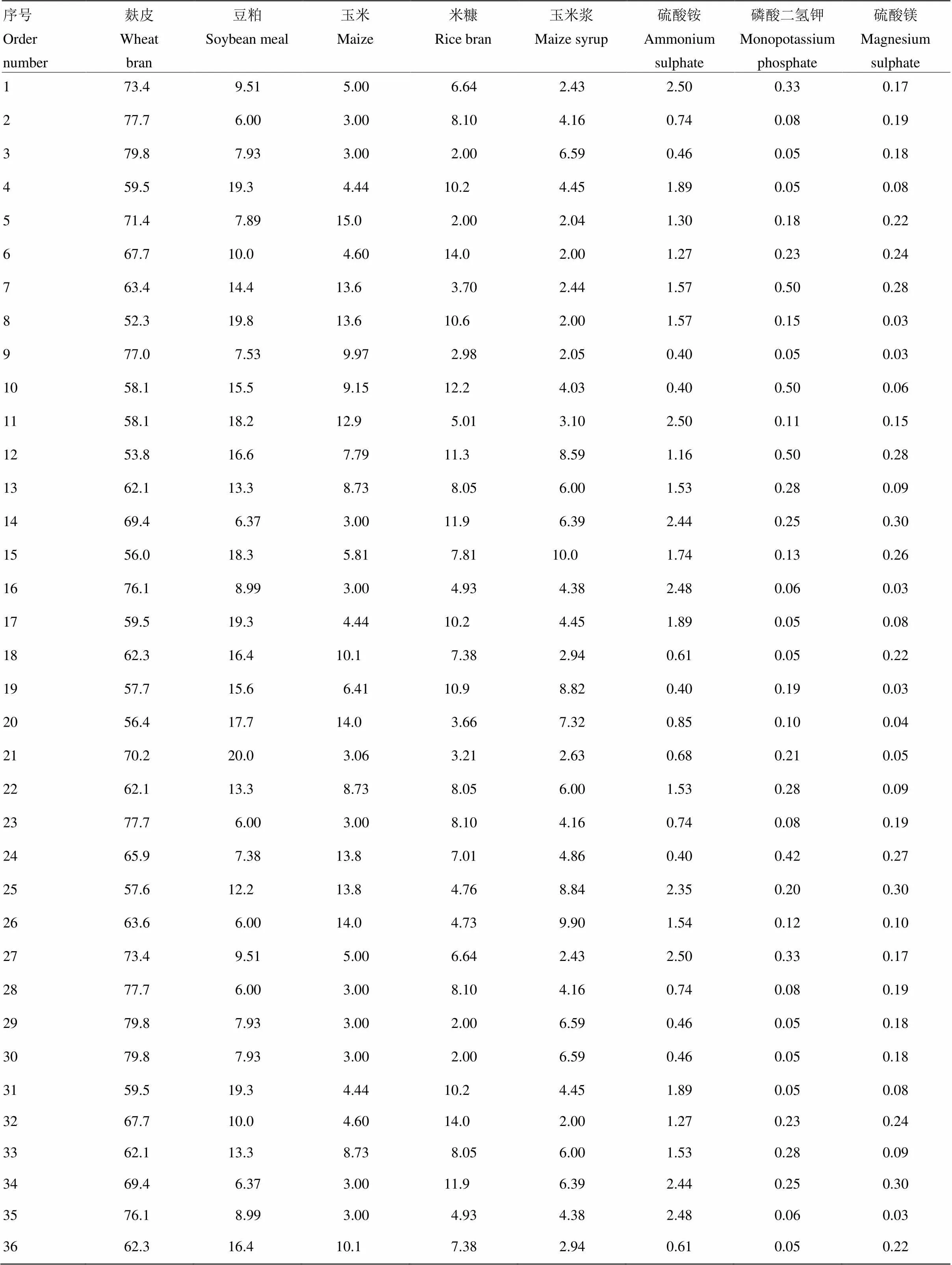
表1 胶红酵母固态发酵底物优化设计
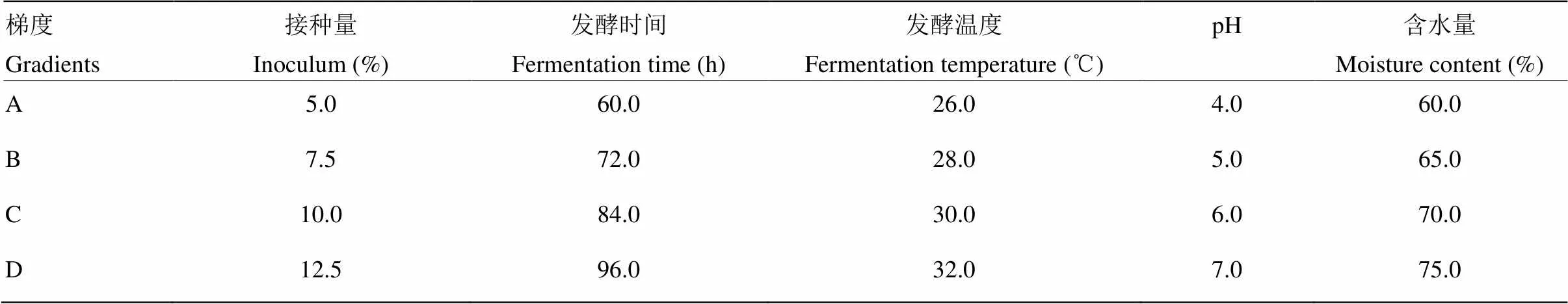
表2 胶红酵母固态发酵条件优化梯度
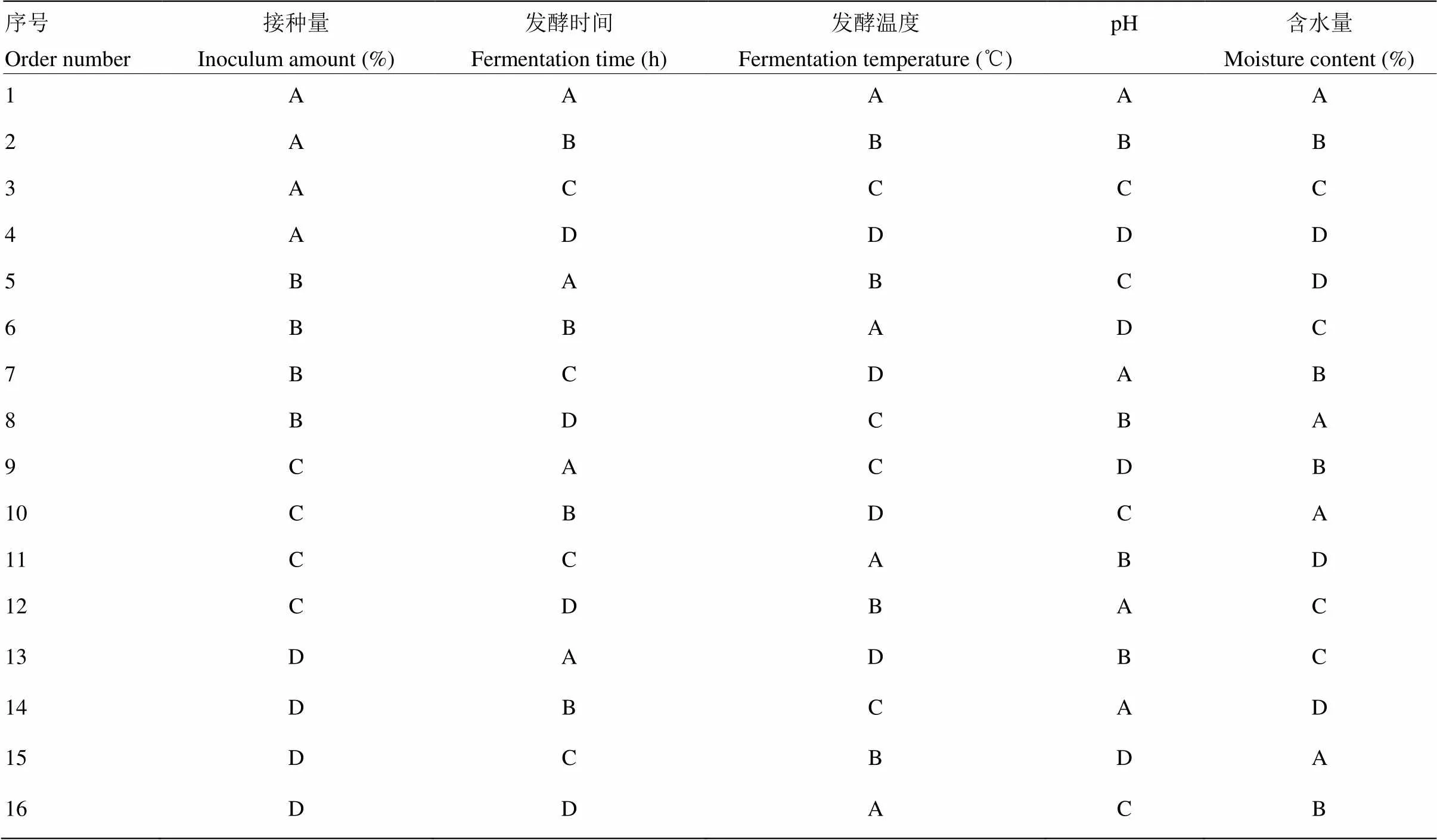
表3 胶红酵母固态发酵条件的优化设计
表中A、B、C、D分别代表表2中相对应的发酵梯度
A, B, C and D represents the relative gradients of inoculum amount, fermentation time, fermentation temperature, pH value, and moisture content in table 2, respectively
色素的含量(µg·g-1干菌体)=Aλ×D×V/0.16×W式中:Aλ为475 nm波长处的吸光值,D为测定试样时的稀释倍数,V为丙酮的用量(mL),W为酵母菌重量(g),0.16为类胡萝卜素的摩尔消光系数。
(3)水分:将样品(105±2)℃烘箱烘干至恒重。
(4)粗蛋白质:采用凯氏定氮法,用半自动凯氏定氮仪进行测定。
(5)粗脂肪:采用乙醚浸提法,用脂肪测定仪进行测定。
(6)粗灰分:将样品在(550±20)℃下灰化至恒重。
(7)粗纤维:采用滤袋技术进行测定。
(8)钙:采用高锰酸钾滴定法进行测定。
(9)磷:采用钼黄比色法进行测定。
(10)氨基酸:采用全自动氨基酸分析仪进行分析。
1.7 统计分析
试验数据使用SAS 9.0和Design-Expert进行统计分析。<0.05表示差异显著。
2 结果
2.1 固态发酵底物优化
由表4所示,发酵底物18所产的类胡萝卜素含量最高,而发酵底物17经过发酵后产物中的活菌数量最高,考虑到本研究是以类胡萝卜素产量为主要目标,因此,将发酵底物18作为最优发酵底物,供后续的研究使用。
2.1.1 试验的数学模型分析 以表4数据为基础,用Design-Expert软件对类胡萝卜素含量和胶红酵母菌数进行分析,得到模型的性噪比(Adeq Precision)和2预测值(Pred R-Squared),如表5所示。当模型的信噪比大于4时表示模型是比较合适的。数据显示类胡萝卜素和胶红酵母菌数模型的性噪比均大于4,表明数据均是可取的,且具有较高的精密度值。当2预测值为负值时意味着预测模型比实际模型更合适。该试验模型分析的结果均为负值,表明预测模型比实际模型具有更理想的效果。
由表6可知,胶红酵母发酵产物中类胡萝卜素含量与固态发酵底物中麦麸的添加量呈显著负相关(=-0.336,=0.045);固态发酵底物中豆粕含量与发酵产物中胶红酵母活菌数呈显著正相关(=0.510,=0.001);玉米浆的添加量与类胡萝卜素产量呈显著正相关(=0.344,=0.040)。此外,发酵底物中米糠添加量与发酵产物中类胡萝卜素含量正相关(=0.329,=0.050)。
2.1.2 试验结果验证 表7为通过Design-Expert软件对各指标进行分析后,以尽可能达到发酵产物中类胡萝卜素含量和胶红酵母菌数最大的一个最佳配方。
以表7配方为基础对两个指标进行模型预测,得出预测值如表8所示。再按照该配方进行发酵试验,将实测值与预测值进行显著性检验。由表8可知,类胡萝卜素的实测值略高于预测值,但差异不显著(>0.05)。
2.2 固态发酵条件优化
用正交设计软件对类胡萝卜素含量和胶红酵母细胞数进行逐个分析处理,找出最佳的配方方案,得到的试验方案如表9所示。由表9可知,就发酵产物中活菌数来看,极差C>E>D>A>B,因此C因素(发酵温度)被确定为最重要的影响因素,并且发酵温度在第4水平时(32℃)发酵产物中活菌数最多;之后进行主次因素依次分析,得到获取最多活菌数的发酵条件为C4E1D1A1B2。而从发酵产物中类胡萝卜素含量进行比较,极差C>D>B>E>A,因此,因素C是最重要的影响因素,并且发酵温度第2水平时(28℃)类胡萝卜素含量最高;然后进行主次因素依次分析,得到获取最高类胡萝卜素产量的发酵条件为C2D3B2E1A2。针对不同发酵目的的优化发酵方案不完全相同,如表10所示。
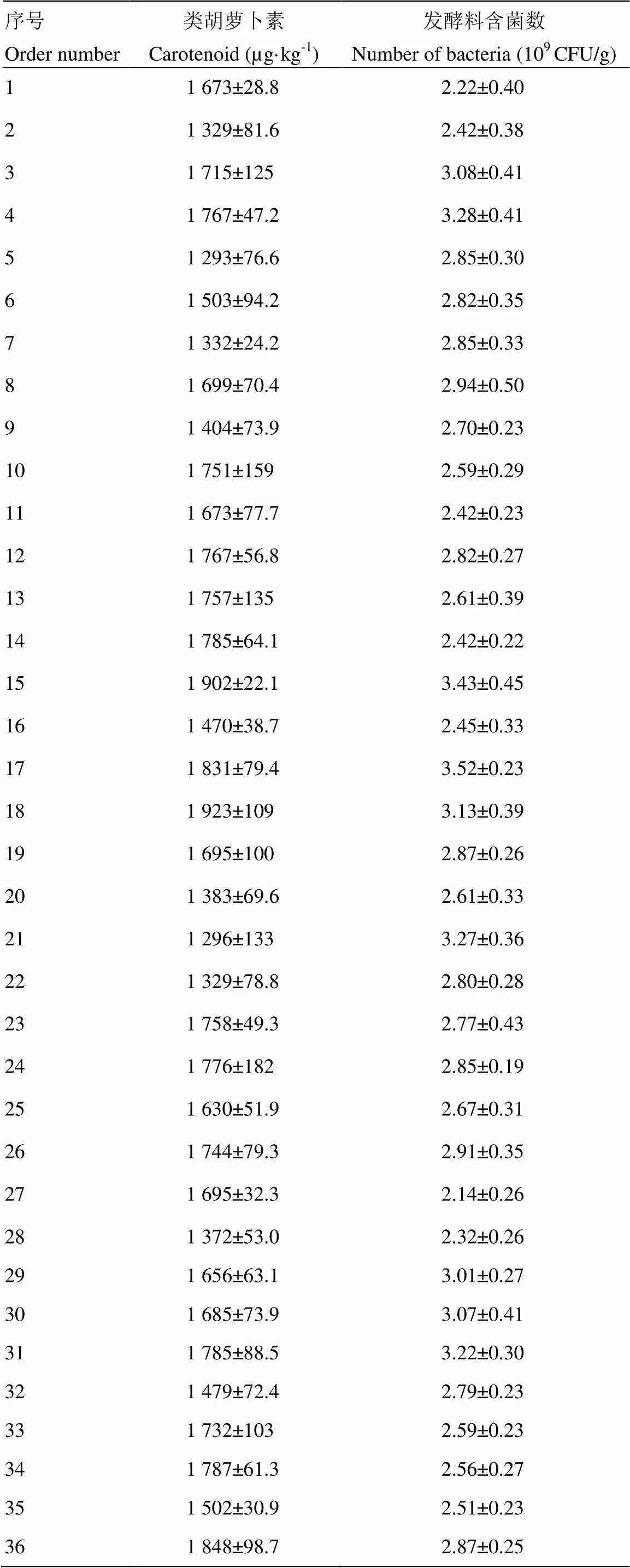
表4 胶红酵母固态发酵底物优化对类胡萝卜素产量和菌体数量的影响
n=3;数值为平均值±标准差。下同
n=3; The value is mean±SD. The same as below
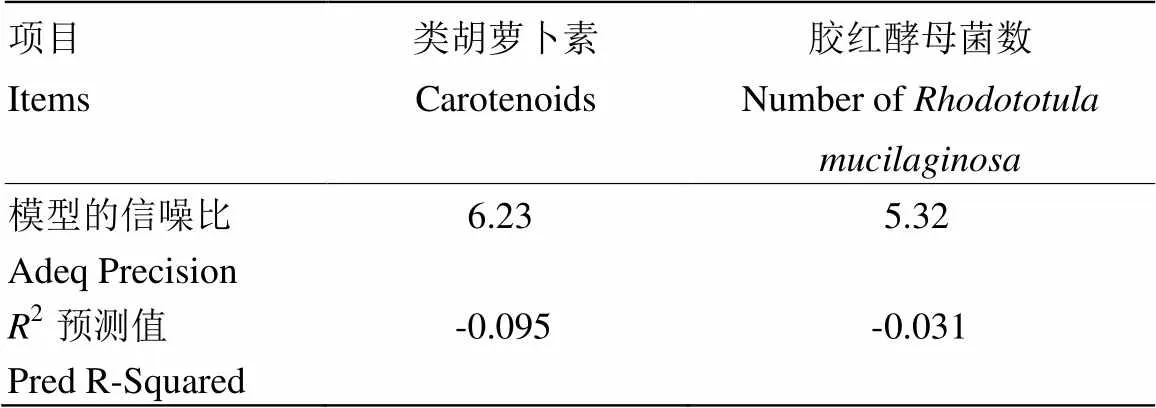
表5 模型的性噪比及R2 预测值
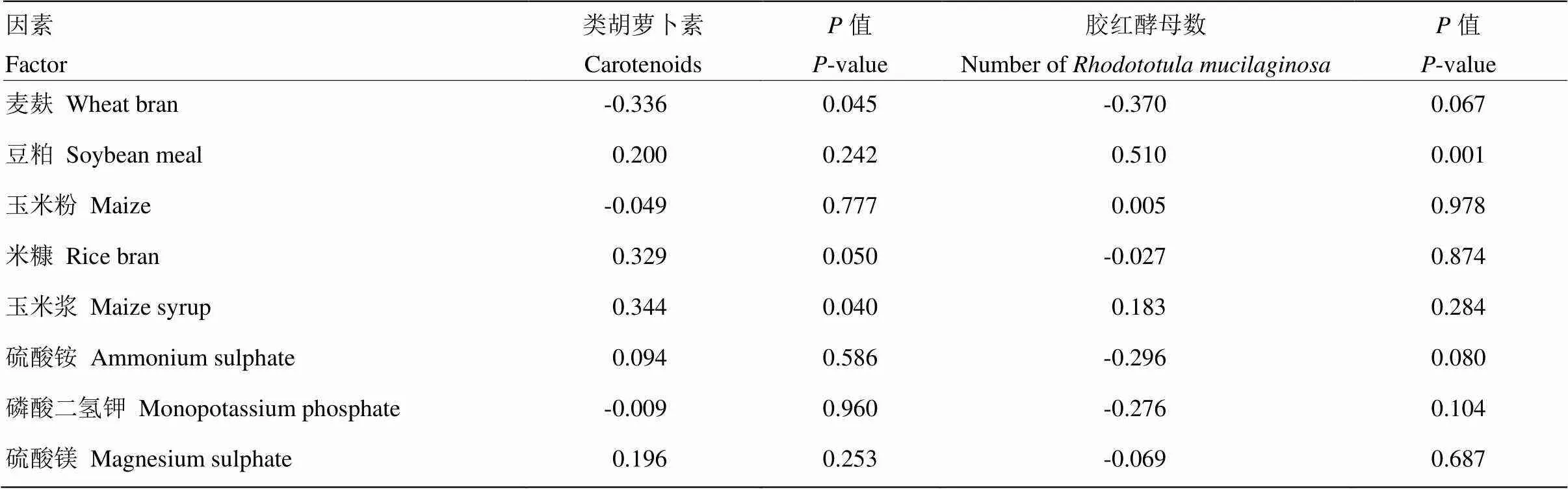
表6 发酵底物与胶红酵母类胡萝卜素产量及菌体数量的相关性

表7 胶红酵母固态发酵底物优化配方

表8 胶红酵母类胡萝卜素产量的模型预测值与实测值
为了更直观地反映各产物在不同因素水平下的变化,本研究还做了关于胶红酵母细胞数和类胡萝卜素含量的相关方差分析,分别如表11、表12所示。由表11可知,接种量、发酵温度、pH、含水量对发酵产物中胶红酵母活菌数均有极显著的影响(<0.001),其中发酵温度影响最大,其次是含水量,之后依次是接种量和pH。由表12得,发酵时间、发酵温度和pH对发酵产物中类胡萝卜素含量的影响均为极显著(<0.01),其中发酵温度的影响最大,其次为pH,最后是发酵时间。
根据影响主次性以及显著性程度,含水量对发酵产物中胶红酵母活菌数影响显著,最佳含水量取E2(60%);发酵时间对发酵产物中类胡萝卜素含量影响显著,且最佳发酵时间为B2(72 h);接种量活菌细胞数影响极显著,最佳接种量取A1(5.0%);pH对活菌数和类胡萝卜素含量影响均显著,因pH选取应优先考虑类胡萝卜素含量,本试验最佳pH取D3(6.0);发酵温度对活菌数和类胡萝卜素含量影响均显著,因本试验以产类胡萝卜素为主要优化目标,最佳发酵温度取C2(28℃)。最佳优化条件下发酵产物中类胡萝卜素含量与胶红酵母菌数如表13所示,对比表4可看出,发酵条件优化后,发酵产物中类胡萝卜素含量与活菌数得到明显增加。
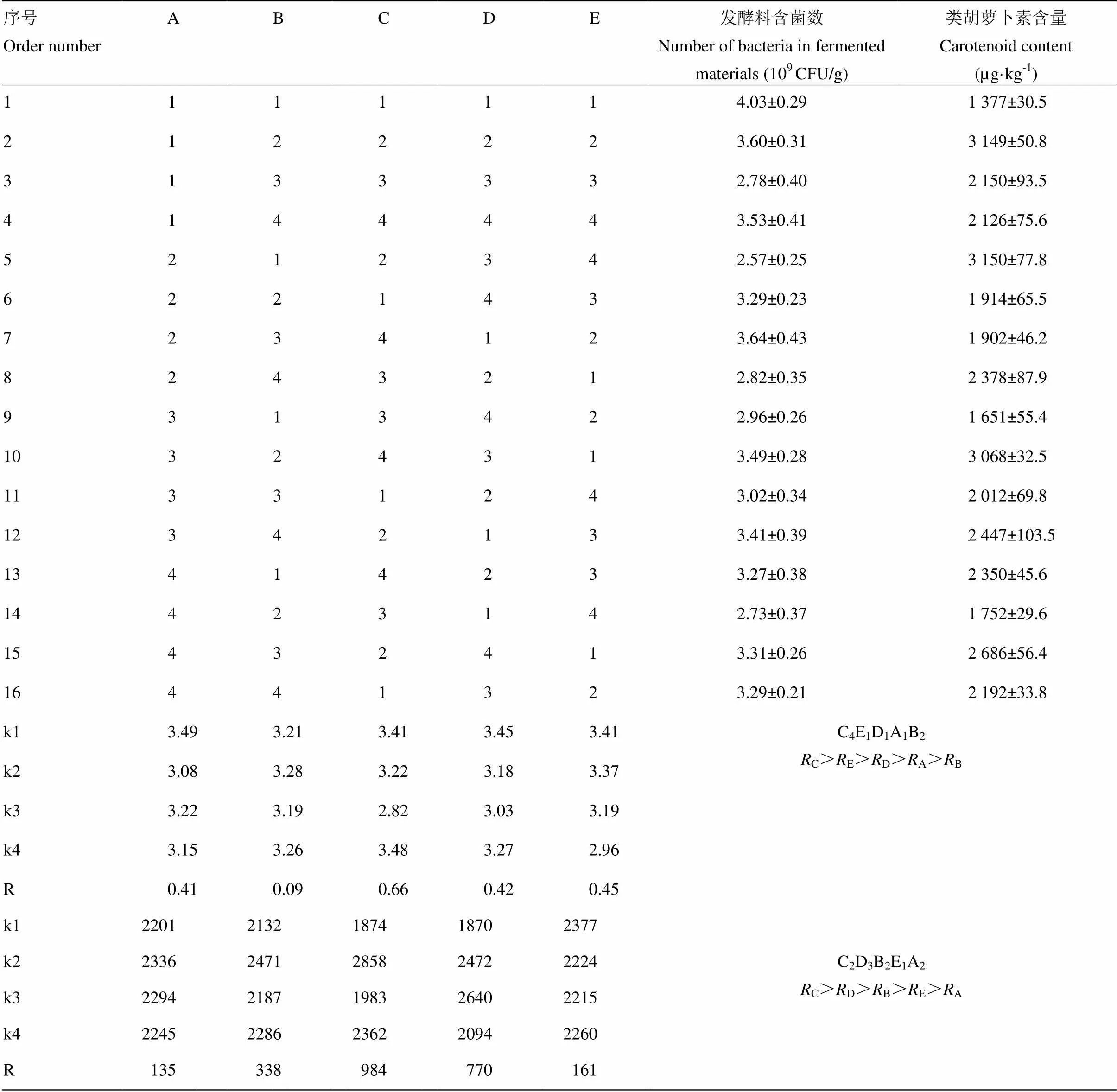
表9 胶红酵母固态发酵条件优化的正交试验结果
A—E分别代表接种量、发酵时间、发酵温度、pH、含水量;n=3;数值为平均值±标准差。下同
A-E represents inoculum amount, fermentation time, fermentation temperature, pH, and moisture content, respectively. n=3; the value is mean±SD. The same as below

表10 胶红酵母固态发酵条件优化方案
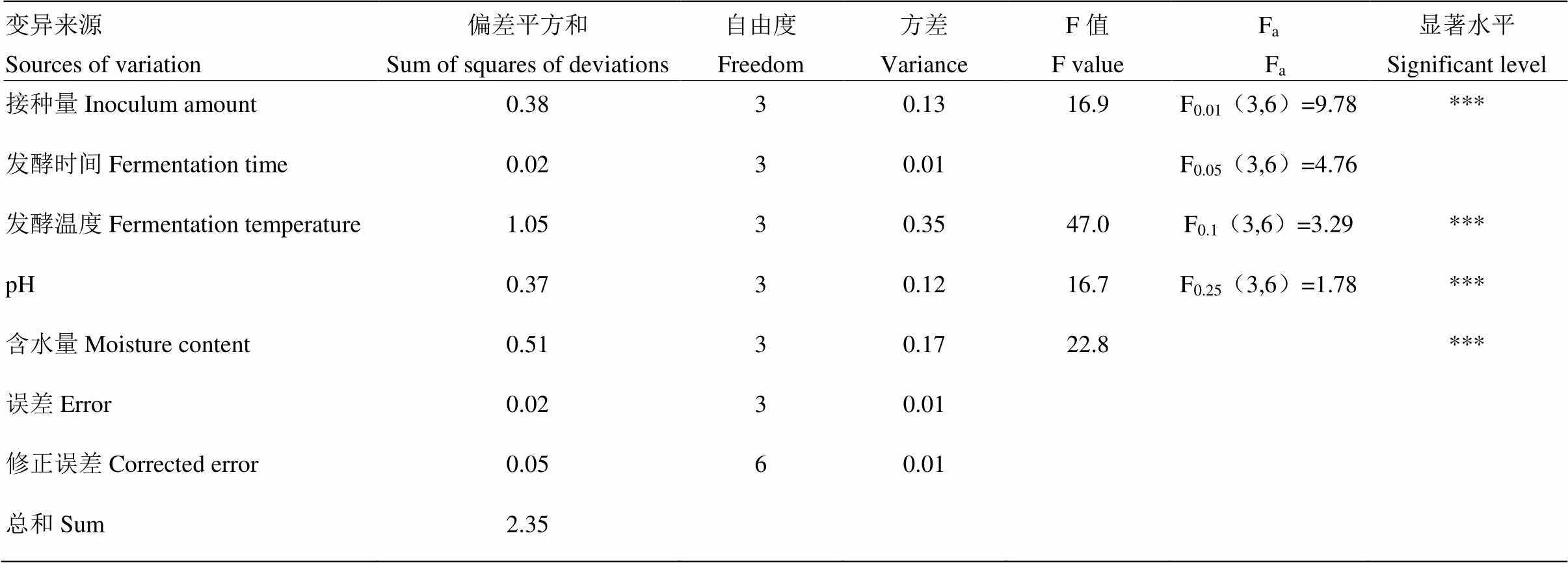
表11 发酵条件对胶红酵母菌体数量影响的方差分析
***代表<0.001;**代表<0.01。下同
*** represents<0.001; ** represents<0.01. The same as below
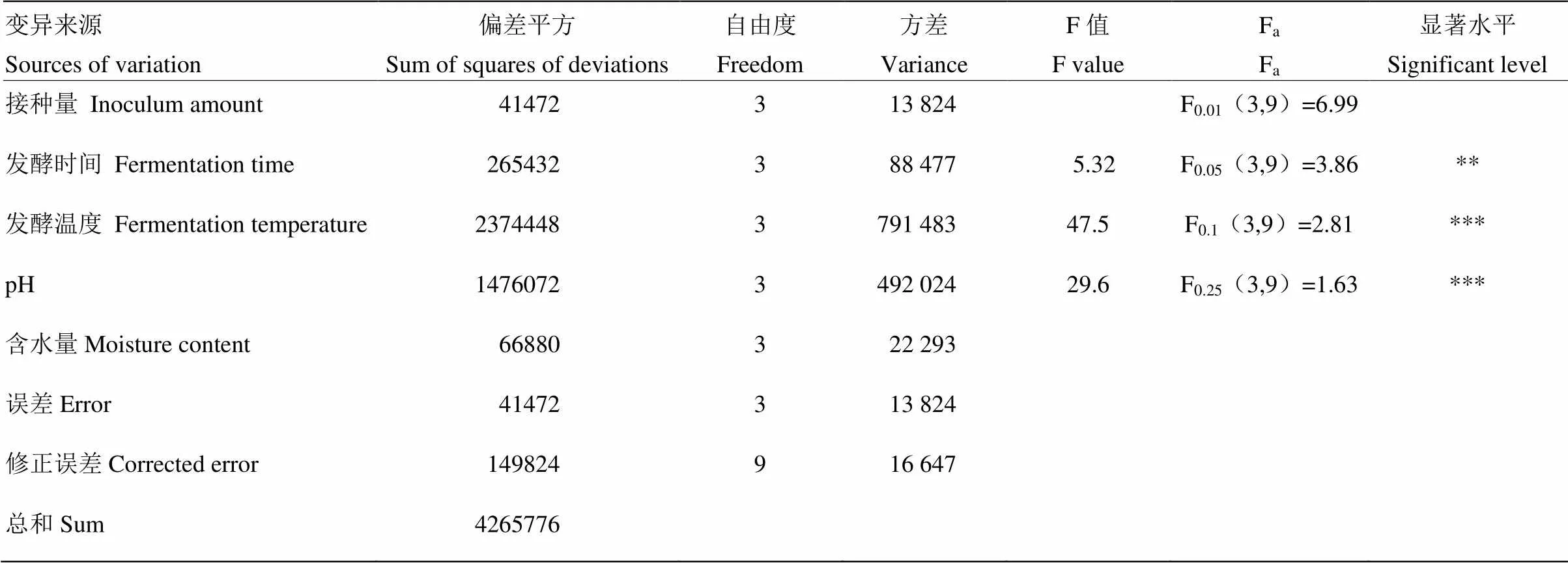
表12 发酵条件对发酵产物中类胡萝卜素含量影响的方差分析

表13 最优发酵工艺下类胡萝卜素产量和胶红酵母数量
2.3 胶红酵母固态发酵工艺优化对底物养分的影响
2.3.1 发酵前后底物常规营养成分对比分析 由表14可知,发酵后粗蛋白质、粗灰分和粗纤维含量显著高于发酵前(<0.05);发酵后含水量和粗脂肪含量显著低于发酵前;而发酵前后钙和磷的含量没有显著差异。
2.3.2 发酵前后底物氨基酸结果分析 由表15可知,发酵后苏氨酸、谷氨酸、脯氨酸含量显著高于发酵前(<0.05)。
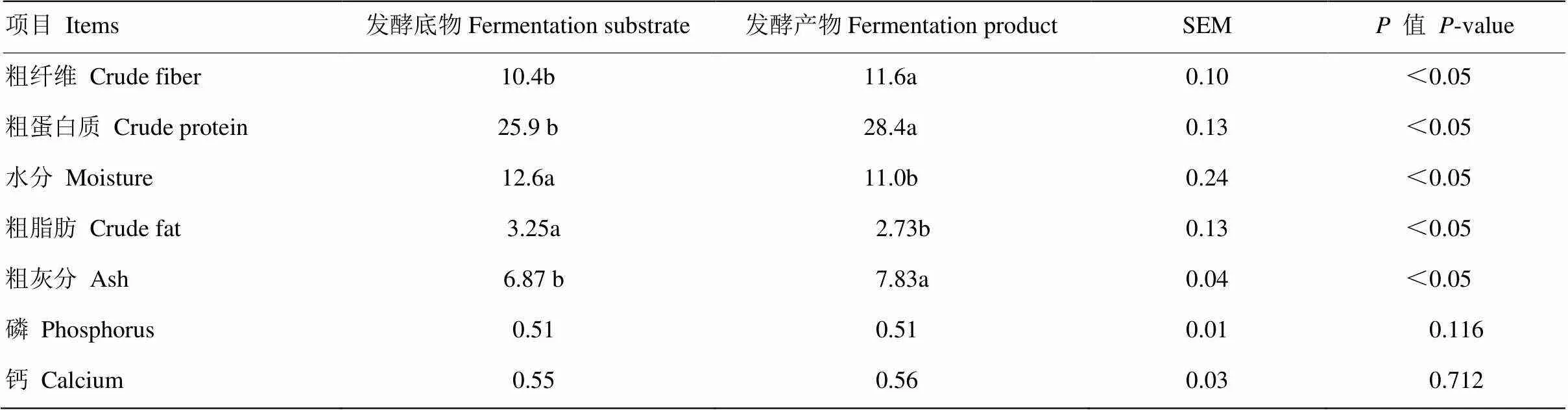
表14 胶红酵母发酵底物常规营养成分在发酵前后的变化
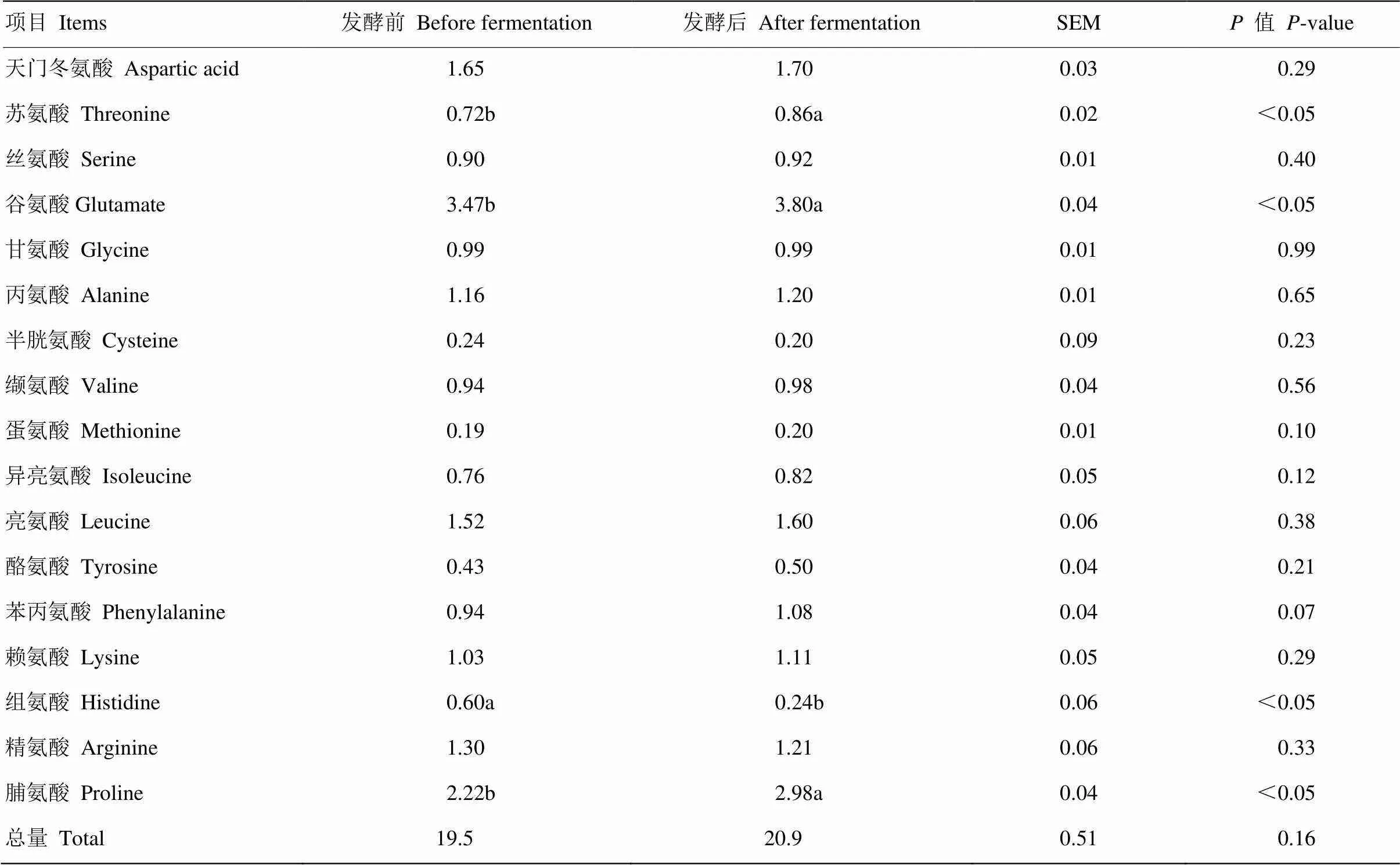
表15 胶红酵母发酵底物氨基酸含量在发酵前后的变化
3 讨论
本试验结果表明,发酵产物中类胡萝卜素含量与固态发酵底物中麦麸的添加量呈显著负相关。这一结果同过去的报道并不完全一致。众所周知,适量添加麸皮可以增加培养基的蓬松程度,有助于氧气的流通,促进好氧菌的生长[14]。但是,发酵底物中麸皮含量过高会影响酵母菌的发酵,其原因在于麸皮纤维含量高,会影响酵母菌的正常生长[15]。为最大限度地利用廉价底物资源,本研究选择了52.5%的麸皮含量作为最适浓度。与麦麸结果相反,发酵底物中豆粕含量与发酵产物中胶红酵母活菌数呈极显著正相关;发酵底物中玉米浆的含量与发酵产物中类胡萝卜素的产量呈显著正相关,可能是这些物质含有酵母生长所必需的蛋白质、氨基酸、维生素、微量元素及某些生长因子。
除麦麸、豆粕、玉米浆、米糠外,其他底物(玉米、硫酸铵、磷酸二氢钾、硫酸镁)与发酵产物中类胡萝卜素含量及胶红酵母活菌数均未达到显著相关。王岁楼等[16]也报道,K+和Mg2+并不能提高红酵母的类胡萝卜素产量。但有研究表明,KH2PO4、MgSO4和(NH4)2SO4对发酵产物中类胡萝卜素含量的影响均为正效应,因此,建议提高发酵底物中上述物质的实际水平[17-18]。另有研究表明,当K2HPO4和MgSO4的浓度分别为1 g·L-1和10 g·L-1时,海洋红酵母Y2细胞生物量最高;当K2HPO4和MgSO4的浓度分别为2.5 g·L-1和8 g·L-1时,类胡萝卜素产量最高[19]。因此,推测在一定剂量范围内,K+、PO43-、Mg2+、NH4+、SO42+与类胡萝卜素产量可能表现出剂量-效应关系,但超出一定范围,剂量-效应则不明显,甚至出现胶红酵母的生长或类胡萝卜素的合成受到抑制的情况[20-23]。
在本研究中,温度对类胡萝卜素产量的影响最大,其次是pH,这一结果与赵紫华等[24]报道的相反。有关资料显示,红酵母发酵产类胡萝卜素温度一般在30℃左右[25],且固态发酵适宜的温度在25—35℃[26-27],这些报道与本试验结果基本相符。关于发酵底物最适pH的报道也不尽相同,Aksu和Eren[28]报道,胶红酵母产类胡萝卜素的最适pH为7.0;张闯[29]研究得出红酵母发酵产类胡萝卜素的最适pH为6.0;还有报道指出,胶红酵母DBVPG 3853产类胡萝卜素的最适值pH为5.8[16]。关于发酵时间,本试验结果与梁晓华等[19]报道一致,而与王岁楼等[16]、刘卉琳[20]的报道不一致,原因可能是菌种、发酵底物或所采取的发酵工艺(固态与液态)不同。
本研究表明,胶红酵母产胡萝卜素的固态发酵工艺经优化后,发酵底物中的粗蛋白质提高9.67%,粗纤维提高11.5%,粗脂肪降低16%,钙和磷含量没有显著变化。此外,发酵后苏氨酸、谷氨酸、脯氨酸浓度显著高于发酵前,且总氨基酸含量提高了7.19%。通过发酵提高蛋白质或氨基酸含量在过去的研究中已得到广泛证实。Zhang等[30]研究表明,脱毒的麻籽饼粕经固态发酵后粗脂肪显著减少了5.53%,粗蛋白质含量增加15.1%。王建军[31]研究表明,利用混菌固态发酵黄酒糟后,发酵产物中共检测出17种氨基酸,除组氨酸、苯丙氨酸和脯氨酸外,其他14种氨基酸的含量均有不同程度的提高。孙展英[32]报道,利用曲霉X3发酵可使粗纤维含量降低51.3%,本研究发酵产物粗纤维升高可能与酵母菌基本不能利用纤维素类多糖有关。
4 结论
前人对胶红酵母的研究多采用液态发酵,本试验本着降低生产成本和环保的原则,采用固态发酵的方式。胶红酵母固态发酵产类胡萝卜素底物的最佳配比为麦麸52.5%、豆粕20.0%、玉米粉3.00%、米糠14.0%、玉米浆10.0%、硫酸铵0.40%、磷酸二氢钾0.05%和硫酸镁0.04%;最佳发酵条件为菌液接种量5.0%、发酵时间72.0 h、发酵温度28.0℃、pH 6.0、底物含水量60.0%。通过对胶红酵母固态发酵底物与发酵条件的优化,提高了发酵产物中类胡萝卜素产量,并改善了发酵底物的营养价值,使胶红酵母不仅可以生产类胡萝卜素,而且其发酵后的产物也可以直接用来饲喂动物。但胶红酵母固态产物对动物生产性能和在动物日粮中的最适添加量还需进一步探究。
[1] BANZATTO D, FREITA L A D, MUTTON M J R. Carotenoid production bycultivated in sugarcane juice, molasses, and syrup., 2013, 33(33): 14-18.
[2] TANG F Y. The silver bullet for cancer prevention: Chemopreventive effects of carotenoids., 2012, 2(3): 117-121.
[3] BHAGAVATHY S, SUMATHI P. Evaluation of antigenotoxic effects of carotenoids from green algaeusing human lymphocytes., 2012, 2(2):109-117.
[4] NELIS H J, DELEENHEER A P. Microbial sources of carotenoid- pigments used in foods and feeds., 1991, 70(3): 181-191.
[5] PERRIER V, DUBREUCQ E, GALZY P. Fatty-acid and carotenoid composition ofstrains., 1995, 164(3): 173-179.
[6] 董娟, 郑晓吉, 孙静涛, 史学伟. 红酵母产类胡萝卜素影响因素及检测方法研究进展. 粮食与油脂, 2013, 26(3): 49-51.
DONG J, ZHENG X J, SUN J T, SHI X W. Research advance in influencing factors of carotenoid producted by red yeasts and detection methods., 2013, 26(3): 49-51. (in Chinese)
[7] FERRAO M, GARG S. Studies on effect of media components on growth and α-carotene production byRC04., 2011, 11(1): 2551-2556.
[8] HERNANDEZ-ALMANZA A, CESAR MONTANEZ J, AGUILAR- GONZALEZ M A, MARTINEZ-AVILA C, RODRIGUEZ- HERRERA R, N.AGUILAR C.glutinis as source of pigments and metabolites for food industry., 2014, 5:
64-72.
[9] KOT A M, BLAZEJAK S, KURCZ A, GIENTKA I, KIELISZEK M.glutinis-potential source of lipids, carotenoids, and enzymes for use in industries., 2016, 100(14): 6103-6117.
[10] ROADJANAKAMOLSON M, SUNTORNSUK W. Production of beta-carotene-enriched rice bran using solid-state fermentation ofglutinis., 2010, 20(3): 525-531.
[11] HERNANDEZ-ALMANZA A, MONTANEZ-SAENZ J, MARTINEZ- AVILA C, RODRIGUEZ-HERRERA R, N.AGUILAR C. Carotenoid production byglutinis YB-252 in solid-state fermentation., 2014(7): 31-36.
[12] 杨文, 吉春明. 一种简单的胞壁破碎方法. 微生物学通报, 1995, 22(1): 58-59.
YANG W, JI C M. A simple method of crushing cell wall., 1995, 22(1): 58-59. (in Chinese)
[13] 王岁楼, 张鑫, 张平之. 红酵母类胡萝卜素提取方法研究. 食品与机械, 2000(6): 14-16.
WANG S L, ZHANG X, ZHANG P Z. The extraction of carotenoids from., 2000(6): 14-16. (in Chinese)
[14] 张玉诚, 薛白, 达勒措, 李秋瑾, 何宇. 混菌固态发酵白酒糟开发为蛋白质饲料的条件优化及营养价值评定. 动物营养学报, 2016, 28(11): 3711-3720.
ZHANG Y C, XUE B, DA L C, LI Q J, HE Y. Distillers Grains: Optimization of mixed bacterial solid-state fermentation conditions to produce protein feed and nutrient value analysis., 2016, 28(11): 3711-3720. (in Chinese)
[15] GABERT V M, SAUER W C, SCHMITZ M, AHRENS F, MOSENTHIN R. The effect of formic acid and buffering capacity on the ileal digestibilities of amino acids and bacterial populations and metabolites in the small intestine of weanling pigs fed semipurified fish meal diets., 1995, 75(4): 615-623.
[16] 王岁楼, 章银良, 王平诸. 红酵母RY-98产类胡萝卜素培养基的优选及其发酵生理学研究. 生物技术, 2000, 10(4): 24-27.
WANG S L, ZHANG Y L, WANG P Z. Studies on the selection of carotenoids fermentation medium for RY- 98 strain ofand its fermentative physiology., 2000, 10(4): 24-27. (in Chinese)
[17] 唐棠. 红酵母Y-5菌株产类胡萝卜素发酵条件的研究[D]. 雅安: 四川农业大学, 2011.
TANG T. Optimization of fermentation condition for production of carotenoid byY-5 [D]. Ya’an: Sichuan Agricultural University, 2011. (in Chinese)
[18] 张坤生, 连喜军, 李红, 任云霞. 红酵母高产β-胡萝卜素营养因子的选择. 食品工业科技, 2004, 25(7): 60-62.
ZHANG K S, LIAN X J, LI H, REN Y X. Nutrition factors selection for β-carotene of red yeast., 2004, 25(7): 60-62. (in Chinese)
[19] 梁晓华, 杨莺莺, 杨铿, 陈永青. 海洋红酵母Y2发酵产类胡萝卜素条件的研究. 中国微生态学杂志, 2011, 23(12): 1068-1073.
LIANG X H, YANG Y Y, YANG K, CHENG Y Q. Production of carotenoid by marine red yeast Y2., 2011, 23(12): 1068-1073. (in Chinese)
[20] 刘卉琳. 红酵母合成类胡萝卜素及体外转化维生素A的研究[D]. 长沙: 湖南农业大学, 2012.
LIU H L. Studies on production of carotenoid byand its conversion to vitamin A in vitro [D]. Changsha: Hunan Agricultural University, 2012. (in Chinese)
[21] 丛莉. 海洋红酵母产类胡萝卜素的研究[D]. 青岛: 中国海洋大学, 2006.
CONG L. Investigation on carotenoids from Marinesp. [D]. Qingdao: Ocean University of China, 2006. (in Chinese)
[22] TINOI J, RAKARIYATHAM N, DEMING R L. Simplex optimization of carotenoid production byusing hydrolyzed mung bean waste flour as substrate., 2005, 40(7): 2551-2557.
[23] 王增煌, 王文策, 翟双双, 谢强, 左鑫, 杨琳. 香蕉茎叶粉固态发酵条件优化及鹅对其养分利用率的研究. 动物营养学报, 2017, 29(4): 1283-1293.
WANG Z H, WANG W C, ZHAI S S, XIE Q, ZUO X, YANG L. Study on optimal solid state fermentation conditions of banana stems and leaves powder and its nutrient utilization for geese., 2017, 29(4): 1283-1293. (in Chinese)
[24] 赵紫华, 韩雪, 王丽丽, 郭晶晶, 张率, 韩萌, 荀静娜. 高产β-胡萝卜素的红酵母培养条件的优化. 食品与发酵科技, 2014, 50(4): 34-38.
ZHAO Z H, HAN X, WANG L L, GUO J J, ZHANG L, HAN M, XUN J N. The fermentation technology optimization with high β-carotene by red yeast., 2014, 50(4): 34-38. (in Chinese)
[25] KAISER P, SURMANN P, VALLENTIN G, FUHRMANN H. A small-scale method for quantitation of carotenoids in bacteria and yeasts., 2007, 70(1): 142-149.
[26] DOMYOUNG K, EUNJI C, JIWON K, YONGWOOG L, HWAJEE C. Production of cellulases bysp in a solid-state fermentation of oil palm empty fruit bunch., 2014, 13(1): 145-155.
[27] MAURYA D P, SINGH D, PRATAP D, Maurya J P. Optimization of solid state fermentation conditions for the production of cellulase by., 2012, 33(1): 5-8.
[28] AKSU Z, EREN A T. Carotenoids production by the yeast: Use of agricultural wastes as a carbon source., 2005, 40(9): 2985-2991.
[29] 张闯. 红酵母发酵生产类胡萝卜素的研究[D]. 大连: 大连工业大学, 2011.
ZHANG C. Preparation of carotenoids by fermention of[D]. Dalian: Dalian Polytechnic University, 2011. (in Chinese)
[30] ZHANG X Y, YANG Z H, LIANG J, TANG L, CHEN F. Detoxification of Jatropha curcas seed cake in solid-state fermentation of newly isolated endophytic strain and nutrition assessment for its potential utilizations., 2016, 109: 202-210.
[31] 王建军. 混菌固态发酵黄酒糟生产蛋白饲料的研究[D]. 杭州: 浙江大学, 2007.
WANG J J. Production and application of protein feed from yellow rice wine lees using mixed strains combinations [D]. Hangzhou: Zhejiang University, 2007. (in Chinese)
[32] 孙展英. 马铃薯渣固态发酵工艺研究及生物学价值评定[D]. 保定: 河北农业大学, 2014.
SUN Z Y. Study on technology of solid-State fermentation and evaluation of biological value of potato residue [D]. Baoding: Hebei Agricultural University, 2014. (in Chinese)
(责任编辑 赵伶俐)
The Solid-state Fermentation Process offor Producing Carotenoids
SUN JiaJing, LI Mao, SUN ZhiHong, TANG ZhiRu, ZHANG XiangXin, CHEN JinChao
(College of Animal Science and Technology/Laboratory for Bio-Feed and Animal Nutrition, Southwest University, Chongqing 400715)
【Objective】This study was performed to enhance carotenoid yield, to improve nutritional value of fermentation product, and to reduce the production cost of carotenoids through optimizing solid-state fermentation substrate and fermentation conditions of【Method】In this study,TZR2014was used as a inoculant. First, the Mixture-Design of Design-Expert software was used to design the fermentation substrate, and the contents of ingredients as followed: 50%-80% wheat bran, 6%-20% soybean meal, 3%-15% maize flour, 2%-14% rice bran, 2%-10% maize syrup, 0.4%-2.5% ammonium sulfate, 0.05%-0.5% monopotassium phosphate, and 0.03%-0.3% magnesium sulfate. Then the optimal ratio of ingredients in substrate was determined according to the carotenoid yield. Based on this result, an L16(45) orthogonal design was used to optimize the fermentation conditions, including inoculum (5.0%-12.5%), fermentation time (60.0-96.0 h), fermentation temperature (26-32℃), and fermentation pH (60.0%-75.0%). Finally, the number ofand contents of carotenoids, crude fiber, crude protein, water, crude fat, ash, calcium, phosphorus, and amino acids in fermentation product were determined to evaluate the effects of the optimized fermentation process on the nutritional values of fermentation product. 【Result】The results showed that there was a positive correlation between maize starch content in substrate and carotenoid content in fermentation product (=0.344,=0.040) or between rice bran content in fermentation substrate and carotenoid content in fermentation product (=0.329,=0.050). There was a significantly negative correlation between carotenoid yield and the content of wheat bran in solid-state fermentation substrate (=-0.336,=0.045). There was a positive correlation between the number of live bacteria ofin fermentation product and the content of soybean meal in fermentation substrate (=0.510,=0.001). Inoculum, fermentation temperature, pH, and moisture had extremely significant impacts on the number of(<0.01), thereinto, fermentation temperature had the greatest effect on the number of, followed by moisture, inoculum, and pH. Fermentation time, fermentation temperature, and pH had extremely significant influences on the carotenoid content in the fermentention product (<0.01), and fermentation temperature had the greatest influence on the carotenoid content in the fermented product, followed by pH and fermentation time. After the optimization of the fermentation process, the carotenoid yield byTZR2014was increased to 4 535 μg·kg-1; the bacteria number was increased to 3.79×109CFU/kg; the contents of crude fiber, crude protein, ash, threonine, glutamate, and proline in fermentation product were significantly increased (<0.05), meanwhile, the contents of histidine, water, and crude fat was significantly decreased (<0.05). 【Conclusion】The optimal ratio of solid-state fermentation substrate forwas as followed: 52.5% wheat bran, 20.0% soybean meal, 3.0% maize flour, 14.0% rice bran, 10.0% maize syrup, 0.4% ammonium sulfate, 0.05% monopotassium phosphate, and 0.04% magnesium sulfate. The optimal fermentation conditions were as followed: inoculum 5.0%, fermentation time 72 h, fermentation temperature 28.0℃, pH 6.0, and moisture 60.0%. The results suggested that the optimized fermentation process ofenhanced the yield of carotenoids and improved the nutritional value of fermentation product.
; solid-state fermentation; carotenoids; fermentation substrates; fermentation conditions
10.3864/j.issn.0578-1752.2018.10.017
2017-10-09;
2018-03-05
国家自然科学基金(31772610)、重庆市留学人才创新计划重点项目(cx2017024)、农业部“948”项目(2015-Z74)
孙佳静,E-mail:2020853948@qq.com。通信作者孙志洪,E-mail:465179460@qq.com
