响应曲面法优化四氟硼酸锂制备工艺研究
2018-05-30王永勤薛旭金郭贤慧
王永勤,薛旭金,郭贤慧
(多氟多化工股份有限公司,河南焦作454006)
随着全球能源需求的不断增长和能源利用率不足等问题层出不穷,许多不可再生资源逐渐枯竭,人们赖以生存的环境也遭受了严重的破坏。因此,能源匮乏和环境污染已经成为制约当代社会发展的两大壁垒,人们急需开发太阳能、风能等新型清洁能源,以缓解经济发展速度过快与能源环境之间日益尖锐的矛盾[1]。1991年,索尼公司攻克了锂离子电池的技术难题,率先发布了商用锂离子电池,并在电子设备中进行大力推行和应用。与传统电池(如镍铬电池等)相比,锂离子电池的优点众多,不仅能够为手机、电脑等便携式电子产品提供理想能源,也能够满足未来新能源电动汽车的高安全、高容量密度和高倍率等需求。锂离子电池以其不可替代的优势已在人们生活中扮演着越来越重要的角色[2-3]。
现有商业化锂离子电池采用的电解质通常为六氟磷酸锂(LiPF6)。 但是,LiPF6对水分十分敏感,其制备过程和使用条件也比较苛刻,必须在完全隔离水分的环境中进行[4]。相比之下,新型锂盐四氟硼酸锂(LiBF4)具有对水分敏感性低、热稳定性好、低温性能良好等优点,可以有效弥补LiPF6的缺点,现已成为广大研究者的关注热点[5-8]。
响应曲面法是利用合理的实验设计方法并通过实验得到一系列数据,采用多元二次回归方程来拟合影响因子与响应变量之间的函数关系,通过对回归方程的分析来寻求最优工艺参数,解决多变量问题的一种统计方法[9]。和单因素实验法和正交实验法相比,响应曲面法具有如下优点:1)实验设计合理;2)确定实验结果的最佳值;3)可将得出的模拟方程与真实值进行对比分析[9]。因此,笔者首次采用响应曲面法研究反应比例、反应时间和降温速率及其相互作用对LiBF6产品纯度的影响,提出了一种响应曲面回归模型,并将其应用于实验研究中。
1 实验部分
1.1 原料、试剂和仪器
原料与试剂:氟化锂[纯度>99.99%,w(H2O)<1.0×10-4,多氟多化工股份有限公司];氢氟酸[纯度>99.99%,w(H2O)<4.0×10-5,多氟多化工股份有限公司];三氟化硼[纯度>99.5%,w(H2O)<4.0×10-5,大连光明化工研究院];氮气[纯度>99.999%,w(H2O)<1.0×10-5,φ(O2)<3×10-6,河南源正科技发展有限公司]。
仪器:DFY-10/60型低温冷却反应浴、MiniFlex 600型X射线衍射仪、Bruker AV 400型核磁共振仪(399.65 MHz)、JSM-6360LV 型扫描电镜、ICPM 8500型电感耦合等离子体发射光谱仪(ICP-OES)。
1.2 实验方法
1.2.1 操作步骤
氮气氛围下,将一定量的氟化锂(LiF)溶解在无水氢氟酸(HF)中,n(LiF)∶n(HF)=1∶2;通入三氟化硼(BF3)气体,反应一段时间后,梯度降温至-10℃,结晶3 h;过滤;氮气气氛下,室温干燥15 h,即得高纯LiBF4产品。
1.2.2 单因素实验设计
通过查阅相关文献,分别选取了3个影响因子:LiF和BF3物质的量比、反应时间、降温速率做了研究,并按照1.3节中的表征方法(3)计算LiBF4产品的纯度。
1.2.3 响应曲面实验设计
本实验在单因素实验设计的基础上,采用Minitab分析软件,进行3因素3水平的响应曲面分析,以确定最佳实验参数。因素及水平如表1所示。
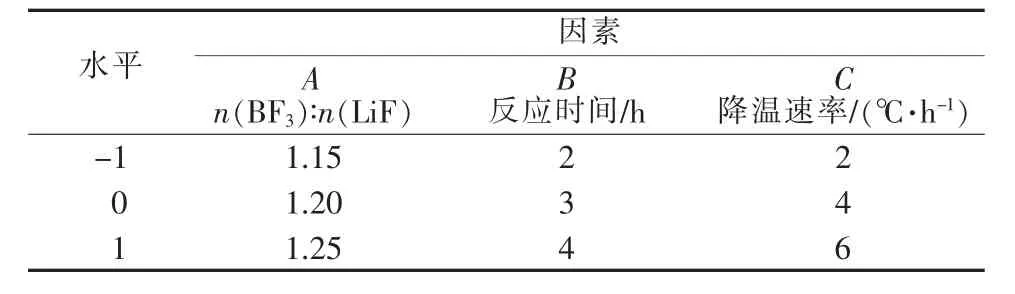
表1 响应曲面实验因素及水平
1.3 产品表征
1)微观结构:采用核磁共振仪对LiBF4产品的微观结构进行表征。
2)表面形貌:采用扫描电镜对LiBF4产品的表面形貌进行表征。
3)纯度:首先分析LiBF4产品中阳离子、阴离子、游离酸、水分、不溶物含量,再用100%减去上述杂质含量即可得到LiBF4产品的纯度。杂质含量测定方法:Na+等阳离子利用ICP-OES测定;NO3-等阴离子利用离子色谱测定;游离酸(以HF计)采用微量滴定管测定;在手套箱中采用831水分测定仪进行水分测定;不溶物利用玻璃砂坩埚、电烘箱测定。
2 结果与讨论
2.1 单因素实验
实验考察了 BF3和 LiF物质的量比(0.6、0.8、1.0、1.2、1.4 和 1.6)对 LiBF4产品纯度的影响,结果如图1a所示。由图1a可知,随着BF3与LiF物质的量比逐渐增大,LiBF4产品的纯度呈现出先增大后稳定的趋势,在 n(BF3)∶n(LiF)为 1.2∶1 左右时达到最大值。其原因:当BF3与LiF物质的量比为0.6~1(不包括1)时,LiF过量,而过量的LiF会随着反应的进行沉积在LiBF4产品中,从而导致产物的不溶物杂质升高,纯度较低;当BF3与LiF物质的量比为1~1.6时,反应物BF3的比例逐渐增大,使得LiF反应逐渐完全,沉积在LiBF4产品中的LiF逐渐减少,产品纯度逐渐提高。 当 n(BF3)∶n(LiF)=1.2 时,LiBF4产品的纯度趋于稳定。因此,实验选择适宜的BF3与LiF物质的量比为1.2左右。
反应时间对反应的进行有重要的影响。当反应不完全时,产品中容易引入其他杂质,导致产品纯度较低。 本实验中,考察了反应时间(2、4、6、8、10、12 h)对LiBF4产品纯度的影响,结果见图1b。由图1b可知,加入LiF后,随着反应时间不断延长,LiBF4产品的纯度呈现出先增大后稳定的趋势。在前6 h时,LiBF4产品的纯度不断增大,这是因为随着反应时间的延长,LiF反应逐渐完全,LiBF4产品的结晶形态趋于完整,从而使得产品纯度不断增大;当反应时间超过6 h时,产品的纯度基本不再变化,因为此时LiF和BF3反应已达到动态平衡。综合考虑,实验选择适宜的反应时间为6 h左右。

图1 单因素条件对产品纯度的影响
LiF与BF3反应完全后,可以通过降低温度的方式来减小LiBF4在HF中的溶解度,从而析出LiBF4,并通过过滤干燥的方式得到高纯LiBF4产品。实验考察了降温速率(2、4、6、8、10 ℃/h)对 LiBF4产品的纯度的影响,结果见图1c。由图1c可知,随着降温速率的增大,产品纯度逐渐降低。这是因为溶液降温的速率越快,LiBF4产品的析出速率越快,容易导致LiBF4晶核生长不完整,Na+等阳离子和Cl-等阴离子易于掺杂在LiBF4晶体中,使得LiBF4产品中杂质含量增大,产品纯度降低。综合考虑,实验选择适宜的降温速率为2℃/h。
2.2 响应曲面分析
2.2.1 拟合模型方差分析
在单因子实验的基础上,在较优水平区间内进行中心复合设计,并以LiBF4产品的纯度为响应变量,找到最佳实验参数。实验设计及其所对应的实验结果如表2所示。回归模型方差分析如表3所示。

表2 实验设计及检测结果

表3 回归模型方差分析表
运用Minitab软件对表2中的实验结果进行多元线性回归分析及二次项拟合,得到纯度的回归方程:

由表3可知,回归模型所对应的P值为0.000 1,说明该实验模型选择比较合适,具有显著性,实验相对误差较小。而且该模型的校正决定系数为0.9854,说明该模型能够对响应变量98.54%的变化规律作出解释。由表3还可以看出:一次项中,A、C所对应的P值小于0.05,所以这2个因素对LiBF4产品的纯度有显著影响;二次项中,A2、C2和反应比例与降温速率的交互作用(AC)所对应的P值小于0.05,所以这2个因素对LiBF4产品的纯度有显著影响。
2.2.2 响应曲面优化
根据2.2.1节所建立的模型方程,应用响应曲面法绘制响应变量LiBF4产品的纯度与A、B、C 3个影响因子之间的三维响应曲面分析图,结果见图2。在实验参数优化区间选择合适的前提下,最佳实验参数应位于响应曲面顶点附近的区域。若响应曲面的坡度较为平缓,则表明该影响因子对响应变量的影响不显著;相反,则意味着该影响因子对响应变量的影响显著。

图2 纯度与反应时间、反应比例(a)及纯度与降温速率、反应比例(b)和纯度与降温速率、反应时间(c)的曲面图
由图2a可看出,当降温速率为2℃/h时,反应时间对产品纯度的影响曲线变化较为平缓,说明其对产品纯度的影响比较小;而反应比的影响曲线呈现出先升高后降低的趋势,说明其对产品纯度的影响较大。由图2b可知,当反应时间为6 h时,反应比和降温速率的交互作用对产品纯度的影响明显,曲线呈上升趋势,且变化幅度较大。由图2c可以看出,当 n(BF3)∶n(LiF)=1.2 时,反应时间和降温速率的交互作用对产品纯度有一定的影响,但是,与反应比和降温速率的交互作用对产品纯度的影响相比,该影响作用相对较小。
通过Minitab软件对回归模型进行分析可以得出最佳实验参数:n(BF3)∶n(LiF)=1.21、反应时间为6 h,降温速率为1.59℃/h。该实验条件下制备的LiBF4产品纯度理论值为99.99%。
2.2.3 实验验证
为进一步验证响应曲面优化结果的可靠性,实验采用上述最佳实验参数进行LiBF4的制备。共做3次平行实验,所得产品的纯度平均值为99.986%,与理论值的误差为0.004%。实验值与理论值非常接近,说明该实验模型具有高度的可靠性和实用价值。
2.3 结构表征
采用核磁共振仪对LiBF4的结构进行表征,测试试剂为氘代氯仿(DMSO-D6),测试温度为25℃,内标物为四甲基硅烷(SiMe4),结果见图3。图3中的化学位移和文献[8]中的实验数据一致,说明本实验制备的产品为LiBF4产品。由图3a可知,1F NMR谱图中,LiBF4在-1.5×10-4处有且只有一个特征峰,这是因为LiBF4的分子结构中虽然含有4个F原子,但是这4个原子处于同等环境中。所以,1F NMR谱图中有且只有一个特征峰;而且,该1F NMR谱图中未出现任何杂峰,说明该产品的纯度很高。从图3b可知,1B NMR谱图中,LiBF4在化学位移0处有且只有一个特征峰,这是因为LiBF4的分子结构中只含有一个B原子,而且,该1B NMR谱图中也未出现任何杂峰,也进一步验证了该产品的纯度很高。
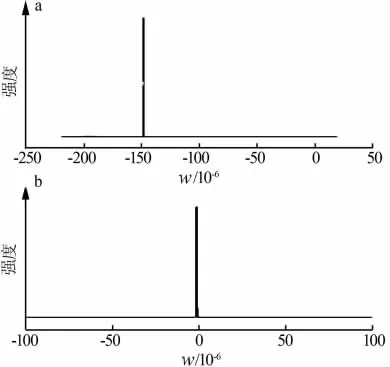
图3 LiBF4的 1F NMR谱图(a)和1B NMR谱图(b)
3 结论
采用响应曲面法研究了反应比、反应时间和降温速率及其相互作用对LiBF4产品纯度的影响,得出结论:1)利用响应曲面中心组合设计(CCD)建立的模型能够解释3个影响因素及其交互作用对LiBF4产品纯度的影响规律,同时具有良好的预测作用;2)对纯度和3个影响因素之间建立了回归方程,该方程与实际数据之间具有很好的吻合度;3)确定最佳实验参数:n(BF3)∶n(LiF)=1.2、反应时间为 6 h、降温速率为1.59℃/h,且该实验条件下制备的LiBF4产品纯度可达99.99%。
[1] Thackeray M M,Wolverton C,Isaacs E D.Electrical energy storage for transportation-approaching the limits of,and going beyond,lithium-ion batteries[J].Energy Environ.Sci.,2012,5(7):7854-7863.
[2] Tarascon J M,Armand M.Issues and challenges facing rechargeable lithium batteries[J].Nature,2001,414(6861):359-367.
[3] Armand M,Tarascon J M.Building better batteries[J].Nature,2008,451(7179):652-657.
[4] 沙顺萍.锂离子电池电解质材料六氟磷酸锂的制备及其性能研究[D].青海:中国科学院青海盐湖研究所,2005.
[5] Zhang S S,Xu K,Jow T R.Study of LiBF4as an electrolyte salt for a Li-ion battery[J].Journal of the Electrochemical Society,2002,149(5):A586-A590.
[6] 桑俊利,赵庆云,刘大凡.锂离子电池电解质盐四氟硼酸锂的制备与表征[J].无机盐工业,2015,47(7):75-78.
[7] 张玥,王坤,刘大凡.锂离子二次电池电解质四氟硼酸锂制备技术研究进展[J].无机盐工业,2014,46(3):64.
[8] 彭静红.溶液法制备电池级四氟硼酸锂及电化学性能研究[D].南昌:南昌大学,2014.
[9] 鲁敏.细菌纤维素的制备及其对重金属离子的吸附性能研究[D].沈阳:东北大学,2012.
