血清鞘脂用于乙肝相关甲胎蛋白阴性肝细胞癌的诊断价值研究
2018-05-30蒋莹莹程香普卞丹丹段钟平郑素军张金兰
蒋莹莹,铁 偲,王 扬,程香普,卞丹丹,王 婷,刘 梅,段钟平,郑素军,张金兰
1.首都医科大学附属北京佑安医院疑难肝病与人工肝中心,北京 100069;2.协和医科大学中国医学科学院药物研究所
乙型肝炎病毒(hepatitis B virus, HBV)感染是全世界的重要公共卫生问题,据统计,全球约有30%的人口目前或既往曾感染过HBV。HBV感染是肝硬化和肝癌的重要病因,约40%的男性和15%的女性慢性HBV感染者最终死于肝硬化或肝细胞癌(hepato cellular carcinoma,HCC)[1-2]。
甲胎蛋白(alpha-fetoprotein,AFP)是目前临床上HCC诊断及复发监测最灵敏、最特异的肿瘤标志物[3]。尽管如此,在HCC患者中,只有约60%的患者出现AFP的升高,即高达40%的HCC无法通过筛查AFP来早期发现[4]。由于HBV相关HCC多数在肝硬化基础上发生,寻找特异的、能将AFP阴性HCC与乙肝肝硬化相区别的肿瘤标志物,则有助于AFP阴性HCC的筛查、早期诊断和及时治疗,最终提高该类患者的生存率。
近来研究[5]显示,鞘脂不仅是构成细胞膜不可或缺的基本成分,且是重要的脂质调控分子,在介导细胞增殖、分化及细胞凋亡的信号传递过程中起到重要作用,是目前研究的热点。多项研究[5-10]显示,鞘脂组学代谢参与到乙型肝炎、丙型肝炎、酒精性肝病等肝脏疾病的发生、发展过程中,且鞘脂代谢紊乱参与了HCC的发病过程。因此,我们推测,基于HBV相关AFP阴性HCC(本文简称“乙肝相关AFP阴性HCC”)患者外周血清鞘脂表达谱,有可能筛选出其诊断标志物。本研究对此进行了初步探索,现将结果报道如下。
1 资料与方法
1.1一般资料收集2014年7月至2015年5月在首都医科大学附属北京佑安医院疑难肝病及人工肝中心住院的64例患者,包括49例乙肝肝硬化患者及15例乙肝相关AFP阴性HCC患者。所有纳入本研究的患者血清HBsAg或HBV DNA阳性超过6个月。所有收集的血清标本在-80 ℃冰箱冷冻保存。本研究经首都医科大学附属北京佑安医院医学伦理审查委员会批准。
1.2纳入及排除标准肝硬化的诊断标准:影像学、生物化学或血液学检查存在肝细胞合成功能障碍或门静脉高压症(如脾功能亢进及食管胃底静脉曲张)证据,或组织学符合肝硬化诊断(例如Metavir评分=4分或Ishak评分≥5分);或Fibroscan的结果>17.5 kPa。所有患者经影像学或肝穿病理检查排除HCC。
AFP阴性HCC的诊断标准:血清AFP阴性(≤20 ng/ml)。病灶直径1~2 cm情况下,两种影像学(CT、MRI)检查均存在HCC典型表现(动脉期快速不均质血管强化,而静脉期或延迟期快速洗脱);病灶直径≥2 cm时,CT和MRI两项影像学检查中,有一项显示上述HCC的特征;或经肝脏组织病理诊断确诊[11]。患者均为首次诊断HCC,在采集血标本时未接受过手术(包括肝移植)、介入、放化疗、血管靶向药物等任何针对HCC的相关治疗。
排除标准:其他病因(包括自身免疫性、酒精性或药物性)导致的慢性肝病;除肝脏损伤外伴有其他严重的活动性身心疾病,包括未被控制的原发性肾脏、心脏、肺脏、血管性、神经性、代谢性疾病(明显甲亢、严重糖尿病和肾上腺疾病);脂质代谢异常:严重高脂血症、脂质贮积病、肥胖症(BMI≥25 kg/m2)、免疫缺陷病或合并其他系统肿瘤等;妊娠期或哺乳期。
1.3血样本的检测血清鞘脂的检测采用高效液相色谱法与串联质谱法(high-performance liquid chromatography coupled to tandem mass spectrometry, HPLC-MS/MS),由中国医学科学院药物研究所完成。HPLC-MS/MS在带有电喷雾接口的H重四极质谱分析仪和Agilent 1200 RRLC系统的Agilent 6410B 三级四级质谱仪(Agilent Technologies Inc, Santa Clara, 美国)上进行。本课题组既往已有多项研究[7,12-14]使用该方法检测血样本鞘脂浓度。
肝功能、AFP等检测由首都医科大学附属北京佑安医院检验中心完成。使用自动生化检测器(AU640生化分析仪,OLYMPUS,日本)进行丙氨酸氨基转移酶(ALT)和天冬氨酸转氨酶(AST)等生化指标的测定。血清APF检测使用ADVIA Centaur XP免疫分析系统(Siemens)。

2 结果
2.1患者一般临床特征64例患者中,男52例,女12例,年龄(53.33±11.56)岁。尽管乙肝相关AFP阴性HCC组患者ALT、AST较乙肝肝硬化组患者水平高,但差异无统计学意义(P>0.05)。两组患者的肝脏纤维化指标(FIB-4评分、APRI评分)及肝病严重程度的指标 (凝血功能、TBIL、ALB、MELD评分等)相比,差异均无统计学意义(P>0.05)(见表1)。

表1 乙肝相关AFP阴性HCC患者和乙肝肝硬化患者一般特征Tab 1 The characteristics of HBV-related AFP negative HCC and cirrhosis patients
注: TBIL: 总胆红素;DBIL: 直接胆红素;TP:总蛋白;ALB: 白蛋白;GGT: 谷氨酰转肽酶;PLT: 血小板;PTA: 凝血酶原活动度;INR: 国际标准化比率;APTT: 活化部分凝血活酶时间;MELD: 终末期肝病模型。
2.2乙肝相关AFP阴性HCC患者血清鞘脂表达情况本研究共检测了61种鞘脂,其中14种鞘脂水平在两组患者间差异有统计学意义(P<0.05)(见表2)。对该14种鞘脂表达水平进行正态、UV处理后,使用OPLSDA模型探索潜在的能够区分乙肝相关AFP阴性HCC和乙肝肝硬化的鞘脂标志物,满足既定三个条件的鞘脂分别为Cer(d18∶1/8∶0)-1-P、Sphingosine (d17∶1)-1-P和Sphingosine (d18∶1)-1-P。这三种血清鞘脂在乙肝相关AFP阴性HCC患者中的水平分别为217.74 pmol/0.1 ml、62.99 pmol/0.1 ml、58.28 pmol/0.1 ml,分别高于乙肝肝硬化患者的207 pmol/0.1 ml、57.81 pmol/0.1 ml、56.26 pmol/0.1 ml(P均≤0.001)。
将三种鞘脂纳入Logistic多因素回归分析,结果表明,Cer(d18∶1/8∶0)-1-P (OR=0.667,95%CI: 0.481~0.923,P<0.05)与乙肝相关AFP阴性HCC独立相关(见表3)。

表2 乙肝相关AFP阴性HCC、乙肝肝硬化患者血清鞘脂水平Tab 2 Serum sphingolipid levels in HBV-related AFP-negative HCC and cirrhosis patients pmol/0.1 ml
续表2

鞘脂总例数 (n=64)均值 标准误乙肝肝硬化(n=49)均值标准误乙肝相关AFP阴性HCC(n=15)均值标准误Z值P值Cer(d18∶1/22∶0)5465.16550.95379.6601.355744.661330.23-0.3880.698Cer(d18∶1/24∶0) 14501.361821.5712398.831146.0121369.656678.13-0.7530.452Cer(d18∶1/24∶1) 35961.394611.1530627.362923.6853385.8916857.7-0.8160.414Cer(d18∶1/26∶0) 629.7791.24484.4943.431104.38343.05-2.6550.008Cer(d18∶1/26∶1)1613.69256.661205.89118.682945.86970.3-2.6070.009C28(octacosanoic acid derivatives)60.250.260.080.1560.80.72-0.8560.392Cer(d18∶1/8∶0)-1-P209.520.822070.36217.742.25-4.6520.000Cer(d18∶1/12∶1)-1-P 88.952.4888.963.1988.931.95-1.4580.145Cer(d18∶1/14∶1)-1-P 60.360.1560.320.1860.490.26-1.0940.274Cer(d18∶1/14∶0)-1-P(a)60.910.2360.820.2761.20.46-0.8560.392Cer(d18∶1/14∶0)-1-P(b)108.397.72111.129.8699.496.97-0.8160.414Cer(d18∶1/16∶0)-1-P89.925.5894.47.0875.323.96-1.1410.254Cer(d18∶1/16∶1)-1-P 73.473.874.364.8170.564.1-1.0860.278Cer(d18∶1/18∶0)-1-P7064.12909.657476.151148.555718.15971.34-0.2300.818Cer(d18∶1/18∶1)-1-P 978.59164.841080.29210.29646.39127-0.1030.918Cer(d18∶1/20∶1)-1-P 121.5723.27132.6830.2785.273.66-0.8000.424Cer(d18∶1/20∶0)-1-P 411.7759.33424.6974.88369.5467.97-0.0080.994Cer(d18∶1/22∶0)-1-P 82.933.0781.152.8888.759.24-0.6580.511Cer(d18∶1/22∶1)-1-P 60.810.2460.620.2561.430.61-1.3310.183Cer(d18∶1/26∶0)-1-P 736.8166.99753.6984.59681.6475.71-0.7690.442Cer(d18∶1/26∶1)-1-P643.2656.49654.1871.37607.5964.07-0.7850.433Cer(d18∶1/28∶0)-1-P 293.1629.27299.5936.53272.1538.19-0.6100.542Cer(d18∶1/28∶1)-1-P 501.7538.69491.1147.21536.560.56-1.3870.166HexCer (d18∶1/8∶0) 184.350.02184.340.02184.370.03-1.9730.048HexCer (d18∶1/12∶0) 63.850.1863.910.2163.640.33-1.5290.126HexCer (d18∶1/14∶0)211.870.67212.420.85210.070.53-1.6560.098HexCer (d18∶1/14∶1) 216.511.21217.421.53213.561.05-1.1170.264HexCer (d18∶1/16∶0) 19762.871758.921277.852210.1214813.921551.51-2.2270.026HexCer (d18∶1/16∶1) 723.158.42767.9874.71576.4931.83-1.0380.299HexCer (d18∶1/18∶0) 392.3721.79417.7526.91309.4719.16-2.1630.031HexCer(d18∶1/18∶1) 541.9737.41582.5546.43409.4132.95-2.2430.025HexCer (d18∶1/20∶0) 206.877.99207.959.78203.3712.31-0.1660.868HexCer (d18∶1/20∶1) 414.0517.43418.1421.35400.6526.65-0.0550.956HexCer (d18∶1/22∶0) 1596.64104.471557.5127.491724.48161.19-1.4820.138HexCer(d18∶1/22∶1) 254.9428.41257.6935.65245.9735.38-0.5470.585HexCer (d18∶1/24∶0) 4180.1279.594067.61293.864547.55721.91-0.1190.905HexCer (d18∶1/24∶1) 65370.123709.8765956.974099.3263453.098700.55-0.6100.542dhSphingosine (d18∶1/18∶0)31.242.2128.741.8839.406.95-2.2270.026dhS(d18∶1/18∶0)-1-P 56.40.0856.350.156.560.14-2.3980.016dhCer(d18∶0/18∶0) 61.650.4461.760.5661.290.37-0.9830.326dhCer (d18∶0/18∶1)67.672.1569.332.7562.280.93-1.4740.140dhCer (d18∶0/20∶0) 65.941.3366.981.762.550.75-0.5150.606dhCer(d18∶0/24∶0) 851.4184.97934.11106.28581.2472.67-1.8310.067dhCer (d18∶0/24∶1) 2366.59326.391970.17198.353661.541203.43-0.9590.338dhCer (d18∶0/16∶0)-1-P 294.3734.23316.2643.79222.8623.07-0.8640.388dhCer (d18∶0/16∶0)1-1-P186.2519.89174.6920.67224.0351.76-1.4030.161dhCer (d18∶0/18∶0)-1-P 219.624.63241.6231.21147.6916.01-1.0300.303dhCer (d18∶0/18∶1)-1-P86.811.1292.0714.4769.591.59-0.6100.542
续表2

鞘脂总例数 (n=64)均值标准误乙肝肝硬化(n=49)均值标准误乙肝相关AFP阴性HCC(n=15)均值标准误Z值P值dhCer (d18∶0/24∶1)-1-P 60.870.2660.710.3361.370.32-2.4730.013HexSph(d18∶1) 46.80.4146.70.547.120.64-1.9730.048Sphingosine (d17∶1)-1-P 59.020.5757.810.3462.991.84-3.3840.001Sphingosine (d18∶1)-1-P56.730.2156.260.0958.280.73-4.0300.000Sphingosine(d18∶1)83.023.7480.593.8690.979.81-1.1330.257
2.3血清Cer(d18∶1/8∶0)-1-P对乙肝相关AFP阴性HCC诊断的预测价值血清Cer(d18∶1/8∶0)-1-P cut-off值为208.81 pmol/0.1 ml时,其预测乙肝相关AFP阴性HCC的灵敏度为81.6%(95%CI:68.0%~91.2%),特异度为86.7%(95%CI:59.5%~98.3%)。ROC曲线下面积为0.899(95%CI:0.798~0.960,P<0.001)(见图1)。
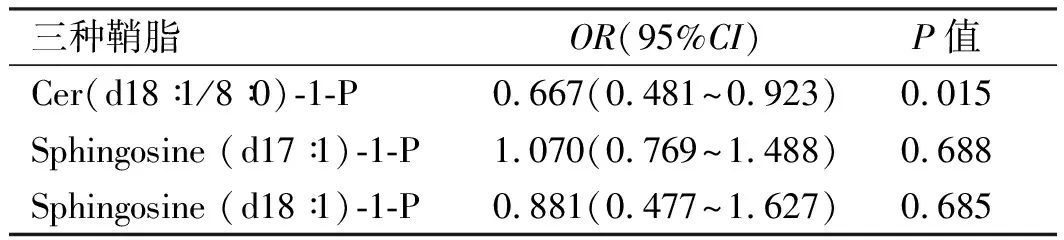
表3 三种鞘脂的Logistic多因素回归分析Tab 3 Logistic regression analysis of three sphingolipids
3 讨论
在中国,慢性乙型肝炎是导致肝硬化、HCC最重要的原因。由于APF阴性HCC早期筛查往往因AFP没有阳性结果而容易被忽视,且HCC早期症状不典型,导致部分患者到临床并发症出现时才被确诊,而此时已经失去了治疗的最佳时机[17]。筛选新的诊断标志物,用来鉴别乙肝相关AFP阴性HCC及乙肝肝硬化,至关重要!本研究采用高效液相色谱与串联质谱分析方法,对乙肝相关AFP阴性HCC血清中61种鞘脂进行了检测分析,首次发现Cer(d18∶1/8∶0)-1-P与乙肝相关AFP阴性HCC独立相关(OR=0.667, 95%CI∶ 0.481~0.923,P<0.05),其诊断的灵敏度为81.6%,特异度为86.7%。
神经酰胺(ceramide)、鞘氨醇(sphingosine)、鞘氨醇-1-磷酸(sphingosine-1-phosphate)、神经酰胺-1-磷酸(ceramide-1-phosphoric acid)等分子构成了鞘脂家族,而神经酰胺位于鞘脂代谢的中心。近年来,已有研究者在分子水平和小鼠模型中将鞘脂代谢与HCC的发病机制联系起来[18-19]。尽管有研究曾用鞘脂来鉴别HCC和肝硬化[20],但用鞘脂来鉴别乙肝相关AFP阴性HCC及乙肝肝硬化的研究尚未见报道。
GRAMMATIKOS等[20]针对长链(C16-C20)和非常长链(C22-C24)神经酰胺,及神经酰胺相关代谢产物,对其鉴别HCC和肝硬化作用进行了相关研究。发现,与肝硬化患者相比,血清鞘磷脂代谢物水平在HCC患者中显示上调,特别是C16-神经酰胺和鞘氨醇-1-磷酸可以作为鉴别肝病患者HCC的新型诊断标记物。与GRAMMATIKOS等的研究相比较,本研究不仅检测了包含长链(C16-C20)和非常长链(C22-C24),同时也包含了短链(C8-C14),检测的鞘脂种类更全面。有趣的是,本研究虽然也发现C16-神经酰胺对于鉴别乙肝相关AFP阴性HCC及乙肝肝硬化具有一定的意义,但最终Logistic多因素回归分析显示,只有Cer(d18∶1/8∶0)-1-P与乙肝相关AFP阴性HCC独立相关,表明乙肝相关AFP阴性HCC的鞘脂表达谱存在疾病独特性。
综上所述,我们发现血清Cer(d18∶1/8∶0)-1-P水平上调有助于乙肝相关AFP阴性HCC的诊断,为潜在的诊断标志物。但本研究也存在一些局限:我们的队列纳入64例患者,但乙肝相关AFP阴性HCC患者仅15例,研究结果需要进一步用大样本的临床队列来进行验证;同时,Cer(d18∶1/8∶0)-1-P是否对其他病因导致的AFP阴性HCC也存在诊断价值,及其在HCC发病中作用,这也需要进一步研究。
[1] SINN D H, LEE J, GOO J, et al. Hepatocellular carcinoma risk in chronic hepatitis B virus-infected compensated cirrhosis patients with low viral load [J]. Hepatology, 2015, 62(3): 694-701. DOI: 10.1002/hep.27889.
[2] CHANG M L, LIAW Y F. Hepatitis B flares in chronic hepatitis B: pathogenesis, natural course, and management [J]. J Hepatol, 2014, 61(6): 1407-1417. DOI: 10.1016/j.jhep.2014.08.033.
[3] SARWAR S, KHAN A A, TARIQUE S. Validity of alpha fetoprotein for diagnosis of hepatocellular carcinoma in cirrhosis [J]. J Coll Physicians Surg Pak, 2014, 24(1): 18-22. DOI: 01.2014/JCPSP.1822.
[4] 吴君荣, 赵惠柳, 舒宏, 等. 抗凝血酶-Ⅲ在甲胎蛋白阴性肝硬化和肝癌的鉴别诊断价值[J]. 国际检验医学杂志, 2016, 37(20): 2875-2876. DOI: 10.3969/j.issn.1673-4130.2016.20.028.
WU J R, ZHAO H L, SHU H, et al. The value of antithrombin-III in the differential diagnosis of alpha-fetoprotein-negative cirrhosis and hepatocellular carcinoma [J]. Int J Lab Med, 2016, 37(20): 2875-2876. DOI: 10.3969/j.issn.1673-4130.2016.20.028.
[5] ZHANG J Y, QU F, LI J F, et al. Up-regulation of Plasma Hexosylceramide (d18: 1/18: 1) contributes to genotype 2 virus replication in chronic hepatitis C: a 20-year cohort study [J]. Medicine (Baltimore), 2016, 95(23): e3773. DOI: 10.1097/MD.0000000000003773.
[7] QU F, ZHENG S J, LIU S, et al. Serum sphingolipids reflect the severity of chronic HBV infection and predict the mortality of HBV-acute-on-chronic liver failure [J]. PLoS One, 2014, 9(8): e104988.
[8] FERNANDEZ A, MATIAS N, FUCHO R, et al. ASMase is required for chronic alcohol induced hepatic endoplasmic reticulum stress and mitochondrial cholesterol loading [J]. J Hepatol, 2013, 59(4): 805-813. DOI: 10.1016/j.jhep.2013.05.023.
[9] TONG M, LONGATO L, RAMIREZ T, et al. Therapeutic reversal of chronic alcohol-related steatohepatitis with the ceramide inhibitor myriocin [J]. Int J Exp Pathol, 2014, 95(1): 49-63. DOI: 10.1111/iep.12052.
[10] PRALHADA RAO R, VAIDYANATHAN N, RENGASAMY M, et al. Sphingolipid metabolic pathway: an overview of major roles played in human diseases [J]. J Lipids, 2013, 2013: 178910. DOI: 10.1155/2013/178910.
[11] 中华人民共和国卫生部. 原发性肝癌诊疗规范(2011年版)[J]. 临床肿瘤学杂志, 2011, 16(10): 929-946.
[12] QU F, WU C S, HOU J F, et al. Sphingolipids as new biomarkers for assessment of delayed-type hypersensitivity and response to triptolide [J]. PLoS One, 2012, 7(12): e52454. DOI: 10.1371/journal.pone.0052454.
[13] MIELKE M M, BANDARU V V, HAN D, et al. Factors affecting longitudinal trajectories of plasma sphingomyelins: the Baltimore longitudinal study of aging [J]. Aging Cell, 2015, 14(1): 112-121. DOI: 10.1111/acel.12275.
[14] LI J F, QU F, ZHENG S J, et al. Elevated plasma sphingomyelin (d18:1/22:0) is closely related to hepatic steatosis in patients with chronic hepatitis C virus infection [J]. Eur J Clin Microbiol Infect Dis, 2014, 33(10): 1725-1732. DOI: 10.1007/s10096-014-2123-x.
[15] QU FENG, ZHENG S J, LIU S, et al. Serum sphingolipids reflect the severity of chronic HBV infection and predict the mortality of HBV-acute-on-chronic liver failure [J]. PLoS One, 2014, 9(8): e104988. DOI: 10.1371/journal.pone.0104988.
[16] BLACHIER M, LELEU H, PECK-RADOSAVLJEVIC M, et al. The burden of liver disease in Europe: a review of available epidemiological data [J]. J Hepatol, 2013, 58(3): 593-608. DOI: 10.1016/j.jhep.2012.12.005.
[17] LU Z P, XIAO Z L, YANG Z, et al. Hepatitis B virus X protein promotes human hepatoma cell growth via upregulation of transcription factor AP2α and sphingosine kinase 1 [J]. Acta Pharmacol Sin, 2015, 36(10): 1228-1236. DOI: 10.1038/aps.2015.38.
[18] RACHIDI S, SUN S, WU B X, et al. Endoplasmic reticulum heat shock protein gp96 maintains liver homeostasis and promotes hepatocellular carcinogenesis [J]. J Hepatol, 2015, 62(4): 879-888. DOI: 10.1016/j.jhep.2014.11.010.
[19] GRAMMATIKOS G, SCHOELL N, FERREIRS N, et al. Serum sphingolipidomic analyses reveal an upregulation of C16-ceramide and sphingosine-1-phosphate in hepatocellular carcinoma [J]. Oncotarget, 2016, 7(14): 18095-18105. DOI: 10.18632/oncotarget.7741.
