血塞通注射液及NEP1-40对脑梗死大鼠大脑皮层及血清炎症因子表达的影响
2018-05-30何慧君刘志娟
何慧君,刘志娟
兰州大学附属第二医院定西医院,甘肃 兰州 743000
脑卒中为临床较为常见疾病,依据其发病机制可分为出血性卒中与缺血性卒中两类。随着人们生活方式和饮食习惯的改变,其发病率呈逐年上升趋势。人类大脑在缺氧缺血受损时,其神经细胞会结合周边支持细胞发生一系列生理与病理的连锁反应,其中最快出现的是免疫炎症反应,它在患者疾病发展中有两面性,即在神经受损结局中既有保护作用也有损害作用[1~2]。患者脑梗死后,机体脑组织不仅受到缺氧缺血等损害,炎症介质所分解的炎症因子对脑部的伤害在患者预后和疾病严重程度方面有重要影响。相关研究显示,肿瘤坏死因子-α(TNF-α)及白细胞介素-1β(IL-1β)等促炎因子会加重脑组织损伤,而转化生长因子-β1(TGF-β1)及白细胞介素-10(IL-10)等抑炎因子则能够促进受损脑神经功能恢复,对脑组织起保护作用[3~4]。因此,本文通过探究血塞通注射液及Nogo胞外肽端残基 1-40(Nogo extra cellular peptide residues 1-40,NEP1-40)对脑梗死大鼠大脑皮层及血清中促炎因子与抑炎因子表达的影响,探讨其作用机制,为临床患者治疗提供一定的参考。
1 材料与方法
1.1 实验动物及分组 选取雄性健康SD大鼠25只,体质量(245.6±15.8)g,购自北京维通利华实验动物有限公司,许可证号:SCXK(京)2015-2016,生产批号:20160472。饲养条件:屏障环境动物实验室室温20~24℃,相对湿度在40%~50%之间,明暗交替12 h/12 h,自由获取食物和水。依据随机数字表法将大鼠分成5组,分别是模型组、NEP1-40组、血塞通组、假手术组及NEP1-40联合血塞通组(P+N组),每组5只。1.2 主要试剂及仪器 试剂:丙烯酰胺(美国Amresco公司,批号:0614);过硫酸铵(美国Sigma公司,批号:A6910);医用X光胶片(日本富士公司,批号:SuperRX);DAB显色试剂盒(北京中杉金桥公司,批号:ZLI-9645);IL-1β一抗(英国Abcam公司,批号:ab8611);TGF-β1一抗(英国Abcam公司,批号:ab06418);TNF-β1及IL-10试剂盒(武汉博士德公司,批号:EK1672、EK0591);TNF-α 及 IL-1β 试剂盒(上海Ameko公司,批号:AE8152Ra、AE8159Ra);氯化钠(北京双鹤药业公司);血塞通(昆明制药公司,批号:13JB10);NEP1-40(美国 Sigma-Aldrich 公司)。
仪器:低温冷冻离心机(美国Thermo公司,型号:Fresco17);超净工作台(苏州净化设备厂,型号:SW-CJ-1F);酶标仪(美国Thermo公司,型号:MK3);摇床(江苏其林贝尔公司,型号:TS-8);微波炉(中国格兰仕公司,型号:P6951)。1.3 模型建立 在相对湿度45%、温度为25℃室内饲养,自由取水、饮食,喂养3天后,除假手术组外,其余4组大鼠依据改良Longa线栓栓塞法进行手术。手术前大鼠禁食12 h,按照1 mL/100 g的剂量腹腔注入3.5%水合氯醛,取仰卧位置固定,正中位置切开,肌肉组织钝性分离,右侧颈总动脉(CCA)分离在视野外部,颈内动脉(ICA)与颈外动脉(ECA)清楚显现;夹闭ICA并结扎CCA与ECA近心端,以形成“Y”字封闭血管,剪一小口在CCA远心端插入尼龙栓线,沿血管方向进入ICA动脉夹处,结扎一圈“活结”在开口上方,动脉夹松开,沿血管将栓线插入遇阻力停止,而后缝合皮肤、消毒。假手术组将皮肤切开,仅把颈部肌肉钝性分离不栓塞线栓,缝合皮肤、消毒。
造模成功标准:术后对大鼠进行TTC染色,若大脑切片右侧出现连续白色梗死,对侧为鲜红色则说明造模成功。
1.4 干预方式 模型组和假手术组腹腔注射10 mg/(kg·d)的0.9%氯化钠。血塞通组,把血塞通溶在0.9%氯化钠内,腹腔注入剂量为71 mg/(kg·d);NEP1-40组,把 NEP1-40溶在0.9%氯化钠内,腹腔注入剂量为85 g/(kg·d);P+N组为血塞通和NEP1-40联合剂量,各组大鼠均连续干预28天。
1.5 样本采集 干预28天后,3.5%水合氯醛(1 mL/100 g)腹腔注射麻醉,取腹主动脉血,室温静置1 h,4℃离心机15 000 rmp离心15 min,取上清液,而后断头、剥脑,取梗死侧大脑皮层液氮冻存备用,后半全脑4%多聚甲醛固定以备用。
1.6 检测指标及方法 ①观察大鼠术后体质量和神经功能评分改变状况(依据Longa法:正常活动,没有相关症状为0分;左侧前肢体不能自由展开为1分;爬行时左侧转圈为2分;爬行时向左侧倾倒为3分;丧失意识,不能行走为4分);②ELISA法检测术后28天大鼠血清促炎因子IL-1β、TNF-α和抑炎因子TGF-β1、IL-10含量,具体步骤依据说明书进行;③免疫组化:常规脱水石蜡包埋,脑切片厚度为5 μm,60℃拷片30 min,酒精水化5 min,加入枸橼酸钠行微波法组织抗原修复,PBS缓冲液冲洗,羊血清封闭,加入一抗NgR1、RhoA和ROCKⅡ 4℃过夜,DAB显色,检测大鼠脑组织内IL-1β、TNF-α、TGF-β1、IL-10蛋白表达,使用Image pro plus分析,累积光密度值(IOD)进行比较。
1.7 统计学方法 使用SPSS19.0统计软件进行数据分析,计量资料以(±s)表示,正态分布和方差齐性数据单因素方差分析,组间比较采用LSD检验。
2 结果
2.1 各组大鼠各时间点体质量比较 见表1。假手术组大鼠随着时间体质量逐渐增大,与假手术组比较,模型组大鼠术后7、14、28天体质量明显下降,差异均有统计学意义(P<0.05)。与模型组比较,NEP1-40组、血塞通组及P+N组大鼠术后7、14、28天体质量显著上升,差异均有统计学意义(P<0.05),其中P+N组效果最佳。
表1 各组大鼠各时间点体质量比较(±s) g
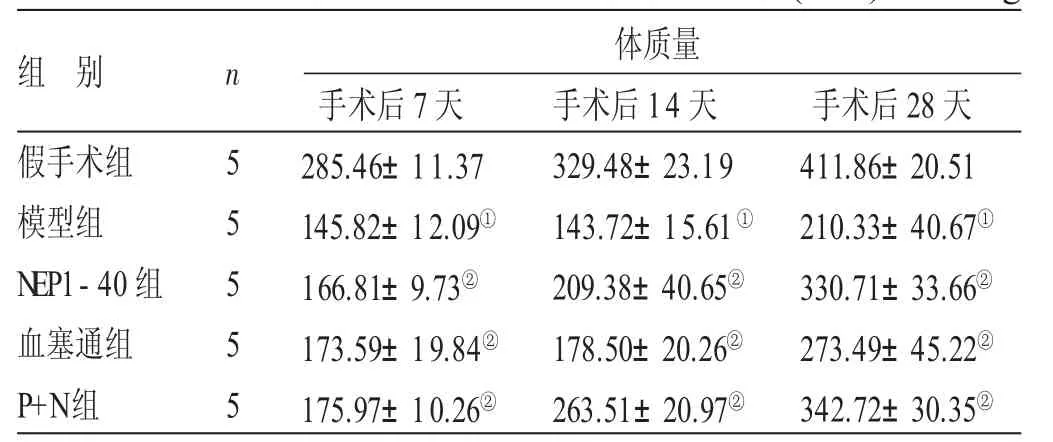
表1 各组大鼠各时间点体质量比较(±s) g
与假手术组比较,①P<0.05;与模型组比较,②P<0.05
组 别假手术组模型组NEP1-40组血塞通组P+N组n 5 5 5 5 5体质量手术后7天285.46±11.37 145.82±12.09①166.81±9.73②173.59±19.84②175.97±10.26②手术后14天329.48±23.19 143.72±15.61①209.38±40.65②178.50±20.26②263.51±20.97②手术后28天411.86±20.51 210.33±40.67①330.71±33.66②273.49±45.22②342.72±30.35②
2.2 各组大鼠各时间点神经功能评分比较 见表2。与假手术组比较,模型组大鼠术后7、14、28天神经功能评分明显上升,差异有统计学意义(P<0.05)。与模型组比较,NEP1-40组、血塞通组及P+N组术后7、14、28天神经功能评分明显下降,差异均有统计学意义(P<0.05)。
表2 各组大鼠各时间点神经功能评分比较(±s) 分

表2 各组大鼠各时间点神经功能评分比较(±s) 分
与假手术组比较,①P<0.05;与模型组比较,②P<0.05
组 别假手术组模型组N EP1-40组血塞通组P+N组n 5 5 5 5 5手术后7天0.00±0.00 2.20±0.39①1.16±0.39②1.16±0.38②1.48±0.48②手术后14天0.00±0.00 1.31±0.48①0.82±0.39②0.81±0.37②0.65±0.48②手术后28天0.00±0.00 0.99±0.10①0.63±0.37②0.71±0.38②0.61±0.39②
2.3 各组大鼠血清促炎及抑炎因子含量比较 见表3。与假手术组比较,模型组大鼠血清TNF-α、TGF-β1含量上升,IL-10含量下降,差异均有统计学意义(P<0.05)。与模型组比较,P+N组大鼠血清IL-β1含量下降;NEP1-40组、血塞通组及P+N组TNF-α含量下降,IL-10含量上升,差异均有统计学意义(P<0.05)。
表3 各组大鼠血清促炎及抑炎因子含量比较(±s)
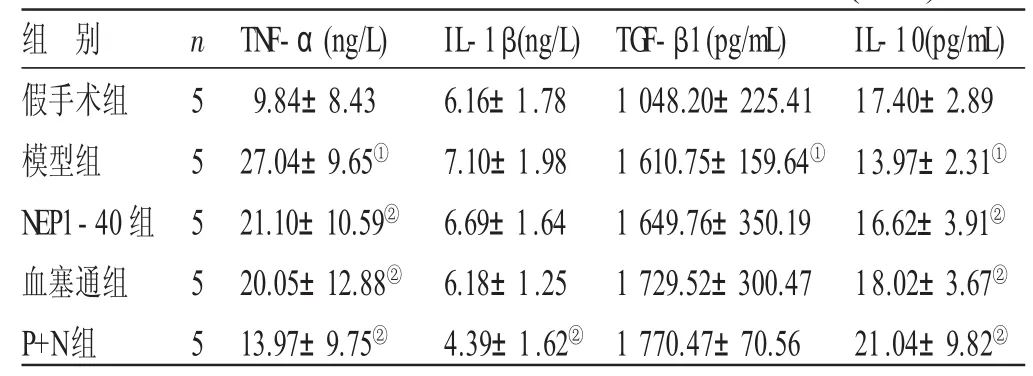
表3 各组大鼠血清促炎及抑炎因子含量比较(±s)
与假手术组比较,①P<0.05;与模型组比较,②P<0.05
组 别假手术组模型组NEP1-40组血塞通组P+N组n 5 5 5 5 5 TNF-α(ng/L)9.84±8.43 27.04±9.65①21.10±10.59②20.05±12.88②13.97±9.75②IL-1β(ng/L)6.16±1.78 7.10±1.98 6.69±1.64 6.18±1.25 4.39±1.62②TGF-β1(pg/mL)1 048.20±225.41 1 610.75±159.64①1 649.76±350.19 1 729.52±300.47 1 770.47±70.56 IL-10(pg/mL)17.40±2.89 13.97±2.31①16.62±3.91②18.02±3.67②21.04±9.82②
2.4 各组大鼠脑组织炎症因子蛋白表达比较 见表4。与假手术组比较,模型组大鼠脑组织TNF-α、IL-1β、TGF-β1蛋白表达上升,IL-10蛋白表达下降,差异均有统计学意义(P<0.05)。与模型组比较,血塞通组及P+N组大鼠脑组织TNF-α、IL-1β蛋白表达下降,TGF-β1、IL-10蛋白表达上升;NEP1-40组大鼠脑组织TNF-α、IL-1β蛋白表达下降,IL-10蛋白表达上升;差异均有统计学意义(P<0.05)。
表4 各组大鼠脑组织炎症因子蛋白表达比较(±s) IO D
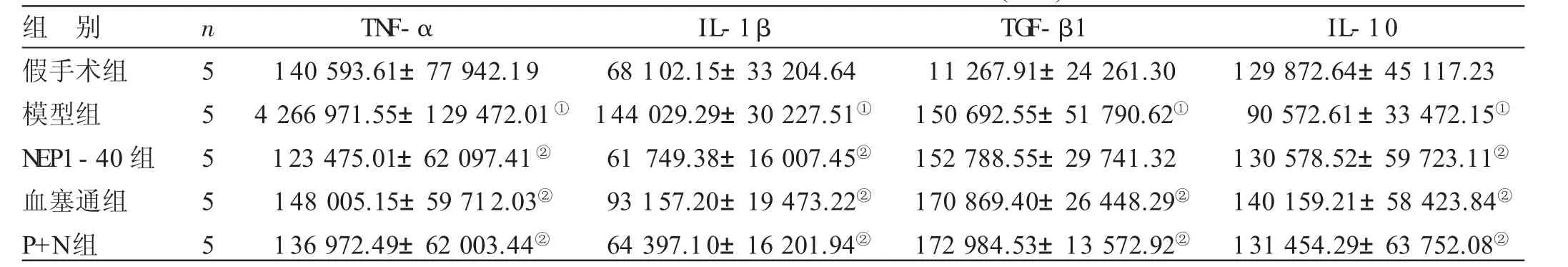
表4 各组大鼠脑组织炎症因子蛋白表达比较(±s) IO D
与假手术组比较,①P<0.05;与模型组比较,②P<0.05
组 别假手术组模型组N EP1-40组血塞通组P+N组n 5 5 5 5 5 TN F-α 140 593.61±77 942.19 4 266 971.55±129 472.01①123 475.01±62 097.41②148 005.15±59 712.03②136 972.49±62 003.44②IL-1β 68 102.15±33 204.64 144 029.29±30 227.51①61 749.38±16 007.45②93 157.20±19 473.22②64 397.10±16 201.94②TG F-β1 11 267.91±24 261.30 150 692.55±51 790.62①152 788.55±29 741.32 170 869.40±26 448.29②172 984.53±13 572.92②IL-10 129 872.64±45 117.23 90 572.61±33 472.15①130 578.52±59 723.11②140 159.21±58 423.84②131 454.29±63 752.08②
3 讨论
本研究显示,干预28天,模型组大鼠大脑皮层TNF-α和IL-1β表达比假手术组上升,说明大鼠大脑皮层在梗死进展中有TNF-α和IL-1β参加,同时也验证了其在永久性梗死内所产生的负面影响。相关研究证明,大鼠脑梗死后会造成IL-1β表达迅速上升,在大鼠全身或者局部注入IL-1β会使大鼠脑受损程度加深[5~6]。TNF-α在脑梗死发生前期,其表达含量比较低,有研究显示拮抗TNF-α能够有效降低大鼠脑梗死面积[7]。Tarkowski E等[8]研究显示,脑梗死患者血清内IL-1β含量明显低于脑脊液内,说明梗死大脑可能直接分泌IL-1β并参加脑损伤。另外,刘卫芳等[9]研究显示,脑梗死患者神经能力受损状况与TNF-α和IL-1β上升紧密相关。IL-10有抑制促炎因子分泌作用,既往研究显示,脑梗死患者体内IL-10含量下降,而且和脑损伤情况呈正相关,相关动物实验也证明了IL-10可使大鼠脑梗死面积下降[10~12]。TGF-β1对缺血性的脑受损也有保护作用,正常脑组织内TGF-β1含量一般较低,脑梗死后血清内TGF-β1含量上升,相关研究显示拮抗TGF-β1后大鼠受损状况会加重[13]。
血塞通主要成分是三七总皂苷,多用于胸痹心痛、脑络瘀阻、脑血管类疾病和中风偏瘫等治疗,临床效果较好。唐婧株等[14]研究显示,三七总皂苷可使脑梗死大鼠上升的IL-8、TNF-α、IL-6和IL-1β含量下降,对血脑屏障受损状况改善显著。多数相关研究对促炎因子研究较多,而抑炎因子研究较少,本研究表明血塞通可使脑梗死大鼠促炎因子TNF-α及IL-1β含量下降,同时使抑炎因子TGF-β1及IL-10含量上升。Nogo-66氨基酸肽端(Neurite outgrowth inhibitor-66,Nogo-66)为髓鞘抑制因子,它和特异性受体Nogo受体1(Nogo receptor 1,NgR1)亲合性最高,NgR1受体为一种GPI锚定蛋白,缺乏胞内域,需要借助其他受体形成NgR受体复合物才可将信号转导入胞内。Nogo-66和NgR1受体复合物结合以后,信号转导入胞内,进而激活下游重要通路,造成轴突生长椎塌陷。NEP1-40为Nogo-66受体拮抗剂,可以和NgR1结合发挥作用,且不会使下游信号通道激活[15~16]。本研究显示,血塞通注射液、NEP1-40都可降低促炎因子TNF-α、IL-1β的表达,升高抑炎因子IL-10和TGF-β1的表达,而联合用药通过调节炎症因子表达,抑制促炎因子对机体损伤作用,进而发挥出神经保护作用,效果更佳。
综上所述,血塞通注射液及NEP1-40是通过调整促炎、抑炎因子的表达,来加快脑梗死大鼠神经功能恢复。
[1]刘丽星,朱陵群,刘炜,等.血塞通注射液对局灶性脑梗死大鼠不同恢复时点大脑皮层Syp和PSD-95蛋白表达的影响[J].中西医结合心脑血管病杂志,2014,12(2):217-219.
[2]黄希艳,魏小琴,李倩,等.血塞通注射液对局灶性脑梗死大鼠NgR mRNA及蛋白表达的影响[J].辽宁中医杂志,2013,40(8):1711-1713.
[3]李若林,叶子明,凌志安.血塞通注射液对急性脑梗死患者细胞免疫功能和超敏C反应蛋白影响的研究[J].广西医科大学学报,2015,32(5):758-760.
[4]Zhang JS,Zhang BX,Du MM,et al.Chinese preparation Xuesaitong promotes the mobilization ofbone marrow mesenchymal stem cells in rats with cerebral infarction[J].Neural Regeneration Research,2016,11(2):292-297.
[5]张翼,付万发,路琴,等.血塞通注射液治疗急性脑梗塞的疗效与安全性系统评价[J].药品评价,2014,12(16):19-23.
[6]刘宓宓.急性脑梗死应用血塞通或丹红注射液治疗的比较研究[J].中国实用医药,2015,8(4):10-12.
[7]Liu JJ,Pan SY. Protective effects of estrogen combined with sevoflurane in an experimental model of cerebral infarction and focal cerebral ischemia-reperfusion injury[J].European Review for Medical Pharmacological Sciences,2016,20(9):1839-1842.
[8]Tarkowski E,Rosengren L,Blomstrand C, et al.Early intrathecal production of interleukin-6 predicts the size of brain lesion in stroke[J].Stroke, 1995, 26(8): 1393-1398.
[9]刘卫芳,艾敏,张俊豪,等.急性脑梗死血清IL-1β、TNF-α的变化与意义[J].中国实用神经疾病杂志,2012,15(23):24-25.
[10]史晓伟.血塞通调节脑梗死大鼠及OGD/R损伤SH-SY5Y细胞NgRl/RhoA/ROCKⅡ通路和炎症因子的研究[D].北京:北京中医药大学,2016.
[11]陆小平.血塞通注射液对急性脑梗死患者CD62 P分子表达的影响[J].临床医学,2014,11(8):13-14.
[12]朱燕,卢桂兰,周经霞.血塞通注射液联合丁苯酞对急性脑梗死疗效及对患者神经功能的影响[J].血栓与止血学,2016,22(6):618-620.
[13]兰修文.血塞通注射液与复方丹参注射液比较治疗急性脑梗死的系统评价[D].成都:成都中医药大学,2014.
[14]唐婧姝,裴清华.三七总皂苷对大鼠脑缺血再灌注损伤的神经保护机制研究[J].中国实验方剂学杂志,2011,17(15):210-213.
[15]Minami N,Mizukawa K,Iwahashi H,et al.Two cases of cerebral infarction due to focal irradiation for glioma in adults.[J].No Shinkei Geka,2015,43(4):344-351.
[16]林岭海,陈莹.血塞通注射液辅助治疗急性脑梗死的效果及对神经功能的影响[J].中国现代药物应用,2017,11(13):17-19.
