黄淮麦区主要推广小麦品种(系)DNA指纹图谱构建及遗传多样性分析
2018-05-30杨艳红尹华燕高雨赵金晓马信王宏伟李安飞孔令让李宪彬
杨艳红,尹华燕,高雨,赵金晓,马信,王宏伟,李安飞,孔令让,李宪彬
黄淮麦区主要推广小麦品种(系)DNA指纹图谱构建及遗传多样性分析
杨艳红,尹华燕,高雨,赵金晓,马信,王宏伟,李安飞,孔令让,李宪彬*
山东农业大学农学院, 山东 泰安 271018
小麦作为世界上重要的粮食作物,其丰富的遗传变异对小麦的遗传改良工作至关重要。本研究利用均匀分布在小麦A、B、D基因组上的84对SSR引物对119份黄淮麦区推广小麦品种进行了DNA指纹数据库的构建,并进行遗传多样性分析。结果表明,84对SSR引物共检测到170个等位变异,每对引物检测出1~5个等位变异,其中有13对引物可以将某一小麦与其他品种区分开。根据SSR基因型聚类结果可将119份小麦品种 (系)分为5大类群,基本能够分辨各个推广品种间的亲缘关系,为小麦亲本选择及杂交组配提供了一定的理论依据。
小麦; SSR引物; 指纹图谱; 遗传相似性
小麦是世界上主要的粮食作物之一,在我国小麦约占粮食总产的27%,是我国第二大粮食作物。近年来,由于长期品种间的杂交选育,现有育成品种间同质性较高,种质资源多样性愈来愈狭窄,小麦遗传改良难以实现突破性进展[1-3]。前人已利用多种方法对小麦遗传多样性进行评价分析,其中分子标记由于不受环境影响且遍布整个基因组,被普遍认为是研究遗传差异的理想工具。简单重复序列SSR(Simple Sequence Repeat),也称作微卫星,是由1~6个碱基组成的基本序列串联重复组成的短片段,具有简便、快速、稳定性好和等位基因多样性高等优点,现已成功应用于小麦的遗传差异和遗传演化研究等诸多方面[4]。DNA指纹图谱是指建立在DNA标记基础上的某一品种所具有的区别于其他品种的特异DNA片段,利用SSR标记进行遗传多样性分析、DNA指纹图谱构建、功能基因标记和比较作图等方面具有公认的优越性和广阔的应用前景[5]。本研究拟采用SSR分子标记技术,通过均匀分布在小麦A、B、D基因组上的84对SSR引物对黄淮地区119份推广小麦品种的遗传多样性进行研究分析,建立DNA指纹图谱数据库,从而掌握小麦品种资源的遗传基础和遗传多样性状况,对于有效促进小麦育种工作具有重要意义。
1 材料与方法
1.1 试验材料
利用均匀分布在小麦A、B、D基因组上的84对SSR标记(表2)对119份近年来黄淮地区育成的小麦新品种(系)和其他一些地方品种(表1)进行指纹构建和遗传多样性分析。引物由上海生工生物工程有限公司(Shanghai Sangon Co.Ltd.上海)合成。试验材料种植于山东农业大学试验基地。

表1 小麦品种(系)名称、编号及系谱信息
1.2 实验方法
1.2.1 DNA提取于小麦分蘖期取新鲜健康的叶片,按照CTAB法提取基因组DNA[6]。
1.2.2 PCR扩增选取均匀分布于小麦A、B、D基因组上的84对SSR引物对上述119份推广小麦品种进行PCR分析。PCR反应体系为10 μL,含5 μL 2*Taq Plus Master Mix,20 ng-1μL前后引物各1 μL,20 ng-1μL基因组DNA1 μL,2 μL ddH2O[7]。PCR扩增程序如下:95 ℃预变性5 min,94 ℃变性30 s,55~65 ℃复性(因不同引物而异)40 s,72 ℃延伸40 s,35个循环;72 ℃延伸10 min;4 ℃保存。
1.2.3 电泳检测扩增产物PCR结束后在扩增产物中加入适量Loading Buffer,混匀后在8%聚丙烯酰胺非变性凝胶上电泳,上样量为1.5 μL 1xTBE,120 V,电泳3~3.5 h(根据片段大小适当延长或缩短电泳时间)。电泳结束后将胶块银染显影,用凝胶成像系统照相,对带型清晰的胶块进行读带。
1.3 数据处理与分析
根据PCR扩增结果,将同一引物扩增出的大小相同的目的带视为1个等位变异[8,9],并进行记录。用同一引物对119份材料进行扩增检测时,相同的带型用同一数字进行赋值,无带赋值为“0”,数据采用Powermarker软件进行聚类,绘制聚类图。
2 结果与分析
2.1 SSR标记在119个小麦品种之间多态性分析
84对引物在119个小麦品种中共检测出170个等位变异,每对引物检测出1~5个等位变异,平均为2.02个。其中,有13对引物(gwm124、gwm617、cfa2019、wmc173、wmc752、barc96、barc126、gwm294、barc35、gwm174、cfd22、gwm397、wmc474)可以将某一品种与其他品种( 系 )区分开,如引物gwm124在“山农29”中检测到的等位变异与其他材料不同(图1),因此可以将“山农29”与其他品种(系)区分开来;同理,引物gwm617可以将“92145E8”与其他品种(系)区分开来;引物cfa2019可以将“良星66”与其他品种(系)区分开;引物wmc173可以将“扬麦158”与其他品种(系)区分开;wmc752可以将“山农15381”与其他品种(系)分开。此外,利用同一个引物还可将2~3个品种从119份品种(系)中区分开,如引物wmc623可以将“封麦6号”“郑麦379”、“周麦27”与其他品种(系)区分开;引物wmc617可以将“扬麦158”、“石麦15”、“烟19”与其他品种(系)区分开来;引物cfd9可以将“徐麦2178”、“邯优3475’与其他材料区分开来;引物gwm480可以将“泰山818”和“烟5158”与其他品种(系)区分开来,引物gwm164可以将“太麦198”和“山农紫麦1号’与其他品种(系)区分开来;cfd48可以将“邯6172”“豫农949”与其他品种(系)区分开。其他引物单独使用时不能鉴别出119份小麦品种(系)中的任何一个或几个材料。
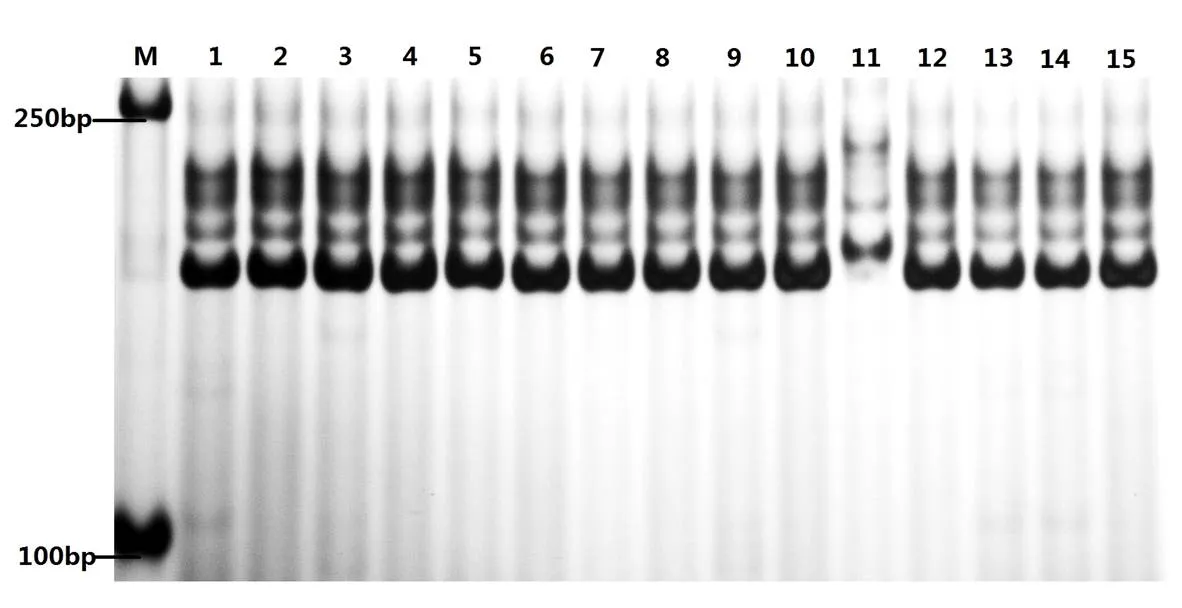
图 1 标记Xgwm124在部分小麦品种中的扩增结果
M:D2000; 1:潍麦33;2:宁麦13;3:镇麦168;4:扬麦158;5:太麦198;6:山农紫麦1号;7:山农20;8:山农23;9:山农24;10:山农25;11:山农29;12:山农30;13:山农31;14:山农32;15:山农15381
M:D2000; 1:Weimai 33;2:Ningmai 13;3:Zhenmai 168;4:Yangmai 158;5:Taimai 198;6:Shannongzimai1hao;7:Shannong20;8:Shannong 23;9:Shannong 24;10:Shannong 25;11:Shannong 29;12:Shannong 30;13:Shannong 31;14:Shannong 32;15:Shannong 15381
2.2 119份小麦种质材料的DNA指纹数据库的初步构建
由于本试验中单个引物仅能区分出少数品种,因此,为了准确鉴别119份小麦品种(系),选择其中10对带型清晰且稳定的引物,将每一对引物扩增的带型进行统计并编号,得到了119份小麦品种(系)的DNA指纹数据库(附表1)。84对SSR引物共鉴定出170个等位变异,所检测到的不同等位变异及所处染色体位置等基本信息详见表2。

表 2 84对 SSR 引物在119份小麦品种中检测到的等位基因
2.3 119份小麦种质材料的遗传多样性分析
利用84对SSR引物所检测出的170个等位变异,对其进行聚类(图2)后可以将119份品种(系)基本划分为5个类群。
第一类群包括“郑麦1325”、“山农664”、“石03-Y119”三个品种;第二类群包括“新乡9852”、“小偃54号”、“郑麦306”3个品种;第三类群包括“德胜508”、“金麦73”、“临麦8号”等18个品种;第四类群包括“周麦26”、“豫麦416”“山农3509”、“矮抗58”等42个品种;第五类群包括“中育211”、“济麦23”、“许科129”、“郑麦379”等53个小麦品种。将上述SSR标记聚类结果就所选材料的系谱关系(表1)进行比较,聚类结果在一定程度上反映了品种之间的亲缘关系,如“周麦27”和“许科316”均为“周麦16”作为母本选择的品种,因此划分到同一类群,但因为其父本分别为“百农64”和“矮抗58”,所以具体分类时,聚类到两个小类群里;“山农23”和“山农24”均是从创建的Ta1(Ms2)小麦轮选群体中选择出的小麦品种,二者在同属一个大类的同时也单独聚为一小类;同样,“新麦35”、“新麦36”均由“周麦22”作为母本选育而成,聚类时聚到同一类群;“孟麦023”、“淮麦39(MS)”、“冠麦1号”均由周麦13作为母本选育出来,因此聚为同一类群里。但也有系谱亲缘关系较近的品种与SSR聚类不一致的现象,如“菏麦0643”就是以“矮抗58”为母本、“济麦19”为父本杂交选育的,但二者SSR基因型存在一定的差异,因此划分为不同的两个类群。出现这种现象一方面可能因为本研究选用分子标记较少,代表性不够;另一方面可能与当下小麦育种资源交流频繁,导致品种的地域性差异程度降低[10]有关。

图 2 119 份材料的SSR聚类分析
3 讨论
由于长期小麦品种间杂交选育,小麦品种遗传多样性的降低已成为世界范围内的共识[11-16]。在我国1586份小麦初选核心种质中,以20世纪50年代的品种具有最高的遗传多样性,到90年代降至最低[17],因此提高小麦种质材料的遗传多样性对促进遗传改良工作至关重要。分子标记被普遍认为是研究遗传差异的最理想工具,新发展起来的微卫星SSR分子标记技术具有简便、快速、稳定性好和等位基因多样性高等优点,已成功应用于小麦遗传差异和遗传演化研究等方面[18]。王立新[19]等采用15个SSR标记和20个AFLP-SCAR标记,分析了来自我国不同麦区的455个小麦品种,证明用分子标记建立小麦DNA指纹可以更加全面地反映品种的遗传多样性。高睦枪等[20]用53对 SSR引物对全国1999~2000年北方冬小麦及黄淮冬麦区观察圃中选出的48个新品种(系)进行了遗传差异分析,共检测到367个等位变异。本研究通过84对SSR标记对119份黄淮地区推广小麦品种(系)进行遗传多样性分析,共检测到170个等位变异,遗传变异较小,经聚类分析后发现,119份材料主要聚为5个类群,这种结果一方面可能因为我们选用的分子标记较少且部分标记在种质材料中多态性较低,另一方面可能也与选用材料大部分为主栽品种有关系。同时本研究结果也为育种工作者选择亲本组配杂交组合提供了一定的理论依据。
[1] 李兴普.不同矮秆基因小麦农艺性状的遗传差异[J].华北农学报,1995,10(1):1-5
[2] 相吉山,杨欣明,李秀全,等.小麦骨干亲本南大2419对衍生品种(系)HMW-GS的贡献分析[J].植物遗传资源学 报,2013,14(6):1053-1058
[3] 刘玉平,李亚军,陈希勇,等.河北省审定优质麦主要性状分析[J].河北农业科学,2006,10(2):50-53
[4] Lelley T, Stachel M, Grausgruber H,. Analysis of relationship between Aegilops tauschil and the D genome of wheat utilizing microsatellites[J]. Genome, 2000,43:661-668
[5] 张学勇,李大勇.小麦及其近亲基因组中的DNA重复序列研究进展[J].中国农业科学,2000,33(5):14-24
[6] 楼巧君,陈亮,罗利军.三种水稻基因组DNA快速提取方法的比较[J].分子植物育种,2005,3(5):749-752
[7] 梁宏伟,王长忠,李忠,等.聚丙烯酰胺凝胶快速、高效印染方法的建立[J].技术与方法,2000,30(10):1379-1382
[8] 李根英, Susanne D, Marilyn LW,等.小麦指纹图谱数据库的建立及SSR分子标记试剂盒的研发[J].作物学 报,2006,36(12):1771-1778
[9] Nei M, Li WH. Mathematical mode for studying genetic varia-tion in terms of restriction endonucleases[J]. Proceedings of the National Academy of Sciences of the United States of Ameri-ca, 1979,76:5269-5273
[10] 程保山,徐海风,顾正中,等.淮安地区主栽小麦品种指纹图谱的构建及遗传多样性分析[J].浙江农业学 报,2011,23(1):20-24
[11] Fu YB, Peterson GW, Richards KW,. Allelic reduction and genetic shift in the Canadian hard red spring wheat germplasm re-leased from 1845 to 2004[J]. Theor Appl Genet, 2005,110:1505-1516
[12] Huang XQ, BŐrner A, RŐder MS,. Assessing genetic diversity of wheat(L.) germplasm using microsatellitemarkers[J]. Theor Appl Genet, 2002,105:699-707
[13] Orabi J, Jahoor A, Backes G. Changes in allelic frequency over time in European bread wheat(L. ) varieties re-vealed using DArT and SSR markers[J]. Euphytica, 2014,197(3):447-462
[14] Roussel V, Koenig J, Beckert M,. Molecular diversity in Frenchbread wheat accessions related to temporal trends and breeding pro-grammes[J]. Theor Appl Genet, 2004,108:920-930
[15] 谢炜,郭青云,郭小敏,等.同名地方品种小红芒和小红芒麦形态学和HMW-GS组成的演变分析[J].植物遗传资源 学报,2011,12(3):381-388
[16] 李远,赵檀,王睿辉,等.河北省小麦品种基于SSR 标记的遗传多样性研究[J].河北农业大学学报,2012,4(35):1-5
[17] Smale M, Reynolds MP, Warburton M,. Dimensions of diver-sity in modern spring bread wheat in developing countries from 1965[J]. Crop Sci, 2002,42:1766-1779
[18] 郝晨阳.五十年来我国小麦育成品种的遗传多样性演变及西北春麦区核心种质的构建[D].兰州:甘肃农业大学,2004
[19] 王立新,李云伏,常利芳,等.建立小麦品种DNA指纹的方法研究[J].作物学报,2007,33(10):1738-1740
[20] 高睦枪,刘冬成,郭小丽,等.我国部分冬小麦新品种(系)SSR标记遗传差异的研究[J].农业生物技术学 报,2001,9(1):49-54
附表1 10对SSR引物构建的 119个小麦品种(系)的SSR指纹图谱
Attached list 1 Data of the SSR fingerprint bands with 10 pairs of SSR primer among 119 wheat cultivars
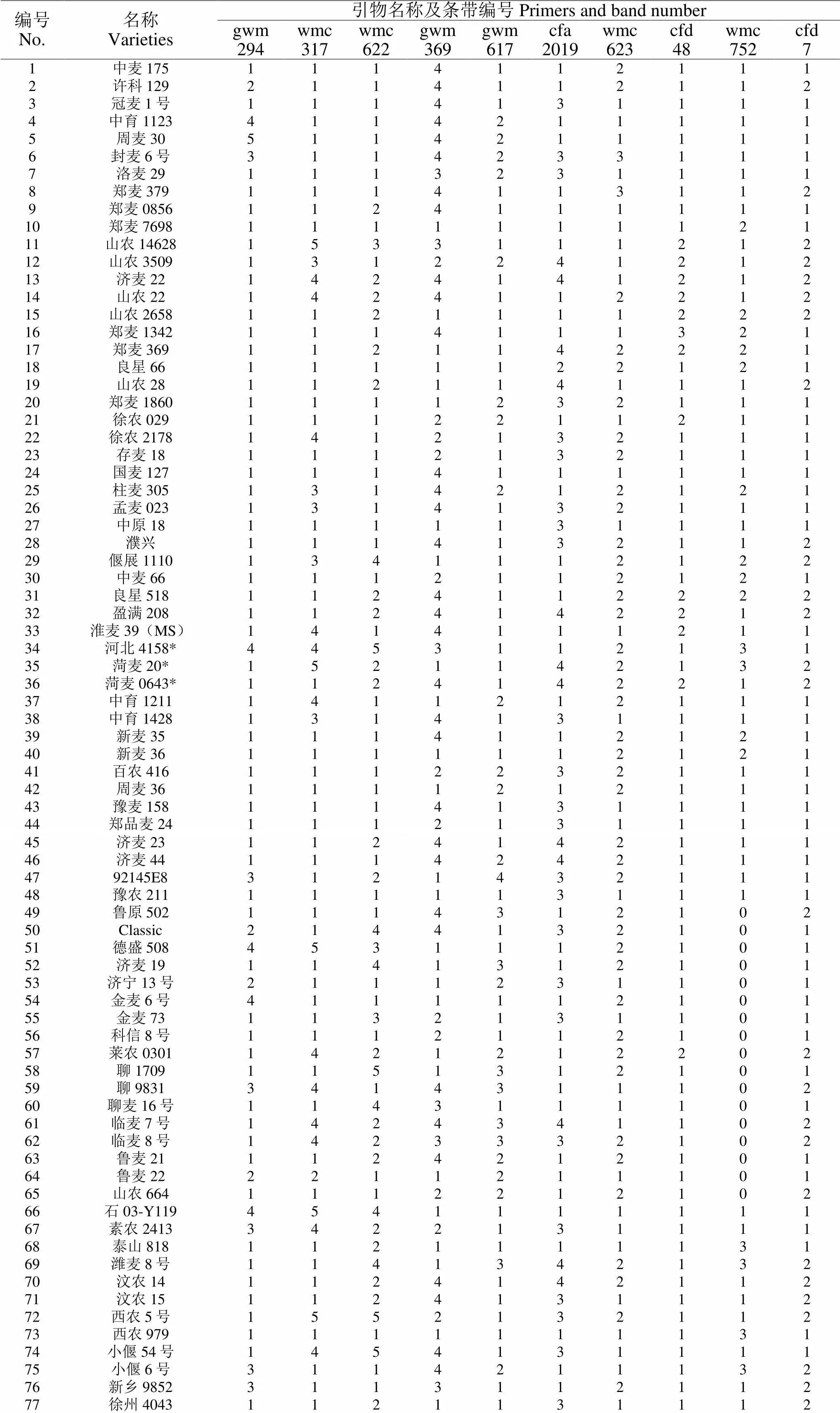
编号No.名称Varieties引物名称及条带编号 Primers and band numbergwm294wmc317wmc622gwm369gwm617cfa2019wmc623cfd48wmc752cfd7 1中麦1751114112111 2许科1292114112112 3冠麦1号1114131111 4中育11234114211111 5周麦305114211111 6封麦6号3114233111 7洛麦291113231111 8郑麦3791114113112 9郑麦08561124111111 10郑麦76981111111121 11山农146281533111212 12山农35091312241212 13济麦221424141212 14山农221424112212 15山农26581121111222 16郑麦13421114111321 17郑麦3691121142221 18良星661111122121 19山农281121141112 20郑麦18601111232111 21徐农0291112211211 22徐农21781412132111 23存麦181112132111 24国麦1271114111111 25柱麦3051314212121 26孟麦0231314132111 27中原181111131111 28濮兴1114132112 29偃展11101341112122 30中麦661112112121 31良星5181124112222 32盈满2081124142212 33淮麦39(MS)1414111211 34河北4158*4453112131 35菏麦20*1521142132 36菏麦0643*1124142212 37中育12111411212111 38中育14281314131111 39新麦351114112121 40新麦361111112121 41百农4161112232111 42周麦361111212111 43豫麦1581114131111 44郑品麦241112131111 45济麦231124142111 46济麦441114242111 4792145E83121432111 48豫农2111111131111 49鲁原5021114312102 50Classic2144132101 51德盛5084531112101 52济麦191141312101 53济宁13号2111231101 54金麦6号4111112101 55金麦731132131101 56科信8号1112112101 57莱农03011421212202 58聊17091151312101 59聊98313414311102 60聊麦16号1143111101 61临麦7号1424341102 62临麦8号1423332102 63鲁麦211124212101 64鲁麦222211211101 65山农6641112212102 66石03-Y1194541111111 67素农24133422131111 68泰山8181121111131 69潍麦8号1141342132 70汶农141124142112 71汶农151124131112 72西农5号1552132112 73西农9791111111131 74小偃54号1454131111 75小偃6号3114211132 76新乡98523113112112 77徐州40431121131112 78烟1801121211111 79烟193421131111 80烟51581111111111 81烟农1811411311111 82矮抗581112132111 83邯61721124131311 84郑麦3063121131111 85周麦221111111131 8602H171141131131 87郑麦8831111212131 88郑麦13251214231312 89国麦3011414211211 90豫农9492111142131 91良星991421131212 92安农11241114211131 93衡观352131111131 94邯优34753114111132 95沧麦193122112132 96中麦1551124242112 97登海50481104131131 98豫农8021102232131 99宿12642101231111 100许科3164201211131 101豫麦4161104111111 102周麦261304132111 103周麦27(粉)1102113111 104石麦151102311131 105潍麦333104112231 106宁麦131403112212 107镇麦1681401112312 108扬麦1581101111112 109太麦1983102112111 110山农紫麦1号1103112111 111山农201414111111 112山农231414111112 113山农241114112112 114山农251114112111 115山农291413141112 116山农303114111112 117山农313414111111 118山农321414141111 119山农153813412111131
Establishment of DNA Fingerprinting and Genetic Diversity Analysis of Main Wheat Cultivars in Huanghuai Region
YANG Yang-hong, YIN Hua-yan, GAO Yu, ZHAO JIN-xiao, MA Xin, WANG Hong-wei, LI An-fei, KONG Ling-rang, LI Xian-bin*
271018,
Wheat is an important food crop in the world, its rich genetic variation is crucial to wheat improvement. Eighty-four SSR primers distributed on A, B, Dgenome were used to build DNA fingerprinting database and genetic diversity analysis in 119 samples of main wheat cultivars in Huanghuai region. The study showed that 170 variations were detected by using the 84 pairs of SSR primers, and each pair of primers exhibited 1-5 alleles in 119 wheat cultivars in Huanghuai region. Out of the 84 pairs of SSR primers, 13 pairs of primers can detect one of wheat cultivars different from the other varieties respectively. According to SSR gene clustering dendrogram, 119 wheat varieties could be divided into 5 groups to some extent, which could provide some theoretical information for wheat improvement in the future.
Wheat; SSR primers; fingerprinting; genetic diversity
S512.1
A
1000-2324(2018)03-0371-08
2017-12-1
2017-12-18
山东省自主创新重大关键技术(2014GJJS0201-3-1);山东省农业良种工程
杨艳红(1993-),女,硕士研究生,主要从事小麦种质资源创新工作. E-mail:yyh19930106@163.com
Author for correspondence. E-mail:lqlwlxb@163.com
