巴什拜羊M C 4R基因多态性及其与生长性状的关联分析
2018-05-29黄李勇曼则热朱尔丁吐尔逊阿依牙力坤依明苏来曼
黄李勇,赵 雄,曼则热·朱尔丁,吐尔逊阿依·牙力坤,依明·苏来曼
(新疆农业大学动物科学学院,乌鲁木齐 830052)
黑素皮质素受体-4(melanocortin-4 receptor)广泛存在于动物中枢神经系统的各个区域,是下丘脑腹内侧核分泌的一种肽类物质[1],MC4R是G-蛋白偶联受体超家族成员之一,可以通过中枢神经系统控制哺乳动物的摄食量、能量稳态和体重,是一个调控动态平衡和能量平衡的重要信号分子,在马和猪等哺乳动物中主要影响采食、增重和脂肪等性状[2]。MC4R是黑素皮质素系统最主要的成员,中枢神经系统的功能主要表现为抑制哺乳动物摄食,导致血糖和胰岛素水平降低,从而减少体内脂肪,降低体重。因此在研究人类肥胖和哺乳动物生长过程中,MC4R基因作为重要的调节因子倍受关注[3]。
巴什拜羊是上世纪初期,新疆塔城地区著名爱国民主人士巴什拜·乔拉克·巴平从地方品种哈萨克羊中选出优良母羊作为母本,并严格选育优良种公羊,同时导入野生盘羊进行杂交改良,通过牧民及科研工作者的长期选育形成的地方优良品种[4]。具有生长发育速度快,产肉性能高,适应性强等特点。原产于塔城裕民县的巴尔鲁克山区[5],现今主要分布在塔城地区的裕民县、额敏县和托里县等地。截止2014年新疆巴什拜羊存栏总数已达150万只[6]。目前,关于新疆巴什拜羊生长发育和肉质等性状候选基因的标记辅助选择研究报道较少。本研究对巴什拜羊MC4R基因进行多态性分析,探讨其多态性与生长指标的关系,以期为巴什拜羊分子标记育种提供有力的科学依据。
1 试验材料与方法
1.1 试验材料
1.1.1 样本选择
血液样本来自于新疆塔城裕民县巴什拜羊繁育基地,随机选取300只年龄相近健康无病的巴什拜羊作为试验羊。采用颈静脉采血的方法,采血10 mL/只,与枸橼酸钠抗凝剂充分混匀置于冰盒中带回实验室,-20℃保存备用。
1.1.2 主要试剂和药品
Tris平衡酚, 氯仿异戊醇, 冰无水乙醇,70%无水乙醇,2×Taq PCR MasterMix,6×Loading Buffer,D2000,ddH2O,蒸馏水,甲醛,Tris碱,EDTA-Na2,AgNO3,NaCl,SDS,NaOH,溴化乙锭,尿素,盐酸,丙烯酰胺,甲叉双丙烯酰胺,过硫酸铵,95%去离子甲酰胺,二甲苯青,溴酚蓝,琼脂糖。
1.1.3 主要试验仪器
PH仪:瑞士梅特勒-托利多公司;电子天平:瑞士梅特勒-托利多公司;31BN型电泳槽:北京市六一仪器厂;HZS-H水浴振荡器:哈尔滨市东明医疗仪器厂制造;HS-3垂直混合器:宁波新芝生物科技股份有限公司;TG16-W 微量高速离心机;WG700TL20Ⅱ-K6:Galanz;AL204-IC:METTLER TOLEDO;Centrifuge 5810 R:eppendorf;水平摇床:北京市六一仪器厂。
1.2 试验方法
1.2.1 巴什拜羊基因组DNA的提取
采用常规酚-氯仿抽提法提取血液基因组DNA,溶于TE中,-20℃保存备用。
1.2.2 引物的设计、合成及稀释
1.2.2.1 引物的设计及合成 按照Genbank所公布的绵羊MC4R基因序列(JQ710684.1),运用Premier5.0软件设计引物F:GTCGGGCGTCTTGTTCAT R:GTTTGGCACCGCAGTTTG,由上海生物工程有限公司进行合成。
1.2.2.2 引物的稀释 将合成的引物1 000 rpm离心1 min后,按照提供的引物稀释说明加入ddH2O稀释至100 μm,充分振荡,再次1 000 rpm离心1 min,放入4℃冰箱,6 h后取出,再次加入ddH2O将贮存液稀释至10 μm,振荡使充分混匀,分装到不同的eppendorf管中,置于-20℃冰箱中,用于PCR扩增试验。
1.2.3 PCR扩增体系与反应条件
PCR 扩增反应总体积 20 μL:DNA 模板(50 ng/ul)1 μL,上游引物(10 pmol/ul)0.5 μL,下游引物(10 pmol/ul)0.5 μL,2×Taq PCR MasterMix10 μL,再加入 8 μL 的 ddH2O 使总体积为 20 μL。
PCR反应程序:94℃预变性5 min,35个循环(94℃变性30 s,60.6℃退火30 s,72℃延伸1 min),72℃延伸5 min,4℃保存。
1.2.4 PCR-SSCP检测
SSCP的检测分析方法参考周延清[7]等的方法进行。取10 μL PCR产物和7 μL变性剂98℃变性10 min,冰浴30 min,用8%的非变性聚丙烯酰胺凝胶。电泳300 V 50 mA空跑30 min,预跑10 min,180 V电泳15 h,取出用配置好的硝酸银溶液进行染色,30 min后取出用氢氧化钠和甲醛溶液进行显色,显色后在凝胶成像仪中进行成像,并对结果进行分析和判定基因型。
1.2.5 DNA测序
选取不同基因型的PCR产物各两个样品进行测序。测序结果与Genbank中绵羊MC4R基因的核苷酸序列进行比较,采用DNAMAN软件和Chromas软件对测序结果进行综合分析,验证突变位点。
1.2.6 巴什拜羊体尺指标的测定
体长、体高、体重、管围及胸围的测量参照《羊生产学》的方法[8],对试验羊进行实地测量并进行记录。
1.2.7 数据统计与分析
使用Microsoft Excel 2003统计和整理巴什拜羊生产数据;运用软件PIC-CALC和POPGENE32计算巴什拜羊MC4R基因的基因型频率、等位基因频率、纯合度、杂合度、多态信息含量和有效等位基因数,并对该位点基因型的分布进行Hardy-Weinberg平衡的卡方适合性检验。使用SPSS 21.0软件中的方差分析,对个体基因型与周岁巴什拜母羊的体重、体长、体高、胸围等数据进行显著性检验,以“最小二乘均值士标准误”表示。显著性检验,P>0.05时差异不显著;P<0.05时差异显著;P<0.01时差异极显著。
2 试验结果与分析
2.1 巴什拜羊基因组DNA的检测
用浓度为1%琼脂糖凝胶对提取的巴什拜羊基因组DNA进行检测,如图1所示,凝胶上的基因组DNA条带整齐清晰,无拖尾现象,且DNA OD260/OD280值在1.6~1.8,表明基因组DNA的完整性和纯度比较好,可用于后续的PCR扩增试验。

图1 巴什拜羊基因组DNA检测结果
2.2 巴什拜羊MC4R基因的PCR检测
PCR产物用浓度为1.5%的琼脂糖凝胶检测结果如图2所示 ,PCR扩增得到的条带清晰明亮,无其他条带,且扩增片段为488bp与预期结果一致,可用于后续的SSCP试验。

图2 MC4R基因的PCR检测结果
2.3 MC4基因的PCR-SSCP检测结果
MC4R基因的PCR扩增产物用8%的聚丙烯酰胺凝胶检测,电泳16 h,检测结果如图3,结果出现了两种不同类型的条带,分别定义为GG型和GC型。

图3 MC4R基因的PCR-SSCP检测结果
2.4 MC4R基因的测序结果
选择MC4R基因扩增的不同类型PCR产物各2个样品送上海生工生物有限公司进行测序,测序结果与Genbank上发表的绵羊MC4R基因序列 (JQ710684.1)进行多序列比较,结果显示MC4R基因在893bp处存在G到C的突变,可以记作G893C。结果如图4、图5所示。通过氨基酸序列分析发现,MC4R基因在G893C处的突变并未使氨基酸的编码发生改变,此位点突变为同义突变。

图4 MC4R基因的测序结果
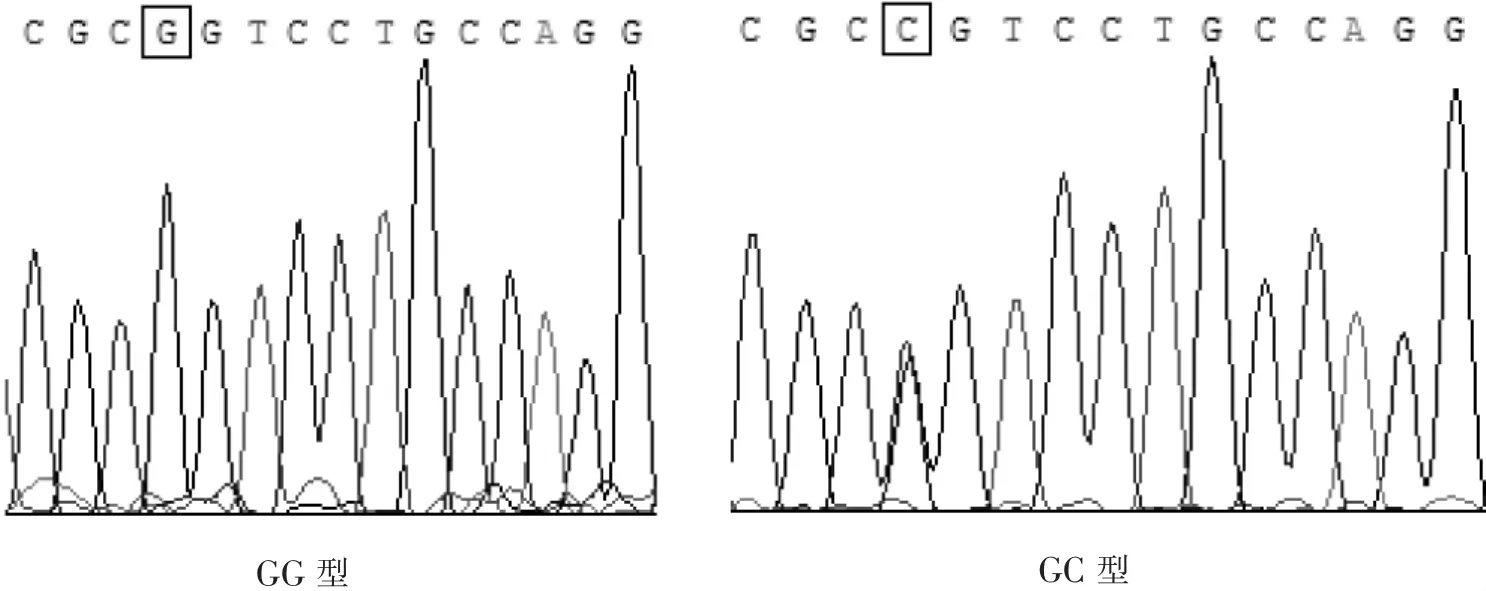
图5 各基因型测序峰图
2.5 基因群体遗传结构分析
2.5.1 MC4R基因的基因频率和基因型频率
由表1可知,在检测的巴什拜羊群体中,MC4R基因存在2种基因型:GG型和GC型,GG型基因频率是0.807,GC型的基因频率是0.193。在巴什拜羊群体中G等位基因频率是0.903,C等位基因频率是0.097。且在巴什拜羊群体中等位基因G为优势等位基因。经卡方检验,MC4R基因在巴什拜羊群体中处于哈代温伯格平衡 (P>0.05)。

表1 MC4R基因的基因型频率和等位基因频率
2.5.2 MC4R基因的遗传参数值
对巴什拜羊MC4R基因多态信息含量、基因纯合度和杂合度等进行分析,结果如表2所示。从表2可得出,MC4R基因在巴什拜羊群体中的基因纯合度是0.825,基因杂合度是0.175,有效等位基因数是1.212,多态信息含量为0.159,为低度多态位点。

表2 MC4R基因的基因纯合度、杂合度、有效等位基因和多态信息含量
2.5.3 巴什拜羊MC4R基因不同基因型与生长性状的关联分析
由表3的分析结果可知在巴什拜羊群体中,GC型个体的胸围显著高于GG型个体 (P<0.05),GC型个体的体重显著高于GG型个体(P<0.05),GC型和GG型个体间的体长、体高和管围等三个指标差异不显著(P>0.05)。因此,初步推测MC4R基因在G893C基因座表现的多态有可能作为一种遗传标记,通过对优势基因型的选择,加快对巴什拜羊育种的遗传改良。

表3 MC4R基因不同基因型与巴什拜羊生长性状的关系
3 讨 论
3.1 MC4R基因群体遗传特征分析
有效等位基因数、多态信息含量、纯合度、杂合度等指标从不同角度反映了群体的遗传变异程度。群体的杂合度一般认为与遗传多样性密切相关,群体杂合度越高,群体的遗传变异越大,遗传多样性就越丰富,选择的潜力就越大。本试验中,MC4R基因的纯合度为0.825,杂合度为0.175,有效等位基因数为1.212,多态信息含量为0.159,为低度多态位点,表明在该位点的遗传变异较小。
3.2 MC4R基因多态性与生长性状的关联分析
近年来,对MC4R基因多态性的研究报道较多,张菊[9]等在MC4R基因中发现四个SNP位点,通过PIRA-PCR技术检测1232位的G→A突变,发现AG和AA型较GG型具有较高的背膘厚度。张高振[10]等运用PCR-SSCP技术对湖羊群体中MC4R基因的多态性进行检测,发现在1 229位点发生G→A的突变,产生的3种基因型,并且发现3种基因型之间羔羊的出生重有显著的差异;在1 232位点发生G→A的突变与绵羊背膘厚度相关,AA型和AG型相比于GG型有较高的背膘厚度。王春玲[11]等对湖羊MC4R基因的研究发现在548位点的C→T的突变与2月龄体重显著相关。
本试验对MC4R基因多态性的遗传变异分析,结果显示MC4R基因在巴什拜羊群体中存在多态性,存在2种基因型:GG和GC,测序结果显示MC4R基因在893bp处发生碱基G到C突变。通过氨基酸序列分析发现,突变并未使氨基酸的编码发生改变,此位点突变为同义突变。与巴什拜羊生长性状等指标进行关联分析可知,GC型个体的胸围显著高于GG型个体的胸围(P<0.05),GC型个体的体重显著高于GG型个体的体重(P<0.05),GG型和GC型个体间的体长、体高和管围等3个指标差异不显著(P>0.05)。一般认为同义突变对动物表型和基因发挥功能没有影响,因为同义突变没有引起编码氨基酸改变[12]。但有些研究表明,同义突变可以通过改变mRNA稳定性和定位、改变基因的翻译效率、改变蛋白质的结构等方式影响基因的表达,最终引起表型数据的差异[13-15]。周明亮[16]等研究结果显示在IGF-I基因外显子3的A→G突变并未引起编码氨基酸发生改变,但该位点的多态性与绵羊出生后的断奶体重和断奶日增重存在相关性。宋桃伟[17]等研究发现,在GHSR基因G200A处突变并未引起氨基酸的改变,但该SNP位点不同基因型的个体在体高上有显著差异(P<0.05)。本试验也表明MC4R基因在893bp处存在G到C的突变对巴什拜羊体重、胸围有显著影响。初步推测MC4R基因在G893C处表现的多态有可能作为一种遗传标记,通过对优势基因型的选择,加快对巴什拜羊育种的遗传改良。
4 结 论
本试验通过对MC4R基因进行PCR-SSCP分析和测序发现,MC4R基因在巴什拜羊群体中有多态性,存在2种基因型:GG和GC,测序结果显示MC4R基因在893bp处发生碱基G到C突变。关联分析表明:巴什拜羊不同基因型之间胸围、体重指标差异显著。巴什拜羊MC4R基因在G893C处表现的多态有可能作为一种遗传标记。
参考文献:
[1]YEO GS,FAROOQI I S,CHALLIS BG,et al.The role of melanocortin signalling in the control of body weight:Evidence from human and murine genetic models[J].Quarterly Journal of Medicine,2000,93(1):7-14.
[2]刘娇娇.绵羊MC4R、MRF4、PROP1基因多态性及生物信息学分析[D].兰州:甘肃农业大学,2014.
[3]左北瑶,钱宏光.MC4R基因研究进展[J].中国草食动物,2011,31(5):45-50.
[4]国家畜禽遗传资源委员会组编.中国畜禽遗传资源志·羊志[M].北京:中国农业出版社,2011,122-123.
[5]买买提明·巴拉提,哈米提·哈凯莫夫,决肯·阿努瓦什.羔羊肉型巴什拜羊的研究[J].草食家畜,1999,(02):16-19.
[6]努尔拉提汗·木哈买提别克,赛力克·木勒达汗,决肯·阿尼瓦什,等.新疆巴什拜羊青色和白色毛绒品质比较分析[J].新疆畜牧业,2015,(11):25-27.
[7]周延清,杨清香,张改娜.生物遗传标记与应用[M].北京:化学工业出版社,2008,104-105.
[8]张英杰.羊生产学[M].北京:中国农业出版社,2010,252-253.
[9]张菊.绵羊CAST、MC4R和BTG1基因的克隆、组织表达和遗传多态性分析[D].北京:中国农业科学院,2009.
[10]张高振.MC4R基因多态性及其与湖羊早期生长性状的相关研究[D].南京:南京农业大学,2009,06.
[11]王春玲,茆达干,曹少先,等.6个绵羊群体MC4R基因CRS-PCR多态性及其与湖羊、东湖杂交羊生长性状的关联分析[J].南京:南京农业大学学报,2014,37(l):121-126.
[12]Komar A A.Silent SNPs:impact on gene function and phenotype[J].Pharmacogenomics,2007,8(8):1075-1080.
[13]任法鑫,杨钧国,李伟,等.国人SCN5A基因新的同义突变位点[J].中国循环杂志,2004,(05):52-54.
[14]陈南春,高辉,陈苏民,等.cⅠ857基因的体外定位同义突变[J].生物化学杂志,1994,(04):509-512.
[15]L.Corrado,S.Magri,A.Bagarotti,et al.A novel synonymous mutation in the MPZ gene causing an aberrant splicing pattern and Charcot-Marie-Tooth disease type 1b[J].Neuromuscular Disorders,2016.
[16]周明亮,张翔宇,綦松智,等.绵羊IGF-Ⅰ基因的表达及其SNPs与生长性状的相关分析研究[J].畜牧兽医学报,2013,44(09):1363-1370.
[17]宋桃伟,蔡慧芬,罗卫星,等.两个贵州山羊品种GHSR和GHRL基因遗传变异及其与生长性状的关联性[J].中国农业科学,2015,48(l):140-153.
