纳米银与镉的复合毒性对拟南芥根系形态及叶片生理指标的影响
2018-05-26张传玲江红生李长江汤棋惠尹黎燕
张传玲,江红生,李长江,汤棋惠,王 悠,尹黎燕*
纳米银与镉的复合毒性对拟南芥根系形态及叶片生理指标的影响
张传玲1,江红生2,李长江1,汤棋惠1,王 悠1,尹黎燕1*
(1.海南大学热带农林学院,海南省热带生物资源可持续利用重点实验室,海南 海口 570228;2.中国科学院武汉植物园,湖北 武汉 430074)
为研究纳米银(AgNPs)与镉(Cd2+)对拟南芥的复合毒性,本文以不同浓度的PVP coated-AgNPs和Cd2+处理拟南芥幼苗一周后,测定了拟南芥幼苗主根长度,根毛数量,叶片中光合色素和可溶性蛋白含量及抗氧化系统相关酶活性.结果表明,高浓度(5mg/L)Cd2+能显著抑制根长,提高可溶性蛋白含量及SOD(超氧化物歧化酶)和POD(过氧化物酶)的活性.在高浓度Cd2+(5mg/L)中加入AgNPs能显著增强Cd2+对根长的抑制作用,而高浓度的Cd2+能缓解AgNPs对根毛的抑制作用;在低浓度Cd2+(0.1mg/L和1mg/L)中加入AgNPs能显著增强Cd2+对色素含量抑制作用;在含有Cd2+的处理中,SOD和POD在1mg/L AgNPs下活性最高;以上结果说明Cd2+和AgNPs对拟南芥幼苗根系形态及叶片生理指标都存在交互影响.
纳米银;镉;复合毒性
纳米银(AgNPs)是指直径在1~100nm之间的金属银单质[1],由于其优异的抗菌特性被广泛应用于医疗保健、食品、化妆品等领域[2],在生产、运输和应用过程中都不可避免地会释放到环境中[3],对整个生态系统产生影响.AgNPs可以明显抑制小球藻的光合作用[4],显著降低紫萍组织中叶绿素含量[5],并且是由于光能的不均衡运输导致ROS的产生和积累,进而使植物遭受氧化损伤[6].
重金属作为传统污染物具有显著生态毒性和健康风险,镉污染尤为突出[7-8].在酸性土壤中,镉可以在农作物根系中大量富集,并转运到地上可食部分,严重影响了食品的质量安全[9].研究表明镉很容易被植物吸收从而影响植物根系生长[10]、光合作用[11]及抗氧化系统相关酶活性[12-14].
重金属对生物体的毒性不仅与重金属本身的浓度、环境pH值相关,而且与环境中的重金属离子如Pb2+[10]、非重金属离子如Ca2+、Mg2+、Zn2+、Na+、K+等[15-16]及化学物质如抗生素[17]和生物质碳[18]的存在相关.纳米材料比表面积大且表面存在多种官能团,可以吸附重金属离子从而降低重金属的离子浓度[19-21].纳米TiO2存降低Cu2+的吸收量[22],改性纳米碳黑可以降低土壤中有效态Cu和Zn的含量[23].然而AgNPs作为一种潜在的新型污染物,是否与Cd2+产生协同作用对植物造成更强的毒害还鲜有研究.因此,本文以拟南芥为植物材料,对AgNPs和Cd2+的复合毒性进行了研究,不仅可为未来纳米材料与重金属对植物的交互影响提供理论基础,也可为重金属下AgNPs的生物安全性提供评价依据.
1 材料与方法
1.1 材料
拟南芥Col-0(哥伦比亚生态型)
1.2 AgNPs的制备及表征
PVP包被的AgNPs的合成参照Cheng等[24]的方法,通过多羟基化合物法进行制备,具体合成纳米银的实验步骤参照陈斌等[25].AgNPs的形态学信息通过TEM观测(JEM2100),AgNPs总浓度通过ICP-OES(Optima 5300DV)测定,AgNPs原液经过3kDa超滤管过滤后通过ICP-OES测定释放的自由银离子含量,XRD射线晶体衍射分析通过D/MX-IIIA X射线衍射仪测定,AgNPs的粒径及Zeta电位使用Zeta电位及粒度分析仪(Zetasizer Nano-ZS)测定.
1.3 试验设计
拟南芥种子先用0.9%的NaClO水溶液消毒16min,1000µL无菌水清洗4次,每次3min,然后用枪头将种子点播于预先加有不同浓度处理液的1/2MS固体培养基上,处理板浓度分别为0,1, 10mg/L AgNPs;0.1,1,5mg/L Cd2+;0.1mg/L Cd2++ 1mg/L AgNPs,0.1mg/L Cd2++ 10mg/L AgNPs, 1mg/L Cd2++ 1mg/L AgNPs,1mg/L Cd2++ 10mg/ L AgNPs,5mg/L Cd2++ 1mg/L AgNPs,5mg/L Cd2++10mg/L AgNPs.总共12个处理,每个处理3个重复.将处理板置于4℃冰箱中春化3d,移入光照培养箱 (Panasonic MLR-352H-PC) 垂直培养,温度为 (22±1)℃,光周期为16h光照:8h黑暗(光照强度为125µmolphoto/(m2×s)).生长一周后统计主根长度及根毛数量,测定叶片光合色素和可溶性蛋白含量及SOD,POD活性.
1.4 主根长度及根毛数量的统计
植物萌发一周后用相机(Nikon D7100)拍照,用ImageJ统计主根长度,然后将培养皿直接放置于体式显微镜(LEICA M205FA)下,观察距离根尖部位0~2mm的根毛生长情况并拍照,每个处理3个重复,每个重复10~15株苗.
1.6 光合色素含量的测定
称取萌发一周后的拟南芥叶片约0.03g放置于5mL离心管中;加入3mL 95%的乙醇溶液,4 ℃暗处理24~48h,待叶片无色后利用紫外可见分光光度计(T6新世纪)测定470, 665和649nm处吸光值,并参照式(1~3)计算叶绿素a(Chl a)、叶绿素b(Chl b)、类胡萝卜素(Car)的含量.
Chl a(mg/g)=(13.95×OD665-6.88×OD649)×
/1000/(1)
Chl b(mg/g)=(24.96×OD649-7.32×OD665)×
/1000/(2)
Car=(1000×OD470-2.05×Chl a-114.8×Chl b)/
245 ×(/1000/) (3)
式中:为提取液体积, mL;为鲜重, g.
1.7 抗氧化系统相关酶及可溶性蛋白含量的测定
称取萌发一周后的拟南芥新鲜叶片约0.1g,放入研钵中,加入1.5mL PBS(0.05M PH = 7.8)缓冲液充分研磨后转移至1.5mL EP管中,4℃, 10000g离心20min,提取酶液约1400mL分装到200mL的八连管中,保存在超低温冰箱.SOD, POD及可溶性蛋白含量的测定的方法参照陈斌等[25].
1.8 数据分析
所有数据均已均值±标准差形式呈现,各处理间的差异水平用SPSS 13.0进行单因素方差分析,多重比较采用Duncan检测,< 0.05时表明差异显著.
2 结果与分析
2.1 纳米银的表征
图1 AgNPs TEM电镜照片和XRD衍射图谱
Fig.1 TEM image and XRD diffraction pattern of AgNPs
TEM电镜观察纳米银颗粒均一,均为球体(图1A).通过ICP-OES测定,所合成的AgNPs总浓度为7127mg/L,释放出来的Ag+含量为纳米银质量的4%.使用Zeta电位及粒度分析仪测定AgNPs粒径为(31.29±5.92) nm,Zeta电位为-23.3mV.XRD晶体衍射分析AgNPs衍射模型符合金属银参考标准(图1B).
2.2 镉与纳米银处理对主根长度及根毛数量的影响
低浓度的Cd2+(0.1mg/L和1mg/L)对拟南芥根长没有显著影响,而高浓度的Cd2+(5mg/L)显著抑制根长(图2).不同浓度Cd2+处理下加入AgNPs对根长的影响表现出不同的规律.在低Cd2+浓度(0.1mg/L和1mg/L)下,随着AgNPs浓度的增加,根长逐渐增长,并达到显著水平;而在高Cd2+浓度(5mg/L)下,AgNPs增强了Cd2+对主根长度的抑制作用并且也达到显著水平.对所有处理比较发现(表2),在AgNPs浓度为10mg/L时,拟南芥的主根最长,显著高于其他处理,而在5mg/L Cd2+浓度下,加入1mg/L或10mg/L AgNPs后,主根最短,对根长抑制作用也最强.
不同浓度的Cd2+处理对根毛的生长没有明显影响(表1).单一AgNPs处理显著抑制了根毛数量(表1)与根毛的长度(图2),在含Cd2+的处理中加入AgNPs后,也表现出根毛短小或不生长.但是高浓度Cd2+(5mg/L)处理中加入AgNPs后,根毛数量分别为2.4和2.7,较单一AgNPs处理下根毛数0.2和0.5多.
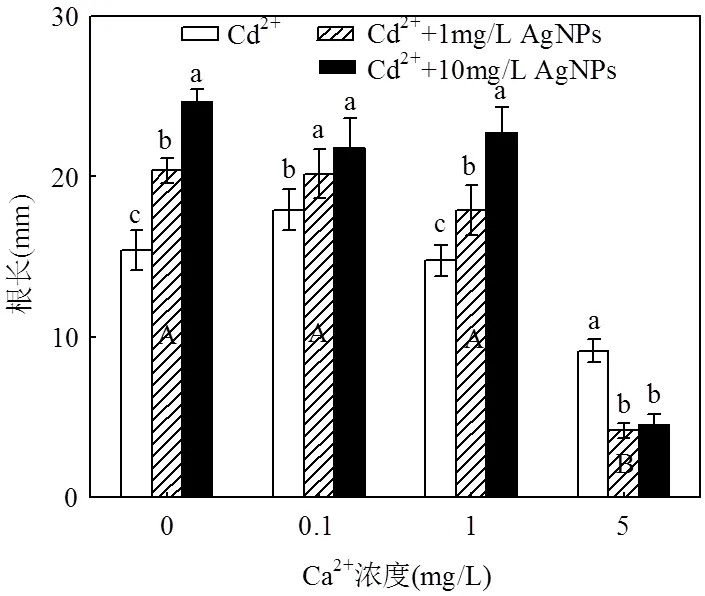
图2 Cd2+与AgNPs处理一周后拟南芥主根长度
不同小写字母表示一定Cd2+浓度下不同浓度的AgNPs处理间差异显著(< 0.05),不同大写字母表示不同浓度Cd2+处理间差异显著(< 0.05)

图3 体式显微镜下Cd2+与AgNPs处理一周后拟南芥根毛图片
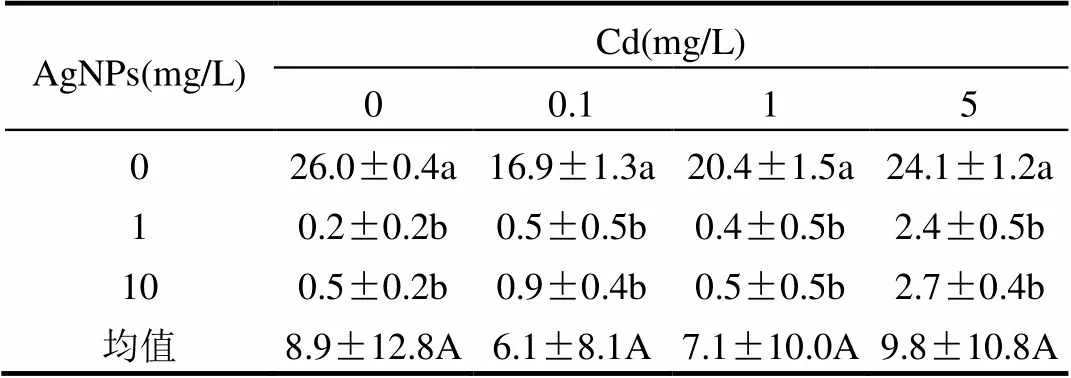
表1 Cd2+与AgNPs处理一周后拟南芥根毛数量
注:不同小写字母表示一定Cd2+浓度下不同浓度的AgNPs处理间差异显著(<0.05),不同大写字母表示不同浓度Cd2+处理间差异显著(<0.05).
2.3 镉与纳米银处理对光合色素的影响
不同浓度的Cd2+处理下光合色素含量没有发生明显变化(图4,5,6);但在低Cd2+浓度(0.1mg/L和1mg/L)下,随着AgNPs浓度的增加,色素含量显著降低,表明AgNPs和Cd2+具有协同作用,加剧了Cd2+对光合系统的影响;而在高Cd2+浓度(5mg/L)下,随着AgNPs浓度的增加,色素含量比单独施用Cd2+或AgNPs处理时含量更高但未达差异显著,说明高浓度Cd2+处理有可能抑制AgNPs对色素含量的影响.以上结果也表明Cd2+与AgNPs对色素含量存在交互影响且达到极显著水平(<0.01)(表2).
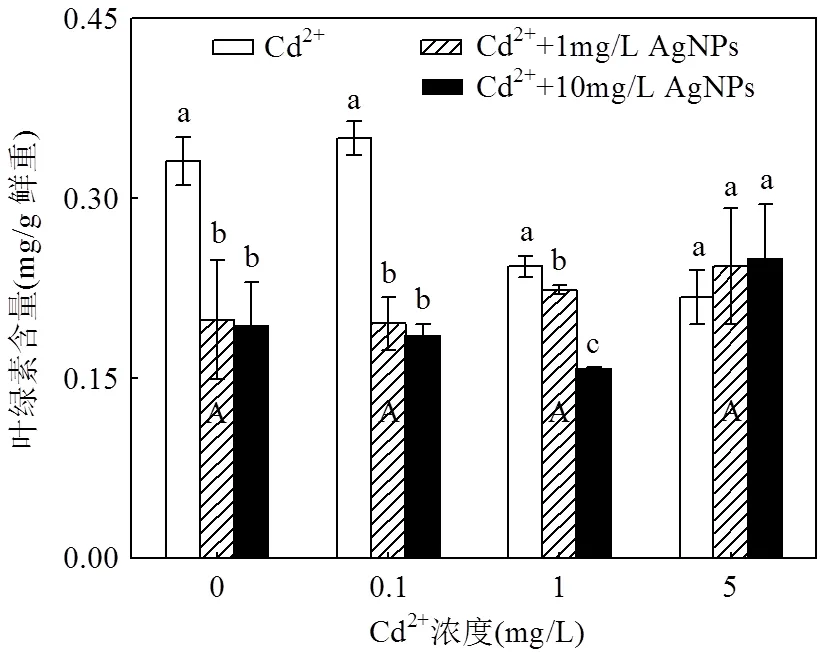
图4 Cd2+与AgNPs处理一周后叶绿素a含量
不同小写字母表示一定Cd2+浓度下不同浓度的AgNPs处理间差异显著(< 0.05),不同大写字母表示不同浓度Cd2+处理间差异显著(< 0.05)
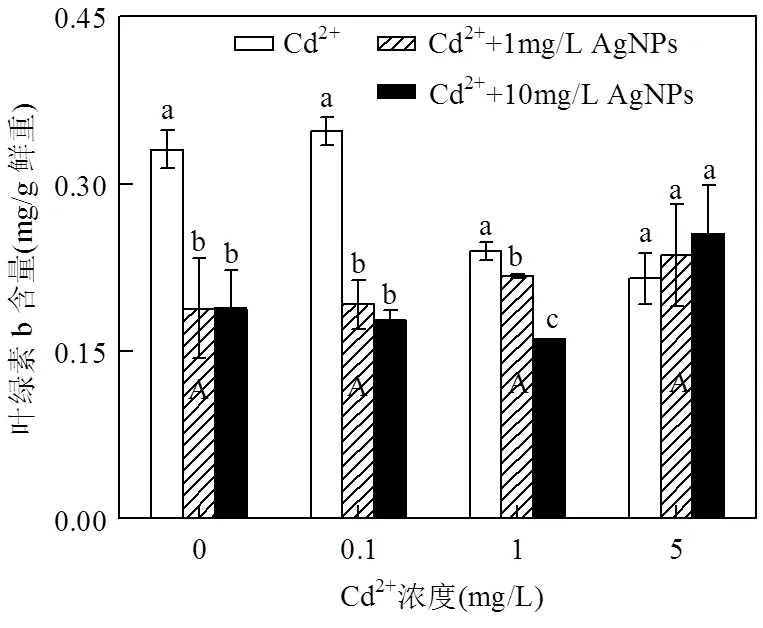
图5 Cd2+与AgNPs处理一周后叶绿素b含量
不同小写字母表示一定Cd2+浓度下不同浓度的AgNPs处理间差异显著(< 0.05),不同大写字母表示不同浓度Cd2+处理间差异显著(< 0.05)
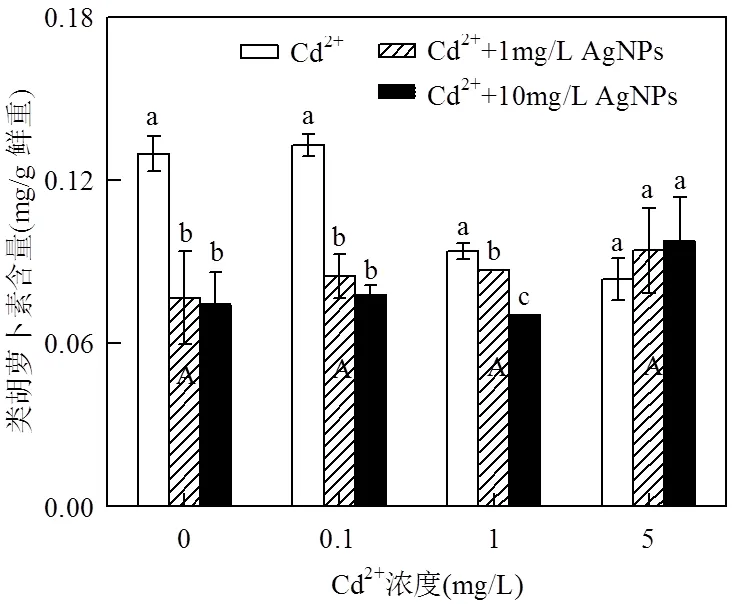
图6 Cd2+与AgNPs处理一周后类胡萝卜素含量
不同小写字母表示一定Cd2+浓度下不同浓度的AgNPs处理间差异显著(< 0.05),不同大写字母表示不同浓度Cd2+处理间差异显著(< 0.05)
2.4 镉与纳米银处理对抗氧化系统的影响
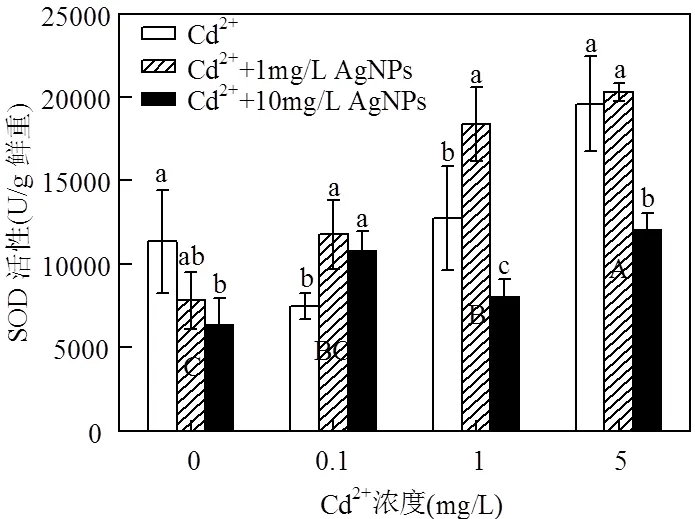
图7 Cd2+与AgNPs处理一周后SOD活性
不同小写字母表示一定Cd2+浓度下不同浓度的AgNPs处理间差异显著(< 0.05),不同大写字母表示不同浓度Cd2+处理间差异显著(< 0.05)
Cd2+和AgNPs处理对拟南芥幼苗抗氧化系统相关酶活性及可溶性蛋白含量都有明显影响.由图7可以看出,1mg/L 和5mg/L Cd2+显著增强SOD活性.在无Cd2+处理中,SOD活性随AgNPs浓度的增加逐渐减低,但在含Cd2+处理中,1mg/L AgNPs能增强SOD活性,10mg/L AgNPs不能引起SOD活性的升高.POD活性的变化表现出和SOD相同的趋势,高浓度Cd2+处理(5mg/L)显著增强POD活性(图8),同样在所有Cd2+处理下,1mg/L AgNPs能显著增强POD活性,10mg/L AgNPs降低POD活性且和对照无明显差异.这表明在Cd2+处理中加入AgNPs改变了Cd2+对SOD,POD活性的影响,且达到极显著水平(<0.01)(表2).对所有处理进行比较也发现,高浓度Cd2+处理(5mg/L)加入1mg/L AgNPs后,SOD和POD活性显著高于其他处理.
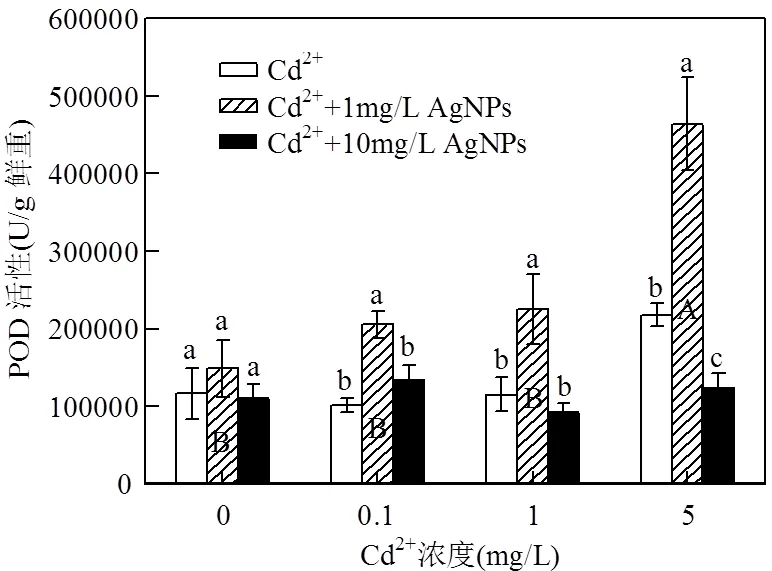
图8 Cd2+与AgNPs处理一周后POD活性
不同小写字母表示一定Cd2+浓度下不同浓度的AgNPs处理间差异显著(< 0.05),不同大写字母表示不同浓度Cd2+处理间差异显著(< 0.05)
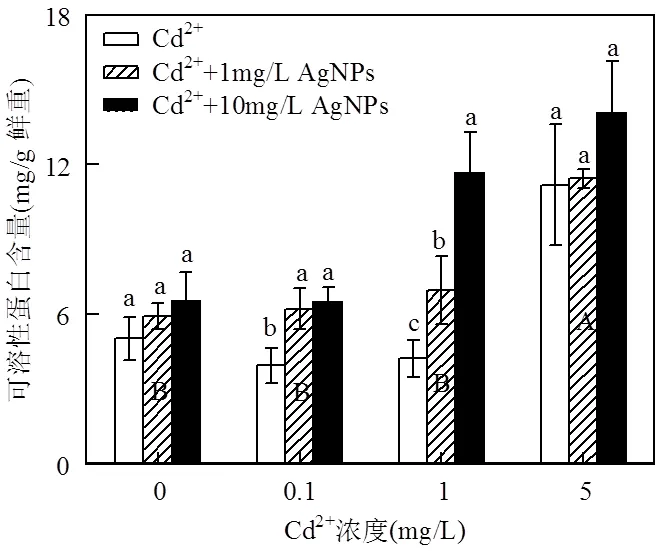
图9 Cd2+与AgNPs处理一周后可溶性蛋白含量
不同小写字母表示一定Cd2+浓度下不同浓度的AgNPs处理间差异显著(< 0.05),不同大写字母表示不同浓度Cd2+处理间差异显著(< 0.05)
由图9可以看出,低浓度的Cd2+(0.1mg/L和1mg/L)对可溶性蛋白含量没有显著影响,高浓度Cd2+处理(5mg/L)显著提高了可溶性蛋白含量.在含有Cd2+的培养基中加入AgNPs,与单独用Cd2+或AgNPs处理相比,可溶性蛋白含量更高,并且随着AgNPs浓度的升高,可溶性蛋白含量增加程度也更高.对所有处理比较也发现,高浓度Cd2+处理(5mg/L)加入10mg/L AgNPs后,可溶性蛋白含量是所有处理中最高的,表明Cd2+和AgNPs对可溶性蛋白含量的影响存在协同作用,且达到极显著水平(<0.01)(表2).
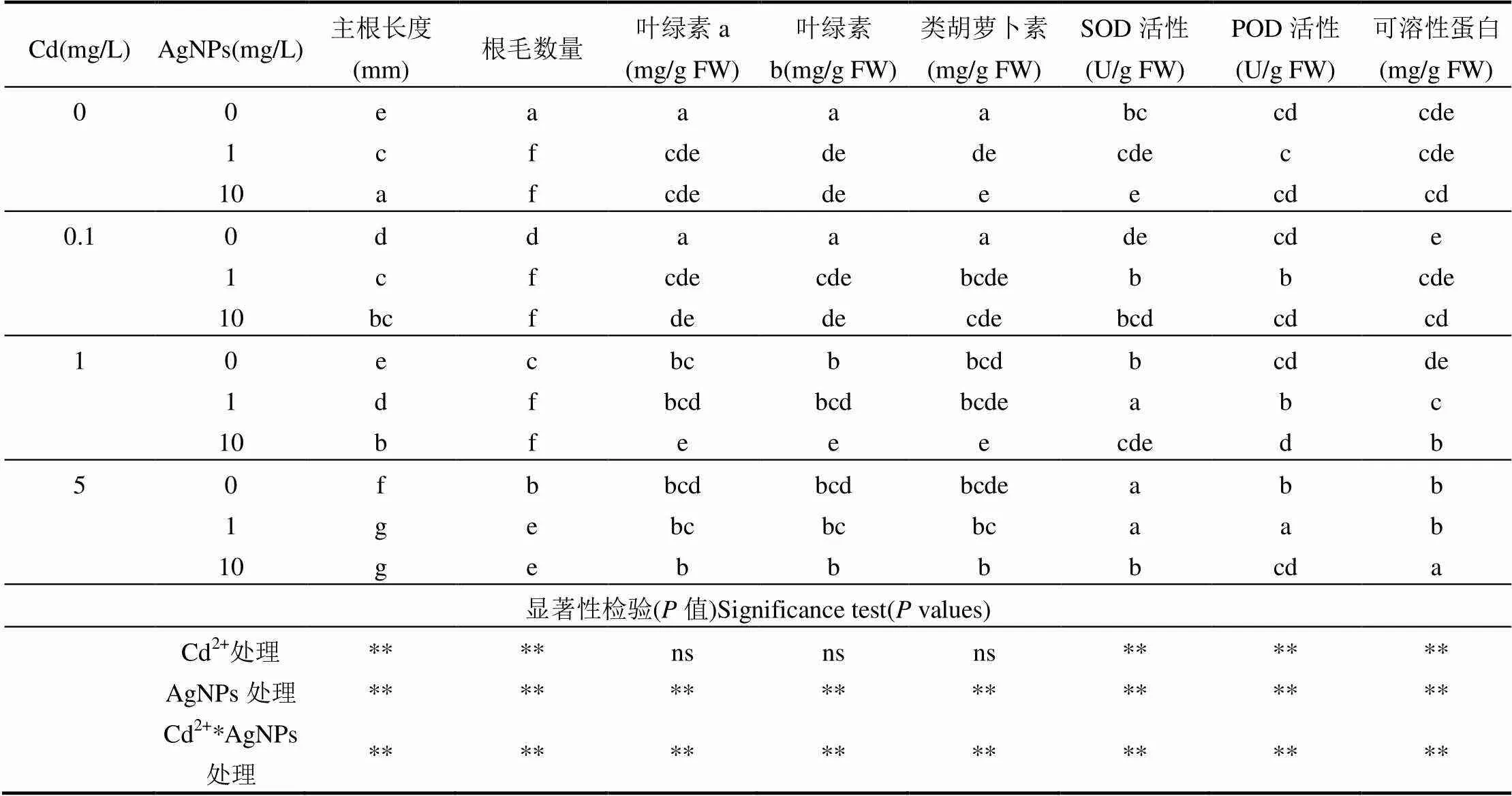
表2 Cd2+与AgNPs处理对拟南芥主根长度、根毛数量、光合色素和可溶性蛋白质含量、SOD活性、POD活性影响的差异性比较
注:同一列中不同的字母表示所有处理间差异水平达0.05;显著性检验(值):用“*”表示差异显著0.05,“**”表示差异极显著0.01,ns表示差异不显著.
3 讨论
根系在植物生长发育和物质与能量代谢中具有重要作用,根系可以直接接触土壤或其他生长介质,吸收营养并感知逆境信号,根的生长发育受到抑制则会影响植物的生理生化活动,所以当受到外界胁迫后,植物可以通过自身的调节系统,使之在生理和形态上发生适应性反应,以增强在胁迫条件下的生存机会[26].先前的研究表明,盐胁迫、干旱胁迫及铝胁迫都能不同程度的诱导主根的伸长或缩短[27-29].Mukherji等[30]的研究表明Cd2+会影响植物根细胞分裂,抑制根系生长.吕笃康等[31]发现Cd2+和Cu2+复合作用显著增强了Cd2+对小麦幼苗的苗长及根长的抑制作用.本研究中,高浓度Cd2+(5mg/L) 显著抑制根长,并且高Cd2+浓度下,AgNPs显著增强了Cd2+对根长的抑制作用,这与前人的研究结果是一致的.同时作者还发现,在低Cd2+浓度(0.1和1mg/L)下,随着AgNPs浓度的增加,主根长度逐渐增长并达到显著水平,表明两者对根长的影响存在交互作用且低浓度和高浓度的Cd2+下AgNPs对根长的影响存在差异.
本研究发现,1和10mg/L的AgNPs均显著抑制根毛生长,表现出根毛基本不生长的状态,说明根毛生长对AgNPs处理非常的敏感,何九军等[32]实验发现Zn2+可严重危害萝卜根系,50mg/mL Zn2+出现根毛脱落,根尖开始萎缩的现象; 100mg/ml时,已无根毛生长,且根尖萎缩发黑.盐胁迫[28]和干旱胁迫[33]也可导致根毛数量的减少.根毛生长受到影响,不仅会干扰植物对外界营养物质及离子的吸收[34],而且会对植物的生长发育产生威胁[35].李隼等[36]也发现Cd2+通过干扰水稻根毛细胞对钾离子的吸收,造成水稻镉毒害.但是单一AgNPs处理下根毛数量为0.2和0.5,高浓度Cd2+(5mg/L)处理中加入AgNPs后,根毛数量较单一AgNPs处理多,可能的原因是高浓度的Cd2+能一定程度上缓解AgNPs对根毛的抑制作用,马旭凤等[33]研究结果表明干旱抑制了植株生长,随着水分亏缺程度的加重,侧根根毛长度、根毛密度、根毛总长度在中度水分亏缺条件下达到最大,表明Cd2+一定程度上可以促进根毛生长吸收水分;仇硕等[37]发现10mg/L Cd2+促进黄菖蒲幼苗根毛生长,表明植物可以通过根毛数量的增加来吸收更多的营养物质缓解毒性.
研究表明,Cd2+严重影响植物的光合系统,显著降低叶绿素含量、净光合速率、气孔导度、胞间二氧化碳和蒸腾速率等[38-41].而本研究中,Cd2+对拟南芥光合色素含量的影响没有达到显著水平,但在低Cd2+浓度(0.1mg/L和1mg/L)下,随着AgNPs浓度的增加,色素含量显著降低,表明AgNPs和Cd2+具有协同作用显著增强Cd2+对光合系统的影响,徐勤松等[42]也发现Zn2+可以加剧Cd2+对叶绿素的破坏作用.叶绿素含量的多少直接决定了光合能力的强弱[43],类胡萝卜素具有清除养护胁迫的能力并且可以参与能量耗散[44-45],色素含量的降低表明植物光合系统受到严重损伤[6].但在高Cd2+浓度(5mg/L)下加入AgNPs,与单一Cd2+或AgNPs处理相比,色素含量反而更高但未达差异显著,表明不同浓度Cd2+处理下, AgNPs对光合色素含量的影响也存在差异,色素含量升高的原因可能是高浓度的Cd2+与AgNPs进一步增强了对植物光合系统的损伤,植物自身通过光合色素含量的增加吸收更多的光能从而缓解外界胁迫对植物光合系统的伤害,何任红等[46]研究发现添加Cd2+和毒死蜱后白菜叶绿素a、叶绿素b、叶绿素(a + b)含量总体都呈上升趋势,可能的原因是在重金属和农药的胁迫下,白菜叶绿素增加是作为抵御环境胁迫的一种有效保护机制[47],植物靠自身叶绿素的增加来保持机体的正常代谢.
本研究中,高浓度(5mg/L)的Cd2+可以显著增强SOD、POD活性,先前的研究表明,Cd2+可以明显诱导铜绿微囊藻和斜生栅藻氧自由基含量及SOD、POD活性升高[48],这与我们的实验结果是一致的.SOD和POD是关键的抗氧化物酶,用于清除氧自由基缓解氧化胁迫.在含有Cd2+处理下中,1mg/L AgNPs可以进一步增强SOD和POD活性,可能的原因是当植物受到外界胁迫后会引起ROS的积累,并主要通过SOD和POD清除ROS,且植物开始启动抗逆机制分泌更多的抗氧化相关酶来清除氧自由基,所以SOD及POD活性显著升高,朱雪梅等[49]研究发现Cd2+浓度一定时,Zn2+可以增强水稻分蘖期根系SOD和POD活性.而10mg/L AgNPs的加入后没有引起SOD和POD活性的升高,这和宇克莉等[50]用Cd2+处理玉米叶片两周后发现随Cd2+浓度升高,SOD、POD和CAT活性也出现先升高后降低的现象是一致的.实验室早期的研究结果也表明,高浓度的AgNPs也会造成SOD,POD及CAT活性的降低[25],可能的原因是高浓度的AgNPs和Cd2+具有协同作用,造成的氧化损伤超出了植物可以承受的范围,从而表现出SOD和POD活性的降低.
葛伟等[51]对速生杨107和速生杨118进行不同浓度Cd2+处理发现根和叶片中可溶性蛋白含量随着Cd2+浓度的增加而增加,这与我们现在的研究结果是一致的.本实验中,5mg/L Cd2+处理后,可溶性蛋白含量显著增加,表明植物遭受外界胁迫时可以分泌相应的蛋白质和重金属之间发生相互作用来缓解植物毒害.先前的研究表明,类似金属硫蛋白(MT-like)[52],植物螯合素(PC)[53-55]和金属硫蛋白(MT)[56-57]等镉的天然配体,可以对镉进行螯合从而缓解镉对植物的毒害作用.在Cd2+处理中加入AgNPs后,可溶性蛋白的含量进一步升高,表明AgNPs与Cd2+具有协同作用增强植物毒害,从而需要分泌更多的蛋白质来缓解毒性.纳米颗粒一旦进入生物体液环境,它巨大的比表面比特性会使它吸附大量的蛋白质[58].大量蛋白吸附在纳米颗粒表面形成蛋白晕(Corona)[59-61],在溶液中球形纳米银与牛血清蛋白(BSA)可以自发结合发生反应并形成复合物[62],引起BSA的荧光猝灭[63],Matsumura等[64]发现,用纳米银处理过的细菌可与巯基结合影响含巯基酶的活性,如呼吸酶,进而抑制呼吸酶活性,表明AgNPs可能影响蛋白的活性从而影响对植物产生毒性.
4 结论
4.1 Cd2+处理对根毛数量和光合色素含量没有显著影响,但高浓度(5mg/L)的Cd2+可以显著抑制根长,提高SOD和POD活性,增加可溶性蛋白含量.
4.2 低Cd2+浓度(0.1和1mg/L)下加入AgNPs,可进一步促进主根伸长,提高可溶性蛋白含量,但显著增强了Cd2+对根毛生长,色素含量的抑制作用.高Cd2+(5mg/L)浓度下加入AgNPs显著增强Cd2+对根长的抑制作用,提高光合色素和可溶性蛋白含量且高浓度Cd2+能一定程度上缓解AgNPs对根毛的抑制作用.在所有含Cd2+处理中,1mg/L AgNPs显著增强了SOD和POD活性.表明Cd2+与AgNPs作为两种不同的重金属对拟南芥根系形态和叶片生理指标存在交互影响.
[1] Chernousova S, Epple M. Silver as antibacterial agent: Ion, nanoparticle, and meta [J]. Angewandte Chemie International Edition, 2013,52(6):1636-1653.
[2] Stampoulis D, Sinha S K, White J C. Assay-dependent phytotoxicity of nanoparticles to plants [J]. Environmental Science & Technology, 2009,43(24):9473-9479.
[3] 王震宇,赵 建,李 娜,等.人工纳米颗粒对水生生物的毒性效应及其机制研究进展[J]. 环境科学, 2010,31(6):1409-1418.
[4] 苑志华,汤晓琳,白炎青,等.纳米银对小球藻光合作用和呼吸作用的影响 [J]. 中国环境科学, 2013,33(8):1468-1473.
[5] Jiang H S, Li M, Chang F Y, et al. Physiological analysis of silver nanoparticles and AgNO3toxicity to Spirodela polyrhiza [J]. Environmental Toxicology and Chemistry, 2012,31(8):1880- 1886.
[6] Jiang H S, Yin L Y, Ren N N, et al. Silver nanoparticles induced reactive oxygen species via photosynthetic energy transport imbalance in an aquatic plant [J]. Nanotoxicology, 2017, 11(2):157-167.
[7] Zhou H, Zeng M, Zhou X, et al. Heavy metal translocation and accumulation in iron plaques and plant tissues for 32 hybrid rice (L.) cultivars [J]. Plant & Soil, 2015,386(1/2):317- 329.
[8] 詹 杰,魏树和,牛荣成.我国稻田土壤镉污染现状及安全生产新措施[J]. 农业环境科学学报, 2012,31(7):1257-1263.
[9] 赵艳玲,张长波,刘仲齐.植物根系细胞抑制镉转运过程的研究进展[J]. 农业资源与环境学报, 2016,33(3):209-213.
[10] 秦天才,吴玉树,王焕校,等.镉、铅及其相互作用对小白菜根系生理生态效应的研究[J]. 生态学报, 1998,18(3):320-325.
[11] 徐正浩,沈国军,诸常青,等.植物镉忍耐的分子机理[J]. 应用生态学报, 2006,17(6):1112-1116.
[12] Tuomainen M H, Nunan N, Lehesranta S J, et al. Multivariate analysis of protein profiles of metal hyperaccumulator Thlaspi caerulescens accessions [J]. Proteomics, 2006,6(12):3696-3706.
[13] Jin X, Yang X, Islam E, et al. Effects of cadmium on ultrastructure and antioxidative defense system in hyperaccumulator and non-hyperaccumulator ecotypes of Sedum alfredii, Hance [J]. Journal of Hazardous Materials, 2008, 156(1–3):387-397.
[14] Sun Y, Zhou Q, Diao C. Effects of cadmium and arsenic on growth and metal accumulation of Cd-hyperaccumulator Solanum nigrum,L [J]. Bioresource Technology, 2008,99(5): 1103-1110.
[15] Garg N, Kaur H. Influence of zinc on cadmium-induced toxicity in nodules of pigeonpea (.) inoculated with arbuscular mycorrhizal (AM) fungi [J]. Acta Physiologiae Plantarum, 2012,34(4):1363-1380.
[16] 李伟强,毛任钊,刘小京.胁迫时间与非毒性离子对重金属抑制拟南芥种子发芽及幼苗生长的影响[J]. 应用生态学报, 2005,16(10):1943-1947.
[17] 马锋锋,赵保卫,刁静茹.小麦秸秆生物炭对水中Cd2+的吸附特性研究 [J]. 中国环境科学, 2017,37(2):551-559.
[18] 傅海霞,刘 怡,董志英,等.抗生素与重金属复合污染的生态毒理效应研究进展[J]. 环境工程, 2016,34(4):60-63.
[19] Sun H, Zhang X, Niu Q, et al. Enhanced Accumulation of Arsenate in Carp in the Presence of Titanium Dioxide Nanoparticles [J]. Water Air & Soil Pollution, 2007,178(1-4): 245-254.
[20] Baun A, Sorensen S N, Rasmussen R F, et al. Toxicity and bioaccumulation of xenobiotic organic compounds in the presence of aqueous suspensions of aggregates of nano-C60[J]. Aquatic Toxicology, 2008,86(3):379-387.
[21] Fan W, Cui M, Liu H, et al. Nano-TiO2enhances the toxicity of copper in natural water to Daphnia magna [J]. Environmental Pollution, 2011,159(3):729-734.
[22] Rosenfeldt R R, Seitz F, Zubrod J P, et al. Does the presence of titanium dioxide nanoparticles reduce copper toxicity? A factorial approach with the benthic amphipod Gammarus fossarum [J]. Aquatic Toxicology, 2015,165:154-159.
[23] 王汉卫,王玉军,陈杰华,等.改性纳米碳黑用于重金属污染土壤改良的研究[J]. 中国环境科学, 2009,29(4):431-436.
[24] Cheng Y, Yin L, Lin S, et al. Toxicity reduction of polymer- stabilized silver nanoparticles by sunlight [J]. Journal of Physical Chemistry C, 2011,115(11):4425-4432.
[25] 陈 斌,张传玲,江红生,等.纳米银诱导拟南芥活性氧自由基的积累和抗氧化系统的改变[J]. 基因组学与应用生物学, 2017(4):1646-1653.
[26] 冯 锋,张福锁,杨新泉.植物营养研究:进展与展望[M]. 北京:中国农业大学出版社, 2000:12-21.
[27] 弋良朋,马 健,李 彦.3种荒漠盐生植物根系及根毛形态特征的比较研究[J]. 植物研究, 2007,27(2):204-211.
[28] 高 林,陈春丽.NaCl胁迫对水稻品种中花11幼苗根系生长发育的影响[J]. 种子, 2012,31(7):7-12.
[29] 杨 敏,黎晓峰,玉永雄,等.铝对苜蓿生长、结瘤及根毛变形的影响[J]. 农业环境科学学报, 2007,26(1):202-206.
[30] Mukherji S, Maitra P. Toxic effects of lead on growth and metabolism of germinating rice (L.) seeds and on mitosis of onion (Allium cepa L.) root tip cells [J]. Indian Journal of Experimental Biology, 1976,14(4):519-521.
[31] 吕笃康,巴音山,赵玉.铜、镉污染对小麦种子萌发及幼苗生长的影响[J]. 种子, 2012,31(9):108-111.
[32] 何九军,王 瀚,杨小录.重金属Zn2+胁迫对萝卜种子萌发及幼苗生长和叶绿素合成的影响[J]. 安徽农业科学, 2011,39(33): 20348-20350.
[33] 马旭凤,于 涛,汪李宏,等.苗期水分亏缺对玉米根系发育及解剖结构的影响[J]. 应用生态学报, 2010,21(7):1731-1736.
[34] 杨忠兰,韦翔华,付旋旋,等.水、氮、镉互作对小白菜生长、镉吸收及土壤微生物量碳的影响[J]. 浙江农业科学, 2016,57(7): 1082-1084.
[35] 张杏辉,陈 懿.镉胁迫对白菜种子萌发的影响[J]. 南方园艺, 2009,20(6):7-9.
[36] 李 隼,黄胜东,赵福庚.重金属镉对水稻根毛细胞钾离子吸收过程的影响[J]. 植物生理学报, 2011,47(5):481-487.
[37] 仇 硕,黄苏珍.Cd胁迫下黄菖蒲幼苗根系生长与Cd积累的研究[J]. 植物资源与环境学报, 2008,17(3):33-38.
[38] Inoue H, Higuchi K, Takahashi M, et al. Three rice nicotianamine synthase genes, OsNAS1, OsNAS2, and OsNAS3are expressed in cells involved in long-distance transport of iron and differentially regulated by iron [J]. Plant Journal for Cell & Molecular Biology, 2003,36(3):366-381.
[39] 赵素贞,洪华龙,严重玲.钙对镉胁迫下秋茄叶片光合作用及超微结构的影响[J]. 厦门大学学报(自然版), 2014,53(6):875- 882.
[40] 秦建桥,夏北成,赵 鹏.五节芒不同种群对Cd污染胁迫的光合生理响应[J]. 生态学报, 2010,20(2):288-299.
[41] 俞 萍,高 凡,刘 杰,等.镉对植物生长的影响和植物耐镉机制研究进展[J]. 中国农学通报, 2017,33(11):89-95.
[42] 徐勤松,施国新,周红卫,等.Cd、Zn复合污染对水车前叶绿素含量和活性氧清除系统的影响[J]. 生态学杂志, 2003,22(1):5-8.
[43] 李裕红,黄小瑜.重金属污染对植物光合作用的影响[J]. 海峡科学, 2006,(6):23-24.
[44] Demmig A, Barbara, William W. The role of xanthophyll cycle carotenoids in the protection of photosynthesis [J]. Trends in Plant Science, 1996,1(1):21-26.
[45] Jiang H S, Qiu X N, Li G B, et al. Silver nanoparticles induced accumulation of reactive oxygen species and alteration of antioxidant systems in the aquatic plant Spirodela polyrhiza [J]. Environmental Toxicology & Chemistry, 2014,33(6):1398-1405.
[46] 何任红,马爱军,王艮梅.镉与毒死蜱复合污染对白菜生长及叶绿素、类胡萝卜素含量的影响[J]. 江苏农业科学, 2013,41(8): 330-332.
[47] 张露洁,兰利琼,卿人韦,等.几种重金属离子对组培盾叶薯蓣叶绿素含量的影响[J]. 四川大学学报(自然科学版), 2006,43(1): 200-205.
[48] 刘 璐,闫 浩,夏文彤,等.镉对铜绿微囊藻和斜生栅藻的毒性效应[J]. 中国环境科学, 2014,34(2):478-484.
[49] 朱雪梅,林立金,邵继荣,等.锌铬复合污染对水稻根系抗氧化酶活性的影响[J]. 农业工程学报, 2008,24(3):203-208.
[50] 宇克莉,邹 婧,邹金华.镉胁迫对玉米幼苗抗氧化酶系统及矿质元素吸收的影响[J]. 农业环境科学学报, 2010,29(6):1050- 1056.
[51] 葛 伟,焦韵秋.镉胁迫下2种杨树可溶性蛋白含量的变化研究[J]. 现代农业科技, 2012(1):199-200.
[52] 时 萌,王芙蓉,王棚涛.植物响应重金属镉胁迫的耐受性机理研究进展[J]. 生命科学, 2016,28(4):504-512.
[53] Harada E, Choi Y E, Tsuchisaka A, et al. Transgenic tobacco plants expressing a rice cysteine synthase gene are tolerant to toxic levels of cadmium [J]. Journal of Plant Physiology, 2001, 158(5):655-661.
[54] Zhu Y L, Pilon-Smits E A, Tarun A S, et al. Cadmium Tolerance and Accumulation in Indian Mustard Is Enhanced by Overexpressing gamma-glutamylcysteine synthetase [J]. Plant Physiology, 1999,121(4):1169-1178.
[55] Martínez M, Bernal P, Almela C, et al. An engineered plant that accumulates higher levels of heavy metals than Thlaspi caerulescens, with yields of 100times more biomass in mine soils [J]. Chemosphere, 2006,64(3):478-485.
[56] Misra S, Gedamu L. Heavy metal tolerant transgenic Brassica napus L. and Nicotiana tabacum L. plants [J]. Theoretical & Applied Genetics, 1989,78(2):161-168.
[57] 陈 虹,姜廷波,丁宝建,等.转柽柳金属硫蛋白基因(MT1)烟草的获得及对重金属镉的抗性分析[J]. 农业生物技术学报, 2007,15(2):247-250.
[58] Lynch I, Cedervall T, Lundqvist M, et al. The nanoparticle- protein complex as a biological entity; a complex fluids and surface science challenge for the 21st century [J]. Advances in Colloid & Interface Science, 2007,134(21):167-174.
[59] Cedervall T, Lynch I, Lindman S, et al. From the Cover: Understanding the nanoparticle-protein corona using methods to quantify exchange rates and affinities of proteins for nanoparticles [J]. Proceedings of the National Academy of Sciences of the United States of America, 2007,104(7):2050-2055.
[60] Sahoob B, Goswami M, Nag S, et al. Spontaneous formation of a protein corona prevents the loss of quantum dot fluorescence in physiological buffers [J]. Chemical Physics Letters, 2007, 445(4-6):217-220.
[61] Lynch I, Dawson K A. Protein-nanoparticle interactions [J]. Nano Today, 2008,3(1):40-47.
[62] 徐香玉,武卫华,杜中玉,等.球形纳米银的合成及其与牛血清白蛋白的相互作用[J]. 济宁医学院学报, 2017,40(1):5-8.
[63] 陈 述,白 珊,王 贞,等.牛血清白蛋白与纳米银的相互作用及半胱氨酸的检测[J]. 光谱实验室, 2011,28(4):2047-2049.
[64] Matsumura Y, Yoshikata K, Kunisaki S, et al. Mode of bactericidal action of silver zeolite and its comparison with that of silver nitrate [J]. Applied and Environmental Microbiology, 2003,69(7):4278-4281.
致谢:感谢中国科学院水生生物研究所方涛老师课题组梁磊承担了AgNPs的全部表征工作.
Effects of AgNPs and cadmium on root morphology and leaves physiological indexes of.
ZHANG Chuan-ling1, JIANG Hong-sheng2, LI Chang-jiang1, TANG Qi-hui1, WANG You1, YIN Li-yan1*
(1.Hainan Key Laboratory for Sustainable Utilization of Tropical Bioresources, Institute of Tropical Agriculture and Forestry, Hainan University, Haikou 570228, China;2.Wuhan Botanical Garden, Chinese Academy of Sciences, Wuhan 430074, China)., 2018,38(5):1951~1960
To investigate the combined toxictiy of AgNPs and Cd2+onseedlings, the root length, the number of root hairs, the content of photosynthetic pigment and protein, superoxide dismutade (SOD) and peroxidase (POD) activity were measured after one week exposure to different concentrations of PVP coated-AgNPs and Cd2+. Results showed that high concentration (5mg/L) of Cd2+could significantly inhibit root elongation and increase the protein content and SOD, POD activity. After adding AgNPs in high concentration (5mg/L) ofCd2+treatment, the inhibition effect of Cd2+onroot length was significantly increased while the inhibition effect of AgNPs onroot hairs was decreased. After adding AgNPs in low concentration (0.1and 1mg/L) ofCd2+treatment, the inhibition effect of Cd2+onphotosynthetic pigment content were significantly increased. In Cd2+treatment, SOD, POD activity reached the highest when the seedlings were exposured to 1mg/L AgNPs. Above results showed that Cd2+and AgNPs had interaction effects on root morphology and leaves physiological indexes of.
silver nanoparticle;cadmium;combined toxicity
X173
A
1000-6923(2018)05-1951-10
2017-09-28
国家自然科学基金资助项目(31460089,31170481);海南大学科研启动基金资助项目(kyqd(zr)1707)
张传玲(1992-),女,河南信阳人,海南大学热带农林学院硕士研究生,主要研究方向为纳米银(AgNPs)影响拟南芥生长的毒性机制.发表论文1篇.
* 责任作者, 研究员, lyyin@163.com
