水库与河流沉积物中好氧甲烷氧化菌群落差异性研究
2018-05-26陈永娟王晓燕许康利杨志伟
刘 洋,陈永娟,王晓燕,3*,许康利,杨志伟
水库与河流沉积物中好氧甲烷氧化菌群落差异性研究
刘 洋1,2,陈永娟1,王晓燕1,3*,许康利1,杨志伟4
(1.首都师范大学资源环境与旅游学院,北京 100048;2.中国水利水电科学研究院,北京 100038;3.首都师范大学首都圈水环境研究中心,北京 100048;4.首都师范大学生命科学学院,北京 100048)
甲烷在自然生态系统碳循环过程中起着重要作用,氮素形态的差异影响了甲烷氧化菌的氧化作用. 选取北京市密云水库和北运河两类不同污染类型的水体作为研究区域,采用克隆文库分子生物学的方法,探究氮素形态及其来源的差异对MOB细菌群落特征的影响. 结果表明:密云水库与北运河沉积物中氮素形态有显著差异,水库中氮素以NO3--N为主,河流中氮素以NH4+-N为主;氮素形态的差异影响了MOB细菌的系统发育,密云水库沉积物中MOB细菌的高同源性菌群主要来自湖泊生态系统,与NO3--N有较强的响应关系,北运河沉积物中MOB细菌高同源性菌群主要来自污水处理厂废水和活性淤泥,与NH4+-N有较强的响应关系,不同环境中氮素对MOB细菌的影响主要依赖于氮素的主要存在形态及其主要来源. 北运河等重污染河流中MOB细菌群落的联系更紧密更趋于模块化,对环境变化的敏感程度更高,微生物更脆弱,更容易受到水质变化以及人类活动的干扰. 北运河沉积物中NH4+-N对MOB细菌氧化速率的抑制性强于密云水库沉积物中NO3--N对甲烷氧化的抑制作用. 重污染的城市河流中高浓度的NH4+-N通过抑制甲烷氧化速率和促进产甲烷产生速率的双重作用影响了河流沉积物中甲烷的产生.
沉积物;好氧甲烷氧化菌;氮素形态;群落结构;系统发育;环境因子;共存关系网络
甲烷(CH4)的排放是自然生态系统中不可忽视的问题,其单位分子的增温潜力是CO2的25倍,平均存留时间为CO2的4倍,在自然生态系统碳循环过程中起着重要作用[1-5].甲烷氧化菌是甲烷重要的生物汇,能消耗转化生态系统中约76%~90%的甲烷,对保持大气甲烷浓度的平衡具有重要的意义[1-5].好氧甲烷氧化菌(MOB)在自然环境中分布广泛,能以甲烷作为碳源和能源,将90%由产甲烷菌产生的甲烷氧化[7].影响甲烷氧化菌的化学因素主要有氧气/水分状况/重金属以及含氮化合物等[8],有研究表明外源氮肥对MOB细菌的影响较复杂,不同的环境中氮素含量的差异能影响MOB细菌的氧化作用[9].
全球CH4排放量约500~600Tg/a,其中湿地是最大的排放源,占总排放量的23%,中国有水库约80000个,河流1500多条,其中水库流域面积超过1000km2,成为CH4排放的热点区域[10-11].密云水库是北京市重要的引用水源地,为保证水质安全,水库水体保持在中营养的状态,流域内甲烷的释放量每年呈现增加的趋势[12].水库中氮磷的污染仍不容忽视,其主要受到流域沿岸的农业面源污染的影响[13].汛期降水径流携带的污染物影响水质状况,氮素存在状态以NO3-为主.北运河是北京市主要的排污泄洪河道,主要流经北京市人类活动最频繁的北部和东部地区,受人类活动影响变化剧烈[14].作为北京市主要的排污河道,大量未经处理的工农业废水、城市生活污水和污水处理厂的退水排入河道,导致水体氨氮含量严重超标[15-17].北运河河道水流缓慢导致沉积物大量淤积,而污染物质的沉降/吸附使得沉积物成为内源污染源[18].密云水库和北运河从污染类型,污染物质来源以及氮素的主要污染类型均存在差异性.
目前氮素形态对MOB细菌群落特征影响的研究主要集中在不同施肥土壤氮素形态对MOB细菌群落特征的影响[19-20]及在实验室条件下模拟氮素的不同形态及不同的添加浓度对MOB细菌群落特征及甲烷氧化速率的影响[20-21].淡水生态系统中外源氮素对MOB细菌的影响主要借鉴农田土壤中氮素影响MOB细菌群落特征的相关研究.人类活动干扰程度/污染程度以及氮素形态差异较大的淡水生态系统中MOB细菌群落特征的差异性研究还存在明显不足.密云水库为北京市饮用水源地,人类活动干扰程度小,污染程度弱,营养物主要为NO3-;北运河为北京市城市河流,人类活动干扰程度强,水体污染严重,NH4+-N污染严重.本文选择密云水库和北运河两类污染程度及主要氮素形态截然不同的自然水体作为研究区域,通过对比沉积物中氮素形态的差异,分析氮素污染类型及氮素来源的差异对MOB细菌的群落多样性以及群落结构的影响,探究不同氮素污染类型水体对MOB细菌与环境因子相应关系的差异,进一步解释污染程度的差异对淡水生态系统中甲烷气体产生和消耗的影响,为不同污染类型水体MOB细菌的氧化过程的调控作用提供理论基础,也为控制重污染河流中甲烷等温室气体的排放提供科学依据.
1 材料与方法
1.1 样品采集
分别于2015年7月和2016年7月于密云水库和北运河采集样品,使用抓泥斗采集底泥样品(0~5cm)约1kg.依据研究区域样点均匀分布的原则,如图1所示,密云水库内布设8个采样点,北运河内共设置7个采样点(样点主要集中在人类活动干扰强度大的中下游).
采集到的样品在聚氯乙烯塑料瓶-4℃储存,24h内运回实验室.所有样品分为两部分:一部分用冷冻干燥机(Alpha 1-2LD plus; Martin Christ, Germany)烘干,研磨过200目筛后用于理化分析;另一部分样品放入-80℃超低温冰箱保存,用于后续分子生物学实验.
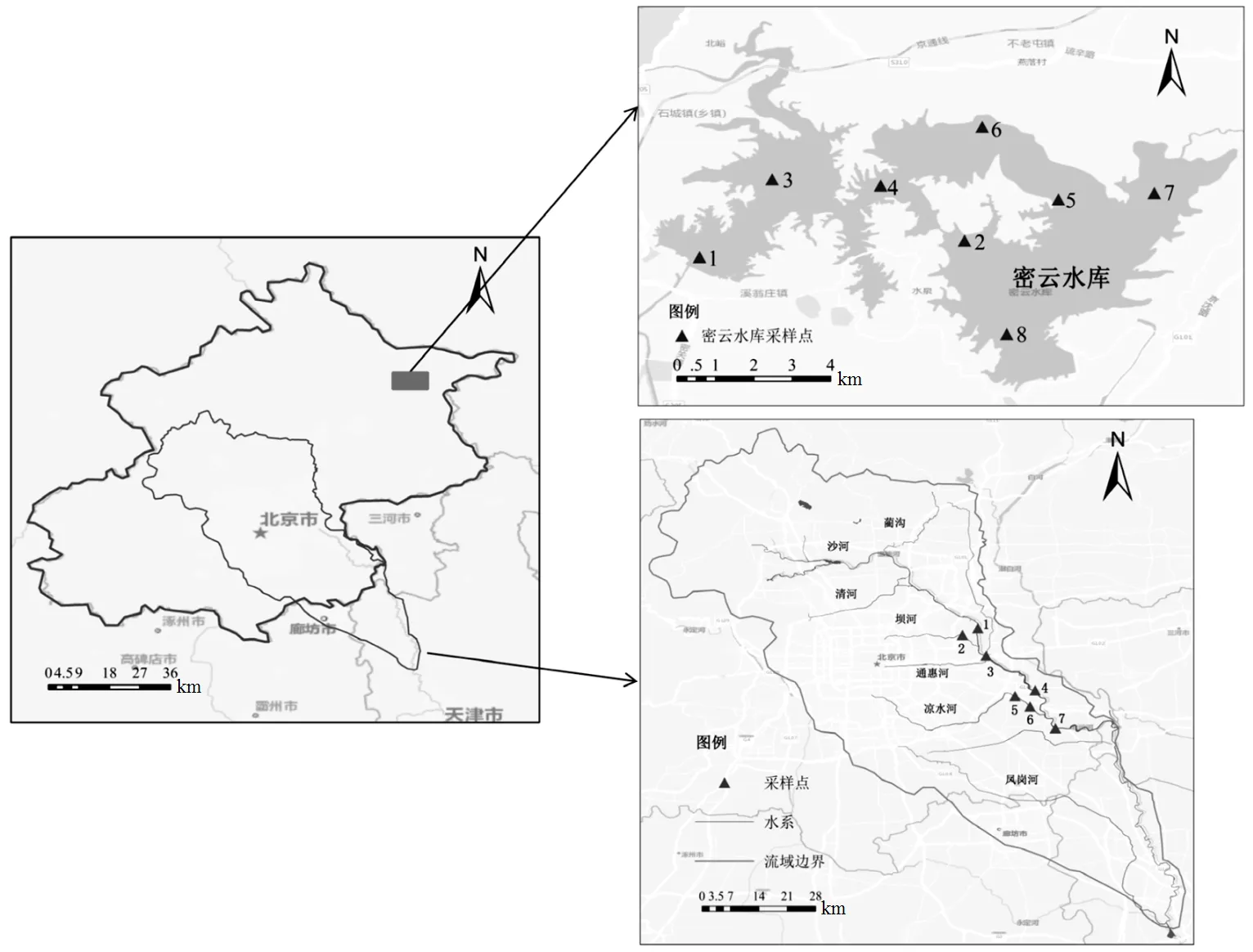
图1 密云水库和北运河采样点分布
1.2 样品理化分析
水质指标使用多参数水质仪(HYDROLABMS5) (HACH,美国)现场测定,包括温度(T)、pH值、溶解氧(DO)、盐度(Salinity)等.其他理化指标依照《土壤农化分析(第5版)》的方法[22]进行测定.沉积物中氨氮(NH4+-N),硝态氮(NO3--N),亚硝态氮(NO2--N)和总磷(TP),用2mol/L KCl溶液浸提,浸提悬浮液离心过滤,使用FIASTAR 5000连续流动进样分析仪(FOSS,丹麦)进行测定;TOC使用总有机碳分析仪进行测定(Liqui TOCⅡ,德国);TN按照凯式定氮法使用凯氏定氮仪(KDY-9830)进行测定.
1.3 DNA提取和amoA基因PCR扩增
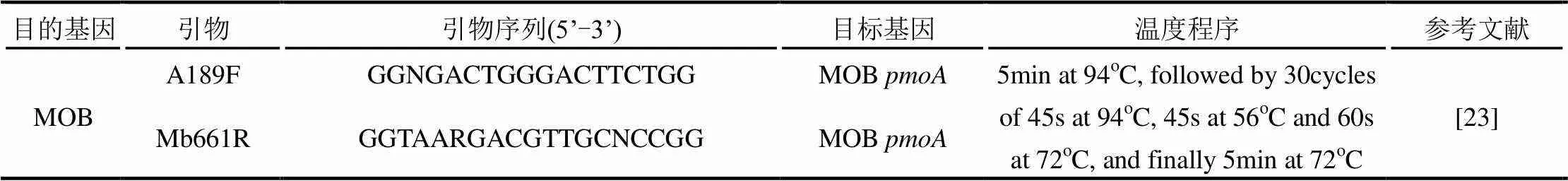
表1 N-DAMO和MOB细菌所需引物和温度程序
沉积物中的DNA使用Power Soil DNA kit(Mo Bio Laboratories,Carlsbad, California, USA)试剂盒,依据说明说提取.MOB细菌的基因扩增引物为A189F和Mb661R,PCR扩增的主要温度程序见表1.
1.4 统计学分析
使用MOTHUR软件以5%的差异度划分独立操作单元(operational taxonomic unit, OUT),计算香农多样性指数/辛普森指数和Chao1指数[23].使用MEGA 4软件[25]以邻位相连法(Neighbor- Joining)构建系统发育树.使用STAMP软件[26]基于T-TEST方法计算两样本之间的差异.使用R 3.3.2的psych package 1.7.5[27]计算样本间微生物之间的共生关系,并进一步使用Cytoscape 3.5.1[28]软件构建微生物的共生网络关系.使用R 3.3.2软件的Vegan package 2.4[29]冗余分析(RDA)计算生物群落分布与环境因子的相关性,通过mantel及partial mantel检验方法识别各环境因子的影响及贡献.采用SPSS(PASW statistics 18.0)软件对理化数据进行统计分析.
2 结果和讨论
2.1 底泥氮素形态差异
对比分析密云水库和北运河沉积物的理化参数(基于T-test方法)(图2).密云水库沉积物中氨氮(NH4+-N)和总磷(TP)均显著低于北运河沉积物中的相关指标(<0.05),密云水库沉积物中硝态氮(NO3--N)/亚硝态氮(NO2--N)和C/N均显著高于北运河沉积物中的相关指标(<0.05).北运河底泥中NH4+-N占总氮的78.70%,为氮素的主要形态,密云水库底泥中NO3--N占总氮的42.97%.
密云水库为北京市的引用水源地,人类活动干扰小,水库处于中营养状态并有向富营养发展的趋势[30].李冬青等[31]和秦丽欢等[32]分别对密云水库水质及营养盐变化进行了研究,均发现密云水库水体氮素以NO3--N为主.北运河作为北京市的泄洪排污河道,人类活动干扰大,氨氮污染严重[15,18].北运河水体中高浓度的氨氮一方面来源于未经处理的工农业废水/城市生活污水及污水处理厂退水的汇入,另一方面来自农业灌溉的输出[33].陈永娟等[34]对北运河污染物通量的研究证实了水体中高浓度的NH4+-N主要来自污水处理厂出水及农业灌溉的输入.本文沉积物理化指标结果表明,NH4+-N为北运河沉积物中氮素的主要存在形态.于洋等[35]和鲍林林等[18]对北运河的相关研究均表明NH4+-N是北运河沉积物中氮污染的主要形态.密云水库沉积物和北运河沉积物中氮素的主要形态存在显著差异,前者以NO3--N为主,后者以NH4+-N为主,两个研究区域沉积物中氮素的主要形态均与水体中氮素的主要形态一致.
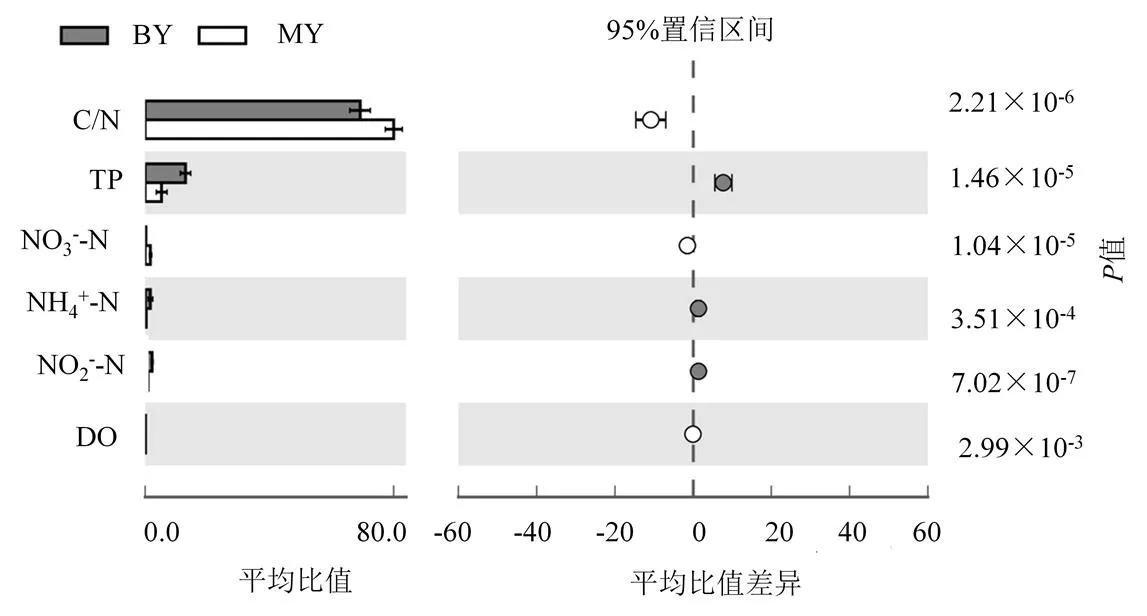
图2 密云水库沉积物和北运河沉积物理化指标差异(MY:密云水库;BY:北运河)
2.2 MOB细菌多样性指标差异
密云水库沉积物中MOB细菌共扩增出222条基因序列,覆盖范围均为0.66~0.96;北运河沉积物中MOB细菌共扩增出基因序列166条,覆盖范围均为0.58~0.83,密云水库和北运河沉积物中MOB细菌序列均具有代表性(表2).基于5%的基因差异,密云水库沉积物中MOB细菌划分出2~23个OTUs(平均值=7.75),香农指数(Shannon)指数范围为0.15~3.04,Simpson指数范围为0.02~0.93;北运河划分出5~19个OTUs(平均值=6.86),Shannon指数范围为1.36~2.78,Simpson指数范围为0.01~0.26.基于T-test方法,对比分析密云水库中MOB细菌的多样性指标和北运河中MOB细菌的多样性指标,结果发现没有显著性差异(>0.05).云南不同土地利用类型的淡水湖泊沉积物中MOB细菌划分OTUs的范围为16~23,Shannon指数范围为2.53~2.79[36].中国云南高原13个富营养淡水湖泊底泥中MOB细菌划分出11~30个OTUs,Shannon指数范围为2.24~3.12[36].密云水库中MOB细菌和北运河中MOB细菌的OTUs个数和Shannon指数均与淡水生态系统中MOB细菌相关指标一致.
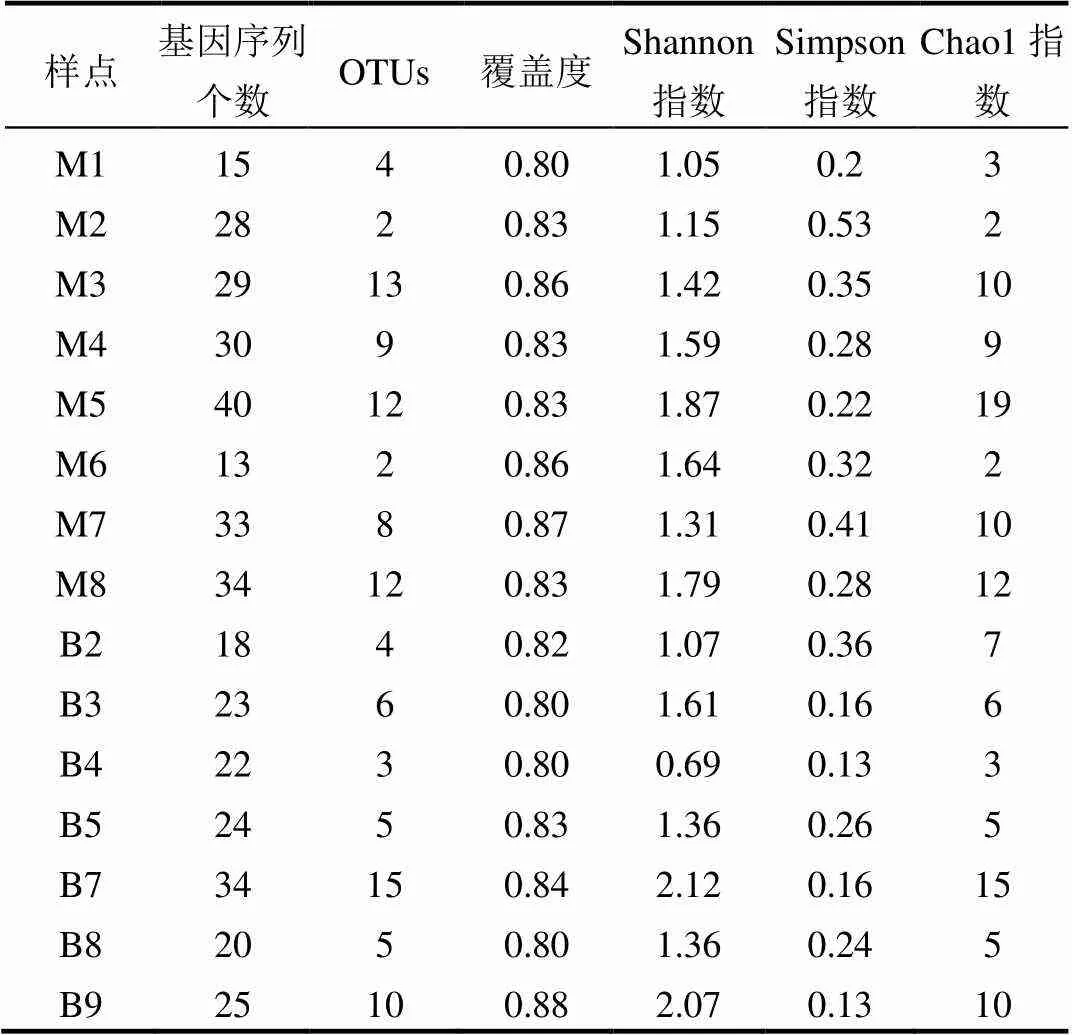
表2 密云水库和北运河底泥中MOB细菌多样性指标
注: M:密云水库;B:北运河.
2.3 MOB细菌系统发育树差异
选取MOB细菌具有代表性的基因序列进行系统发育树分析.密云水库中MOB细菌共分为4个分支[图3(a)].ClustersⅠ(42.34%)和ClustersⅢ(13.06%)分别为第一大和第三大分支,两者均与淡水湖泊[36]中的MOB细菌有较高的同源性,ClustersⅢ分支中MOB细菌与纯培养sp(Ⅰ型MOB)的同源性较高. ClustersⅡ和ClustersⅣ分别为第二大和最小的分支,前者与土壤纯培养的(Ⅰ型MOB)和(Ⅰ型MOB)同源性高,后者与纯培养的(Ⅰ型MOB)同源性高.
北运河中MOB细菌共分为3个分支[图3(b)].ClustersⅠ为最大的分支(42.17%),高同源性菌群主要来自废水淤泥[38]和活性淤泥[39]. ClustersⅡ(39.76%)和ClustersⅢ (13.06%)分别为第二大和第三大分支,前者与湖泊[40]中MOB细菌的同源性高,后者主要与稻田土壤[41]和纯培养、和(Ⅱ型MOB)的同源性高.基于Bray-Curtis距离算法对细菌群落进行Heatmap分析(图4),MOB细菌共聚为3类,第一聚类以密云水库为主(M5、M3、M4、M8、M7、B9和B7),第二聚类以北运河为主(B5、B8、B3、M1和B2).
系统发育树分析结果显示,TypeⅠ型的MOB细菌在密云水库和北运河中占主导,前者高同源性菌群主要来自湖泊生态系统,后者主要来自活性淤泥和废水淤泥.云南13个淡水湖泊[23]和美国阿拉斯加北部的Qalluuraq湖泊[42]中均发现TypeⅠ型MOB细菌占主导地位.华盛顿湖[43]、康士坦茨湖[44]、Stechlin湖[45]及我国淡水沼泽湿地[23]的相关研究均证明了TypeⅠ型MOB细菌是我国淡水湖泊沉积物中的优势菌种.人类活动的干扰导致北运河岸边水土流失严重,大量的农田土壤随雨水汇入河中[33].由于缺乏自然径流,北运河依靠污水处理厂的再生水补给,处理厂的再生水携带设施中的微生物一同汇入北运河[15].北运河系统发育树ClustersⅢ与农田土壤中细菌的同源性高.有研究表明TypeⅠ型和TypeⅡ型的MOB细菌均可在农田土壤中被检测,其中TypeⅡ型的MOB细菌占主导地位[36].北运河系统发育树ClustersⅠ中细菌与活性淤泥及废污水中MOB细菌有较高的同源性.鲍林林等[17-18]对北运河沉积物中的脱氮功能微生物及氨氧化微生物群落特征的研究发现,两种细菌均与废水和活性污泥中的类群同源性高[17-18].不同功能细菌的研究均证实了北运河沉积物中微生物群落受到了周边污水处理设施及未经处理的生活污水的影响,北运河水体环境的改变会对MOB细菌群落结构及细菌的来源产生影响.
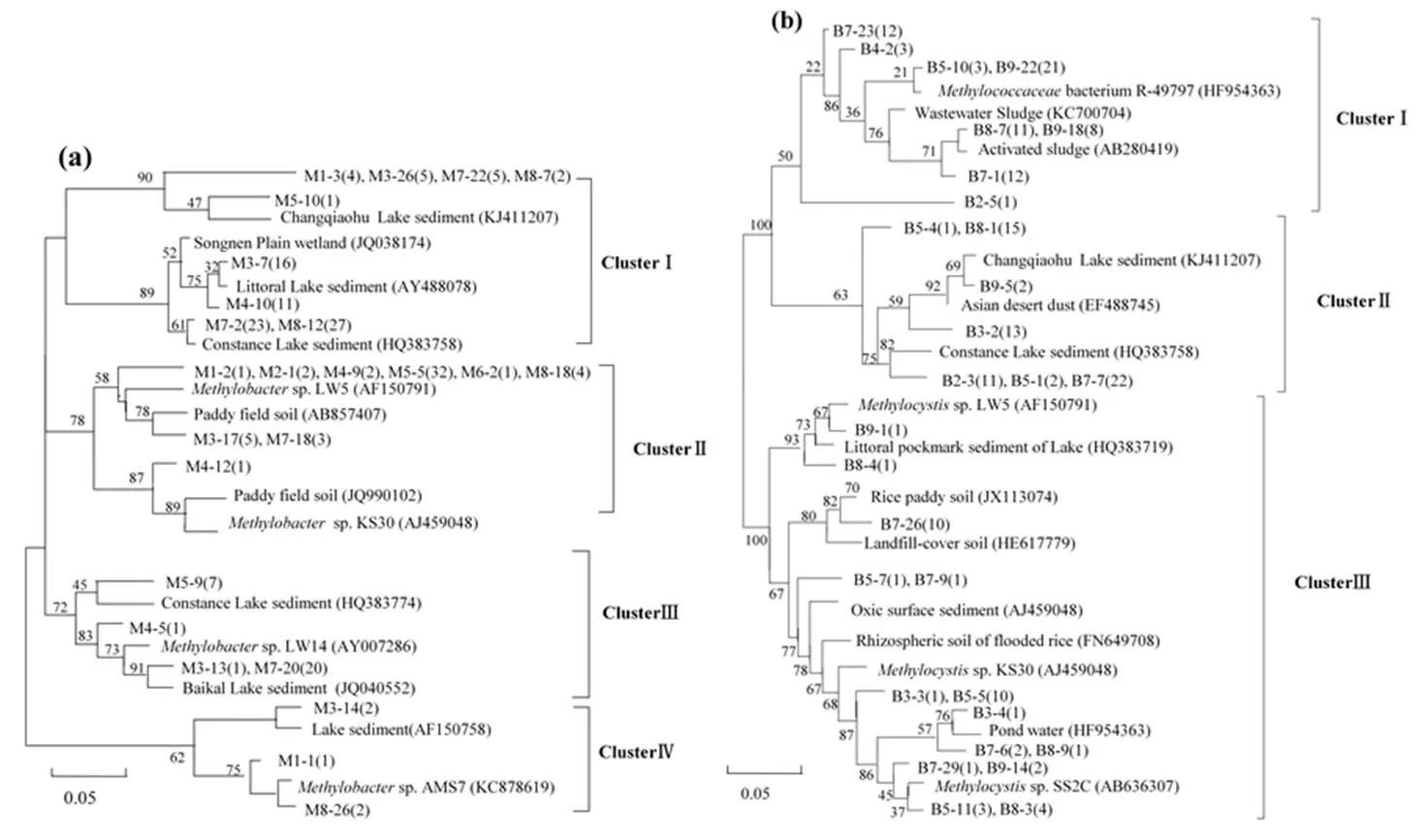
图3 密云水库(a)和北运河(b)pmoA基因序列的系统发育树
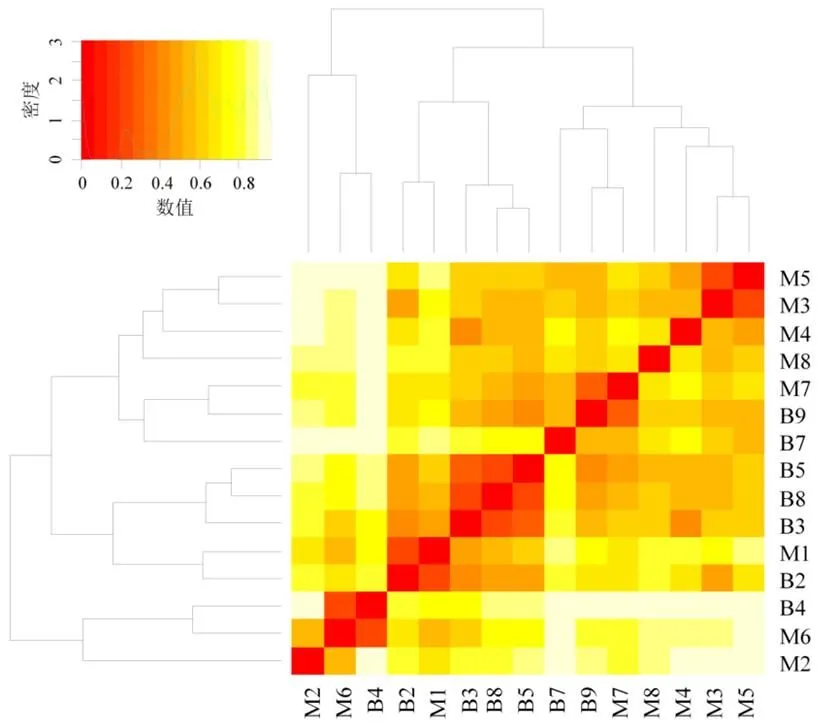
图4 MOB细菌Heatmap分析(基于Bray-Curtis距离)
2.4 共存关系网络Co-occurrence Network差异性
MOB细菌的共存关系网络(co-occurrence network)可以用来评估复杂生态系统中微生物之间以及微生物与环境因子之间的相互关系,能表征栖息地环境特征与微生物群落之间的聚集关系[46-48].通过MOB细菌的Network分析,北运河中MOB细菌的共生关系网络图中共有25个点,52条相关线[图5(b)],密云水库中MOB细菌的共生关系较复杂,共15个点,71条相关线[图5 (a)].MOB的OTUS与环境因子的相关性来看,北运河中的相关性更强.环境的异质性及理化特征的复杂程度来看,北运河环境的异质性更高、理化特征的复杂性更强.
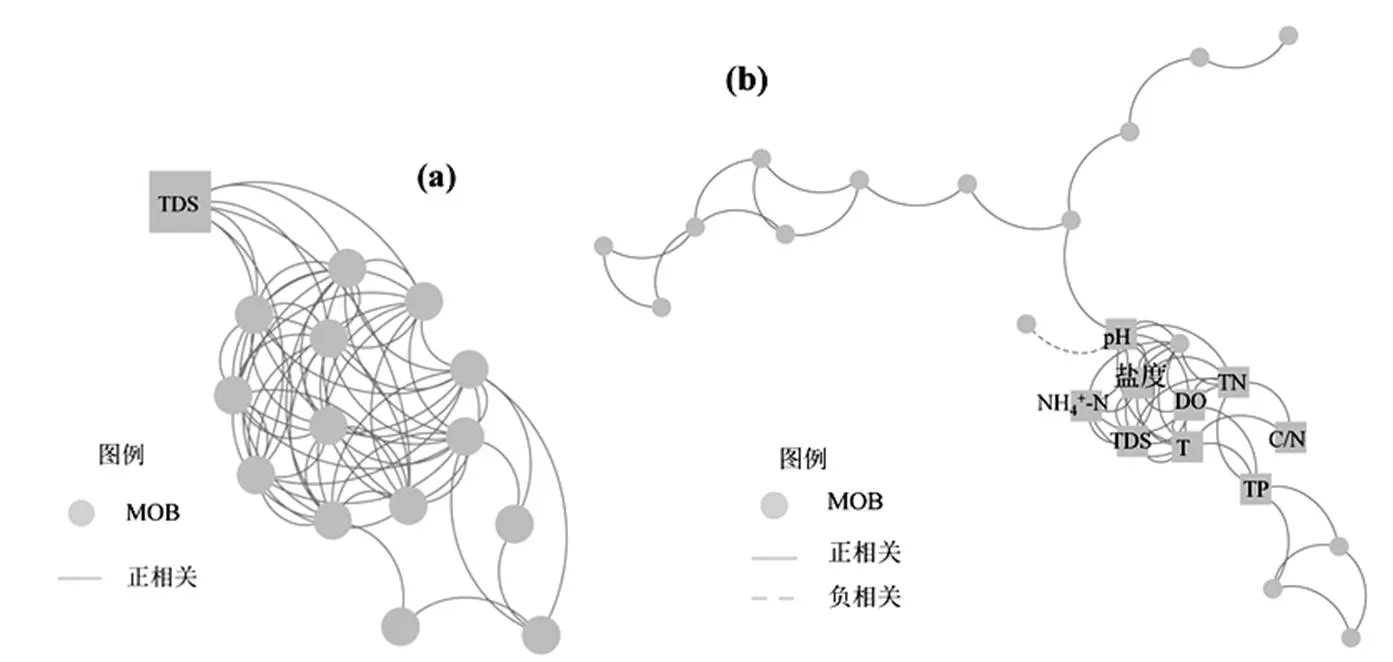
图5 密云水库(a)和北运河(b) MOB细菌Network分析
圆点代表MOB细菌的OTUs,线段代表相关性,只有<0.05的相关关系在图中显示
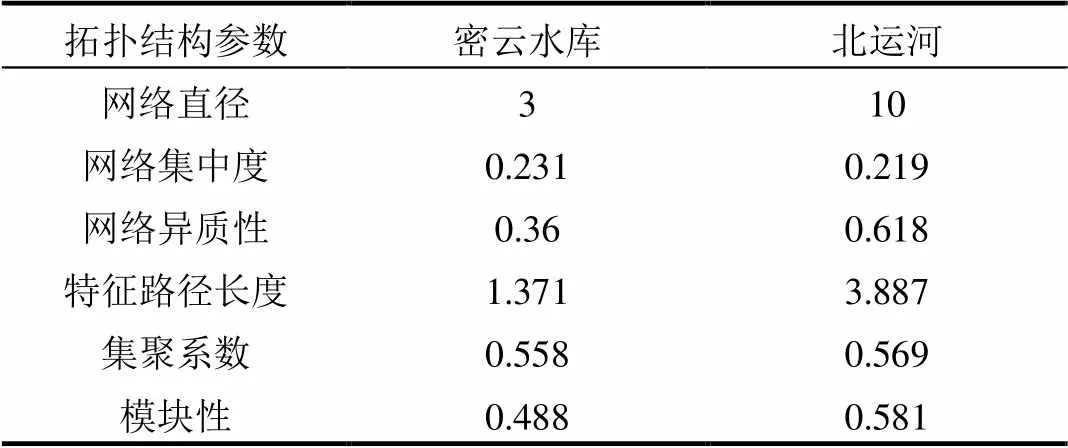
表3 密云水库和北运共存关系网络的拓扑参数
对比分析密云水库和北运河拓扑结构参数(表3),北运河的网络结构范围更大、结构的异质性更强及特征路径更长.密云水库MOB细菌和北运河MOB细菌的中心化程度、集聚系数均较高.网络结构拓扑图中点的分布和以及点与点之间的相互关系能影响系统的稳定性[49-50].模块化程度(Modularity) >0.4表明网络拓扑图已经形成模块化[51],用于表征微生物群落生态位的分化程度,模块化程度越高微生物生长的生态位分化程度越高.模块化程度可以表征微生物各个模块群落之间的联系紧密程度,模块化程度越高表征微生物群落模块内物种之间的联系越紧密,微生物群落越脆弱,受到环境变化的干扰程度越高[48,52].就模块化程度而言,重污染的北运河沉积物中MOB细菌的OTUS之间的模块化程度更高,细菌更脆弱,微生物对环境改变的敏感性更强,MOB细菌受到人类活动干扰的程度更高.
2.5 相关环境因子差异性
依据Pearson相关性分析(表4),密云水库MOB细菌和北运MOB细菌的多样性指标均与三态氮(NH4+-N、NO3--N、NO2--N)、TN和TOC有显著的相关关系(<0.05).密云水库系统发育树的ClustersⅠ和ClustersⅢ分支的MOB细菌均与NO3--N有显著相关关系.北运河系统发育树ClustersⅠ分支的MOB细菌与NH4+-N有显著相关关系.结合系统发育树的分析,北运河沉积物中高同源性的MOB细菌主要来自废水淤泥,高浓度的氨氮也主要来自未经处理的废污水及污水处理厂排水的汇入,北运河中高浓度的污染物(NH4+-N)是MOB细菌的主要环境因子,污染物的来源进一步影响了细菌的系统发育和群落结构.
依据CCA分析,轴1和轴2的解释变量分别为33.86%和21.86%,前两个排序轴的总解释变量为55.72% (图6).依据Monte Carlo检验, NO3--N (0.94)与RDA1的相关性强,NH4+-N (-0.87)、NO2--N (-0.79)和C/N (-0.81)与RDA2的相关性强.北运河样点主要分布在RDA2轴,与NH4+-N有强响应关系,而密云水库样点分布没有规律性.依据Mantel检验,分析各个环境因子对微生物群落分布的影响,N和NH4+-N使用Mantel Partial检验(TN和NH4+-N有较强相关性)(表5).NH4+-N对北运河沉积物中MOB细菌群落分布有显著影响(<0.05),而NO3--N和NO2--N对密云水库沉积物中MOB细菌的影响显著(< 0.05).Mantel检验的结果证明,环境中氮素的主要存在形态对MOB细菌群落分布的影响显著.
外源氮素通过刺激或抑制甲烷氧化菌的活性影响甲烷的氧化过程[53].一般而言,NH4+-N的输入会抑制甲烷的氧化,因为NH4+与CH4有相似的分子结构,NH4+通过与CH4竞争甲烷氧化酶系统相同的位点,减少甲烷氧化酶的有效性途径来抑制甲烷氧化菌的氧化作用[54].本研究中,北运河沉积物中NH4+-N对MOB细菌多样指标及群落分布均有显著影响.有研究表明,不同的氨氮浓度会对MOB细菌产生不同的抑制作用,低浓度的NH4+-N对氧化作用起到20%的抑制作用,随着NH4+-N浓度的增加,NH4+-N对微生物氧化速率的抑制作用增强[55-56].齐润杰等[56]通过向土壤中添加不同浓度的NH4+-N探究NH4+-N浓度的不同对甲烷氧化速率的影响,发现CH4氧化速率随NH4+-N浓度的增加而下降,NH4+-N对CH4氧化的抑制率与其浓度呈极显著正相关.北运河沉积物中高浓度NH4+-N抑制了MOB细菌的氧化速率,由于北运河中NH4+-N浓度显著高于密云水库中NH4+-N浓度,NH4+-N对北运河甲烷氧化的抑制率显著高于密云水库中NH4+-N对甲烷氧化的抑制率.NH4+-N除对甲烷氧化作用有抑制性之外,还会显著促进CH4的产生,土壤中NH4Cl的输入使甲烷的产生率提高了136.7%[21].高浓度的NH4+-N通过抑制甲烷的氧化速率和促进甲烷的产生速率的双重作用影响了甲烷的产生.因此,氨氮污染严重河流中甲烷气体释放是值得关注的问题.
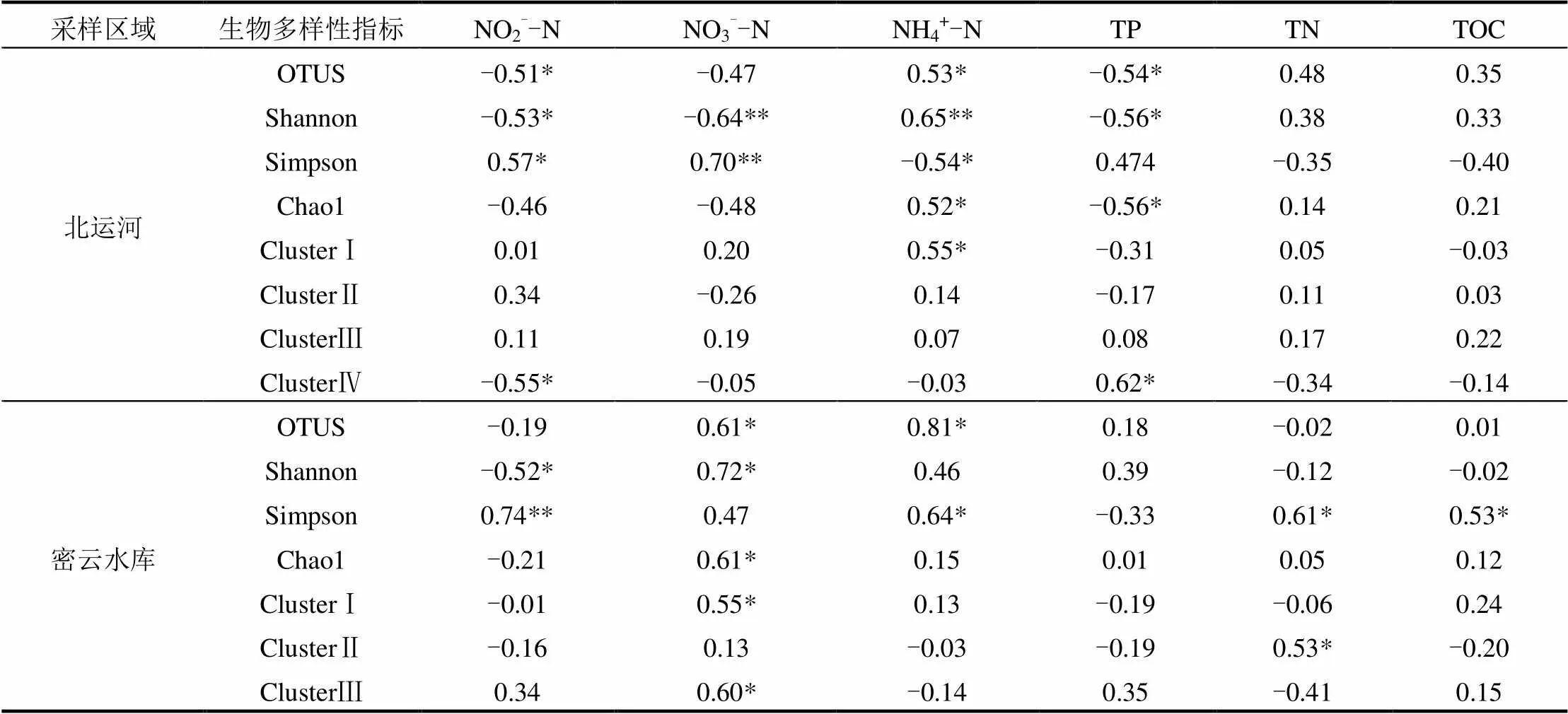
表4 MOB细菌多样性指标与环境因子Pearson相关性
注:*表示在0.05 水平上显著相关. **表示在0.01水平上显著相关;其他无显著相关.
除NH4+-N对甲烷氧化作用有抑制性外,NO3--N对甲烷的氧化也有直接的抑制作用[53,57]氮的不同存在形态对甲烷氧化产生不同的影响,且NH4+-N对甲烷氧化的抑制作用显著强于NO3--N的抑制性作用[58].齐润杰等[19]通过探究外源氮对5种不同类型的土壤甲烷氧化能力的影响,发现100(mg/kg)N添加的NO3--N仅对一种土壤有显著的抑制效果,而相同浓度添加的NH4+能显著降低5中土壤的氧化速率,抑制率为17.64~35.86%.本研究中,NO3--N是密云水库沉积物中氮素的主要形态,Pearson相关性、RDA分析及Mantel检验均显示NO3--N与水库沉积物中MOB细菌有显著相关关系.由于NO3--N对MOB细菌的抑制作用显著低于NH4+-N[59],密云水库中NO3--N对甲烷氧化速率的抑制作用低于北运河中NH4+-N对甲烷氧化的抑制作用.有研究表明,外源NH4NO3的输入显著的促进了土壤甲烷的产生速率,导致产生速率提高136.55%[21]. NO3-和NH4+的同时输入在抑制甲烷氧化作用的同时,会显著促进甲烷的产生,因此在密云水库等淡水生态系统中,不同氮素形态的输入对CH4气体释放的影响是不容忽视的.
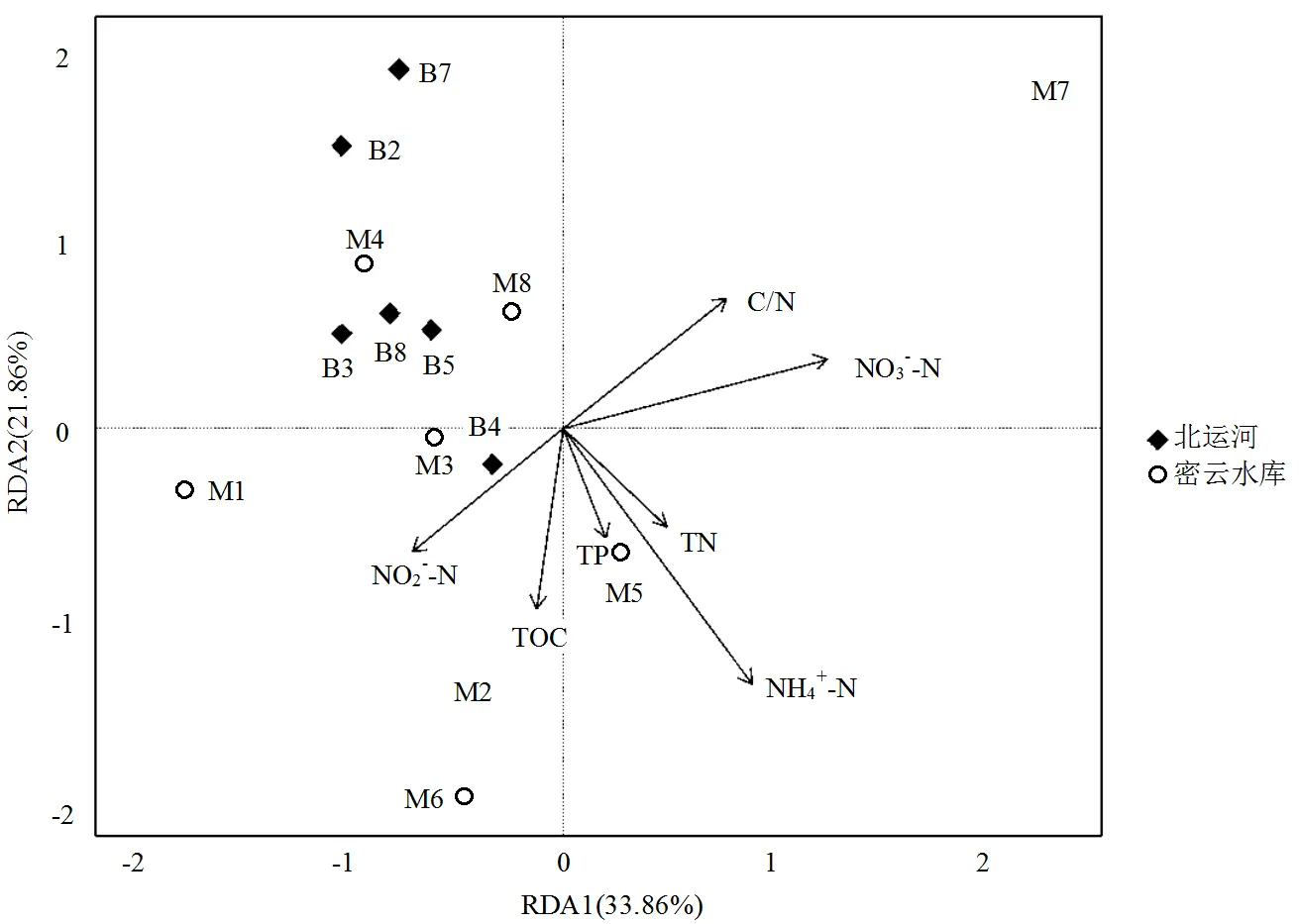
图6 密云水库和北运河MOB细菌与环境因子RDA分析
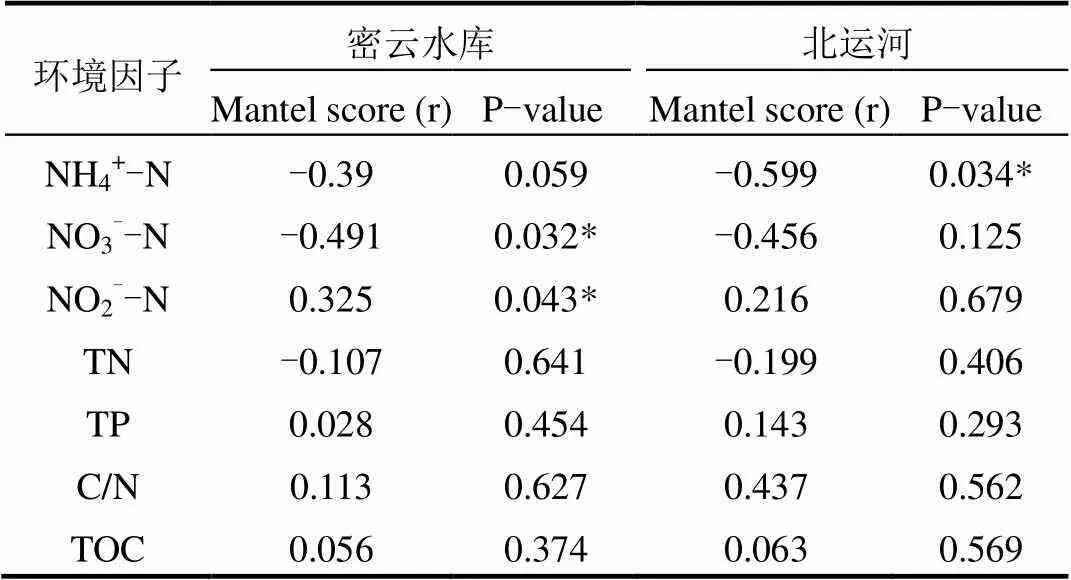
表5 MOB细菌群落组成与环境因子相关关系的Mantel检验
注:*表示在0.05水平上显著相关. **表示在0.01水平上显著相关;其他无显著相关.
3 结论
3.1 密云水库与北运河沉积物中氮素的主要形态存在显著差异,前者以NO3--N为主,后者以NH4+-N为主,均与两个研究区水体中氮素的存在形态一致.
3.2 氮素形态的差异对MOB细菌的系统发育树和群落结构有影响,两研究区域中高同源性菌群的来源与其各自的氮素来源一致,水体中主导的氮素形态是MOB细菌的主要影响因子.
3.3 MOB细菌群落的共生关系受到水体污染程度的影响,重污染河流中微生物群落相互联系更紧密,共生关系更趋于模块化,微生物更脆弱,对环境变化的敏感程度更高,更容易受到水质变化以及人类活动的干扰.
3.4 淡水环境中氮素的存在形态显著影响了MOB细菌的群落分布.北运河中高浓度的NH4+-N通过抑制甲烷氧化菌的氧化速率和促进产甲烷速率的双重作用影响河流甲烷的产生,密云水库中NO3--N对甲烷氧化速率的抑制性低于北运河中NH4+-N对甲烷氧化的抑制作用.
[1] Shen L, Liu S, Zhu Q, et al. Distribution and diversity of nitrite-dependent anaerobic methane-oxidising bacteria in the sediments of the Qiantang River [J]. Environmental Microbiology, 2014,67(2):341-349.
[2] Hu B, Shen L, Lian X, et al. Evidence for nitrite-dependent anaerobic methane oxidation as a previously overlooked microbial methane sink in wetlands [J]. Proceedings of the National Academy of Sciences, 2014,111(12):4495-4500.
[3] 吴 彬.辽河三角洲影响甲烷产生与氧化的微生物群落研究[D]. 长春:长春理工大学, 2013.
[4] 沈李东.湿地亚硝酸盐型厌氧氨氧化和厌氧甲烷氧化微生物生态学研究[D]. 杭州:浙江大学.
[5] Guillaume B, Didier J Z Q, Corinne B, et al. Production and consumption of methane in freshwater lake ecosystems [J]. Research in Microbiology, 2011,162(9):832-847.
[6] 蔡元锋,贾仲君.土壤大气甲烷氧化菌研究进展[J]. 微生物学报, 2014,54(8):841-853.
[7] Le M J, Roger P. Production, oxidation, emission and consumption of methane by soils: a review [J]. European Journal of Soil Biology, 2001,37(1):25-50.
[8] Bodelier P L E, Roslev P, Henckel T, et al. Stimulation by ammonium-based fertilizers of methane oxidation in soil around rice roots [J]. Nature, 2000,403(6768):421-424.
[9] 贠娟莉,王艳芬,张洪勋.好氧甲烷氧化菌生态学研究进展[J]. 生态学报, 2013,(21):6774-6785.
[10] Chen X. Gazette of the ministry of water resources of the People's Republic of China [J]. Beijing: Ministry of Water Resources of the People’s Republic of China, 2009.
[11] Wang Y, Huang P, Ye F, et al. Nitrite-dependent anaerobic methane oxidizing bacteria along the water level fluctuation zone of the Three Gorges Reservoir [J]. Applied Microbiology and Biotechnology, 2016,100(4):1977-1986.
[12] Yang M, Geng X, Grace J. Spatial and seasonal CH4flux in the littoral zone of Miyun Reservoir near Beijing: The Effects of Water Level and Its Fluctuation [J]. Plos One, 2014,9(4):e94275.
[13] 欧 洋,王晓燕,耿润哲.密云水库上游流域不同尺度景观特征对水质的影响[J]. 环境科学学报, 2012,32(5):1219-1226.
[14] 荆红卫,张志刚,婧 郭.北京北运河水系水质污染特征及污染来源分析[J]. 中国环境科学, 2013,33(2):319-327.
[15] 单 铎.北运河氨氮降解系数测算研究[D]. 北京:首都师范大学, 2013.
[16] 张汪寿,李晓秀,王晓燕.北运河武清段水污染时空变异特征[J]. 环境科学学报, 2012,32(4):836-846.
[17] 鲍林林,王晓燕,陈永娟,等.北运河沉积物中主要脱氮功能微生物的群落特征[J]. 中国环境科学, 2016,36(5):1520-1529.
[18] 鲍林林,陈永娟,王晓燕.北运河沉积物中氨氧化微生物的群落特征[J]. 中国环境科学, 2015,35(1):179-189.
[19] 齐润杰,陈金霞,但建国.外源氮对琼北不同类型土壤甲烷氧化能力的影响[J]. 热带作物学报, 2016,37(8):1534-1539.
[20] 牟晓杰,刘兴土,仝 川,等.氮输入和互花米草入侵下闽江河口潮滩土壤甲烷氧化速率研究[J]. 湿地科学, 2017,15(4):601- 607.
[21] 胡敏杰,邹芳芳,任 鹏,等.闽江河口湿地土壤CH4产生与氧化速率对外源氮、硫添加的响应[J]. 生态学报, 2017,37(1): 167-176.
[22] 鲍士旦.土壤农化分析[M]. 北京:中国农业出版社, 2010.
[23] Liu Y, Zhang J, Zhao L, et al. Aerobic and nitrite-dependent methane-oxidizing microorganisms in sediments of freshwater lakes on the Yunnan Plateau [J]. Applied Microbiology and Biotechnology, 2015,99(5):2371-2381.
[24] Schloss P D, Westcott S L, T R. Introducing mothur_ Open-Source, Platform-Independent, Community-Supported Software for describing and comparing microbial communities [J]. Applied and Environmental Microbiology, 2009,75(23):7537- 7541.
[25] Tamura K, Dudley J, Nei M, et al. MEGA4: Molecular evolutionary genetics analysis (MEGA) software version 4.0 [J]. Molecular Biology and Evolution, 2007,24(8):1596-1599.
[26] Parks D, Tyson G, Hugenholtz P, et al. STAMP: Statistical analysis of taxonomic and functional profiles [J]. Bioinformatics, 2014(30):3123-3124.
[27] Revelle W. psych: procedures for personality and psychological research, northwestern university, evanston, Illinois, USA [CP/OL]. https://CRAN.R-project.org/package=psych.
[28] Assenov Y, Ramirez F, Schelhorn S, et al. Computing topological parameters of biological networks [J]. Bioinformatics, 2008,(24): 282-284.
[29] Oksanen J, Blanchet F, Friendly M, et al. Vegan: Community Ecology Package. R package version 2.4-3 [CP/OL]. https: //CRAN.R-project.org/package=vegan.
[30] 刘 霞.密云水库水体富营养化研究[D]. 北京:首都师范大学, 2001.
[31] 李东青,梁 籍,张立燕,等.密云库区1991~2011年水质变化趋势研究[J]. 中国环境科学, 2015,35(6):1675-1685.
[32] 秦丽欢,曾庆慧,李叙勇,等.北京密云水库内湖消落带有机质、营养盐(氮/磷)含量分布特征[J]. 湖泊科学, 2016,28(4):794-801.
[33] 杜 伊,胡玮璇,王晓燕,等.北京市北运河水体中化学需氧量组分含量及其可生化性研究[J]. 湿地科学, 2017,(3):470-477.
[34] 陈永娟,庞树江,耿润哲,等.北运河水系主要污染物通量特征研究[J]. 环境科学学报, 2015,35(7):2167-2176.
[35] 于 洋,王晓燕,张鹏飞.北运河水体浮游细菌群落的空间分布特征及其与水质的关系[J]. 生态毒理学报, 2012,7(3):337- 344.
[36] Dai Y, Wu Z, Xie S, et al. Methanotrophic community abundance and composition in plateau soils with different plant species and plantation ways [J]. Applied Microbiology and Biotechnology, 2015,99(21):9237-9244.
[37] Jo Rg S D, Bernhard S. Anaerobic oxidation of methane in sediments of Lake Constance, an oligotrophic freshwater lake [J]. Applied and Ppplied and Environmental Microbiology, 2011, 77(13):4429-4436.
[38] Adrian H, Siegfried E V, Katharina F E, et al. Revisiting methanotrophic communities in sewage treatment plants [J]. Applied and Environmental Microbiology, 2013,79(8):2841- 2846.
[39] Dong J, Ding L, Wang X, et al. Vertical Profiles of community abundance and diversity of anaerobic methanotrophic archaea (ANME) and bacteria in a simple waste landfill in North China [J]. Applied Biochemstry Biotechnology, 2015(175):2729-2740.
[40] He R, Wooller M J, Pohlman J W, et al. Diversity of active aerobic methanotrophs along depth profiles of arctic and subarctic lake water column and sediments [J]. The ISME Journal, 2012, (6):1937-1948.
[41] Wang Y, Zhu G, Harhangi H R, et al. Co-occurrence and distribution of nitrite-dependent anaerobic ammonium and methane-oxidizing bacteria in a paddy soil [J]. FEMS Microbiology Letter, 2012,336:79-88.
[42] Costello A M, Auman A J, Macalady J L, et al. Estimation of methanotroph abundance in a freshwater lake sediment [J]. Environmental Microbiology, 2002,4(8):443-450.
[43] Rahalkar M, Schink B. Comparison of aerobic methanotrophic communities in littoral and profundal sediments of Lake Constance by a molecular approach [J]. Applied and Environmental Microbiology, 2007,73(13):4389-4394.
[44] Yun J L, Zhuang G Q, Ma A Z, et al. Community structure, abundance, and activity of methanotrophs in the Zoige Wetland of the Tibetan Plateau [J]. 2012,63(4):835-843.
[45] Perner P. Mining sparse and big data by case-based reasoning [J]. Procedia Computer Science, 2014,35(0):19-33.
[46] Fuhrman J. Microbial community structure and its functional implications [J]. Nature, 2009,(459):193-199.
[47] Barberan A S, Bates E, Casamayor N F. Using network analysis to explore co-occurrence patterns in soil microbial communities [J]. ISME Journal, 2012,(6):343-351.
[48] Saavedra S, Stouffer D B, Uzzi B, et al. Strong contributors to network persistence are the most vulnerable to extinction [J]. Nature, 2011,(478):233-235.
[49] Freedman Z, Zak D. Atmospheric N deposition alters connectance, but not functional potential among saprotrophic bacterial communities [J]. Molecular ecology, 2015,24(12):3178- 3180.
[50] Newman M E. Modularity and community structure in networks [J]. P Natl Acad Sci Usa, 2006,(103):8577-8582.
[51] Montoya J M, Pimm S L, Sole R V. Ecological networks and their fragility [J]. Nature, 2006,(442):259-264.
[52] Mosier A, Schimel D, Valentine D, et al. Methane and nitrous oxide fluxes in native, fertilized and cultivated grasslands [J]. 1991,350(6316):330-332.
[53] 胡敏杰,仝 川,邹芳芳.氮输入对土壤甲烷产生、氧化和传输过程的影响及其机制[J]. 草业学报, 2015,(6):1004-5759.
[54] Yang S S, Chen I C, Ching P L. Carbon dioxide and methane emissions from Tanswei River in Northern Taiwan [J]. Atmospheric Pollution Research, 2015,6(1):52-61.
[55] Van der Nat F W A, DE Brouwer J F C, Middelburg J J, et al. Spatial distribution and inhibition by ammonium of methane oxidation in intertidal freshwater marshes [J]. Applied and Environmental Microbiology, 1997,63(12):4734-4740.
[56] Fu L, Ding J, Lu Y, et al. Nitrogen source effects on the denitrifying anaerobic methane oxidation culture and anaerobic ammonium oxidation bacteria enrichment process [J]. Environmental Biotechnology, 2017.
[57] Xu X, Inubushi K. Responses of ethylene and methane consumption to temperature and pH in temperate volcanic forest soils [J]. European Journal of Soil Science, 2009,60(4):489-498.
[58] 王智平,胡春胜,杨居荣.无机氮对土壤甲烷氧化作用的影响[J]. 2003,14(2):305-309.
[59] Xu X, Inubushi K. Responses of ethylene and methane consumption to temperature and pH in temperate volcanic forest soils [J]. European Journal of Soil Science, 2009,60(4):489-498.
Microbial communities differences between aerobic methanotrophs in Miyun Reservoir and North Canal.
LIU Yang1,2, CHEN Yong-juan1, WANG Xiao-yan1,3*, XU Kang-li1,Yang zhi-wei4
(1.College of Resources, Environment and Tourism, Capital Normal University,Beijing 100048, China;2.China Institute of Water Resources and Hydropower Research, Beijing, 100038, China;3.Research Center of Aquatic Environment in the Capital Region, Capital Normal University, Beijing 100048, China;4.Capital Normal University School of Life Sciences, Capital Normal University,Beijing 100048, China)., 2018,38(5):1844~1854
The aerobic methanotrophs play an important role in mitigating methane emissions and promoting the carbon-nitrogen cycle in the freshwater ecosystems. In this study, the influences of different water pollutant on aerobic methanotrophs were analyzed between the Miyun Reservoir and the North Canal at the Beijing Metropolitan. The results showed that differences of physiochemical between Miyun Reservoir and the North Canal were significantly, especially the main form of nitrogen. The main form of nitrogen in Miyun Reservoir was NO3--N, while NH4+-N dominated in the North Canal. The physicochemical differences caused significantly influences on the MOB bacterial phylogenetic. Phylogenetic analyses revealed that the upstream freshwater highly contribute to the MOB sequences in Miyun Reservoir, and MOB has closely relationship with NO3--N. However, MOB sequences were mainly from activated sludge and wastewater in the North Canal, and MOB closely related with NH4+-N. The different form of nitrogen in these two ecosystems showed significant influences not only on the MOB serious, but also the sources of MOB. Furthermore, the MOB OTUs showed higher modular microbial network in the North Canal than the Miyun Reservoir. The tightly connected species of MOB communities indicated that bacterial community composition was more vulnerable and sensitive to the various disturbances in the North Canal. The different forms of nitrogen influenced the MOB oxidation and MOB inhibitant activity in different extent, the influence of NH4+-N on MOB was stronger than the influence of NO3--N on the Miyun Reservoir. The high concentration of NH4+-N in the city river that would not only inhibitant the MOB bacteria oxidation but also promote the CH4release.
sediment;aerobic methanotrophs;nitrogen;community structure;phylogeny;environmental factors;co-occurrence network
X172
A
1000-6923(2018)05-1844-11
2017-10-26
国家自然科学基金项目(41271495);国家重大水专项(2009ZX07209-001-02)
* 责任作者, 教授, wangxy@cnu.edu.cn
刘 洋(1988-),女,山东枣庄人,首都师范大学硕士研究生,主要从事环境微生物学研究.发表论文9篇.
