医疗器械不良事件报表质量评估抽样方案研究与探讨
2018-05-26杨飞钟蕾刘东红
杨飞,钟蕾,刘东红
北京市药品不良反应监测中心,北京 100035
引言
随着科学技术的发展,医疗器械品种、类型日益增多,被广泛应用于医疗机构、疗养机构、社区卫生机构和家庭等场所,具有分类多样、品种繁多、应用广泛等特点。医疗器械不良事件是指获准上市的质量合格的医疗器械在正常使用情况下发生的,导致或者可能导致人体伤害的各种有害事件[1]。医疗器械不良事件监测工作是我国对上市后器械安全监管的重要手段,报表数量及质量是不良事件监测工作开展的前提和关键,高质量的报表是器械不良事件分析评价的基础和核心。
全国收集到可疑医疗器械不良事件报表数呈现稳步增长趋势,2013年报表数为179份/百万人口;2014年报表数为198份/百万人口;2015年报表为240份/百万人口,2015年全国共收到报表32万份。北京市医疗器械不良事件报表也呈现逐年增加的趋势,2013年为2370份;2014年为3579份;2015年为5377份。
随着医疗器械不良事件报表数量稳步增长,报表质量存在报表不及时,上报单位未达到《医疗器械不良事件监测和再评价管理办法(试行)》(国食药监械〔2008〕766号)[1]上报时限要求,重复报表,报告内容不完整,报表来源、患者信息、不良事件情况、器械信息,评价处理等重要信息缺失等问题,给后续分析评价和风险防控工作带来不良影响。
国家药品不良反应监测中心于2016年6月6日颁布了《医疗器械不良事件报告表质量评估规定(试行)》(监测与评价械〔2016〕25号),开展医疗器械不良事件报表质量评估工作。通过医疗器械不良事件报表质量评估工作,发现可疑医疗器械不良事件发现、上报过程中存在的问题,实施改进措施,逐步提高报表填报质量,为医疗器械不良事件报表的分析和评价提供有效数据和基础,更加科学地进行医疗器械风险防控,促进医疗器械不良事件监测工作的规范开展。
1 依据、原则与方法
1.1 依据
本文主要参考标准有:① 《医疗器械不良事件监测和再评价管理办法(试行)》[1];② 《医疗器械不良事件监测工作指南(试行)》[2];③ GB/T 10111-2008 随机数的产生及其在产品质量抽样检验中的应用程序[3];④ GB/T 2828.1-2012计数抽样检验程序 第1部分:按接收质量限(AQL)检索的逐批检验抽样计划[4];⑤ GB/T 2828.2-2008计数抽样检验程序 第2部分:按接极限质量(LQ)检索的孤立批检验抽样方案[5];⑥ GB/T 2828.3-2008计数抽样检验程序 第3部分:跳批抽样程序[6];⑦ GB/T 2828.4-2008计数抽样检验程序 第4部分:声称质量水平的评定程序[7]。
1.2 抽样原则
1.2.1 代表性原则(严重程度)
随机抽样代表性是抽样结果是否真实可靠的关键,因此保证群体中每一个个体都有均等的被抽中机会。死亡、严重报表全部抽取,抽取比率为100%,严重程度为一般的报表按样本量适宜原则(抽样比例和总数)和调查对象变异小原则(地域平衡)抽取,保证群体中每个个体都有均等的被抽中的机会。
1.2.2 样本量适宜原则(抽样比例和总数)
北京市2016年第三季度共收到报表1571份,其中7月为450份,占比28.64%;8月份为530份,占比33.74%;9月份为591份,占比37.62%。抽取样本比例为10%,共抽取160份,按照每个月报表所占总报表比率抽取,7月份抽取46份,8月份抽取54份,9月份抽取60份 (表1)。
根据式(1),不重复分层抽样平均误差:
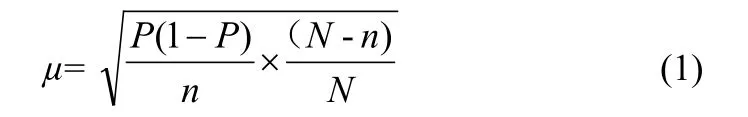
式(1)中,P为抽样成数;n为抽样数目;N为总体数。当P=10%,n=160,N=1571时,平均误差µ=0.0229,具有统计学意义。
1.2.3 调查对象变异小原则(上报地域、器械类别、器械分类平衡)
为保证调查对象变异小,调查数据准确,按上报月份比例抽取,且北京市有16个所属区,执行上报地域、器械类别和器械分类平均抽取原则,平均每个区抽取10份报表。
1.3 抽样方法
1.3.1 非概率抽样调查(典型调查、重点调查)
1.3.1.1 严重程度分类
《可疑医疗器械不良事件报表》按事件后果的严重程度划分为三级:死亡、严重、其他。死亡和严重报表提示事件可能存在高风险,具有评价意义,因此对于死亡和严重的报表采用非概率抽样调研,进行典型调查和重点调查,抽取比例为100%。北京市7月份死亡报表1份,严重13份;8月份死亡报表0,严重19份;9月份死亡报表0,严重10份,合计第三季度死亡1份,严重42份,合计43份(表2)。每个月一般报表数量=总抽样数量×当月报表所占比率-当月总抽样数量为160份,因此得到一般报表应一共抽取117份,其中7月32份,8月35份,9月50份。

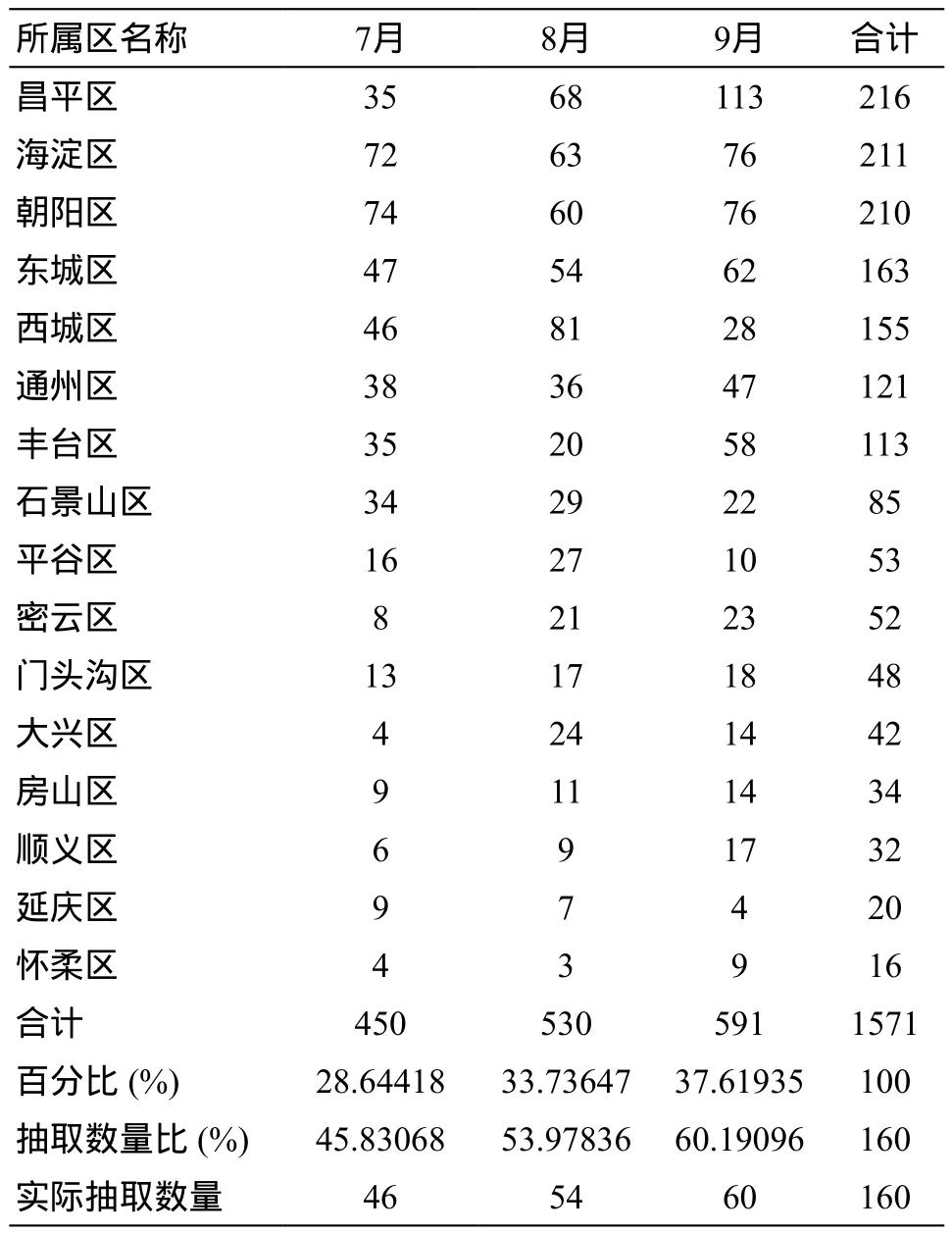
表1 北京市2016年第三季度报表数量及抽样数量(份)

表2 北京市2016年第三季度抽取报表严重程度
1.3.1.2 上报单位类型
北京市第三季度报表按上报单位类型划分(表3),分为医疗机构、生产企业、经营企业,上报数量为7月份医疗机构437份,生产企业12份,经营企业1份;8月份513份,生产企业13份,经营企业4份;9月份医疗机构579份,生产企业37份,经营企业0份,共计医疗机构上报1529份,生产企业上报37份,经营企业5份。生产企业和经营企业主动发现产品风险并上报可疑医疗器械不良事件报表更具有评价意义,且所占比例较低,故本次生产企业和医疗机构上报报表全部抽取,抽取率为100%,根据式(3)可得,抽取医疗机构报表数为118份。

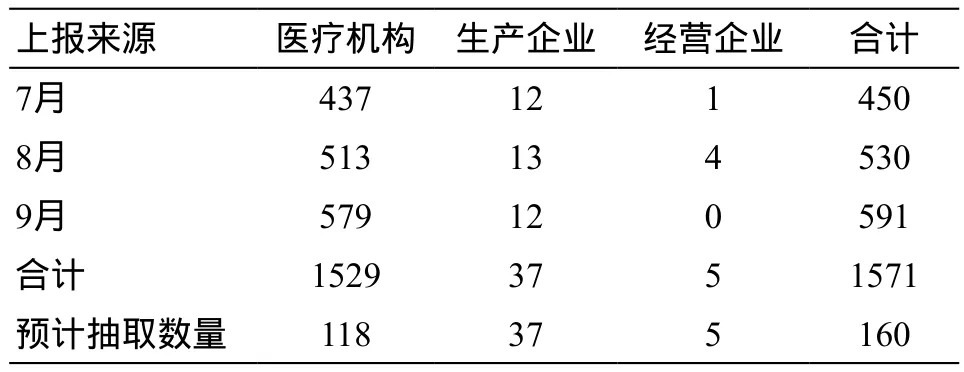
表3 北京市2016年第三季度抽取报表上报单位类型(份)
1.3.2 概率抽样调查(针对一般报表分层抽样)
针对除去非概率抽样调查(典型调查、重点调查)选中的按死亡、严重、生产企业、经营企业的所有报表,采用分层抽样的概率抽样调查方法[8-18]。北京市有16个所属区,执行地域平均抽取原则,平均每个区抽取10份报表,因首先执行典型调查和重点调查原则,因个别区被典型调查和重点调查数量较多,所以抽取其他区会相对较少。分层抽样示意图,见图1,样本总量N可以分成1…M层,每次按照系统抽样抽取相对应样本,总和为抽样样本n。
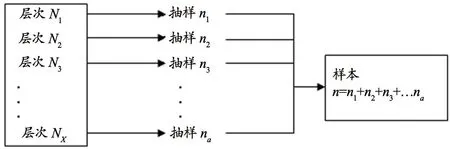
图1 分层抽样示意图
分层抽样,按主要特征分成按比例抽样,按上报区域、上报时间(月份)、严重程度分层,具体每个区域抽取结果如下表所示,一般报表按照生产企业和经营企业全部抽取,其他按照每个月份器械类别、器械分类系统抽样方法抽取。北京市2016年第三季度抽取报表分布,见图2。
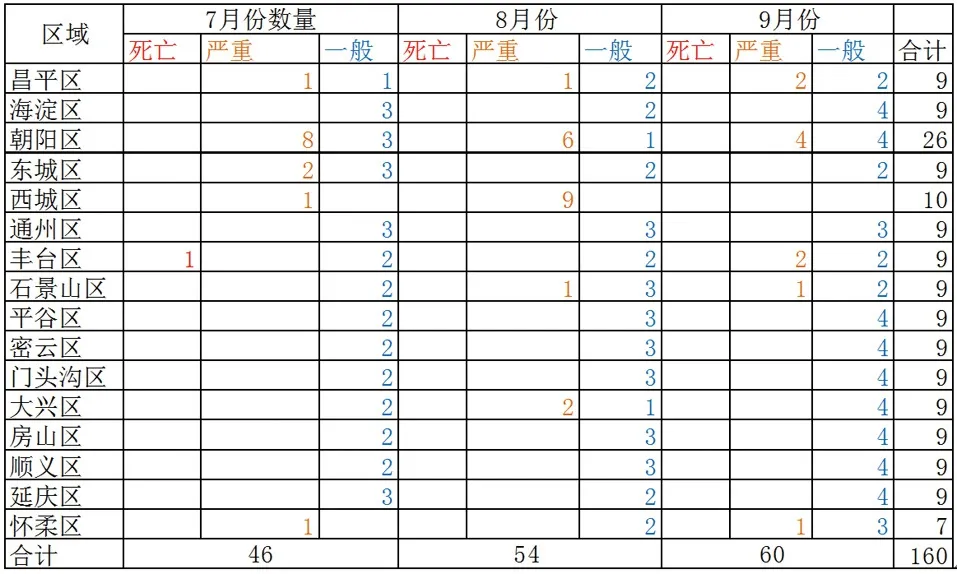
图2 北京市2016年第三季度抽取报表分布矩阵
1.4 评估方法
北京市共有16个辖区,2016年第三季度共抽取160份报表评估,每个区评估10份,评估原则为公平和随机。每个区除本辖区外(不评估本区,体现公平原则),在15个区中每个区随机抽取1份(公平和随机原则),直到抽取10份为止。
2 评估结果与分析
2.1 评估结果
北京市2016年第三季度根据《医疗器械不良事件报告表质量评估规定(试行)》(监测与评价械〔2016〕25号),开展160份医疗器械不良事件报表质量评估工作,分别统计辖区、上报月份、严重程度、器械类别、器械分类、上报单位、剔除项、否决项、报告时限、报告来源、患者信息、不良事件情况、器械信息和评价处理等信息,平均得分为80.6分,报表质量平均等级为良。
2.2 报表质量优良情况分析
北京市2016年第三季度,报表质量等级为良88份(55.00%),优的报表数量为37份(23.13%),合格报表23份(14.38%),不合格报表12份(7.50%)。报表质量总体呈现良好状态,但仍有不合格报表,应引起足够重视。
2.3 严重程度分析
2.3.1 按严重程度抽取评估比例
第三季度共有严重程度一般报表1528例,抽取117例评估,抽取比例为7.66%;严重报表42例,全部抽取,抽取比例为100%;死亡报表1例,全部抽取,抽取比例为100%。
2.3.2 评估报表严重程度比例
第三季度评估严重程度一般报表117例(73.13%)评估,严重报表42例(26.25%),死亡报表1例(0.63%)。
2.4 器械类别分析
国家对医疗器械按照风险程度实行分类管理。Ⅰ类是风险程度低,实行常规管理可以保证其安全、有效的医疗器械。Ⅱ是具有中度风险,需要严格控制管理以保证其安全、有效的医疗器械。Ⅲ是具有较高风险,需要采取特别措施严格控制管理以保证其安全、有效的医疗器械。
评价160例报表中,Ⅲ类器械79例(49.38%),Ⅱ类器械70例(43.75%),Ⅰ类器械11例(6.88%)。按照医疗器械类别Ⅲ类风险最高,风险依次递减原则,抽样数据也成递减趋势,抽样数据较合理,能基本反映北京市实际用械类别情况。
2.5 器械分类分析
《医疗器械分类目录》中从6801基础外科手术器械到6877介入器材共有43类器械(表4)。评价160例报表中,共涉及24类(70.59%)。其中6866医用高分子材料及制品26例(16.25%),6846植入材料和人工器官25例(15.63%),6854手术室、急救室、诊疗室设备及器具19例(11.88%),与这三类产品应用广泛,风险较高有关。
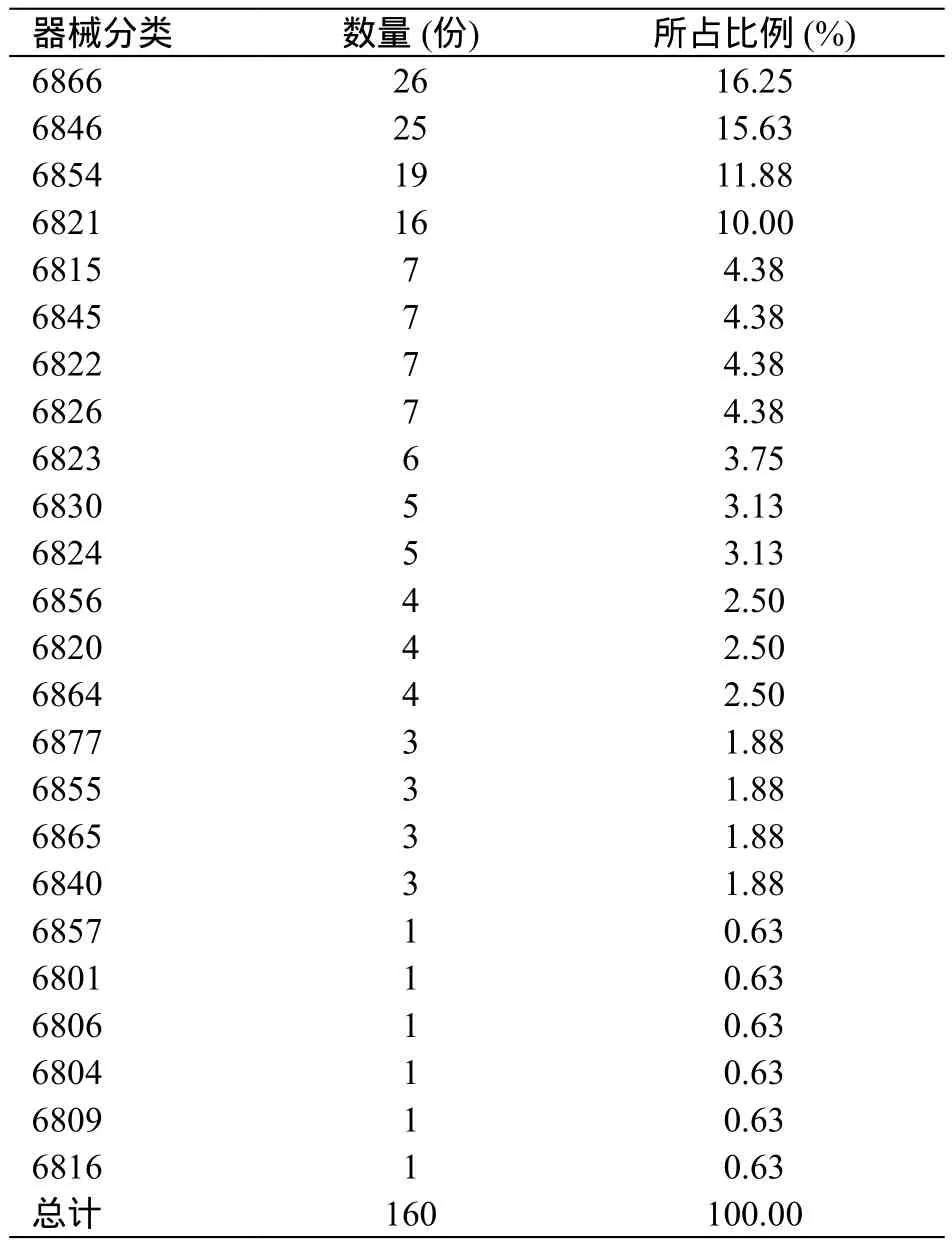
表4 评估报表器械分类统计
3 存在问题及建议
3.1 不合格报表存在原因及改进办法
北京市2016年第三季度共有12份质量评估为不合格报表,所占比例为7.5%。器械分类集中在6846植入材料和人工器官共7例,在不合格报表器械分类中占比58.33%,具体分类为6846-1植入器材中人工髋关节,器械信息平均分为16.1(器械信息分类项满分为34分),分数较低原因为,多数可疑医疗器械不良事件相关器械为患者多年前在外院(本市或外省)植入,相关具体医疗器械信息患者并不十分清楚,本市上报医疗机构了解困难,所以上报信息空缺项非常多。
对于原医疗器械在外院植入到本院翻修或二次手术情况较多的医疗器械品种,如6846植入材料和人工器官,加强此类上报科室相关医疗器械不良事件相关知识培训,在患者初诊时,详尽记录医疗器械及相关医疗器械不良事件情况,并在置换、翻修或二次手术过程中,尽量详尽记录可辨识的医疗器械信息,如品牌、生产厂家、型号等信息,提高报表质量。
3.2 报告时限方面存在问题及改进方法
评估过程中严格按照《医疗器械不良事件监测和再评价管理办法(试行)》中规定的死亡报告5个工作日内上报,严重及一般报告15个工作日内上报评估。按规定时限内上报为94例,所占比例58.75%;未按规定时限上报为66例,所占比例为41.25%,总体良好,尚有待提高。
医疗机构为医疗器械使用单位,临床使用环节可在可疑医疗器械不良事件发生的第一时间发现,因此加强对医疗机构上报时限及医疗器械不良事件相关知识培训,严格按照《医疗器械不良事件监测和再评价管理办法(试行)》规定时限设定院内上报流程和时限,保证院内上报流程畅通。
因一般企业通过顾客抱怨系统或者客户随访系统了解发生的本企业的可疑医疗器械不良事件,从熟悉到上报时间一般比上报规定时限滞后,因此加强企业相关知识培训,做好企业内部获悉可疑不良事件的流程,主动积极尽量在规定时限内上报。
3.3 报告来源方面存在问题及改进方法
平均得分3.8分,满分为4分,除“联系方式”小项因联系电话未填写或错误号码例如123456,扣分外,其他项都为满分。对于“联系方式”填写错误上报单位,电话核实,在《国家药品不良反应监测系统》中更正过来,确保系统中报告来源信息正确。
3.4 患者信息方面存在问题及改进方法
“患者姓名”“患者年龄”和“预期治疗疾病或作用”为主要缺失项。加强对上报单位的培训,明确“患者姓名”“患者年龄”和“预期治疗疾病或作用”为必须填写项目,对于频临事件(未发生或器械未使用前发现的事件)明确在此3项内容或“不良事件情况”内容中写明,但一定不要空项。
3.5 不良事件情况方面存在问题及改进方法
“器械故障”和“主要伤害”只写一项,另一项为空的居多。对于频临事件(未发生或器械未使用前发现的事件)“事件陈述部分”空项居多。加强对上报单位培训,明确“器械故障”和“主要伤害”都为必填项。因频临事件(未发生或器械未使用前发现的事件)一般未对患者造成伤害,因此“不良事件情况”中的不适用项,采取给中间系统标准(0.5)的评分。
3.6 器械信息方面存在问题及改进方法
“有效期”和“停用日期”两项对于有些医疗器械为不适用项,因此报告中为空项。加强对上报单位培训,明确对于此两项不适用项,因软件在原分项无法说明,在“不良事件情况”中可文字输入部分中说明。
4 结论
通过医疗器械不良事件报表质量评估工作,采用非概率抽样与概率抽样相结合的方法,典型调查死亡报告,重点调查严重报告,兼顾上报区域、上报单位类型、上报时间,医疗器械类别和医疗器械分类等因素进行分层抽样一般报告,更加科学有效地发现可疑医疗器械不良事件发现、上报过程中存在的问题,实施改进措施,逐步提高报表填报质量,为医疗器械不良事件报表的分析和评价提供有效数据和基础,为更加科学地进行医疗器械风险防控,促进医疗器械不良事件监测工作的规范开展奠定基础。
[参考文献]
[1] 国食药监械[2008]766号,国家食品药品监督管理总局.医疗器械不良事件监测和再评价管理办法(试行)[EB/OL].(2008-12-29)[2016-04-27].http://www.sda.gov.cn/.
[2] 国食药监械[2011]425号,国家食品药品监督管理总局.医疗器械不良事件监测工作指南(试行)[EB/OL].(2011-09-16)[2016-04-27].http://www.sda.gov.cn/.
[3] GB/T 10111-2008/T10111-2008,随机数的产生及其在产品质量抽样检验中的应用程序[S].北京:中国标准出版社,2008.
[4] GB/T 2828.1-2012,计数抽样检验程序 第1部分:按接收质量限(AQL)检索的逐批检验抽样计划[S].北京:中国标准出版社,2012.
[5] GB/T 2828.2-2008,计数抽样检验程序 第2部分:按极限质量LQ检索的孤立批检验抽样方案[S].北京:中国标准出版社,2008.
[6] GB/T 2828.3-2008/ISO 2859-3:2005,计数抽样检验程序 第3部分:跳批抽样程序[S].北京:中国标准出版社,2008.
[7] GB/T 2828.4-2008,计数抽样检验程序 第4部分:声称质量水平的评定程序[S].北京:中国标准出版社,2008.
[8] 孟刚,潘蕾,高菁,等.医疗器械不良事件报表质量评估方法与研究[J].中国医疗器械信息,2008,14(2):43-47.
[9] 刘斌,翟伟,马宁,等.医疗器械不良事件报告表质量评价方法探索[J].中国药物警戒,2011,18(3):166-168.
[10] 贾秀才,汤少梁.江西省9810例医疗器械不良事件数据统计分析[J].中国医疗设备,2016,31(5):146-148.
[11] 曲婷婷,崔昊.1303例可疑医疗器械不良事件报告分析[J].中国医疗器械信息,2016,15(1):25-28.
[12] 胡麦玲,朱建,翠彭聪,等.畜禽产品风险监测抽样方案设计探讨[J].农产品质量与安全,2015,2(1):51-54.
[13] 曹韵波,高林.1028例医疗器械不良事件报告的回顾性分析[J].中国医疗器械杂志,2013,37(6):447-450.
[14] 田月洁,李泮海,谢彦军,等.医疗器械不良事件报告质量控制的实践与探讨[J].中国药物警戒,2011,8(11):651-653.
[15] 张学宁,王玲,王刚,等.医疗器械不良事件报告质量分析与改善对策[J].中国药物警戒,2015,12(8):479-486.
[16] 黄江宁,郭瑞鹏,赵舫,等.电力系统可靠性评估中的分层均匀抽样法[J].电力系统自动化,2012,36(20):19-24.
[17] 胡桂华,吴东晟.人口普查质量评估调查的抽样设计[J].数量经济技术经济研究,2014,4:113-129.
[18] 张业武,郭青,张春曦,等.全国法定传染病报告率评估调查抽样方法设计[J].疾病监测,2015,30(7):546-549.
