黄酮类化合物与其他化合物相互作用的研究进展
2018-05-25郎宇曦颜廷才丑述睿王月华孟宪军
郎宇曦,马 岩,李 斌,颜廷才,张 琦,丑述睿,林 杨,王月华,孟宪军,*
黄酮类化合物是一类从天然植物体中分离出来的色素,主要指2 个带有酚羟基的苯环(A和B)经由中心三碳链相互连接而形成的,即以C6-C3-C6为基本碳骨架构成的一系列化合物。依据三碳键(C3)的氧化水平和B环连接位点的差异等,可将黄酮类化合物分为黄酮类、黄酮醇类、异黄酮类、花色素类、查尔酮类、橙酮类、黄烷类等(图1)。酚羟基上连接多种官能团便形成了多样的黄酮衍生物,这些衍生物根据配基的不同会呈现出不同的生物活性[1]。
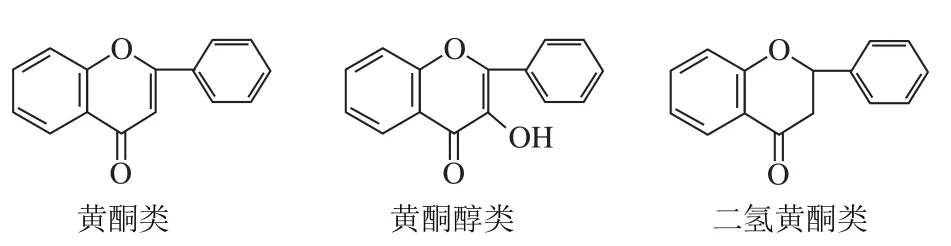

图1 黄酮类化合物碳骨架图Fig. 1 Carbon skeleton of flavonoids
黄酮类化合物在人类的食物如粮食、水果等中广泛存在,其作为一种天然色素,因独特的化学结构而对人类和动物具有许多重要的生理、生化作用,具有高食用和药用价值,它的抗氧化、抗菌、抗炎、抗病毒、抗癌、抗衰老、保肝、保护心血管、清除自由基、提高免疫力等生物活性和功能是不容小觑的;对它的研究开发可以代替安全性不稳定的人工合成色素[2-3]。而黄酮类化合物在自然界中通常与其他化合物共同存在,人类食用富含黄酮类化合物的食物时也往往伴随着摄入其他化合物,并且黄酮类化合物被食用后也可以与人体内的其他化合物作用,如碳水化合物、脂肪、蛋白质、酸等,它们之间的相互作用与黄酮类化合物自身特性的变化以及其如何在体内发挥各种各样的生理活性密切相关,这也是当下该领域备受人们关注的课题之一。本文综述了黄酮类化合物与几类常见的化合物之间相互作用的研究进展。
1 脂类化合物
1.1 黄酮类化合物的脂溶性
一般来说,黄酮类化合物的脂溶性因其连接的基团不同而各有差异,比如黄酮类化合物在母核上引入羟基时随着羟基数量增加水溶性增加,而引入甲氧基、异戊烯基等基团脂溶性会相对增加[4-5]。亲脂性能的增加最直观的益处是能增加黄酮类化合物通过细胞膜进入细胞内发挥其作用的能力,提高其生物利用率和生物活性[6]。Sohn等[7]对在5 种天然植物中分离出来的18 种异戊烯基黄酮的研究中发现了其均有抑菌活性,这是因为其易于通过细胞膜进入细胞内,因此显示了较强的抗菌能力。
1.2 脂质与黄酮类化合物在体内吸收的相互影响
人体摄入的脂质90%为甘油三酯,其余是磷脂和胆固醇,脂质主要在小肠内消化吸收,多达95%通过胰脂肪酶消化,这种酶主要作用于甘油三酯,同时胆固醇主要通过胆固醇酯酶来水解,黄酮类化合物正是通过抑制它们的活性来抑制脂肪在人体中的吸收。Rahim等[8]研究中显示表没食子儿茶素和表没食子儿茶素没食子酸酯具有较强的抑制胰脂肪酶的作用,从而能够抑制脂肪的吸收;Sugiyama等[9]对苹果多酚的研究中发现其多酚中的原花青素通过抑制胰脂肪酶来抑制人体对甘油三酯吸收。Yao Shulong等[10]在对黑米的研究中发现其花色苷对抑制胆固醇的吸收也有显著作用,这个发现对降低血脂有很大意义。
而脂类物质对黄酮类化合物的影响却较小。例如,Schramm等[11]对可可的研究中显示食物中的脂肪对可可中黄烷醇的吸收影响非常之小。
1.3 脂质体提高黄酮类化合物稳定性
尽管黄酮类化合物有抗氧化等各种生理活性,但其不稳定性是限制其发挥生物活性的一大障碍。为了克服这一阻碍,有大量的研究证明将脂质体作为载体,与黄酮结合成为黄酮脂质体,可提高黄酮在生物体内的吸收率与有效性[12-16]。Hädrich等[14]对槲皮素的研究中显示,由于槲皮素在人体内高度系统前代谢和低水溶性的影响使其口服生物利用率很低,但利用规格为20 nm的脂质纳米载体包裹并保护槲皮素,能够延缓槲皮素在体内的释放,大大提高了其口服生物利用率。孟祥平[15]、严航[16]等对葛根黄酮脂质体和体外模拟实验的研究中显示这种脂质体有效地提高了黄酮的稳定性,使其更多地发挥生物活性和药理作用。
1.4 黄酮类化合物抑制脂质过氧化
以多聚不饱和脂肪酸为首的脂类化合物,在自由基的作用下十分容易发生过氧化反应,由于脂类化合物在细胞膜中比重很大,因此脂质过氧化对细胞的损伤是不可小觑的,这也与人体的衰老以及各类疾病密切相关[17-18]。黄酮类化合物有积极地抗脂质过氧化作用,Ozsahin等[19]对Camarosa、Selva和Dorit 3 个种植地区的草莓的研究中显示其草莓中的黄酮类化合物均显示了强抑制脂质过氧化的活性。国内学者付明等[20]将藤茶叶中的黄酮与VC比较,结果显示黄酮类化合物的抗脂质过氧化作用更强。
2 蛋白质
2.1 作用机制
黄酮类化合物与蛋白质的相互作用一般通过非共价作用力或共价键的作用结合而实现的。非共价作用力占大多数,包括氢键、范德华力、疏水作用力和离子相互作用等,它是可逆的。而共价键是不可逆的,比非共价作用力稳定。温度、pH值、蛋白质类型与浓度、黄酮类化合物的类型与结构等都会影响它们之间的结合[21]。如Arroyo-Maya等[22]利用荧光光谱研究黄酮类化合物和蛋白质交互作用的特点,发现天竺葵色素在pH值为3和7的时候与β-乳球蛋白都是通过相互间的疏水作用自发结合,而与酪蛋白结合时,在pH值为3的条件下是通过氢键,在pH值为7时是通过疏水作用。Tantoush等[23]在对樱桃酚类物质和β-乳球蛋白的研究中发现樱桃中以花青素为主要成分的酚类物质与β-乳球蛋白在漆酶作用下通过无二硫化物共价键发生交联。
2.2 对蛋白质的影响
黄酮类化合物与蛋白质结合后,对蛋白质的性能有明显的影响。黄酮类化合物与蛋白质结合后会改变蛋白质的结构,从而改变其性能,如溶解性、稳定性、生物利用率、营养特性等。Zerrin等[24]对绿茶黄酮和乳蛋白相互作用的研究中表明,黄酮与牛乳蛋白的疏水位点有很强的吸引力,结合会使蛋白表面的疏水位点减少,疏水性能下降。Rawel等[25]在对黄酮类化合物和酚酸与大豆蛋白相互作用的研究中表明,其与大豆蛋白的结合会改变蛋白质分子的静电荷,影响蛋白质的溶解性、pH值等,同时会对氨基酸产生封闭作用,减少人体对如赖氨酸、色氨酸等必需氨基酸的利用率。Rohn等[26]将绿原酸和槲皮素与大豆蛋白结合后喂食大鼠,在其排泄物中发现氮的含量增加,说明可能这种结合会影响大鼠对蛋白的利用率,而Tantoush等[23]对以花青素为主要成分的酚类物质与β-乳球蛋白交联的研究发现这种交联可以促进消化后多肽的生物利用率并同时降低乳球蛋白的易致过敏性,提高了乳球蛋白的食用安全性。
酶的本质就是蛋白质,许多研究显示黄酮类化合物可以抑制多种酶的活性,例如上文提到的与脂质吸收有关的胰脂肪酶,还有与血糖升高有关的α-葡萄糖苷酶和α-淀粉酶等[27-28]。Arimboor等[29]对沙棘原花青素的研究中表明其能够沉淀蛋白质并抑制消化酶,影响蛋白质的消化率;Rui等[30]对葡萄籽原花青素对α-淀粉酶抑制作用的研究中显示其抑制作用与原花青素聚合度有关。
2.3 对黄酮类化合物的影响
同样地,黄酮类化合物与蛋白质结合使黄酮类化合物的各类性能如抗氧化活性、生物利用率等发生改变。Arts等[31-32]对黄酮类化合物和蛋白结合后抗氧化能力的研究表明这种结合会掩饰黄酮类化合物的抗氧化能力。Belščak等[33]对不同品种巧克力的研究中发现尽管牛奶巧克力中可可含量比可可巧克力高,但牛奶巧克力中总酚,总黄酮含量和抗氧化活性是最低的,这是由于可可中的儿茶素和牛奶中的蛋白质强烈的相互作用掩盖了儿茶素的抗氧化活性。而Neilson等[34]对加了牛奶的巧克力中可可黄酮体外实验的研究中发现牛奶对可可中的黄烷-3-醇的生物利用率并没有明显的负面影响。Kyle等[35]在加入牛奶后对红茶中多酚的影响研究中显示在80 min内血浆中总酚质量分数为20%、儿茶素为32%、黄酮醇槲皮素为39%,它们并没有受到牛奶添加的影响。Schramm等[11]对食物中的成分可可黄酮的作用的研究中也显示,牛奶对黄酮在体内的吸收无影响[36]。
3 碳水化合物
3.1 糖基化黄酮
在自然界中就存在着与单糖或多糖连接的黄酮类物质,俗称黄酮苷,其主要以O-糖基化衍生物形式存在于植物中,也有少数是以C-糖苷的形式,如葛根素、牡荆素等。随着科技的发达,黄酮与糖基结合的人工方法也有很大进展,同时也证实了黄酮类化合物与糖类的结合在生物学上具有很大的意义[37-38]。
黄酮类化合物与单糖或多糖结合的现象在自然植物体中非常常见,如Wang Yuehua等[38]在对4 个品种的蓝靛果的研究中发现矢车菊素-3-葡萄糖苷是是蓝靛果中最主要的花色苷成分;陈嘉景等[39]在总结柑橘中类黄酮的组成中报道柑橘类水果中糖基化的黄酮多达40余种,且黄烷酮O-糖苷类、黄酮O-糖苷类和黄酮C-糖苷类含量最丰富。发现这类糖基修饰的黄酮类化合物后,人类开始不断探究方法,采用来源于大自然的微生物、植物细胞、酶等通过控制糖基连接位点,糖基种类和糖基数目来定向合成黄酮糖苷类化合物,使糖基化修饰更加高效并具有针对性,现如今这项技术已经取得了重大突破[40-41],如Ferreyra等[42]分离出了了一种cDNA编码的双功能性的糖基转移酶——UGT708A6,在以2-羟基黄酮为底物的体外实验和在酵母中共同表达ZmF2H1和 UGT708A6的体内活性实验中,这种酶显示了可合成C-糖苷黄酮的活性;而在大肠杆菌生物转化实验和在使用纯化的重组蛋白体外实验中,这种酶可以合成O-糖苷黄酮。糖基化会使黄酮的水溶性、稳定性和功能性等均发生改变,并使其具有抗菌、抗炎、抗氧化等生物活性,这在医药、食品都中有很高的利用价值[43]。Yang等[44]对槐花的干花瓣中提取的糖苷黄酮的研究显示其较好地抑制了会导致人类牙龋齿的变形链球菌的活性;Xie Yang等[45]对野生雅葱草本植物中提取的糖苷黄酮衍生物的研究中证实了其有保护肝脏的活性;Lee等[46]对分离出的新型碳甘黄酮斯皮诺素的研究表明其具有通过上调成年海马神经发生或激活细胞外信号调节蛋白激酶(extracellular-regulated kinase,ERK)-反应元件结合蛋白(cAMP response elementbinding protein,CREB)-脑源性神经营养因子(brainderived neurotrophic factor,BDNF)信号通路来治疗精神疾病患者的认知功能紊乱的生物活性。
3.2 相互作用
黄酮类化合物与碳水化合物可以通过氢键、疏水作用等互相作用[47]。Padayachee等[48]对花色苷和植物细胞壁结合的研究中发现花色苷与细胞壁上的果胶和纤维素均可结合,与果胶通过离子相互作用,与纤维素通过疏水相互作用,酰化花色苷与细胞壁的结合率会比未酰化的多5%~10%。Wang Yuxue等[49]对燕麦β-葡聚糖与多酚相互作用的研究显示黄酮类化合物的吸附能力从高到低为黄酮醇>黄酮>黄烷酮>异黄酮。这两类物质的结合会对彼此都产生影响。Schramm等[11]通过人体实验证明同时摄入碳水化合物和黄酮类化合物可以促进黄酮类化合物的吸收。根据MacDonald[50]和Tuohy[51]等的研究,在人体内,黄酮类物质与碳水化合物的结合,可以将膳食纤维看作载体,保护黄酮不被酶分解并将其运输到结肠中释放出来,再与各类酶和微生物作用从而提高了黄酮类化合物的利用率,同时作用后的代谢物有很积极的抗菌、抗炎等活性并且能够降低患结肠癌的风险。另一方面,碳水化合物与黄酮类化合物的结合抑制黄酮与有效蛋白的结合,如Gonçalves等[52]的研究显示多聚半乳糖醛酸、阿拉伯树胶、果胶、黄原胶原可以阻止花青素B3和胰蛋白酶的结合。
4 酸类物质
4.1 相互作用
黄酮类化合物的极不稳定性极大地限制了其实际应用,大量研究表明酸类物质对黄酮类化合物有辅色作用并能提高其稳定性。张丽霞等[53]对黑莓花色苷的研究显示草酸、丙二酸和苹果酸对黑莓花色苷均具有辅色作用并能提高其热稳定性,其中草酸效果最好,草酸作用下黑莓花色苷与辅色前相比成分未发生变化,推测草酸通过分子间非共价键与黑莓花色苷作用进行辅色。Jiao Yuzhi等[54]对阿魏酸对紫玉米花色苷作用的研究显示阿魏酸可以加强花色苷的色泽并提高其在贮藏和加热中的稳定性。同时黄酮类化合物可以抑制酸在人体内转化成有害物质,Wong等[55]对黄酮和羟基肉桂酸在机体内的相互作用的研究显示黄酮类物质能有效抑制羟基肉桂酸硫酸化,产生有害的硫酸化代谢产物。
4.2 黄酮酰基化
人们在植物体内发现了糖基化黄酮类化合物与有机酸或脂肪酸结合的酰化产物,Giusti等[56]对可食用资源的花色苷的研究中指出萝卜、红皮马铃薯、红叶卷心菜、黑胡萝卜等中都存在酰化的花色苷。同时,人工合成酰化黄酮化合物的技术也日渐成熟,所用的方法主要为酶法和化学法,酶法大多使用南极假丝酵母脂肪酶B和枯草杆菌蛋白酶,主要的酰化部位是黄酮糖苷上糖基的醇羟基,少数发生在酚羟基上。酰化常用的有机酸为阿魏酸、咖啡酸、芥子酸、没食子酸等,脂肪酸为乙酸、草酸、苹果酸、琥珀酸、月桂酸、棕榈酸等,影响酰化的条件包括方法、pH值、溶剂、温度、酰化试剂等[57-58]。如Xanthakis等[59]对酶法酰化黄酮的研究中表明以油酸为酰基供体转化率为70%,α-亚麻酸为80%,γ-亚油酸为68%。Salem等[60]对酰基链长对异槲皮苷酰化影响的研究显示随着脂肪酸碳链从C4增加到C18,其转化率和起始转化速率均程下降趋势;再比如Ziaullah等[61]利用超声波辅助南极假丝酵母脂肪酶法,用脂肪酸酰化根皮素2’-葡萄糖苷和槲皮素-3-O-葡萄糖苷,结果证明利用超声波辅助比传统酶法的酰化速率快很多。酰化后的黄酮类化合物的生物活性、脂溶性、稳定性等都会有所增加,并且还可能被赋予新的性能,这会越来越多地应用于食品、化妆品、医药等领域中[62]。Zhao Changling等[63]总结了花色苷酰化后的特性,表明了酰化后无论在体内受消化酶影响还是体外受环境因素(pH值、温度、光照等)影响其稳定性均比未酰化的强;同时在贮藏和加工过程中酰化花色苷也比未酰化的稳定,双酰化的花色苷要比单酰化的稳定。Ma Xiang等[64]用酶法使用不同链长的脂肪酸酰化竹叶黄酮中的异荭草苷和异牡荆苷并探究其酰化后的性能,研究表明使用月桂酸酰化两种黄酮的转化率最高,酰化位点在葡萄糖苷上的羟基并且均为单酰化,酰化后的黄酮脂溶性增加,但清除自由基的能力却降低,这可能是由于酰化减少了发挥清除自由基能力的羟基数量。此外,Ma Xiang等[65]用南极假丝酵母脂肪酶B酶法酰化竹叶黄酮,以月桂酸为酰基供体得到了4 种酰化黄酮,结果显示它们在炸土豆片中抑制丙烯酰胺生成的作用比未酰化的黄酮要好。薛敏等[66]用乙酸和丙酸酰化柚皮苷合成柚皮素-7-O-乙酸酯和柚皮素-7-O-丙酸酯,发现酰化可以改善柚皮苷的水溶性并提高其抗血小板的聚集活性,这对治疗心血管疾病有很大意义。
5 其 他
黄酮类化合物之间也可以发生相互作用,如王维茜等[67]研究黄酮对刺葡萄花色苷辅色稳定化效果显示槲皮素、黄芩素和芦丁对刺葡萄花色苷均有辅色作用,其中槲皮素效果最强,并且这3 种黄酮均能提高花色苷的热稳定性。丁豪等[68]对昆仑雪菊中5 种黄酮类化合物的研究显示它们的抗氧化相互作用关系与化合物的结构和浓度有关,3′,4′-二羟基结构使多种黄酮化合物复配后抗氧化活性受到抑制,选择适当的配比浓度可以有效地降低昆仑雪菊不同类黄酮化合物之间的拮抗作用。
同时,黄酮类化合物还可和许多其他物质有相互影响,对黄酮的影响主要体现在稳定性和功能性上。蒋益花等[69]对花色苷稳定性的总结中提到分子氧可使花色苷降解、二氧化硫可以漂白花色苷、金属离子可与花色苷形成络合物增加花色苷的稳定性等;倪良旭等[70]对滁菊茶汤中黄酮类化合物稳定性的研究表明强酸强碱均易破坏滁菊黄酮,金属离子Cu2+、Fe3+、Al3+和Ca2+对黄酮稳定性影响较大,Na+、K+、Mg2+对稳定性无影响,氧化剂(H2O2)、还原剂(Na2SO3)对其稳定性有影响,而防腐剂(山梨酸钾)对黄酮稳定性则无明显影响;陈斌等[71]利用对甲基苯甲酰氯等一系列化合物合成了3 种新型苯并吡喃黄酮并证明了其有较好的抗肿瘤活性;魏朝治等[72]在对乳酸菌在黄酮类化合物生物转化中的作用研究中发现通过乳酸菌发酵可以将黄酮糖苷去糖基化转化成黄酮苷元,使其更易被人体吸收利用,大幅增强了黄酮的生物利用率。此外,Bautísta-Ortin等[73]发现两种单宁含量相差不多但花色苷含量不同的葡萄酿成的红酒的单宁含量不同,其原因是花色苷可与单宁竞争其与细胞壁相互作用的位点来提高单宁的释放量。随着科技的日益发达与人们的不断探索,之后还会发掘出更多可与黄酮类化合物相互作用的物质,并将其中的积极作用应用于实际中。
6 结 语
黄酮类化合物一种多功能的活性物质,其抗氧化、抗炎抗癌等生物活性使其在医药和食品中具有很大的利用价值。根据人类的饮食习惯,食物中黄酮类化合物经常与其他成分一起摄入体内,并在体内消化与体内物质相互作用,因此探究黄酮类化合物与其他化合物的相互作用在生物学上具有非常大的意义。黄酮类化合物与其他化合物通过各种形式相互作用或结合产生本身不具备的功能或强化、弱化某种功能,其大多为积极作用,但也有少数负面影响。黄酮可以抑制体内脂肪的吸收和脂质过氧化,用脂质作载体可以提高黄酮在体内的稳定性,连接不同配基的黄酮脂溶性不同,较强的脂溶性会更易于黄酮发挥生物活性作用;蛋白质与黄酮通过非共价作用力或共价键结合,结合后会影响蛋白质活性,氨基酸的利用率等,但抑制某些酶的活性对人体有益,同时这种结合对黄酮在体内的吸收并无影响;糖基化的黄酮具有很高的生物活性,同时黄酮与碳水化合物结合也有很多积极效应;酸类化合物对黄酮的辅色作用对提高黄酮稳定性和维持黄酮的色泽有很大的帮助,并且酰基化黄酮的稳定性和脂溶性均有很大的提升,功能也有所改变,同时黄酮可以抑制酸在体内代谢成有害物质。
食品中物质种类丰富,在人体内代谢变化多样,越来越多的研究表明黄酮类化合物在体内发挥生物活性的机制与黄酮类化合物同其他化合物之间的相互作用密不可分。天然黄酮类化合物虽然在自然界中广泛存在,但因其结构复杂、溶解性差、作用位点多等特点,其生理活性的利用率并不是很高,限制了它们在医学药学等领域的应用。目前,仍需继续探索黄酮与其他化合物之间的作用机制和黄酮的生理作用机制,找到更多可靠的依据,在减缓黄酮类化合物的不稳定性的同时将其功效尽大程度地发挥出来,这对黄酮类药物和保健食品的开发有很大帮助。
参考文献:
[1] 彭程程, 王青山, 赵国祥, 等. 黄酮类化合物的研究进展[J]. 农产品加工(学刊), 2010(5): 38-41; 43 DOI:10.3969/j.issn.1671-9646(X).2010.05.010.
[2] 文开新, 王成章, 严学兵, 等. 黄酮类化合物生物学活性研究进展[J].草业科学, 2010, 27(6): 115-122.
[3] 陈颢, 李丽娟, 李良, 等. 中药材中黄酮类化合物的提取及药理作用研究进展[J]. 云南化工, 2011, 38(4): 50-52. DOI:10.3969/j.issn.1004-275X.2011.04.014.
[4] 宋家玲, 杨永建, 李强, 等. 多甲氧基黄酮类化合物研究进展[J].中国实验方剂学杂志, 2012, 18(17): 308-313. DOI:10.3969/j.issn.1005-9903.2012.17.088.
[5] 赵平, 张颖君, 山本浩文, 等. 苦参异戊烯基黄酮类化合物的化学活性及其生物合成研究进展[J]. 天然产物研究与开发, 2004, 16(2):172-178. DOI:10.3969/j.issn.1001-6880.2004.02.022.
[6] 石晓伟, 张嫡群, 王云志. 苦参异戊烯基黄酮生物活性研究进展[J].河北医科大学学报, 2006, 27(4): 318-321.
[7] SOHN H Y, SON K H, KWON C S, et al. Antimicrobial and cytotoxic activity of 18 prenylated flavonoids isolated from medicinal plants:Morus alba L., Morus mongolica Schneider, Broussnetia papyrifera(L.) Vent, Sophora flavescens Ait and Echinosophora koreensis Nakai[J]. Phytomedicine, 2004, 11(7/8): 666-672. DOI:10.1016/j.phymed.2003.09.005.
[8] RAHIM M A, TAKAHASHI Y, YAMAKI K. Mode of pancreatic lipase inhibition activity in vitro by some flavonoids and non-flavonoid polyphenols[J]. Food Research International, 2015, 75: 289-294.DOI:10.1016/j.foodres.2015.05.017.
[9] SUGIYAMA H, AKAZOME Y, SHOJI T, et al. Oligomeric procyanidins in apple polyphenol are main active components for inhibition of pancreatic lipase and triglyceride absorption[J]. Journal of Agricultural and Food Chemistry, 2007, 55(11): 4604-4609.DOI:10.1021/jf070569k.
[10] YAO Shulong, XU Ying, ZHANG Yanyan, et al. Black rice and anthocyanins induce inhibition of cholesterol absorption in vitro[J].Food & Function, 2013, 4(11): 1602-1608. DOI:10.1039/C3FO60196J.
[11] SCHRAMM D D, KARIM M, SCHRADER H R, et al. Food effects on the absorption and pharmacokinetics of cocoa flavanols[J]. Life Sciences, 2003, 73(7): 857-869. DOI:10.1016/S0024-3205(03)00373-4.
[12] 袁菊, 张亚宁, 范云鹏, 等. 响应面分析法优化蜂胶黄酮脂质体制备工艺[J]. 食品科学, 2012, 33(20): 1-6.
[13] MEHNERT W, MÄDER K. Solid lipid nanoparticles production,characterization and applications[J]. Advanced Drug Delivery Reviews, 2012, 64: 83-101. DOI:10.1016/S0169-409X(01)00105-3.
[14] HÄDRICH G, MONTEIRO S O, RODRIGUES M R, et al. Lipid-based nanocarrier for quercetin delivery: system characterization and molecular interactions studies[J]. Drug Development and Industrial Pharmacy, 2016,42(7): 1165-1173. DOI:10.3109/03639045.2015.1118491.
[15] 孟祥平, 周群, 王治平, 等. 口服葛根总黄酮固体脂质纳米粒冻干粉的制备及其4 种成分释放度考察[J]. 中草药, 2014, 45(17): 2467-2474. DOI:10.7501/j.issn.0253-2670.2014.17.009.
[16] 严航, 杨晶, 唐婷, 等. 葛根黄酮脂质体的制备及体外透皮实验研究[J]. 中成药, 2014, 36(3): 623-625. DOI:10.3969/j.issn.1001-1528.2014.03.041.
[17] NEGRE-SALVAYRE A, AUGE N, AYALA V, et al. Pathological aspects of lipid peroxidation[J]. Free Radical Research, 2011, 44(10):1125-1171. DOI:10.3109/10715762.2010.498478.
[18] WILDBURGER R, MRAKOVCIC L, STROSER M, et al. Lipid peroxidation and age-associated diseases: cause or consequence?:review[J]. Turkiye Klinikleri Tip Bilimleri Dergisi, 2009, 29(1): 189-193.
[19] OZSAHIN A D, GOKCE Z, YILMAZ O, et al. The fruit extract of three strawberry cultivars prevents lipid peroxidation and protects the unsaturated fatty acids in the Fenton reagent environment[J].International Journal of Food Sciences and Nutrition, 2011, 63(3):353-357. DOI:10.3109/09637486.2011.628646.
[20] 付明, 胡朝暾, 周亮, 等, 藤茶黄酮含量及其体外抗脂质过氧化能力研究[J]. 食品工业科技, 2013, 34(7): 146-148; 214.
[21] OZDAL T, CAPANOGLU E, ALTAY F. A review on protein: phenolic interactions and associated changes[J]. Food Research International,2013, 51(2): 954-970. DOI:10.1016/j.foodres.2013.02.009.
[22] ARROYO-MAYA I J, CAMPOS-TERÁN J, HERNÁNDEZARANA A, et al. Characterization of flavonoid-protein interactions using fluorescence spectroscopy: Binding of pelargonidin to dairy proteins[J]. Food Chemistry, 2016, 213: 431-439. DOI:10.1016/j.foodchem.2016.06.105.
[23] TANTOUSH Z, STANIC D, STOJADINOVIC M, et al. Digestibility and allergenicity of β-lactoglobulin following laccase-mediated crosslinking in the presence of sour cherry phenolics[J]. Food Chemistry,2011, 125(1): 84-91. DOI:10.1016/j.foodchem.2010.08.040.
[24] ZERRIN Y, ELIF A, YASARKEMAL E. Characterization of binding interactions between green tea flavanoids and milk proteins[J]. Food Chemistry, 2010, 121(2): 450-456. DOI:10.1016/j.foodchem.2009.12.064.
[25] RAWEL H M, CZAJKA D, ROHN S, et al. Interactions of different phenolic acids and flavonoids with soy proteins[J]. International Journal of Biological Macromolecules, 2002, 30(3/4): 137-150.DOI:10.1016/S0141-8130(02)00016-8.
[26] ROHN S, PETZKE K J, RAWEL H M, et al. Reactions of chlorogenic acid and quercetin with a soy protein isolate: influence on the in vivo food protein quality in rats[J]. Molecular Nutrition and Food Research,2006, 50(8): 696-704. DOI:10.1002/mnfr.200600043.
[27] 范金波, 侯宇, 蔡茜彤, 等. 果蔬中酚类成分及其抑制酶活性的研究进展[J]. 食品与发酵科技, 2014, 50(4): 74-78 DOI:10.3969/j.issn.1674-506X.2014.04-020.
[28] YAO Xincheng, ZHU Ling, CHEN Yuxin, et al. In vivo and in vitro antioxidant activity and α-glucosidase, α-amylase inhibitory effects of flavonoids from Cichorium glandulosum seeds[J]. Food Chemistry,2013, 139(1/2/34): 59-66. DOI:10.1016/j.foodchem.2012.12.045.
[29] ARIMBOOR R, ARUMUGHAN C. Sea buckthorn (Hippophae rhamnoides) proanthocyanidins inhibit in vitro enzymatic hydrolysis of protein[J]. Journal of Food Science, 2011, 76(6): 130-137.DOI:10.1111/j.1750-3841.2011.02238.x.
[30] RUI G, MATEUS N, FREITAS V D. Inhibition of α-amylase activity by condensed tannins[J]. Food Chemistry, 2011, 125(2): 665-672.DOI:10.1016/j.foodchem.2010.09.061.
[31] ARTS M J, HAENEN G R, VOSS H P, et al. Masking of antioxidant capacity by the interaction of flavonoids with protein[J]. Food and Chemical Toxicology, 2001, 39(8): 787-791. DOI:10.1016/S0278-6915(01)00020-5.
[32] ARTS M J, HAENEN G R, WILMS L C, et al. Interactions between flavonoids and proteins: effect on the total antioxidant capacity[J].Journal of Agricultural and Food Chemistry, 2002, 50(5): 1184-1187.DOI:10.1021/jf010855a.
[33] BELŠČAK A, KOMES D, HORŽIĆ D, et al. Comparative study of commercially available cocoa products in terms of their bioactive composition[J]. Food Research International, 2009, 42(5/6): 707-716.DOI:10.1016/j.foodres.2009.02.018.
[34] NEILSON A P, GEORGE J C, JANLE E M, et al. Influence of chocolate matrix compositionon cocoa flavan-3-ol bioaccessibility in vitro and bioavailability in humans[J]. Journal of Agricultural and Food Chemistry, 2009, 57(20): 9418-9426. DOI:10.1021/jf902919k.
[35] KYLE J A, MORRICE P C, MCNEILL G, et al. Effects of infusion time and addition of milk on content and absorption of polyphenols from black tea[J]. Journal of Agricultural and Food Chemistry, 2007,55(12): 4889-4894. DOI:10.1021/jf070351y.
[36] 延玺, 刘会青, 邹永青, 等. 黄酮类化合物生理活性及合成研究进展[J]. 有机化学, 2008, 28(9): 1534-1544. DOI:10.3969/j.issn.1673-1328.2011.20.030.
[37] 张红城, 吴正双, 高文宏, 等. 黄酮类化合物改性方法的研究进展[J].食品科学, 2011, 32(3): 256-261.
[38] WANG Yuehua, ZHU Jinyan, MENG Xianjun, et al. Comparison of polyphenol, anthocyanin and antioxidant capacity in four varieties of Lonicera caerulea berry extracts[J]. Food Chemistry, 2016, 197: 522-529. DOI:10.1016/j.foodchem.2015.11.006.
[39] 陈嘉景, 彭昭欣, 石梅艳, 等. 柑橘中类黄酮的组成与代谢研究进展[J]. 园艺学报, 2016, 43(2): 384-400. DOI:10.16420/j.issn.0513-353x.2015-0689.
[40] 李晓波, 刘雪, 赵广荣. 微生物合成黄酮糖苷类天然产物研究进展[J]. 中国生物工程杂志, 2016, 36(8): 105-112. DOI:10.13523/j.cb.20160814.
[41] 吴薛明, 许婷婷, 储建林, 等. 黄酮类化合物酶法糖基化修饰的研究进展[J]. 中国天然药物, 2010, 8(5): 389-400.
[42] FERREYRA M L F, RODRIGUEZ E, CASAS M I, et al. Identification of a bifunctional maize C-and O-glucosyltransferase[J]. Journal of Biological Chemistry, 2013, 288(44): 31678-31688. DOI:10.1074/jbc.M113.510040.
[43] VEITCH N C, GRAYER R J. Flavonoids and their glycosides,including anthocyanins[J]. Natural Product Reports, 2011, 28(10):1626-1695. DOI:10.1039/c1np00044f.
[44] YANG W Y, KIM C K, AHN C H, et al. Flavonoid glycosides inhibit sortase a and sortase a-mediated aggregation of Streptococcus mutans, an oral bacterium responsible for human dental caries[J].Journal of Microbiology and Biotechnology, 2016, 26(9): 1566-1569.DOI:10.4014/jmb.1605.05005.
[45] XIE Yang, GUO QiuShi, WANG GuangShu. Flavonoid glycosides and their derivatives from the herbs of Scorzonera austriaca wild[J].Molecules, 2016, 21(6): 1-9. DOI:10.3390/molecules21060803.
[46] LEE Y, JEON S J, LEE H E, et al. Spinosin, a C-glycoside flavonoid,enhances cognitive performance and adult hippocampal neurogenesis in mice[J]. Pharmacology Biochemistry and Behavior, 2016, 145: 9-16.DOI:10.1016/j.pbb.2016.03.007.
[47] LE B C, RENARD C M G C. Interactions between polyphenols and macromolecules: quantification methods and mechanisms[J]. Critical Reviews in Food Science and Nutrition, 2012, 52(3): 213-248. DOI:10.1080/10408398.2010.499808.
[48] PADAYACHEE A, NETZEL G, NETZEL M, et al. Binding of polyphenols to plant cell wall analogues: part 1: anthocyanins[J].Food Chemistry, 2012, 134(1): 155-161. DOI:10.1016/j.foodchem.2012.02.082.
[49] WANG Yuxue, LIU Jia, CHEN Fang, et al. Effects of molecular structure of polyphenols on their noncovalent interactions with oat β-glucan[J]. Journal of Agricultural and Food Chemistry, 2013, 61(19):4533-4538. DOI:10.1021/jf400471u.
[50] MACDONALD R S, WAGNER K. Influence of dietary phytochemicals and microbiota on colon cancer risk[J]. Journal of Agricultural and Food Chemistry, 2012, 60(27): 6728-6735.DOI:10.1021/jf204230r.
[51] TUOHY K M, CONTERNO L, GASPEROTTI M, et al. Up-regulating the human intestinal microbiome using whole plant foods, polyphenols,and/or fiber[J]. Journal of Agricultural and Food Chemistry, 2012,60(36): 8776-8782. DOI:10.1021/jf2053959.
[52] GONÇALVES R, MATEUS N, DE FREITAS V. Influence of carbohydrates on the interaction of procyanidin B3 with trypsin[J].Journal of Agricultural and Food Chemistry, 2011, 59(21): 11794-11802. DOI:10.1021/jf203060s.
[53] 张丽霞, 周剑忠, 顾振新, 等. 不同有机酸对黑莓花色苷辅色效果的影响[J]. 食品与发酵工业, 2013, 39(6): 105-110.
[54] JIAO Yuzhi, ZHANG Youwei, HE Zhiyong, et al. Effect of ferulic acid on the formation of pyranoanthocyanins from purple corn (Zea mays L.) cob in a model system and their effects on color[J]. International Journal of Food Properties, 2016, 19(4): 847-858. DOI:10.1080/10942 912.2015.1050500.
[55] WONG C C, WILLIAMSON G. Inhibition of hydroxycinnamic acid sulfation by flavonoids and their conjugated metabolites[J].BioFactors, 2013, 39(6): 644-651. DOI:10.1002/biof.1127.
[56] GIUSTI M M, WROLSTAD R E. Acylated anthocyanins from edible sources and their applications in food systems[J]. Biochemical Engineering Journal, 2003, 14(3): 217-225. DOI:10.1016/S1369-703X(02)00221-8.
[57] 张红城, 吴正双, 高文宏, 等. 黄酮类化合物改性方法的研究进展[J].食品科学, 2011, 32(3): 256-261.
[58] 肖咏梅, 毛璞, 栗俊田, 等. 黄酮类化合物酶促衍生化的研究进展[J].河南工业大学学报(自然科学版), 2011, 32(1): 78-82: 94.
[59] XANTHAKIS E, THEODOSIOU E, MAGKOUTA S, et al. Enzymatic transformation of flavonoids and terpenoids: structural and functional diversity of the novel derivatives[J]. Pure and Applied Chemistry,2010, 82(1): 1-16. DOI:10.1351/PAC-CON-09-01-19.
[60] SALEM J H, HUMEAU C, CHEVALOT I, et al. Effect of acyl donor chain length on isoquercitrin acylation and biological activities of corresponding esters[J]. Process Biochemistry, 2010, 45(3): 382-389.DOI:10.1016/j.procbio.2009.10.012.
[61] ZIAULLAH, RUPASINGHE H P. Sonochemical enzyme-catalyzed regioselective acylation of flavonoid glycosides[J]. Bioorganic Chemistry, 2016, 65: 17-25. DOI:10.1016/j.bioorg.2016.01.005.
[62] VISKUPICOVÁ J, ONDREJOVÍC M, STURDIK E. The potential and practical applications of acylated flavonoids[J]. Pharmazie, 2009,64(6): 355-360. DOI:10.1691/ph.2009.9501.
[63] ZHAO Changling, YU Yuqi, CHEN Zhongjian, et al. Stabilityincreasing effects of anthocyanin glycosyl acylation[J]. Food Chemistry, 2017, 214: 119-128. DOI:10.1016/j.foodchem.2016.07.073.
[64] MA Xiang, YAN Rian, YU Shuqi, et al. Enzymatic acylation of isoorientin and isovitexin from bamboo-leaf extracts with fatty acids and antiradical activity of the acylated derivatives[J]. Journal of Agricultural and Food Chemistry, 2012, 60(43): 10844-10849.DOI:10.1021/jf303595e.
[65] MA Xiang, WANG Erpei, LU Yuyun, et al. Acylation of antioxidant of bamboo leaves with fatty acids by lipase and the acylated derivatives’efficiency in the inhibition of acrylamide formation in fried potato crisps[J].PLoS ONE, 2015, 10(6): 1-11 DOI:10.1371/journal.pone.0130680.
[66] 薛敏, 张浩, 朱玉凤, 等. 柚皮素-7-O-乙酸酯和柚皮素-7-O-丙酸酯的制备及抗血小板聚集活性[J]. 天然产物研究与开发, 2016, 28(8):1273-1278.
[67] 王维茜, 邓洁红, 田小燕, 等. 黄酮对刺葡萄花色苷辅色稳定化效果的研究[J]. 食品工业科技, 2016, 72(2): 318-321; 361. DOI:10.13386/j.issn1002-0306.2016.02.055.
[68] 丁豪, 杨海燕, 辛志宏. 昆仑雪菊黄酮类化合物的抗氧化相互作用研究[J]. 食品科学, 2015, 36(21): 26-32. DOI:10.7506/spkx1002-6630-201521006.
[69] 蒋益花, 蒋新龙. 花色苷稳定化技术及产业化前景[J]. 浙江树人大学学报(自然科学版), 2009, 9(3): 20-25.
[70] 倪良旭, 孙艳辉, 苗文娟. 滁菊茶汤中黄酮类化合物稳定性研究[J].滁州学院学报, 2016, 18(2): 80-84.
[71] 陈斌, 刘雄伟, 陈诗尧, 等. 新型苯并吡喃黄酮的合成及其抗肿瘤活性[J]. 合成化学, 2014, 22(1): 30-33. DOI:10.3969/j.issn.1005-1511.2014.01.007.
[72] 魏朝治, 辛雪, 陈蕾蕾, 等. 乳酸菌在黄酮类化合物生物转化中的应用[J]. 中国酿造, 2016, 35(10): 13-17. DOI:10.11882/j.issn.0254-5071.2016.10.004.
[73] BAUTISTA-ORTÍN A B, MARTÍNEZ-HERNÁNDEZ A, RUIZGARCÍA Y, et al. Anthocyanins influence tannin-cell wall interactions[J]. Food Chemistry, 2016, 206: 239-248. DOI:10.1016/j.foodchem.2016.03.045.
