高压均质预处理对玉米淀粉阳离子化、结构和性能的影响
2018-05-25李贵萧代养勇侯汉学李向阳王文涛董海洲刘传富
李贵萧,代养勇*,侯汉学,张 慧,李向阳,王文涛,董海洲*,刘传富
阳离子淀粉是含卤代基或环氧基的有机胺类化合物与淀粉分子中羟基进行醚化反应而生成的一种含氨基的淀粉醚类衍生物[1]。因其对带负电荷物质具有强亲和性,该变性淀粉被广泛应用于造纸、医药、纺织、油田钻井等多种领域[2]。目前为突破传统方法制备阳离子淀粉的缺陷,通过破坏晶体结构来提高淀粉取代度及反应效率已成为研究热点。
机械力化学法可实现热力学上无法发生的化学反应,是一种很有价值的高效改性淀粉的方法,近年来一直为热点研究领域之一[3]。Kasemwong[4]和涂宗财[5]等分别研究高压微流化对木薯淀粉、马铃薯淀粉结构和性质的影响,结果均显示高压微射流处理可破坏淀粉结构,使淀粉分子质量分布更加均匀。而高压均质作为一种可使淀粉乳中淀粉颗粒发生糊化的非热处理方法,对物料可产生强烈的剪切、撞击、振荡和气穴等机械力效应[6]。孟爽等[7]应用高压均质技术制备玉米淀粉-硬脂酸复合物,结果表明高压均质处理促进了淀粉颗粒与硬脂酸复合。故本实验以3 种不同机械力作用阶段的玉米淀粉为原料,研究高压均质预处理对湿法制备阳离子淀粉微观结构及理化性质的影响,为制备高性能阳离子淀粉提供理论参考。
1 材料与方法
1.1 材料与试剂
普通玉米淀粉(含水率13.06%,粗蛋白质量分数0.39%,粗脂肪质量分数0.34%) 山东诸城兴贸玉米开发有限公司;8-氨基芘基-1,3,6三磺酸三钠盐(8-aminopyrene-1,3,6-trisulfonic acid, trisodium salt,APTS) 美国Sigma-Aldrich公司;3-氯-2羟丙基三甲基氯化铵(3-chloro-2-hydroxypropyltrimethylammonium chloride,CHPTMA)、NaOH、K2SO4、Cu2SO4、H3BO3、冰醋酸等均为分析纯。
1.2 仪器与设备
RVA-Eritm快速黏度分析(rapid visco analysis,RVA)仪 瑞典波通仪器公司;D8 ADVANCE型X射线衍射仪 德国Bruker-AXS有限公司;ZKY-303S型高压均质机 北京中科浩宇科技发展有限公司;B-383POL偏光显微镜 意大利康帕斯公司;QUANTA FEG250扫描电子显微镜 美国FEI公司;is5傅里叶变换红外光谱仪 美国热电尼高力公司;200PC差示扫描量热仪 耐驰科学仪器商贸(上海)有限公司。
1.3 方法
1.3.1 不同机械力化学效应阶段淀粉的制备
取200.00 g玉米淀粉(干基),配成质量分数为18%的淀粉乳,搅拌均匀,利用高压均质机于100 MPa压力下分别处理1、5、7 次,40 ℃通风干燥48 h,采用高速多功能粉碎机研磨、过200 目筛,制备得受力、聚集、团聚3 个机械力化学阶段淀粉,密封备用。
1.3.2 阳离子淀粉制备
取100.00 g不同阶段的玉米淀粉,加入体积分数95%乙醇混匀,加入醚化剂搅拌混匀,调pH值至11.0,于40 ℃反应8 h,结束后调节pH值至中性。离心、洗涤至上清液无氯离子,干燥、研磨得阳离子淀粉备用[8]。
1.3.3 阳离子淀粉取代度和反应效率的确定
采用凯氏定氮法测定样品含氮量。取代度(degree of substitution,DS)、反应效率(reaction efficiency,RE)分别按以公式(1)、(2)计算[9]。

式中:W为阳离子淀粉与原淀粉含氮量差值/%;162为脱水葡萄糖残基相对分子质量;1 400为氮的相对原子质量×100;152.5为阳离子取代基的相对分子质量;n1为淀粉葡萄糖残基物质的量/mol;n2为醚化剂物质的量/mol。
1.3.4 扫描电子显微镜观察
试样经40 ℃恒温干燥12 h,均匀涂在模具上,离子溅射喷涂铂金后,采用扫描电子显微镜进行观察。
1.3.5 激光共聚焦显微镜
采用陈佩[10]方法进行激光共聚焦显微镜测定。
1.3.6 偏光显微镜
将样品配成质量分数1%淀粉乳,置于载玻片上,盖上盖玻片于光学显微镜下观察,记录淀粉在偏振光源下的形貌特征。
1.3.7 X射线衍射
采用X射线衍射仪测定结晶特性。测试条件:特征射线CuKα,管压40 kV,电流100 mA,扫描速率4(°)/min,测量角度(2θ)5°~40°,步长0.02°,发散狭缝1°,防发散狭缝1°,接收狭缝0.16 mm[11]。
1.3.8 糊化特性测定
利用快RVA仪进行测定。采用Standard 1标准程序,用Thermocline for Windows进行分析得淀粉糊黏度曲线。
1.3.9 差示扫描量热分析
称取5 mg淀粉样品于铝制密封坩埚中,加入20 µL去离子水,室温下平衡过夜。升温速率为5 ℃/min,升温温度为10~99 ℃,记录升温过程DSC曲线。保护气为N2,流速为60 mL/min。同时记录淀粉糊化起始温度(To)、峰值温度(Tp)、终止温度(Tc)和糊化焓变(ΔH)。
1.3.10 热重分析
试样经45 ℃干燥12 h,采用TA-60热重分析仪测定样品热稳定性。测试条件:试样质量5 mg,升温速率25 ℃/min,温度范围25~600 ℃,N2为保护气。
1.3.11 透光率测定
称取0.5 g玉米淀粉(干基),配成50 mL淀粉乳,沸水浴加热糊化30 min。每水浴5 min利用磁力搅拌器搅拌2 min。糊化完成后冷却至室温,利用分光光度计于650 nm波长处测定吸光度,以蒸馏水为空白,平行测定3 次,计算淀粉糊的透光率[5]。
1.3.12 傅里叶变换红外光谱分析
采用傅里叶变换红外光谱仪衰减全反射附件对样品进行扫描和测定,波长范围500~4 000 cm-1,扫描次数32,分辨率4 cm-1。
1.4 数据处理
实验数据重复3 次,采用Excel、Origin 8.5软件进行数据处理。
2 结果与分析
2.1 高压均质预处理对阳离子淀粉取代度及反应效率的影响

表1 阳离子淀粉的取代度与反应效率Table 1 DS and RE of cationic starch at different homogenization stages
由表1可知,与以玉米淀粉为原料制备的阳离子淀粉相比,淀粉经高压均质预处理后所制备的阳离子淀粉取代度、反应效率均显著提高,这表明高压均质预处理促进了淀粉分子中羟基与醚化剂的反应,显著提高了阳离子淀粉的醚化程度。当淀粉处于聚集阶段时,制备的阳离子淀粉取代度和反应效率最大,分别为0.0591和49.30%,增幅分别达43.80%、43.86%。可见该阶段淀粉颗粒内部虽然发生聚集,但其化学活性较高。而当淀粉处于团聚阶段时,制备的阳离子淀粉取代度和反应效率又显著下降,分别为0.0491和40.92%,说明团聚阶段淀粉化学活性降低。
2.2 高压均质预处理对阳离子淀粉颗粒形貌的影响
玉米淀粉颗粒多呈现椭圆形,表面较光滑,部分为多角形,少数呈无规则形状[12]。由图1可知,以玉米淀粉为原料制备的阳离子淀粉颗粒形貌变化不大。而以高压均质预处理后玉米淀粉为原料制备的阳离子淀粉颗粒形貌发生显著变化,聚集阶段多数淀粉颗粒发生变形,形貌结构破坏最严重(图1D);因该变化使淀粉内部结构暴露,促进醚化剂与淀粉羟基结合,从而使取代度显著增大(表1)。而当淀粉处于团聚阶段时,制备的阳离子淀粉颗粒出现明显黏连现象(图1E),导致有效醚化面积减少,从而使取代度和反应效率变小[13](表1)。

图1 高压均质预处理不同阶段制备的阳离子淀粉颗粒扫描电子显微镜图(×2 000)Fig. 1 SEM images of cationic starch at different stages of homogenization pretreatment (× 2 000)
2.3 高压均质预处理对阳离子淀粉内部微观结构的影响
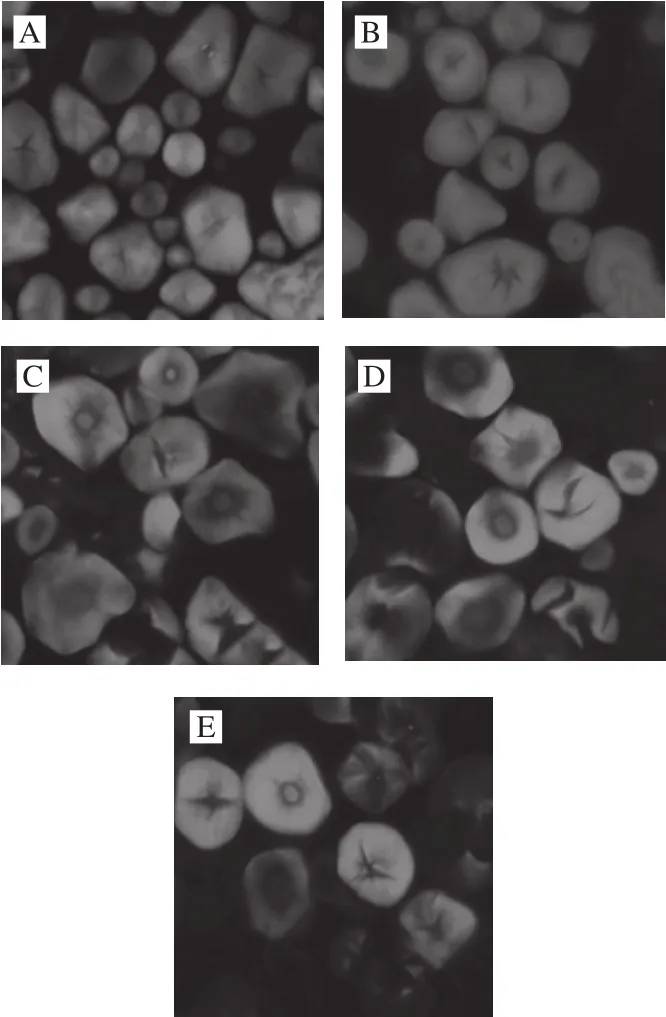
图2 高压均质预处理不同阶段制备的阳离子淀粉颗粒激光共聚焦显微图(×1 600)Fig. 2 CLSM images of cationic starch at different stages of homogenization pretreatment (× 1 600)
淀粉颗粒是由结晶区和无定形区交替组成的多晶体系。结晶区主要为支链淀粉有序排列的紧密结构;无定形区主要由直链淀粉构成,形成淀粉颗粒内部核心稀疏结构[14]。APTS染色剂与淀粉还原基末端反应使其呈现荧光特征,相同分子质量下,直链淀粉具有更多还原末端,荧光强度较强[10],故内部核心亮度较高。
由图2可知,玉米淀粉颗粒内部存在孔道结构,中央核心位置荧光强度较大[10]。以玉米淀粉为原料制备的阳离子淀粉内部微观结构未发生明显变化(图2B)。而以高压均质预处理后玉米淀粉为原料制备的阳离子淀粉颗粒孔道结构明显增大,部分颗粒出现破裂现象,同时颗粒中央出现高荧光强度的球状结构,且部分淀粉颗粒球形结构周围亮度较暗,推断其为与淀粉羟基结合的醚化剂。可见高压均质撞击力、空化效应等机械力作用增大了淀粉孔道,促进醚化剂渗透进入淀粉内部发生醚化反应[15-16]。而团聚阶段制备的阳离子淀粉多数颗粒中心球体消失,破裂淀粉颗粒增多,荧光区域分散(图2E),可见该阶段破坏的无定形区和晶体结构发生作用,直链淀粉分散,醚化剂与淀粉羟基结合减少,故该阶段取代度和反应效率降低。
2.4 高压均质预处理对阳离子淀粉偏光十字现象的影响
淀粉由结晶区和非结晶区组成,两者因密度及折射率存在差别而产生各向异性现象,从而形成偏光十字,该双折射现象强度取决于颗粒大小及结晶度和微晶取向[17]。

图3 高压均质预处理不同阶段制备的阳离子淀粉颗粒偏光显微镜图(×400)Fig. 3 PLM images of cationic starch at different stages of homogenization pretreatment (× 400)
由图3A可知,玉米淀粉颗粒偏光十字清晰完整,多数呈垂直交叉的正十字型,表明玉米淀粉多数近似球状晶体[18]。以玉米淀粉为原料制备的阳离子淀粉多数颗粒偏光十字较为清晰。而以高压均质预处理后玉米淀粉为原料制备的阳离子淀粉偏光十字结构明显破坏,尤其聚集阶段大颗粒淀粉偏光十字破坏最为严重。说明均质处理破坏了淀粉颗粒的晶体结构,故与以玉米淀粉为原料制备的阳离子淀粉相比,该阳离子淀粉取代度与反应效率增大(表1)[19]。
2.5 高压均质预处理对阳离子淀粉晶体结构的影响
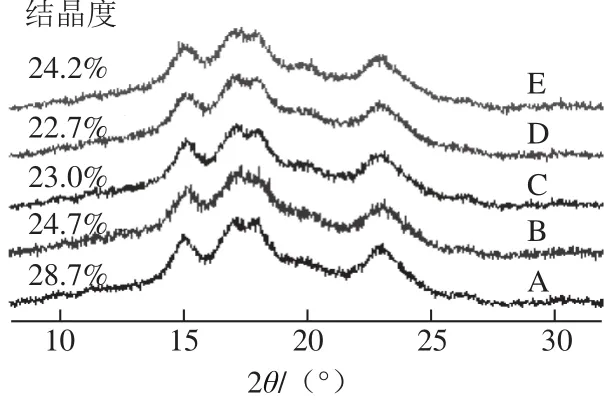
图4 高压均质预处理不同阶段制备的阳离子淀粉颗粒X射线衍射图Fig. 4 XRD patterns of cationic starch at different stages of homogenization pretreatment
玉米淀粉在15.3°、17.1°、18.2°、23.5°有明显的衍射峰,为典型的A型晶体结构[20]。由图4可知,与以玉米淀粉为原料制备的阳离子淀粉相比,经均质预处理后制备的阳离子淀粉晶型未发生改变,但当淀粉处于受力和聚集阶段时,制备的阳离子淀粉衍射峰强度减小,结晶度显著下降。受力阶段,结晶度由原来的24.7%下降至23.0%,聚集阶段结晶度继续下降至22.7%,说明淀粉晶体晶格有序化程度降低[21]。一方面,高压均质作用对晶体双螺旋结构产生了破坏作用(图3);另一方面,醚化反应引入季铵基团,破坏了原淀粉分子链的规整性,减弱了分子链间氢键作用,从而导致淀粉晶体结构破坏[22-23]。而团聚阶段因发生重结晶,结晶度又有所上升(24.2%),故导致化学活性相应下降。
2.6 高压均质预处理对阳离子淀粉糊化特性的影响

图5 高压均质预处理不同阶段制备的阳离子淀粉糊化特性Fig. 5 Pasting properties of cationic starch at different stages of homogenization pretreatment
RVA测定淀粉从吸水溶胀到颗粒结构破坏和淀粉分子浸出的过程。由图5可知,与玉米淀粉相比,阳离子淀粉糊化峰值温度下降,峰值黏度增大,尤其经均质预处理后制备的阳离子淀粉变化更为显著。其中当淀粉处于聚集阶段时,制备的阳离子淀粉糊化峰值温度最低(50.07 ℃),峰值黏度最高(7 234.33 mPa·s),其原因是淀粉发生醚化反应,结合了季铵基团带有正电荷,提高了淀粉颗粒与水分子间亲和力,导致淀粉易吸水膨胀,从而使糊化温度下降,峰值黏度上升[6,24],聚集阶段可显著促进淀粉糊化,且增大淀粉的增稠能力。而团聚阶段制备的阳离子淀粉糊化峰值温度又升高为51.57 ℃,峰值黏度下降为5 525 mPa·s,可见阳离子淀粉糊化特性与取代度相关。
回生值主要反映淀粉冷糊稳定性及老化趋势,其值越小,冷糊稳定性越好,淀粉越不易老化。由图5可看出,4 种阳离子淀粉回生值依次呈下降趋势,说明均质预处理有利于延缓淀粉老化[25]。
2.7 高压均质预处理对阳离子淀粉DSC曲线的影响
淀粉颗粒受热吸水膨胀,分子间和分子内氢键断裂,淀粉分子扩散,因此呈现吸热峰。糊化焓为糊化过程解开双螺旋所需的能量,热焓值越大,表示淀粉颗粒结构越紧密,越难糊化[26]。
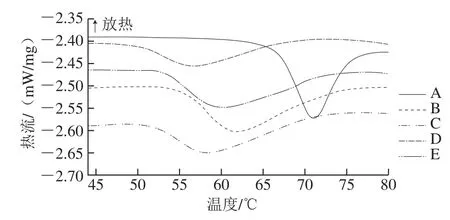
图6 高压均质预处理不同阶段制备的阳离子淀粉DSC曲线Fig. 6 DSC curves of cationic starch at different stages of homogenization pretreatment
由图6可知,与玉米淀粉相比,阳离子淀粉糊化峰左移,峰值面积明显减小,说明糊化温度、糊化焓显著降低,分别由71.0 ℃下降为61.8 ℃,10.80 J/g下降为6.23 J/g;该现象表明阳离子淀粉因发生醚化反应提高了淀粉颗粒与水分子间的亲和力,使淀粉易糊化。与未经均质处理制备的阳离子淀粉相比,聚集阶段制备的阳离子淀粉糊化温度由61.8 ℃下降为56.6 ℃,糊化焓也由6.23 J/g下降至3.22 J/g,而团聚阶段糊化温度和焓变又分别升高为58.8 ℃、5.52 J/g。可见阳离子淀粉取代度越高,淀粉越易糊化。
2.8 高压均质预处理对阳离子淀粉透光率的影响
由图7可知,与未经均质处理制备的阳离子淀粉相比,高压均质预处理后制备的阳离子淀粉糊透光率增大。其原因是经高压均质处理后,淀粉颗粒与醚化剂更易反应,淀粉带的正电荷增多,促进淀粉链在糊液中充分分散、伸展,淀粉团粒残余量减少,从而使淀粉糊液折光、反光作用减弱,故透光率增大[27],聚集阶段透光率达最高,为90.14%。而在团聚阶段时,破坏的晶体结构与无定形区作用,醚化反应减弱,季铵基团减少,透光率又有所下降(87.69%)。
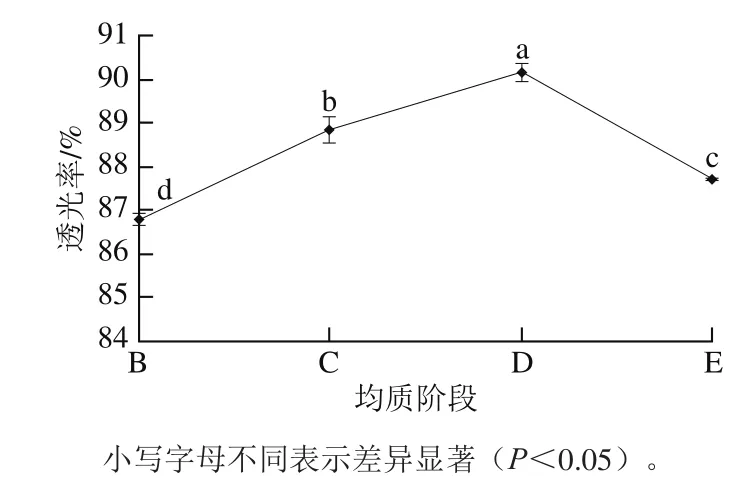
图7 高压均质预处理不同阶段制备的阳离子淀粉透光率的变化Fig. 7 Light transmittance of cationic starch at different stages of homogenization pretreatment
2.9 高压均质预处理对阳离子淀粉热重的影响

图8 高压均质预处理不同阶段制备的阳离子淀粉的TGA曲线Fig. 8 TGA curves of cationic starch at different stages of homogenization pretreatment
由图8可看出,玉米淀粉TGA曲线有3 个质量损失阶段,分别为:60~150、280~350、350~500 ℃。其中60~150 ℃阶段因挥发性组分、吸附水及结晶水析出导致质量略有下降[28];而280~350 ℃阶段质量损失明显,主要是由淀粉分子链的断裂以及葡萄糖单元的热分解所致[29]。而第3阶段质量损失则源于淀粉自身的热分解,为碳化阶段[29-30]。由280~350 ℃阶段可看出:与玉米淀粉相比,阳离子淀粉热降解温度下降;其原因可能是淀粉的阳离子化使淀粉分子间及分子内部氢键结构破坏,导致结合力下降,从而使阳离子淀粉更易热降解[31]。
另外,当温度处于350~500 ℃时,聚集阶段质量残余率最低,即该阶段淀粉质量损失量最大,可见取代度越大,淀粉结构最疏松,稳定性越差。
2.10 高压均质预处理阳离子淀粉傅里叶变换红外光谱结果
由图9可以看出,玉米淀粉特征吸收峰波数为:3 361、2 932、1 643 cm-1,分别为O—H的缔合伸缩特征峰、CH2中C—H的不对称伸缩特征峰、与仲醇羟基相连接的C—OH的伸缩振动特征峰[2,31]。因高压均质物理机械力促进醚化剂与淀粉中的—OH发生醚化反应,导致3 361、2 932 cm-1波数段吸收峰强度发生变化[6]。另外,阳离子玉米淀粉在波数为2 110 cm-1处出现了新的吸收峰,其为阳离子试剂季铵基团上NH+的特征吸收峰[31],同时在1 566~1 643 cm-1波数间吸收峰的改变也与N+(CH3)3基团的引入有关[32],可见淀粉已进行醚化反应形成了阳离子淀粉。
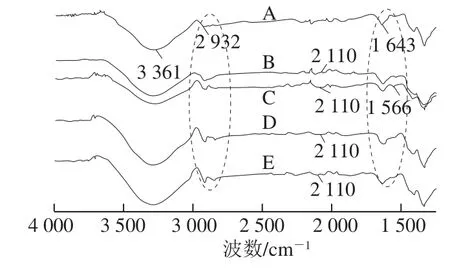
图9 高压均质预处理不同阶段制备的阳离子淀粉的傅里叶变换红外光谱Fig. 9 FT-IR spectra of cationic starch at different stages of homogenization pretreatment
3 结 论
高压均质预处理产生的机械力作用可破坏淀粉晶体结构,提高了淀粉的化学活性,导致其与醚化剂反应效率增大。与未经均质处理制备的阳离子淀粉相比,高压均质预处理后制备的阳离子淀粉透光率、峰值黏度增大,糊化温度、回生值降低,其中聚集阶段因醚化反应最剧烈导致阳离子淀粉性质变化最为显著,而团聚阶段淀粉因发生重结晶使各性质变化减弱。
参考文献:
[1] 张燕萍. 变性淀粉制造与应用[M]. 2版, 北京: 化学工业出版社,2007: 114-124.
[2] CHANG Y J, CHOI H W, KIM H S, et al. Physicochemical properties of granular and non-granular cationic starches prepared under ultra high pressure[J]. Carbohydrate Polymers, 2014, 99(1): 385-393.DOI:10.1016/j.carbpol.2013.09.010.
[3] SARANU S, SELVE S, KAISER U, et al. Effect of large mechanical stress on the magnetic properties of embedded Fe nanoparticles[J].Beilstein Journal of Nanotechnology, 2011, 2(1): 268-275.DOI:10.3762/bjnano.2.31.
[4] KASEMWONG K, RUKTANONCHAI U R, SRINUANCHAI W, et al.Effect of high-pressure microfluidization on the structure of cassava starch granule[J]. Starch/Stärke, 2011, 63(3): 160-170. DOI:10.1002/star.201000123.
[5] 涂宗财, 余莉, 尹月斌, 等. 动态高压微射流对马铃薯直链淀粉性质和结构的影响[J]. 食品与发酵工业, 2014, 40(3): 46-51.
[6] 王丽, 秦利娟, 宋贤良, 等. 不同压力预处理对小麦醋酸酯淀粉制备的影响及产物结构表征[J]. 食品工业科技, 2016, 37(4): 128-131.
[7] 孟爽, 马莺, 刘天一. 应用高压均质技术制备玉米淀粉-硬脂酸复合物[J]. 哈尔滨工业大学学报, 2015, 47(4): 52-57.
[8] 张慧, 侯汉学, 董海洲, 等. 超声预处理对湿法阳离子淀粉性质的影响[J]. 食品与发酵工业, 2015, 41(4): 68-72. DOI:10.13995/j.cnki.11-1802/ts.201504013.
[9] MOURYA V, INAMDAR N N. Chitosan-modifications and applications: opportunities galore[J]. Reactive and Functional Polymers, 2008, 68(6): 1013-1051. DOI:10.1016/j.reactfunctpolym.2008.03.002.
[10] 陈佩. 不同链/支比玉米淀粉的形态及其在有/无剪切力下糊化的研究[D]. 广州: 华南理工大学, 2010: 79-80.
[11] WARREN F J, GIDLEY M J, FLANAGAN B M. Infrared spectroscopy as a tool to characterise starch ordered structure: a joint FTIR-ATR, NMR, XRD and DSC study[J]. Carbohydrate Polymers,2016, 139: 35-42. DOI:10.1016/j.carbpol.2015.11.066.
[12] WANG S Q, WANG L L, FAN W H, et al. Morphological analysis of common edible starch granules by scanning electron microscopy[J].Food Science, 2011, 32(15): 74-79.
[13] WANG C, HE X W, FU X, et al. High-speed shear effect on properties and octenylsuccinic anhydride modification of corn starch[J]. Food Hydrocolloids, 2015, 44(4): 32-39. DOI:10.1016/j.foodhyd.2014.09.007.
[14] SUKHIJA S, SINGH S, RIAR C S. Physicochemical, crystalline,morphological, pasting and thermal properties of modified lotus rhizome (Nelumbo nucifera) starch[J]. Food Hydrocolloids, 2016, 60:50-58. DOI:10.1016/j. Foodhyd.2016.03.013.
[15] PINTO V Z, VANIER N L, DEON V G, et al. Effects of single and dual physical modifications on pinhão starch[J]. Food Chemistry,2015, 187: 98-105. DOI:10.1016/j.foodchem.2015.04.037
[16] 刘斌, 张媛, 冯涛, 等. 混合液态载体对高压射流均质玉米淀粉颗粒微细化的影响[J]. 食品科学, 2013, 34(17): 78-81. DOI:10.7506/spkx1002-6630-201317018.
[17] 张斌, 罗发兴, 黄强, 等. 不同直链含量玉米淀粉结晶结构及其消化性研究[J]. 食品与发酵工业, 2010, 36(8): 26-30.
[18] ARRÁIZ H, BARBARIN N, PASTUREL M, et al. Starch granules identification and automatic classification based on an extended set of morphometric and optical measurements[J]. Journal of Archaeological Science: Reports, 2016, 7: 169-179. DOI:10.1016/j.jasrep.2016.03.039.
[19] 周海宇, 任瑞林, 包亚莉, 等. 高静压酯化木薯淀粉结构及其理化性质的研究[J]. 现代食品科技, 2016, 32(2): 107-112.
[20] BIAN L L, CHUNG H J. Molecular structure and physicochemical properties of starch isolated from hydrothermally treated brown rice flour[J]. Food Hydrocolloids, 2016, 60: 345-352. DOI:10.1016/j.foodhyd.2016.04.008.
[21] 蒲华寅. 等离子体作用对淀粉结构及性质影响的研究[D]. 广州: 华南理工大学, 2013: 30-46.
[22] 韩斐. 醋酸酯玉米淀粉的制备、表征及性能研究[D]. 兰州: 兰州大学, 2013: 43-45.
[23] ZHANG B, NI B, LU S, et al. Synthesis and characterization of a novel potato starch derivative with cationic acetylcholine groups[J].International Journal of Biological Macromolecules, 2012, 50(3): 701-706. DOI:10.1016/j.ijbiomac.2011.12.031.
[24] 宁芯, 程学勋, 赵思明, 等. 微波对大米淀粉物化特性的影响[J]. 华中农业大学学报, 2009, 28(3): 369-372.
[25] 蔡旭冉, 顾正彪, 洪雁, 等. 瓜尔胶和黄原胶对马铃薯淀粉及其变性淀粉糊化和流变性质的影响[J]. 食品科学, 2011, 32(17): 22-26.
[26] 隋学斌. 低温糊化淀粉胶粘剂的制备及其理化性能的研究[D]. 北京: 北京化工大学, 2011: 18-34.
[27] SU Y T, DU H Y, HUO Y Q, et al. Characterization of cationic starch flocculants synthesized by dry process with ball milling activating method[J]. International Journal of Biological Macromolecules, 2016,87: 34-40. DOI:10.1016/j.ijbiomac.2015.11.093.
[28] 石海信, 方丽萍, 王爱荣, 等. 微波辐射下木薯淀粉结构与性质的变化[J]. 食品科学, 2015, 36(3): 68-74. DOI:10.7506/spkx1002-6630-201503013.
[29] SZYMONSKA J, MOLENDA M, WIECZOREK J. Study of quantitative interactions of potato and corn starch granules with ions in diluted solutions of heavy metal salts[J]. Carbohydrate Polymers,2015, 134: 102-109. DOI:10.1016/j.carbpol.2015.07.041.
[30] 游力军. 阳离子淀粉/壳聚糖交联共混絮凝剂(CATCS)的制备与应用研究[D]. 武汉: 华中农业大学, 2010: 23-24.
[31] 刘进. 阳离子蜡质玉米淀粉的制备及其在新闻纸废纸浆中的应用研究[D]. 广州: 华南理工大学, 2015: 40-43.
[32] 施建平, 张宏伟, 唐爱民, 等. 丙烯酰胺改性阳离子淀粉制备及对纸张增强作用研究[J]. 造纸科学与技术, 2007, 26(6): 94-97.
