宫颈癌组织中miRNA-125a、STAT3、IL-10的表达变化及意义
2018-05-25李秀福贾世峰耿彤瑶王新月张琪马冬李鸥
李秀福,贾世峰,耿彤瑶,王新月,张琪,马冬,李鸥
(1华北理工大学研究生学院,河北唐山063000;2华北理工大学附属医院;3唐山工人医院)
宫颈癌是导致全世界妇女癌症相关死亡的第4大原因[1]。目前研究表明,高危型人乳头瘤病毒(HR-HPV)的持续感染是其发生、发展的必要因素[2,3]。然而,宫颈局部免疫平衡状态的改变在HR-HPV感染转归中具有重要作用。而白细胞介素10(IL-10)作为一种具有免疫抑制作用的细胞因子对宫颈癌变的发生、发展具有重要作用,当其在人体内大量合成可抑制免疫系统的调控,引起HPV病毒入侵,导致宫颈癌的发生。IL-10作为TH2型细胞因子,其表达调控主要发生在转录水平[4]。尽管最新研究表明,miR-125a靶向调控信号转导及转录活化因子3(STAT3)在宫颈癌细胞中发挥抑制增殖、侵袭与转移作用[5],但是在免疫平衡调节中作用的研究未见报道。本文进行了相关探讨。
1 资料与方法
1.1 临床资料 收集2015年9月~2017年3月唐山工人医院住院部就诊的宫颈鳞癌患者(接受根治性子宫切除及盆腔淋巴结切除术)的术中切除病理标本56例份(宫颈癌组),纳入标准:临床资料完整;病理明确诊断为宫颈鳞癌;术前未接受过放、化疗。排除标准:术前3个月内曾行宫颈治疗,如阴道用药、激光治疗等;患者为妊娠状态;合并其他妇科恶性肿瘤,如子宫内膜癌、卵巢癌等;合并其他脏器肿瘤,如肠道、乳腺肿瘤等。其中患者年龄40~69(55.27±6.18)岁,病程1~3(2.12±0.28)年;按宫颈癌国际妇产科联盟(FIGO)(2000年)临床分期标准进行临床分期[6]:Ⅰ期34例,Ⅱ期22例;组织分化程度:高、中分化37例,低分化19例;有淋巴转移11例,无淋巴结转移45例;肿瘤直径>40 mm者15例,≤40 mm者41例。另选同期行全子宫切除术的子宫良性病变患者术中切除病理标本40例份作为对照组,患者年龄40~65(52.76±5.32)岁,病程1~4(2.78±0.62)年。两组年龄有可比性。对照组纳入标准:因子宫良性病变而行全子宫切除术者,如子宫肌瘤、子宫腺肌症等;宫颈薄层液基细胞学检查未见非典型鳞状细胞或癌细胞。排除标准同宫颈癌组。取组织标本前均未行放、化疗或免疫治疗。标本收集后于-80 ℃冰箱保存。所有患者知情同意,本研究经医院伦理委员会批准。
1.2 宫颈组织中miR-125a、STAT3、IL-10 mRNA表达的检测 参照文献[7,8]方法采用RT-qPCR法检测miR-125a mRNA,qRT-PCR法检测STAT3 mRNA和IL-10 mRNA。将液氮保存的宫颈组织按TRIzol试剂盒说明书提取组织总RNA,以RNA为模板,采用反转录试剂盒(Invitrogen)进行反转录。反转录条件:16 ℃、30 min,42 ℃、30 min,75 ℃、15 min。miR-125a的茎环结构;5′-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACTCACA-3′;反转录结束后进行PCR扩增。PCR反应体系按试剂盒说明配制。具体引物序列:miR-125a-F:5′-ACACTCCAGCTGGGTCCCTGAGACCCTTTAA-3′;miR-125a-R:5′-CTCAACTGGTGTCGTGGAGT-3′;STAT3-F:5′-AAGAGGCGGCAACAGATT-3′;STAT3-R:5′-CGGTCTTGATGCCGAGGG-3′;IL-10-F: 5′-ACAAAG-GAAGGAGGGGTTCAC-3′;IL-10-R:5′-AGAAGTGGA-CTCAGCATGGG-3′;U6-F:5′-GAGAGGGAAATCGTGCGTGAC-3′;U6-R:5′-GAGAGGGAAATCGTGCGT-GAC-3′;GAPDH-F:5′-GAAAGCCTGCCGGTGACTA-A-3′;GAPDH-R: 5′-AGGAAAAGCATCACCCGGAG-3′。 miR-125a、STAT3和IL-10 mRNA三者PCR扩增的反应条件为:95 ℃、2 min,95 ℃、15 s,72 ℃、35 s共40个循环,记录循环阈值(Ct),采用2-ΔΔCt法计算miR-125a、STAT3和IL-10 mRNA的相对表达量。每组实验重复3次,比较两种标本miR-125a mRNA、STAT3 mRNA、IL-10 mRNA相对表达量。miR-125a mRNA以U6为内参基因,STAT3 mRNA、IL-10 mRNA以GAPDH为内参基因。
1.3 宫颈组织中STAT3和IL-10蛋白表达的检测 采用免疫组织化学Elivision二步法。按照试剂盒操作说明书进行操作。一抗抗体分别采用鼠抗人STAT3(Proteinch,1∶100比例稀释)、鼠抗人IL-10(Proteinch,1∶80比例稀释),二抗采用通用型HRP标记兔抗鼠抗体,DAB显色。阴性对照组中,以PBS液代替一抗。染色结果判定:STAT蛋白以细胞质内出现明显的黄色或棕黄色颗粒为阳性着色,少数位于细胞核;IL-10染色为棕黄色或褐色颗粒,多数位于细胞质。参照Mattern等[9]的方法进行判定。阳性染色深度:未见染色为0分,轻度染色(浅黄色)为1分,中度染色(棕黄色)为2分,深度染色(棕褐色)为3分;阳性细胞百分比:未见染色为0分,染色细胞小于25%为1分,25%~50%为2分,>50%为3分。两方面得分相加,0~2分判为阴性表达,>2分判为阳性表达,随机选择10个高倍视野(×50倍),计数1 000个细胞,取均值。
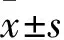
2 结果
2.1 宫颈组织中miR-125a、STAT3和IL-10 mRNA的表达 宫颈癌组、对照组中miR-125a mRNA相对表达量分别为4.20±0.79、11.02±3.20,与对照组比较,宫颈癌组miR-125a mRNA相对表达量降低(P<0.05);宫颈癌组、对照组中STAT3 mRNA相对表达量分别为5.21±1.70、1.00±0.34;IL-10 mRNA相对表达量分别为5.82±1.34、0.81±0.56;与对照组相比,宫颈癌组STAT3和IL-10 mRNA的相对表达量均升高(P均<0.05)。
2.2 宫颈组织中STAT3和IL-10蛋白的表达 STAT3蛋白阳性信号呈棕黄色或棕褐色颗粒状,弥漫或局灶性分布于肿瘤细胞质及核周,而肿瘤间质组织未见STAT3蛋白阳性染色。IL-10染色为棕黄色或褐色颗粒,多数位于细胞质,少数位于细胞核。与对照组相比,宫颈癌组STAT3表达强,宫颈癌组中STAT3阳性表达率高[69.7%(39/56)比22.5%(9/40)](χ2=20.74,P<0.01);与对照组相比,宫颈癌组IL-10阳性表达率高[(58.9%(33/56)比7.5%(3/40)](χ2=27.12,P<0.01)。
2.3 宫颈癌组织miR-125a及STAT3 mRNA的相对表达量与患者临床病理特征的关系 宫颈癌组miR-125a mRNA的表达水平与宫颈癌的组织分化程度、FIGO分期、淋巴结转移有关(P均<0.05),与年龄、肿瘤大小无关(P均>0.05);宫颈癌组STAT3 mRNA的相对表达量与组织分化程度、淋巴结转移有关(P均<0.05),与年龄、肿瘤大小、FIGO分期无关(P均>0.05)。见表1。

表1 宫颈癌组织miR-125a和STAT3 mRNA表达与宫颈癌患者临床病理特征的关系
2.4 宫颈癌组织中miR-125a mRNA与STAT3、IL-10 mRNA表达的相关性 Pearson相关分析结果显示,宫颈癌组中,STAT3 mRNA和miR-125a mRNA的相对表达量呈负相关(r=-0.285 4,P=0.024 5);IL-10和STAT3的mRNA相对表达量呈正相关(r=0.457 8,P=0.000 4)。
3 讨论
宫颈癌是女性生殖系统最常见恶性肿瘤[10]。迄今为止,每年有529 800个新增病例,死亡病例275 100个,且多发生于发展中国家[11]。临床治疗手段包括手术、放疗及化疗,后两种治疗手段会对机体免疫系统产生持久而显著的影响。目前,宫颈癌的免疫治疗逐渐成为研究的热点。前期研究表明,宫颈局部免疫状态的改变在宫颈癌发生发展中具有重要作用[12]。IL-10是一种具有免疫抑制作用的因子,通过多种途径抑制机体免疫系统对肿瘤的杀伤作用,造成HR-HPV的持续感染进而促进宫颈癌细胞的增殖、侵袭与转移[13]。IL-10基因的表达主要是通过启动子区一系列转录因子的结合进行调控,例如STAT3[14],STAT3是STATS家族重要成员之一,在对照组织中多数呈低表达水平,而在多种恶性肿瘤中往往呈持续性高表达。研究表明,STAT3的高表达能够促进肿瘤的发生发展,如肝癌[15]、胃癌[16]。本研究结果显示,与对照组相比,STAT3 mRNA和蛋白在宫颈癌组中均呈高表达,且随着宫颈癌分化程度降低及淋巴结转移,STAT3的表达进一步提高。相关性分析结果显示,STAT3和IL-10的mRNA表达水平呈正相关,且免疫组织化学染色结果显示,宫颈癌组STAT3及IL-10的蛋白表达水平均高于对照组,提示STAT3可能通过调控IL-10的表达,从而使宫颈局部免疫状态失衡,造成HR-HPV持续感染,促进宫颈癌的发生与发展,但两者具体调控机制尚未明确。
通过在线预测软件TARGETSCAN发现,STAT3与miR-125a存在结合位点。众所周知,miRNAs需通过相应的靶向基因才能发挥多种生物学过程,包括肿瘤的发生与发展。miR-125a位于染色体19q13上,在不同病理类型肿瘤中具有促癌和抑癌作用[17],在不同肿瘤中表达程度亦不相同,有可能成为治疗恶性肿瘤的新靶点或肿瘤标记物[18]。Zheng等[19]发现,miR-125a在肝癌中低表达,可作为其发展进程的标志物,在肝癌病程进展中起到监测作用。本研究结果显示,与对照组相比,宫颈癌组miR-125a的相对表达量下降,与文献[5]报道一致,且随着肿瘤向晚期进展、分化程度降低及淋巴结转移,miR-125a的相对表达量进一步降低,与患者的年龄及肿瘤大小无明显相关性。进一步研究显示,在宫颈癌组中,STAT3和miR-125a的表达水平呈负相关,提示miR-125a与STAT3可能存在靶向调节关系,宫颈癌中miR-125a、STAT3和IL-10之间相互作用,形成免疫逃逸,促进宫颈癌的进展,但三者具体调控机制尚不清楚。
综上所述,随着宫颈癌恶性程度的进展,miR-125a表达水平降低,可使STAT3的表达上调,并进一步提高IL-10的表达水平,造成免疫逃逸,使HR-HPV持续感染,促进宫颈癌的发生与发展,本研究为治疗宫颈癌提供了新靶点。
参考文献:
[1] Appleby P, Beral V, Berringtond GA, et al. Cervical cancer and hormonal contraceptives: collaborative reanalysis of individual data for 16,573 women with cervical cancer and 35,509 women without cervical cancer from 24 epidemiological studies[J]. Lancet, 2007,370(9599):1609-1621.
[2] Hu Z, Zhu D, Wang W, et al. Genome-wide profiling of HPV integration in cervical cancer identifies clustered genomic hot spots and a potential microhomology-mediated integration mechanism[J]. Nat Genet, 2015,47(2):158-163.
[3] Kjaer SK. Epidemiologic Classification of human papillomavirus types associated with cervical cancer-NEJM[J]. N Engl J Med, 2003,348(6):518-527.
[4] 胡嫚,石琨.IL-10在宫颈癌发生发展中作用的研究进展[J].肿瘤学杂志,2013,19(11):893-896.
[5] Fan Z, Cui H, Xu X, et al. MiR-125a suppresses tumor growth, invasion and metastasis in cervical cancer by targeting STAT3[J]. Oncotarget, 2015,6(28):25266-25280.
[6] 李双,李雄,张媛,等.宫颈癌的手术-病理分期和评分系统的建立和验证[J].现代妇产科进展,2016,25(11):801-807.
[7] 徐新伟,李佩瑞,张增山,等.miR-125a-5p通过靶向调控GAB2抑制乳腺癌细胞的迁移能力[J].中国生物化学与分子生物学报,2017,33(9):925-930.
[8] 杨朝晖,章辉,顾华敏,等.宫颈癌组织中miR-21和Stat3的表达及相关性研究[J].浙江医学,2017,39(2):93-96.
[9] Mattern J, Koomägi R, Volm M. Association of vascular endothelial growth factor expression with intratumoral microvessel density and tumour cell proliferation in human epidermoid lung carcinoma[J]. Br J Cancer, 1996,73(7):931-934.
[10] Kim S, Cho SW, Min HS, et al. The expression of tumor-associated macrophages in papillary thyroid carcinoma[J]. Endocrinol Metab, 2013,28(3):192-198.
[11] Ferlay J, Shin HR, Bray F, et al. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008[J]. Cancer, 2010,127(12):2893-2917.
[12] 薛旻,俞文菊,朱凯.宫颈癌及癌前病变中IL-10表达和HPV感染的相关性研究[J].中华肿瘤防治杂志,2011,18(9):701-703.
[13] Ali KS, Ali HY, Jubrael JM. Concentration levels of IL-10 and TNFα cytokines in patients with human papilloma virus (HPV) DNA and DNA-cervical lesions[J]. Immunotoxicol, 2012,9(2):168-172.
[14] Cai QW, Li J, Li XQ, et al. Expression of STAT3, MMP-1 and TIMP-1 in gastric cancer and correlation with pathological features[J]. Mol Med Rep, 2012,5(6):1438-1442.
[15] Sonnenblick A, Shriki A, Galun E, et al. Tissue microarray-based study of patients with lymph node-positive breast cancer shows tyrosine phosphorylation of signal transducer and activator of transcription 3 (tyrosine705-STAT3) is a marker of good prognosis[J]. Clin Transl Oncol, 2012,14(3):232-236.
[16] 张竹青,卢书明,陈美如,等.胃癌中STAT3、p-STAT3和Bcl-x的表达及临床意义[J].肿瘤防治研究,2014,41(5):430-433.
[17] 范忠义,焦顺昌.Mir-125a与相关疾病关系的研究进展[J].解放军医学院学报,2015,36(11):1152-1155.
[18] Min W, Wang B, Li J, et al. The expression and significance of five types of miRNAs in breast cancer[J]. Med Sci Monit Basic Res, 2014,20(21):97-104.
[19] Zheng J, Zhou Z, Xu Z, et al. Serum microRNA-125a-5p, a useful biomarker in liver diseases, correlates with disease progression[J]. Mol Med Rep, 2015,12(1):1584-1590.
