磁性Fen+@GO非均相Fenton催化氧化亚甲基蓝
2018-05-25杨远秀刘建新唐源胜
杨远秀,姚 创*,刘 晖,刘建新,黄 弦,唐源胜
磁性Fe+@GO非均相Fenton催化氧化亚甲基蓝
杨远秀1,姚 创1*,刘 晖2,刘建新1,黄 弦1,唐源胜1
(1.广东省工程技术研究所,广东 广州 510440;2.仲恺农业工程学院环境科学与工程系,广东 广州 510225)
采用化学共沉淀法制备了磁性Fen+@GO(MFGO)纳米复合材料,并将其用于非均相Fenton催化氧化亚甲基蓝(MB).扫描电镜、透射电镜和光电子能谱分析表明,催化活性粒子(Fen+/铁氧化物)成功负载在GO表面.实验研究了pH值、H2O2初始浓度、催化剂投加量等因素对MB降解效果的影响.结果表明,H2O2、MFGO和H2O2+MFGO体系在反应120min后,MB降解率分别达到7.83%、25.58%和99.19%;在优化条件为H2O2浓度0.79mol/L、MFGO用量0.75g/L、pH值8时,MB降解率可达99.90%;在pH值为3~11范围内,MB降解率均在99%以上;MFGO经过6次重复使用后对MB的降解率仍可达到95.08%,是一种pH值响应宽、可磁分离回收的新型非均相催化剂.
Fe+;石墨烯;磁分离;非均相Fenton;亚甲基蓝
随着科技的发展,工业上生产出的染料(特别是偶氮染料)越来越稳定,对氧化剂具有化学惰性,不易氧化降解[1].亚甲基蓝(MB)是一种极具代表性的水溶性偶氮染料,因其芳香结构不易被破坏,在水溶液中容易形成一价阳离子型的季胺盐离子基团,其废水色度高且难以生物降解,采用传统的水处理方法很难彻底处理[2].
高级氧化技术(AOPs)是去除难降解有毒有害物质的有效方法,其中研究最深入的是Fenton反应.有研究表明Fenton反应产生的羟基自由基氧化对偶氮染料具有良好的矿化效果[3-4].但是Fenton氧化存在以下局限:适用pH值范围窄、Fe2+投加量大且处理后废水色度增大、Fe2+流失严重、催化剂回收困难及容易造成二次污染[5-6].
非均相Fenton试剂具有较高催化H2O2活性、较低铁损失、更加宽广的pH值适用范围、良好的稳定性等特点,克服了均相Fenton试剂存在的缺点[7];但是非均相Fenton催化剂存在粒径小,分离难和回收率低的缺陷,限制了其广泛应用[8].
非均相Fenton反应是催化剂表面吸附有机物及其表面铁活性组分催化H2O2分解产生羟基自由基氧化有机物的过程[9-10].新型二维碳材料石墨烯,除了具有高比表面积,物理化学结构稳定性外,还具有良好的吸附性能和优异的电学特性[11].有研究发现石墨烯可以作为染料吸附和电荷传输的平台,不仅能起到重要的吸附作用,还能有效地抑制电荷复合,从而产生更高的吸附效果[12].若能将亚铁离子等活性组分负载在石墨烯上,使其具有良好的催化氧化性能;加之其磁特性易于分离,具有良好的应用前景.本研究制备了负载铁活性组分(Fe+)的磁性氧化石墨烯(MFGO),并作为一种非均相催化剂去除偶氮染料MB,在常温下考察了初始pH值,H2O2浓度,催化剂用量等因素对MB氧化降解效果的影响.
1 材料与方法
1.1 试剂与仪器
试剂:亚甲基蓝(C16H18ClN3S·3H2O,分子量:373.90g/mol),石墨粉(粒径£30μm,天津恒新化学试剂有限公司),过氧化氢(H2O2,30%),六水合氯化铁(FeCl3·6H2O),七水合硫酸亚铁(FeSO4·7H2O),盐酸(37%),硫酸(98%),氢氧化钠,以上试剂均为分析纯.实验用水为超纯水.
仪器:PHS-3C型pH计,电热鼓风干燥箱, UV-1780型紫外可见分光光度计,超声波细胞粉碎机,真空恒温反应器,SHA-B数显恒温气浴振荡器.
1.2 材料的制备和表征
1.2.1 MFGO的制备 采用改进的Hummers法[13-14]将石墨氧化后超声剥离得到氧化石墨烯水溶液(GO).在室温下,准确称取质量比为1:2的FeCl3·6H2O和FeSO4·7H2O,分别溶解于100mL去氧超纯水中,将得到的铁离子和亚铁离子混合溶液加入500mL上述的氧化石墨烯溶液中,在温度为85℃水浴锅中快速搅拌2~5min,然后迅速加入90mL NaOH溶液(100g/L)调节pH值至10左右,继续搅拌45min,将得到的混合液冷却沉淀,分离出沉淀物并洗涤至中性,得到负载铁活性组分(Fe+)的磁性氧化石墨烯悬液(磁性Fe+@GO),简称为MFGO.
1.2.2 MFGO的表征 采用扫描电镜(SEM, S4800Hitachi,JEO,Ltd.,日本)和场发射透射电镜(HRTEM,Tecnai-G2-F20,FEI,Ltd.,美国)观察样品表面形态特征;采用X射线光电子能谱(XPS, Thermo ESCALAB 250Xi,美国)分析样品表面元素组成和化学价态.
1.3 催化降解实验
配制一定浓度的亚甲基蓝溶液100mL于250mL锥形瓶中.降解反应开始前,先将一定量的催化剂(MFGO)加入至亚甲基蓝溶液中.该反应液在室温(298K)避光下,恒温振荡过夜,保持振荡速度为160rpm,使其达到吸附饱和.然后加入一定量的H2O2,作为催化反应的起点,在一定时间间隔内,取4mL反应液,立即用0.45μm滤膜过滤,滤液稀释至一定倍数后,利用紫外-可见吸收光光度计在MB最大吸收波长665nm处测定其吸光度.实验过程中用0.1~1mol/L NaOH或HCl(可忽略体积)调节体系pH值至相应值.每组样品设3个平行,取其平均值分析.
1.4 数据处理
实验数据通过SPSS19.0进行数据分析,利用Origin 8.5进行绘图.根据MB标准曲线换算为浓度值,并按式1计算其降解率.
降解率=(0– C)/0×100% (1)
式中:0为MB初始浓度,mg/L; C为取样测定时的染料浓度,mg/L.
2 结果与讨论
2.1 MFGO的表征
MFGO的扫描电镜(SEM)图(图1a)显示,MFGO表面有明显的褶皱,这是由于氧化石墨烯经超声剥离后,加入NaOH将石墨烯表面含氧官能团还原而形成的.这些褶皱结构能够增大材料的比表面积,增强吸附容量,提高吸附性能,并且有利于磁性催化活性颗粒负载在表面上[15],增强催化性能.图1b显示,纳米铁粒子受地磁力,小粒子间的静磁力及表面张力共同作用发生了不同程度的团聚.团聚粒子表面凹凸性较为明显,增大比表面积,提高表面催化活性位点.
图1c的场发射透射电镜(HRTEM)图表明,磁性催化活性组分(Fe+/铁氧化物)已成功地负载到氧化石墨烯(GO)表面,负载效果良好,催化活性成分不易剥落,这从侧面解释了催化剂具有较强催化活性的原因.同时,由于氧化石墨烯可以充当分散剂的作用,故铁催化活性粒子的分布相对均匀,这与Yang等[16]的研究结果相似.由图还可以清晰地看见片状半透明的MFGO,这说明GO层数较少.由于氧化还原后的GO片层中间的羧基量少于边缘羧基数量,从而导致GO边缘和褶皱上观察到的磁性活性粒子比基面上多;表面的磁性活性组分粒子增多,羧基数量减少,说明MFGO水热稳定性较好[17].
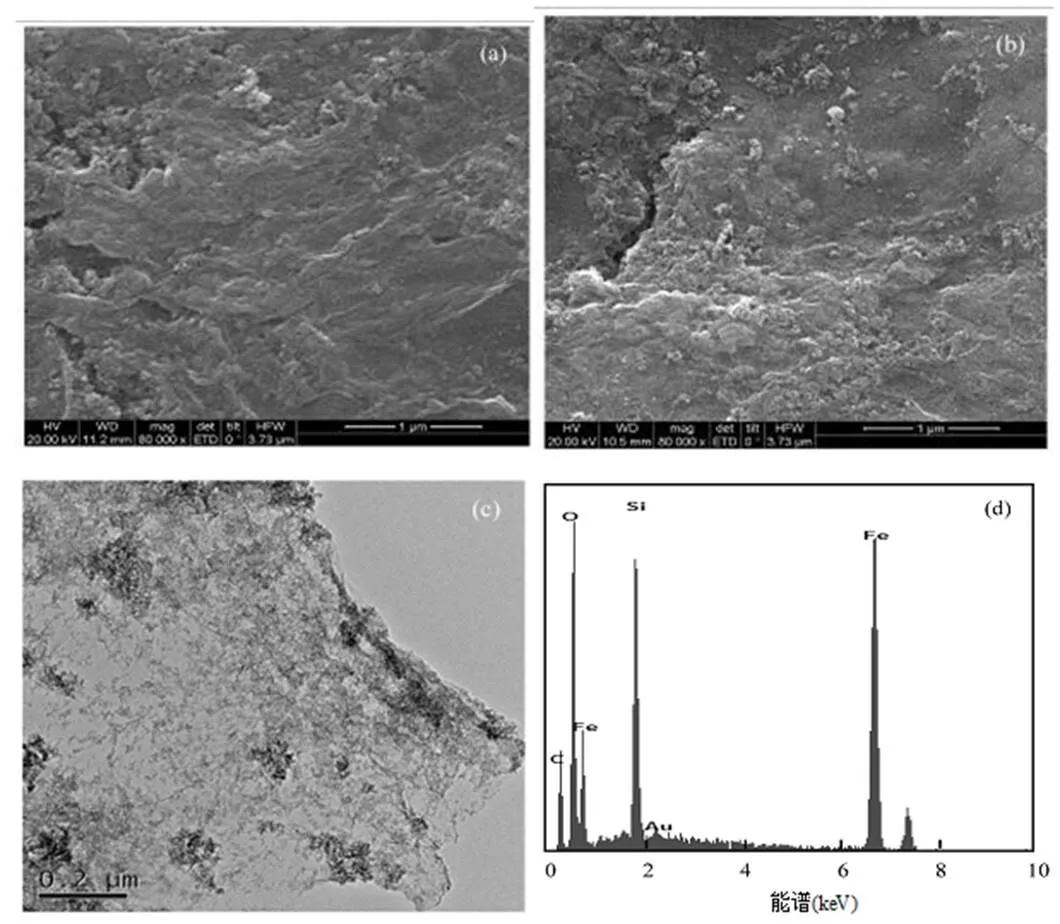
图1 MFGO扫描电镜,场发射透射电镜和能谱图
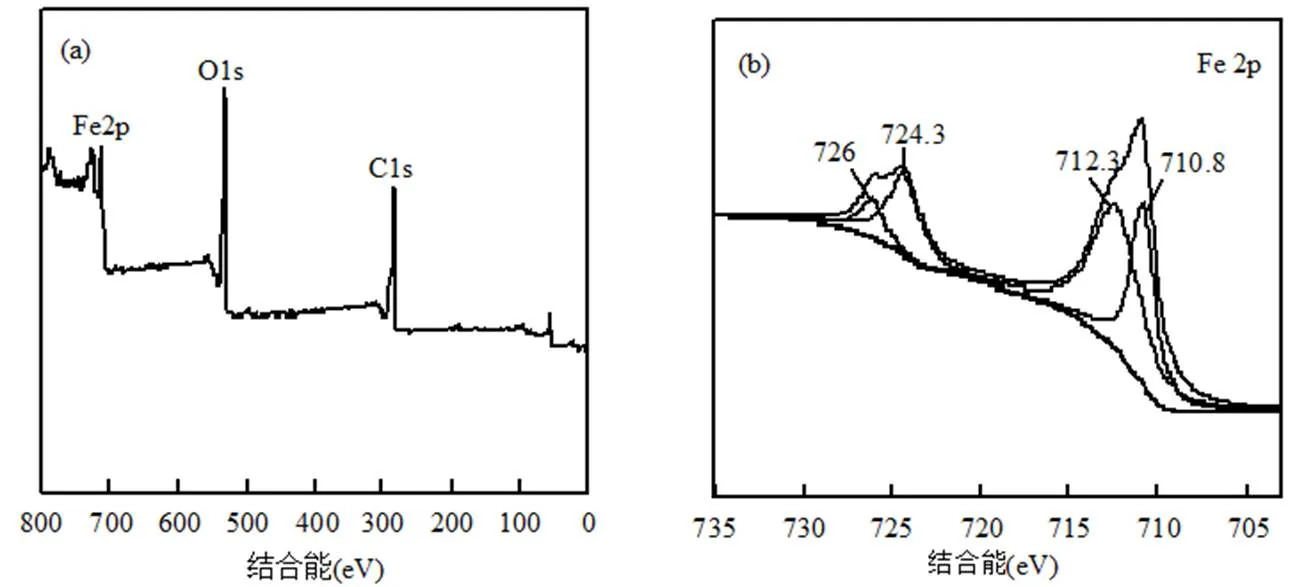
图2 MFGO光电子能谱图
能谱(EDS)图(图1d)表征显示,MFGO主要由C,O和Fe元素构成,C来自石墨烯,O来自石墨烯和铁氧化物,Si来自SEM衬底;根据EDS的原子比率,MFGO中的C:O:Fe为31.87:39.75:28.37,表明MFGO表面催化活性组分铁含量相对较高.
利用光电子能谱(XPS)进一步分析MFGO的元素组成和化学价态.图2a MFGO的XPS全谱图显示其有C,O和Fe 3种元素,这与EDS结果相符.根据XPS的原子比率,MFGO中的C:O:Fe为53.68:37.42:8.9,铁元素的存在说明在制备MFGO时,亚铁盐和可溶性铁盐与GO上羧基形成配合物进而化学沉积于GO载体上,在碱性条件下形成了负载铁活性(Fe+)的磁性氧化石墨烯[18],提高了材料的催化活性.图2b是Fe2p XPS谱图.位于710.8eV和724.3eV处的峰是MFGO表面Fe2+特征峰,位于712.3eV和726eV处的峰是Fe3+特征峰,说明负载在MFGO表面的铁以多价态形式存在[19].这表明反应体系中的×OH和×O2H可以与MFGO表面的H2O2、Fe2+、Fe3+等活性组分反应或互相反应使链反应终止或延长Fe2+/Fe3+的循环[20].
2.2 催化氧化效果
评价H2O2、MFGO和H2O2+ MFGO 3种不同体系对MB的催化氧化效果,如图3所示.实验条件初始MB=100mg/L;pH=8.0; MFGO=0.75g/L; H2O2=0.79mol/L.在不加H2O2体系中显示了MB在MFGO催化剂上达到吸附平衡后的剩余量,吸附容量为57.53mg/g,表明MFGO对MB具有良好的吸附性能,这是由于MFGO具有较高的比表面积,可以提供更多的吸附活性位点,同时由于MB与石墨烯片层间的静电引力和π-π堆积作用[21-22],增强了其吸附能力.
3种不同体系在反应90min后对MB的降解效果由高到低依次为H2O2+MFGO>MFGO> H2O2,降解率分别为99.19%,25.58%和7.83%.由此可见,单独投加H2O2体系,由于H2O2的氧化还原电位较低,对MB处理效果不明显. H2O2+ MFGO体系对MB降解效果远高于它们单独投加时的效果,这是由于高比表面,强吸附性石墨烯载体的引入,能使亚铁离子等活性组分均匀地负载于其表面上,并避免团聚现象的产生,扩大反应的有效接触面积,提高对H2O2催化活性[23];而这些活性组分直接催化并加快H2O2分解为氧化性极高的×OH (=2.8V)的效率,从而产生更强的降解效果.结果表明,石墨烯与负载的磁性活性组分之间具有协同催化效应,MB降解主要是以非均相Fenton催化为主.
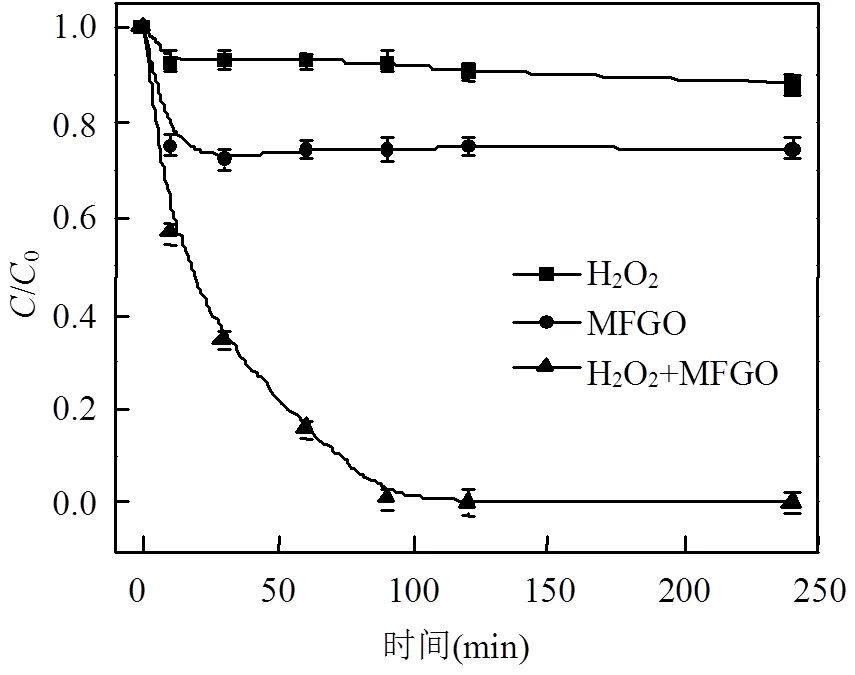
图3 不同催化体系下MB的降解过程
2.3 溶液pH值的影响
本实验在初始MB=100mg/L,MFGO= 0.75g/ L,H2O2=0.79mol/L,pH值分别调为3、6、8、11的条件下,考察MFGO对MB吸附和催化性能的影响,结果如图4所示.随着pH值增加,MFGO对阳离子染料MB的吸附能力也随之增强.这可能是因为在较低pH值的条件下,MFGO处于酸性环境中,其周围会有大量的水合氢离子(H3O+),而H3O+与MB阳离子竞争MFGO吸附位点,促使其表面羟基和羧基质子化为—OH2+的形式,MB阳离子和高度质子化MFGO表面之间产生静电排斥而降低吸附容量;随着pH值增加,MB阳离子与表面带负电的MFGO之间产生静电吸引而增大了吸附容量[24].
当MFGO吸附饱和后,在溶液中加入H2O2构成非均相Fenton体系.如图所示,当pH值从8增加至11时,MFGO对MB降解速率迅速增加;在pH=11时,MFGO对MB降解速率最快,反应10min后,其降解率达87.54%.当pH值为3、6和8时,MB降解速率均缓慢增加,催化反应10min后MB降解率分别为40.43%、47.50%和50.49%,三者没有明显的区别,这可能是由于强酸介质不仅会对石墨烯载体上的磁性催化活性粒子有一定的刻蚀,减弱催化剂磁性和减少反应活性位点,还可能会产生H3O2+,增强H2O2稳定性,从而阻止×OH产生[25];另外,MB分子结构中S带正电荷,在酸性条件下,不利于MFGO表面吸附MB[26],从而降低催化氧化效果.
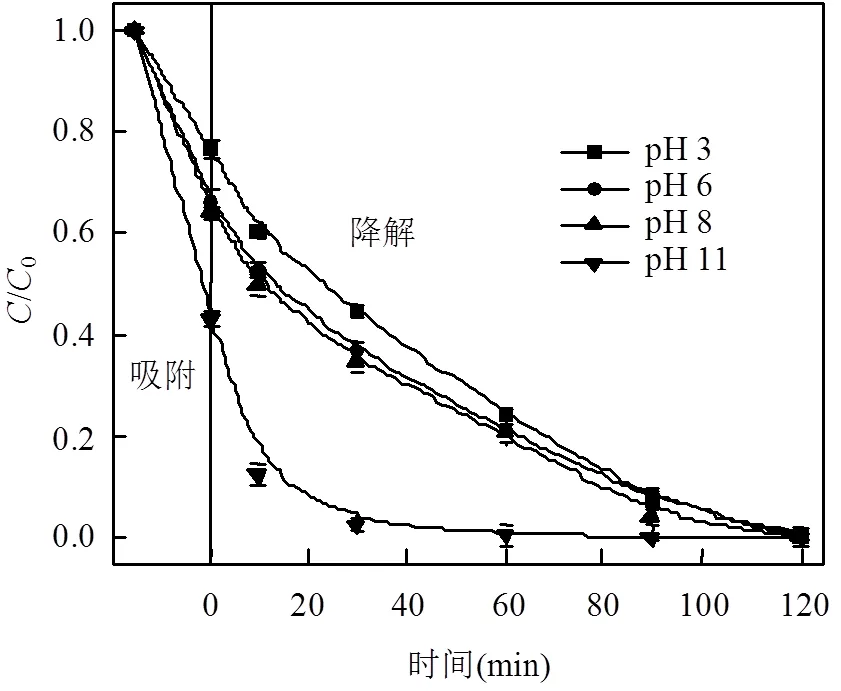
图4 溶液pH值对MB降解的影响
但此后同一条件下继续反应仍保持一定速率,反应120min后MB降解率均在99%以上,只是在反应速率上有所差别,说明只需有充足的时间,体系在pH=3~11范围内均能达到理想的去除效果.其中,当pH=11时,MFGO对MB吸附和降解速率最快,原因在于MB分子结构中存在苯环,而GO由碳环构成,所以MB可以通过π-π相互作用[21]被吸附;在高pH值的条件下,OH-浓度越大,OH-越容易吸附在MFGO表面,使其表面带有负电,而MB分子则可以通过静电引力被吸附[22].在降解的过程中,Hoffman机理中认为,OH-可以充当价带空穴h+的捕获剂,MFGO(h+)具有氧化性,会发生h++ OH-→×OH的反应,同时避免了4×OH→2H2O+O2反应的发生,这就进一步增加了×OH的量[27].反应中产生的×OH一旦和MB分子接触,就可以使MB降解.同时,×OH又可以与吸附表面的H2O2、Fe2+、Fe3+等活性组分反应或相互反应使链反应终止或延长[28].
结果表明,MFGO能在较宽的pH值范围下高效地催化氧化亚甲基蓝.考虑实际水体环境和实验操作的简繁,并使MB达到相对较高的去除效率,后续实验的pH值条件确定为8.0.
2.4 初始H2O2浓度的影响
H2O2的投加量会直接影响强氧化剂(×OH)的产生速率和产生量,从而影响到MFGO氧化降解MB的效率.反应过程中其他条件保持不变,研究H2O2浓度对MB降解的影响,结果如图5所示.当MFGO达到吸附饱和后,在体系中加入H2O2.当H2O2浓度较低时,随着H2O2用量增加,MB降解率随之增大;当H2O2浓度为0.79mol/L时,MB降解速率最快,降解率为99.90%.之后随着H2O2浓度增加,MB降解率稍有下降,这可能是因为H2O2浓度较低时,随着H2O2浓度的增加最终电离成×OH的浓度得到较大的增加,进而增强×OH与吸附在催化剂表面MB的接触机会,有效提高MB降解;但当H2O2浓度达到其临界值后,继续增大浓度时,H2O2对×OH的捕获作用随之加强,反而使溶液中×OH总量减少,抑制过量的×OH自由基与MB反应,影响反应速率的进一步提高[29].过量的H2O2与体系中的×OH发生了反应[30](见式(2),(3)).
H2O2+×OH → HO2×+ H2O (2)
HO2×+×OH → O2+ H2O (3)
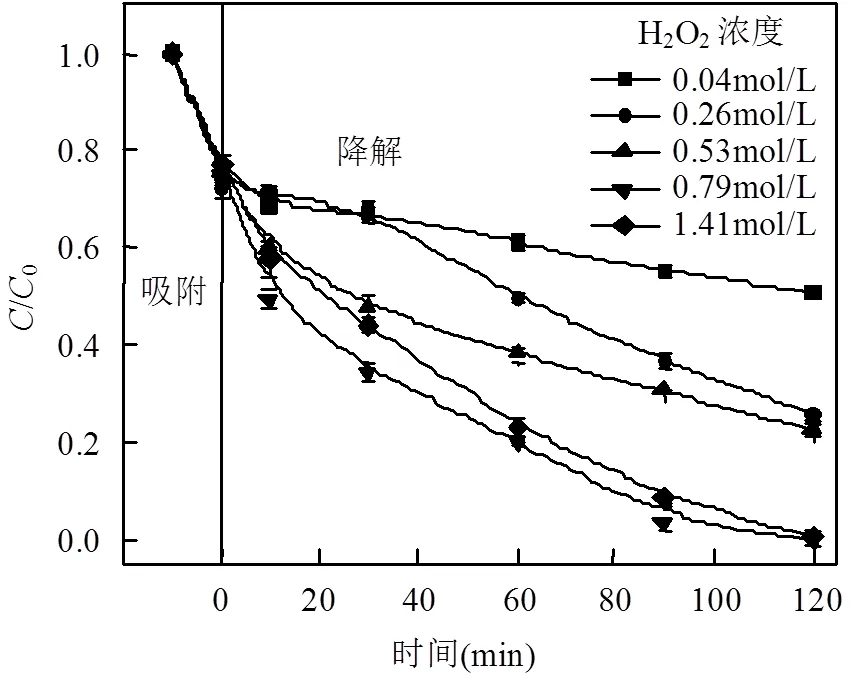
图5 初始H2O2对MB降解的影响
该反应不仅消耗×OH,还会使H2O2无效分解产生HO2×.相比于×OH, HO2×的氧化能力较弱,而HO2×不但会与×OH反应产生副产物H2O和O2,还会发生自身分解,该过程降低了H2O2实际利用率.可见,非均相Fenton催化氧化MB的过程中H2O2既产生了×OH,又消耗了×OH,是一个竞争的过程[31].当竞争达到平衡时,反应才能得到最佳的处理效果.所以本研究中H2O2的最佳浓度为0.79mol/L.
2.5 催化剂量的影响
图6显示了在相同条件下通过改变催化剂投加量,考察MFGO浓度对MB降解效果的影响.在吸附-脱附平衡过程中,随着MFGO浓度的增加,MFGO对MB的吸附量越大;在降解过程中,随着MFGO浓度逐渐增加至0.75g/L,反应120min后,MB降解率增加至99.90%.这是因为非均相Fenton反应主要发生在催化剂的表面,增加MFGO投加量,非均相Fenton反应接触面积增大,为H2O2提供了更多的活性位点,×OH产量也随之增加,反应速率也随之增大[32].当MFGO浓度增加至0.90g/L,MB的降解速率稍有所下降,继续增加至1.20g/L,MB的降解速率又有所提高,而随着反应时间达到120min时,降解率基本一致.这是由于MFGO浓度过高时,活性位点过剩,×OH被捕捉.此外,也可能是因为H2O2用量相同,而MB降解效率本身已经较高,很难有再进一步提升的空间.
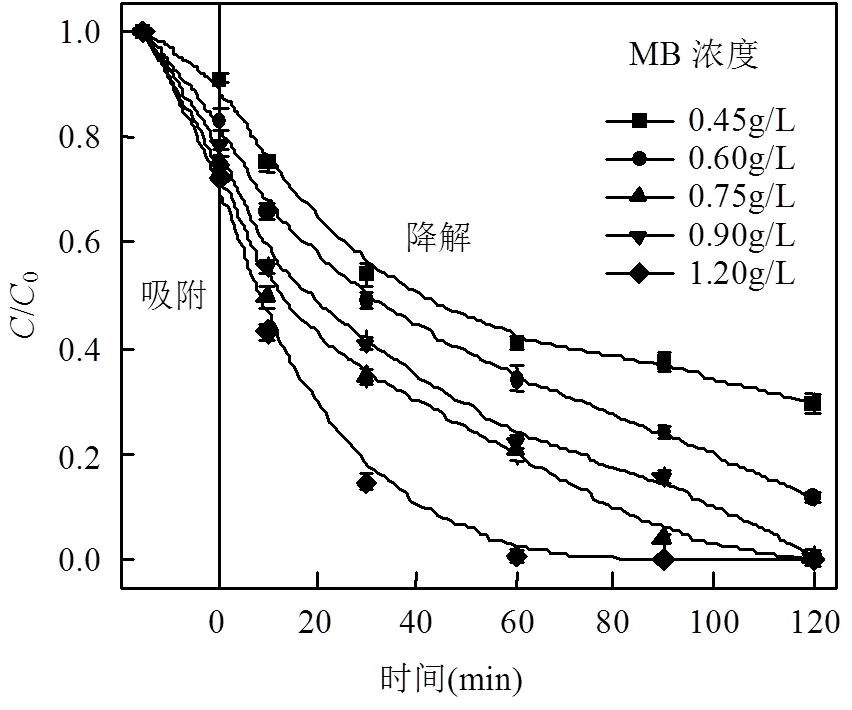
图6 催化剂量对MB降解的影响
结果表明,在催化剂浓度较低时,可以通过增加催化剂浓度来提高催化氧化效率.当催化剂浓度较高时,由于部分催化剂会发生聚集,减少了固液接触面,导致有效活性位点数减少,从而不能有效地产生催化作用,所以增加催化剂浓度对同样反应时间处理效果的提高作用差异不大.综合考虑优选MFGO投加量为0.75g/L.
2.6 MB初始浓度的影响
图7显示了MB初始浓度对催化氧化效果的影响.实验在室温,H2O2浓度为0.79mol/L,MFGO浓度为0.75g/L,MB初始浓度分别为50,100,150和200mg/L,pH=8的条件下进行.由图7可见,MB降解效率随其初始浓度的增大而呈明显下降趋势.当MB初始浓度为50和100mg/L时,反应120min后降解率分别是99.87%和99.90%;但当MB初始浓度增加到200mg/L时,反应120min后降解率仅为22.38%.这个过程主要受制于反应体系中H2O2的浓度.在H2O2浓度相同的条件下, MFGO催化H2O2产生×OH的量是一定的,MB浓度的增大使得MB分子和×OH的有效反应机制减弱,从而降低了MB的降解率.
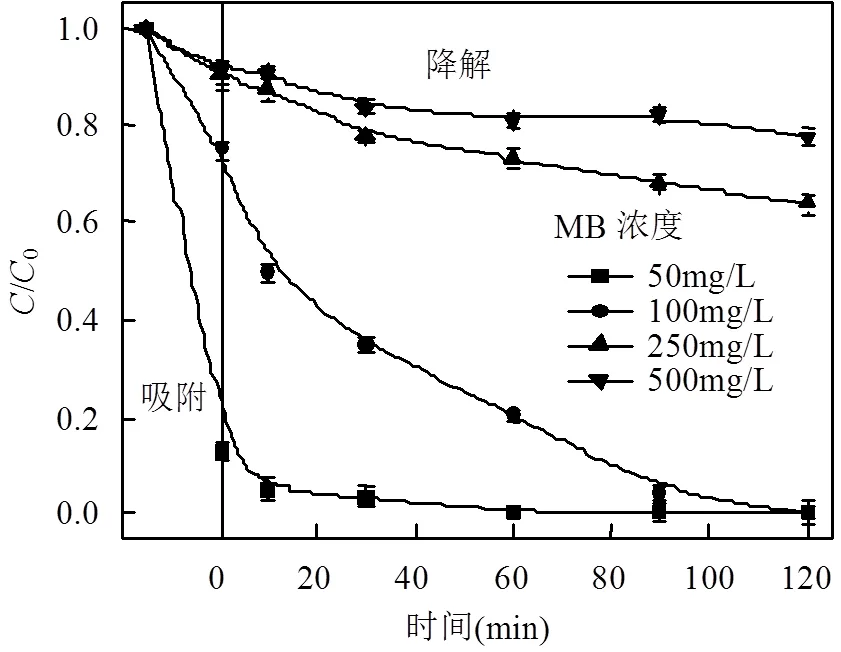
图7 MB初始浓度对降解的影响
2.7 催化剂的磁分离特性及重复利用性
磁性催化活性粒子赋予了催化剂良好的磁分离性能.从图8可以看出,在外加磁场作用下,催化剂可以在30s内快速地与反应体系分离,在一定程度上避免了其流失,具有良好的磁分离特性.
实验在室温,MB初始浓度为100mg/L, MFGO浓度为0.75g/L,H2O2浓度为0.79mol/L, pH=8的条件下,考察了MFGO催化氧化MB的活性和稳定性.在每次循环反应之前将上一循环中的催化剂MFGO用磁铁分离出来,按照前述步骤,加入等量H2O2和回收的MFGO进行下一个循环反应.结果如图9所示,经6次循环,循环降解120min后,第1次的降解率为99.93%,第6次的降解率为95.08%,MFGO的催化活性没有明显的变化,说明该磁性非均相Fenton催化剂不仅可以稳定有效地降解MB,亦可回收循环使用,弥补了传统Fenton试剂的固有缺陷.

图8 MFGO的磁分离示意
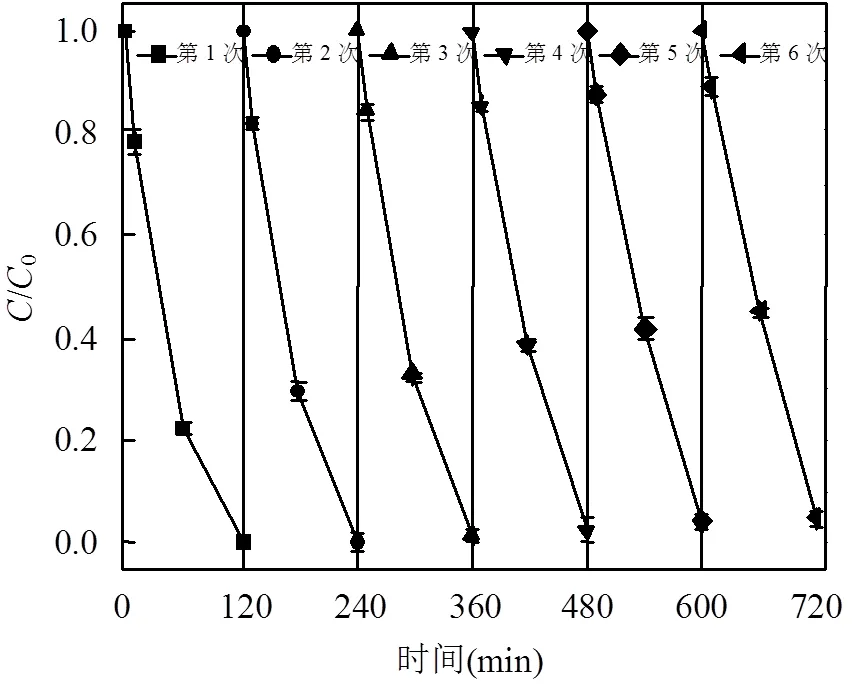
图9 MFGO的循环使用效果
3 结论
3.1 通过改进的Hummers法联合化学共沉淀法制备出非均相Fenton催化剂MFGO,并将其应用于催化氧化MB.在H2O2+MFGO,MFGO,H2O23种不同体系反应120min后,MB降解率由高到低依次为H2O2+MFGO,MFGO,H2O2,表明石墨烯的引入提高了催化活性.
3.2 优化反应条件后,在H2O2浓度为0.79mol/ L、MFGO用量0.75g/L、pH值8时,反应120min,初始浓度为100mg/L MB的降解率为99.90%.
3.3 MFGO在pH=3~11范围内均有较强催化氧化能力,且其经过6次重复使用后,MB降解率仍能达到95.08%.
[1] 石淑云,任百祥.新型杂多酸盐光催化降解亚甲基蓝染料废水 [J]. 应用化学, 2016,33(5):577-582.
[2] 刘双柳,施春红,牛红云,等.纳米铜复合材料催化还原染料废水的研究 [J]. 中国环境科学, 2015,10(3):764-769.
[3] 孙 浩,吴 娟,马 东,等.钒酸铁类Fenton催化剂的制备及性能研究 [J]. 中国环境科学, 2015,35(6):1734-1739.
[4] 冯 勇,吴德礼,马鲁铭.黄铁矿催化类Fenton反应处理阳离子红X-GRL废水 [J]. 中国环境学, 2012,32(6):1011-1017.
[5] Zhou M, Yu Q, Lei L, et al. Electro-Fenton method for the removal of methyl red in an efficient electrochemical system [J]. Separation and Purification Technology, 2007,57(2):380-387.
[6] Li X, Wang J, Rylov A I, et al. Prussian blue/TiO2nanocomposites as a heterogeneous photo-Fenton catalyst for degradation of organic pollutants in water [J]. Catalysis Science and Technology, 2015,5(2):504-514.
[7] Bokare A D, Choi W. Review of iron-free Fenton-like systems for activating H2O2in advanced oxidation processes [J]. Journal of Hazardous Materials, 2014,275(5):121-135.
[8] 杨春维,王 栋,王 坤,等.非均相Fenton反应催化剂的制备及其催化性能[J]. 化工环保, 2011,31(6):557-560.
[9] Fu Y, Chen H, Sun X, et al. Graphene-supported nickel ferrite: A magnetically separable photocatalyst with high activity under visible light [J]. Aiche Journal, 2012,58(11):3298-3305.
[10] Fu Y, Chen H, Sun X, et al. Combination of cobalt ferrite and graphene: High-performance and recyclable visible-light photocatalysis [J]. Applied Catalysis B Environmental, 2012,111- 112(2):280-287.
[11] 尹 竞,廖高祖,朱冬韵,等.g-C3N4/石墨烯复合材料的制备及光催化活性的研究 [J]. 中国环境科学, 2016,36(3):735-740.
[12] Kuila T, Bose S, Mishra A K, et al. Chemical functionalization of graphene and its applications [J]. Progress in Materials Science, 2012,57(2):1061-1105.
[13] Hummers W S, Offeman R E. Preparation of graphitic oxide. [J]. Journal of the American Chemical Society, 1958,80(6):1339.
[14] Yang Y X, Hu X J, Zhao Y L, et al. Decontamination of tetracycline by thiourea-dioxide–reduced magnetic graphene oxide: Effects of pH, ionic strength, and humic acid concentration [J]. Journal of Colloid and Interface Science, 2017,495:68-77.
[15] 吴日良,刘云芳,任 森,等.Fe3O4@碳/氧化石墨烯复合材料制备及染料吸附性能 [J]. 中国环境科学, 2016,36(10):2981- 2987.
[16] Yang X Y, Zhang X Y, Ma Y F, et al. Superparamagnetic graphene oxide-Fe3O4nanoparticles hybrid for controlled targeted drug carriers [J]. Journal of Materials Chemistry, 2009,19(2):2710- 2714.
[17] 常 青,江国栋,胡梦璇,等.石墨烯基磁性复合材料吸附水中亚甲基蓝的研究 [J]. 环境科学, 2014,35(5):1804-1809.
[18] Kuila T, Bose S, Mishra A K, et al. Chemical functionalization of graphene and its applications [J]. Progress in Materials Science, 2012,57(7):1061-1105.
[19] Khmeleva T N, Georgiev T V, Jasieniak M, et al. XPS and ToF-SIMS study of a chalcopyrite-pyrite-sphalerite mixture treated with xanthate and sodium bisulphite [J]. Surface and Interface Analysis, 2010,37(8):699-709.
[20] 杨岳主,李玉平,杨道武,等.铁铜催化剂非均相Fenton降解苯酚及机制研究 [J]. 环境科学, 2013,34(7):2658-2664.
[21] Guo X, Du B, Qin W, et al. Synthesis of amino functionalized magnetic graphenes composite material and its application to remove Cr(VI), Pb(II), Hg(II), Cd(II) and Ni(II) from contaminated water [J]. Journal of Hazardous Materials, 2014, 278:211-220.
[22] 魏金枝,陈芳妮,孙晓君,等.氨基修饰磁性氧化石墨烯吸附离子型染料性能 [J]. 中国环境科学, 2016,36(7):2020-2026.
[23] Yao Y J, Miao S D, Liu S Z, et al. Synthesis, characterization, and adsorption properties of magnetic Fe3O4@grapheme nanocomposite [J]. Chemical Engineering Journal, 2012,184(1): 326-332.
[24] Fan W, Gao W, Zhang C, et al. Hybridization of graphene sheets and carbon-coated Fe3O4nanoparticles as a synergistic adsorbent of organic dyes [J]. Journal of Materials Chemistry, 2012,22(48): 25108-25115.
[25] Herney R J, Vicente M A, Madeira L M. Heterogeneous photo-Fenton oxidation with pillared clay-based catalysts for wastewater treatment: A review [J]. Applied Catalysis B Environmental, 2010,98(1):10-26.
[26] 邓景衡,文湘华,李佳喜.碳纳米管负载纳米四氧化三铁多相类芬顿降解亚甲基蓝 [J]. 环境科学学报, 2014,34(6):1436-1442.
[27] Valatka E, Kulėšius Z. TiO2-mediated photoelectrochemical decoloration of methylene blue in the presence of peroxodisulfate [J]. Journal of Applied Electrochemistry, 2007,37(4):415-420.
[28] Dhakshinamoorthy A, Navalon S, Alvaro M, et al. Metal nanoparticles as heterogeneous Fenton catalysts [J]. Chemsuschem, 2012,5(1):46-64.
[29] Zhang Y, Tang Z R, Fu X, et al. Engineering the unique 2D mat of graphene to achieve graphene-TiO2nanocomposite for photocatalytic selective transformation: what advantage does graphene have over its forebear carbon nanotube? [J]. Acs Nano, 2011,5(9):7426.
[30] Jiang J, Zou J, Zhu L, et al. Degradation of methylene blue with H2O2activated by peroxidase-like Fe3O4magnetic nanoparticles [J]. Journal of Nanoscience and Nanotechnology, 2011,11(6): 4793.
[31] Li X Y, Huang Y, Li C, et al. Degradation of pCNB by Fenton like process using α-FeOOH [J]. Chemical Engineering Journal, 2015,260(2):28-36.
[32] 张 荷.新型磁性碳材料的制备及其在非均相类Fenton体系中的应用 [D]. 兰州:兰州大学, 2015.
Heterogeneous Fenton catalyzed oxidation of methylene blue by magnetic Fe+@GO.
YANG Yuan-xiu1, YAO Chuang1*, LIU Hui2, LIU Jian-xin1, HUANG Xian1, TANG Yuan-sheng1
(1.Institute of Engineering Technology of Guangdong Province, Guangzhou 510440, China;2.Department of Environmental Science and Engineering, Zhongkai University of Agricultural and Engineering, Guangzhou 510225, China)., 2018,38(5):1719~1726
Magnetic Fe+@GO (MFGO) nanocomposite was prepared by coprecipitation and applied as a heterogeneous Fenton catalyst for catalytic oxidation of methyl blue (MB). The scanning electron microscopy (SEM), High-Resolution transmission electron microscopy (HRTEM) and X-ray photoelectron spectroscopy (XPS) indicated that the GO nanosheets were successfully loaded by catalytically active particles (i.e., Fe+, iron oxide). The effects of pH value, initial H2O2concentration and catalyst dosage on the degradation efficiency were investigated. The degradation efficiencies for the system of H2O2, MFGO and H2O2with MFGO after 120min reached 7.83%, 25.58% and 99.19%, respectively. The degradation efficiency of MB was 99.90% at the optimal operating conditions of 0.79mol/L H2O2and 0.75g/L MFGO, pH=8. With the pH ranging from 3to 11, the degradation efficiency of MB was still higher than 99%.Even MFGO was reused for six consecutive runs, the degradation efficiency of MB still reached 95.08%.Furthermore, the novel catalyst was preferable to be utilized in wide pH value and took the advantages in magnetic separation and reuse.
Fe+;graphene oxide;magnetically separable;heterogeneous Fenton;methylene blue
X703.5
A
1000-6923(2018)05-1719-08
2017-09-29
广东省科技计划资助项目(2015B070701029,201704030084)
* 责任作者, 高级工程师, yaochuang1984@163.com
杨远秀(1990-),女,广东广州人,广东省工程技术研究所硕士研究生,主要从事环境功能材料的研发及应用研究和水污染控制工程的研究工作.发表论文4篇.
