低分子肝素钙皮下注射治疗慢性阻塞性肺疾病急性加重期合并肺心病的疗效
2018-05-24徐婕曾龙飞龚建祖葛德海
徐婕 曾龙飞 龚建祖 葛德海
南京梅山医院呼吸科(南京210041)
慢性阻塞性肺疾病急性加重(acute exacerbation of chronic obstructive pulmonary disease,AECOPD)是临床上常见的呼吸系统疾病,AECOPD患者随着病程的延长,肺心病、肺动脉高压等不良心血管并发症的发生率在增加,进而影响预后。文献显示年龄>45岁的患者中,AECOPD合并肺心病患者的发生率逐渐上升,而抗感染、糖皮质激素、支气管扩张剂等常规综合性治疗措施的总体有效率不足45%,且治疗后患者的病情缓解率较低[1-2]。在COPD急性期中,机体存在较强的炎症反应,血液呈高凝状态[3],而低分子肝素钙(molecular weight heparin calcium,MvH)可以抑制患者体内的高凝状态,改善血流动力学指标,进而恢复患者通气/血流比值,改善肺通气或者肺换气功能[4-5],同时MvH具有比肝素更好的抗炎症作用[6]。有鉴于此本研究选取2016年1月至2017年12月我院收治的AECOPD合并肺心病患者128例,通过皮下注射MvH联合常规治疗措施,探讨MvH对AECOPD肺心病患者的影响机制和临床效果。
1 资料与方法
1.1 一般资料 选取2016年1月至2017年12月我院收治的AECOPD合并肺心病患者128例,采用EXCEL 2007生成随机数字表分为观察组和对照组各64例。观察组64例,男41例、女23例,年龄56~79岁,平均(65.7± 9.2)岁,病程6~18年,平均病程(12.6±5.9)年,纽约心脏病协会(NYHA)心功能分级:Ⅲ级48例、Ⅳ级16例。对照组64例,男43例、女21例,年龄58~79岁,平均(67.4±8.6)岁,病程6~21年,平均病程(13.0±5.5)年,NYHA心功能分级:Ⅲ级50例、Ⅳ级14例。两组患者的年龄、性别、病程、NYHA心功能分级差异均无统计学意义(P>0.05)。
1.2 纳入排除标准
1.2.1 纳入标准 (1)AECOPD患者的诊断标准参考2007年中华医学会呼吸病学分会制定COPD诊疗指南(修订版)中的标准[7];(2)肺心病诊断符合内科学第七版肺心病诊断标准[8];(3)NYHA心功能分级Ⅲ~Ⅳ级;(4)年龄 ≤ 79岁;(5)本观察研究获得患者及医学伦理委员会的批准。
1.2.2 排除标准 (1)近6个月应用华法林、肝素、阿司匹林药物;(2)肝肾功能不全;(3)具有脑血管出血病史、上消化道出血病史、消化道活动性出血疾病;(4)合并冠心病、瓣膜性心脏病的患者。
1.3 治疗方法 对照组:给予常规抗感染、吸氧、祛痰、维持水电解质平衡、强心利尿等基础治疗;观察组在对照组的基础上联合皮下注射低分子肝素钙(速碧林,葛兰素史克公司生产),4 100 U/次,每日2次,连续治疗1周。
1.4 观察指标 检测并对比两组患者治疗前后的舒张末期心室容积(EDV)、收缩末期心室容积(ESV)、右心室射血分数(RVEF)、肺动脉加速时间(AT)、动脉血氧分压(PaO2)、动脉血二氧化碳分压(PaCO2)、pH值、全血黏度低切、全血黏度高切、血浆黏度、红细胞压积、血浆D-二聚体(D-D)。
清晨采集空腹静脉血,分离血清后,-20℃保存待测,采集标本后1周内检测、全血黏度低切、全血黏度高切、血浆黏度、红细胞压积、血浆D-二聚体(D-D),相关指标测定采用酶联免疫吸附测定试验,检测试剂盒购自福建新大陆生物技术有限公司;pH值的检测采用电化学发光法,具体检测方法参照试剂盒说明书,试剂盒内配有质控血清或质控标准品,所有操作严格按照操作说明完成。
1.5 统计学方法 数据统计分析采用SPSS 20.0进行处理,所有计量指标均采用均数±标准差进行统计描述,干预前后组内比较应用配对t检验,组间比较采用两组独立样本的t检验;P<0.05表示差异具有统计学意义。
2 结果
2.1 两组患者的心功能变化 治疗前,观察组和对照组的EDV、ESV、RVEF、AT差异无统计学意义(P>0.05);治疗后,观察组的EDV、ESV均低于对照组(P<0.05),RVEF、AT均高于对照组(P<0.05)。见表1。
表1 两组患者的心功能变化Tab.1 Changes of heart function index in two groups ±s
注:与治疗前比较,*P<0.05,与对照组比较,△P<0.05
时间治疗前治疗后组别研究组对照组研究组对照组EDV(mL)88.4±5.9 86.0±6.2 63.0±5.5*△69.6±7.3*ESV(mL)62.8±5.9 64.3±7.4 38.0±6.7*△43.0±7.5*RVEF(%)28.9±6.4 29.5±6.8 45.2±6.0*△41.6±7.3*AT(s)0.11±0.03 0.12±0.04 0.17±0.04*△0.14±0.05*
2.2 两组患者的血气指标比较 治疗前,观察组和对照组的PaO2、PaCO2、pH值差异无统计学意义(P>0.05);治疗后,观察组的PaCO2值低于对照组(P<0.05),PaO2、pH值均高于对照组(P<0.05)。见表2。
表2 两组患者的血气指标比较Tab.2 Changes of blood gas index in two groups ±s
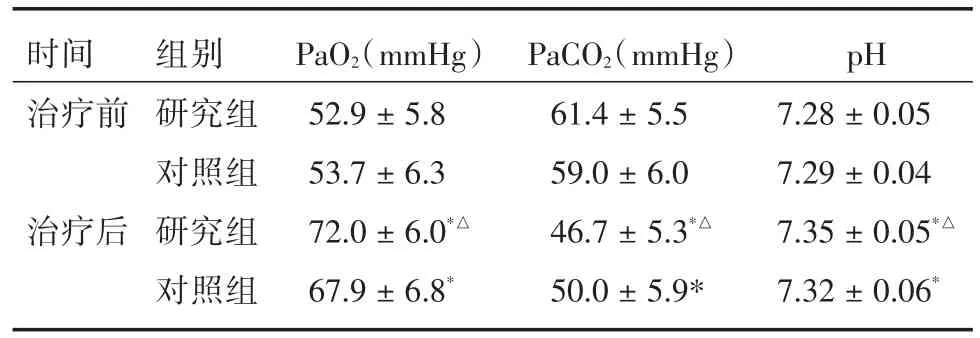
表2 两组患者的血气指标比较Tab.2 Changes of blood gas index in two groups ±s
注:与治疗前比较,*P<0.05,与对照组比较,△P<0.05
时间治疗前治疗后组别研究组对照组研究组对照组PaO2(mmHg)52.9±5.8 53.7±6.3 72.0±6.0*△67.9±6.8*PaCO2(mmHg)61.4±5.5 59.0±6.0 46.7±5.3*△50.0±5.9*pH 7.28±0.05 7.29±0.04 7.35±0.05*△7.32±0.06*
2.3 两组患者的血液流变学指标比较 治疗前,观察组和对照组的全血黏度低切、全血黏度高切、血浆黏度、红细胞压积、血浆D-D值差异无统计学意义(P>0.05);治疗后,观察组的全血黏度低切、全血黏度高切、血浆黏度、红细胞压积、血浆D-D值低于对照组(P<0.05)。见表3。
表3 两组患者的血液流变学指标比较Tab.3 Changes of the blood rheology index in two groups ±s

表3 两组患者的血液流变学指标比较Tab.3 Changes of the blood rheology index in two groups ±s
注:与治疗前比较,*P<0.05,与对照组比较,△P<0.05
时间治疗前治疗后D-D(mg/dL)2.87±0.36 2.91±0.44 1.95±0.35*△2.52±0.41*组别研究组对照组研究组对照组全血黏度低切(mPa·s)12.41±2.15 12.05±2.36 8.73±1.89*△10.14±1.96*全血黏度高切(mPa·s)7.89±1.38 7.74±1.33 6.52±1.14*△7.50±1.07*血浆黏度(mPa·s)1.83±0.31 1.81±0.28 1.63±0.30*△1.79±0.26*红细胞压积(%)0.522±0.031 0.528±0.029 0.461±0.043*△0.498±0.036*
2.4 不良发应 观察组有4例患者出现注射部位皮下瘀斑、1例出现痰中带血、1例出现消化道不适,对照组有3例出现消化道不适,两组患者的不良发应发生率比较差异无统计学意义(P>0.05)。
3 讨论
COPD患者随着病情的反复和进展,可出现肺心病、肺动脉高压等严重并发症,导致病死率的上升[9-10]。一项汇集了172例样本量的研究显示,AECOPD合并肺心病患者的临床综合治疗效果有限,治疗后患者的阻塞性通气功能障碍或者呼吸系统炎症表现仍然无明显改善[11]。我们已经认识到AECOPD患者肺部异常炎症反应会导致患者气道周围聚集大量的浸润性炎细胞,并不断释放TNFa、IL-6、白三烯B4等炎症介质,研究证实:TNFα、IL-6等因子能导致局部肺泡组织及毛细血管的过氧化应激损伤,促进肺动静脉的内皮损伤;能激活凝血系统、抑制纤维蛋白降解、血液粘稠度增高、肺微小动脉栓塞的形成等,继而促进了肺动脉压力的增高、心脏代偿功能的障碍和增加AECOPD合并肺心病患者心肌梗死、急性心力衰竭或失代偿性心功能不全等的发生[12-13]。因此寻求针对AECOPD患者并发肺心病、肺动脉高压发生机理的治疗措施,可能有利于控制病情的进展。
低分子肝素钙在AECOPD患者并发肺心病患者的应用研究中显示低分子肝素可以有效治疗AECOPD患者,促进综合治疗效果的显著增强[14-15],而低分子肝素钙改善AECOPD合并肺心病的机制可能与下列因素有关:(1)低分子肝素改善了局部肺泡毛细血管血流动力学的紊乱,降低了心脏泵血负荷,改善了心脏功能;(2)低分子肝素对于血小板性微血栓或者局部氧化应激性损伤的抑制作用,可以保护心肌细胞膜完整性免受损伤,改善心脏舒张功能[16];本组研究资料显示反应肺心病患者心脏收缩或者舒张功能的影像学指标EDV或ESV,在观察组患者中明显下降,提示患者收缩或者舒张末期的心室壁容积明显减小,心脏舒张或者收缩功能明显改善。同时本研究发现治疗后右心室射血分数(RVEF)、肺动脉加速时间(AT)等指标明显上升,高于对照组,提示心脏代偿功能的进一步改善。结果与周凌等回顾性分析的低分子肝素钙治疗AECOPD合并肺心病患者的心脏射血分数可平均上升15%以上,且左侧心房及左侧心室壁舒张末期容积明显下降临床结果基本一致[17]。因此笔者认为低分子肝素钙对于肺心病患者心功能改善作用的机制可能与下列因素有关:(1)低分子肝素钙可以通过改善冠状动脉或者肺动脉的血流动力学指标,促进局部血流微循环,降低心脏收缩的前负荷[17];(2)低分子肝素钙治疗后,可以通过降低肺栓塞或者冠状动脉血栓形成导致的心脏舒张或者收缩功能的障碍,改善心脏代偿功能;(3)低分子肝素钙对于肺静脉压力的改善或者低于右侧心室壁回心血流动力学的保护;(4)比肝素更好的抗炎症作用[6],进而保护内皮细胞功能,重建机体免疫系统内稳状态等。
本组研究资料还显示:低分子肝素钙治疗后观察组患者的血气代谢指标明显改善,血压饱和度及动脉血氧含量上升,而二氧化碳分压持续下降,血气分析指标的改善,考虑可能与低分子肝素钙治疗后对于肺泡局部氧气弥散功能的改观有关,同时也可能与低分子肝素钙治疗后对于肺部血小板性血栓形成的抑制,进而提高局部有效通气有关。血流动力学指标的分析也可以发现,低分子肝素钙治疗后的观察组患者的全血黏度低切、全血黏度高切、血浆黏度、红细胞压积等均明显改善,D-二聚体也明显下降,患者的纤维蛋白溶解系统亢进表现得到了显著的抑制,进一步提示了低分子肝素钙治疗AECOPD合并肺心病的临床效果。
综上所述,MvH皮下注射治疗AECOPD合并肺心病患者能改善患者的血液流变学水平、改善心功能及血气水平,且治疗后并未出现明显的副反应,临床安全性较为可靠,值得推广应用。但本研究仍有许多不足,如MvH治疗AECOPD合并肺心病患者远期生存预后指标、MvH治疗的最佳剂量和疗程等,有待进一步的研究探讨。
参考文献
[1]GARCIA RIO F.Enfermedad pulmonar obstructiva crónica y cardiopatía isquémica:una asociación no tan infrecuente[J].Revista Clínica Española,2014,214(5):281-282.
[2]GRIFFO R,SPANEVELLO A,TEMPORELLI P L,et al.Frequent coexistence of chronic heart failure and chronic obstructive pulmonary disease in respiratory and cardiac outpatients:Evidence from SUSPIRIUM,a multicentre Italian survey[J].Euro J Prevent Cardiol,2017,25(6):170-173.
[3]李广生,李月川.血小板平均体积及中性粒细胞/淋巴细胞比率联合检测在老年AECOPD近期预后中的临床价值[J].实用医学杂志,2017,33(6):928-931.
[4]VAN DER PLAS A G,OOSTERVELD-VLUG M G,PASMAN H R W,et al.Relating cause of death with place of care and healthcare costs in the last year of life for patients who died from cancer,chronic obstructive pulmonary disease,heart failure and dementia:A descriptive study using registry data[J].Palliat Med,2017,26(06):56-58.
[5]丁明霞,卢丹,常媛媛,等.低分子肝素治疗老年慢性阻塞性肺疾病合并肺心病急性发作期效果[J].临床肺科杂志,2015,20(3):487-489.
[6]吴志雄,冯坤好,谭家余,等.小剂量肝素钠与低分子肝素钙对脓毒症治疗作用的对比研究[J].临床和实验医学杂志,2016,15(4):359-361.
[7]王琴,王岩,王玉宏.APACHEⅢ评分对无创通气治疗慢性阻塞性肺疾病急性加重患者的预后评估[J].中华临床医师杂志(电子版),2014,22(8):1585-1587.
[8]陆再英,钟南山.内科学[M].北京:人民卫生出版社,2008:167.
[9]QIAN Y,X IE H,TIAN R,et al.Efficacy of low molecular weight heparin in patients with acute exacerbation of chronic obstructive pulmonary disease receiving ventilatory support[J].COPD,2014,11(2):171-176.
[10]姚婉贞.慢性阻塞性肺疾病病情和预后评估指标新认识[J].中华医学杂志,2015,95(8):561-563.
[11]PARKER D R,LIU J,ROBERT M B,et al.Is inflammatory chronic obstructive pulmonary disease a coronary heart disease risk equivalent?A longitudinal analysis of the third National Health and Nutrition Examination Survey(NHANES III),1988-1994[J].BMC Pulm Med,2014,14(1):90-92.
[12]毛小青,马文江.COPD患者实施抗栓预防治疗应用低分子肝素的效果分析及纤维蛋白原的改变情况分析[J].中国医院药学杂志,2015,22(15):1414-1417.
[13]史灵芝.抗凝治疗对慢性阻塞性肺疾病稳定期患者合并血栓前状态的影响[J].江苏医药,2014,42(23):2845-2847.
[14]王玉春.低分子肝素钙皮下注射治疗慢性阻塞性肺疾病急性加重期合并肺心病疗效观察[J].中西医结合心血管病杂志,2016,4(36):38.
[15]朱瑞航,余艳芳,屠春林.低分子肝素钠治疗慢性阻塞性肺疾病急性加重期的疗效分析[J].贵州医药杂志,2016,40(5):484-486.
[16]卫小红,王军辉,Asmitanand Thakur,等.低分子肝素、N-乙酰半胱氨酸干预对COPD大鼠气道重塑的影响[J].西安交通大学学报(医学版),2014,25(02):196-199.
[17]周凌,席家宁.低分子肝素对慢性阻塞性肺疾病急性加重治疗效果的Meta分析[J].军事医学,2015,22(08):621-625.
