等毒性剂量芥子气诱导大鼠肺损伤炎性因子和蛋白表达变化
2018-05-24于丹钟玉绪李源谢剑炜祝筱姬
于丹 钟玉绪 李源 谢剑炜 祝筱姬
1潍坊医学院研究生部(山东淮坊261053);2军事医学研究院毒物药物研究所,毒理学与抗毒药物国家重点实验室(北京 100850);3解放军第89医院呼吸科(山东潍坊 261021)
芥子气(sulfur mustard,SM)是一种能导致DNA烷化,蛋白修饰,细胞膜损伤的化学性毒剂[1-2]。SM可经呼吸道、皮肤、眼睛及消化道等不同途径染毒,但不同途径中毒的毒理学特点各异[3-6]。研究表明,不同途径SM染毒的分子毒理学与其毒性作用的分子靶标和代谢差异密切相关。SM损伤的分子毒理机制主要涉及炎性反应、氧化应激、细胞凋亡、DNA损伤等,但其具体的分子机制迄今仍未明确[7]。肺是SM损伤的主要靶器官之一,一旦染毒将会导致高的致残率和致死率[8-9]。前期研究发现,SM诱导大鼠急性肺损伤后,其血清炎性因子水平和肺泡间隔炎性细胞浸润及肺泡支气管灌洗液细胞和蛋白含量明显增多[10-11]。然而,在SM等毒性剂量(1LD50)下,经两种染毒途径诱导急性肺损伤炎性反应是否存在差别,文献未见报道。本文通过建立经腹腔和气管途径SM(1LD50)诱导大鼠急性肺损伤模型,比较2种模型血清炎性因子水平和肺泡间隔相关蛋白表达的差异性,并探讨SM肺损伤的分子机制,为其药物防治提供理论依据。
1 材料与方法
1.1 试剂与仪器 白细胞介素-23(interleukine-23,IL-23)、γ-干扰素(interferon gamma-γ,INF-γ)、白细胞介素-4(interleukine-4,IL-4)Elisa试剂盒,由上海绘辛生物科技有限公司提供;细胞核因子-β1(nuclear transcription factor-β1,NF-κβ1)、细胞核因子-βp65(nuclear transcription factor-βp65,NF-κβp65)、细胞外信号调节激酶(extracellular signalregulated kinase,ERK)、c-Jun氨基端激酶(c-Jun N-terminal kinase,JNK)、p38激活丝裂原活化蛋白酶(p38 mitogen-activated protein kinase,p38MAPK)免疫组化试剂盒,由北京博奥森生物技术有限公司提供;Versa Max酶标仪,美国Molecular Devices公司;Image-Pro Plus 6.0病理细胞图像分析系统,美国Media Cybernetics公司。
1.2 动物和实验分组 健康雄性SD大鼠(SPF级,军事医学研究院实验动物中心,合格证号:0015902)136只,体质量280~300 g,年龄15周。预实验,经过霍恩氏法计算,腹腔途径SM(0.96 LD50=8 mg/kg)和经气管途径SM(0.98 LD50=2 mg/kg)的半数致死量(median lethal dose,LD50),然后通过等毒性剂量SM(1LD50)染毒。将大鼠分为腹腔SM组(32只)、腹腔丙二醇组(32只)、气管SM组(32只)、气管丙二醇组(32只)、正常对照组(8只)。SM液(纯度96%)临用前用丙二醇稀释至所需浓度。(1)气管途径染毒动物模型建立:实验前气管SM组和气管丙二醇组皮下注射阿托品(0.05 mg/kg),30 min后腹腔内注射盐酸氯胺酮(100 mg/kg)实施麻醉,气管内注入稀释的SM 0.1 mL(1LD50=2 mg/kg),气管丙二醇组注入丙二醇0.1 mL。(2)腹腔途径染毒动物模型建立:同气管途径方法实施麻醉。腹腔SM组大鼠腹腔内注入稀释的SM 0.1 mL(1LD50=8 mg/kg),腹腔丙二醇组注入丙二醇0.1 mL。正常对照组不做任何处理。
1.3 ELISA法检测血清炎性因子 将腹腔SM组、腹腔丙二醇组、气管SM组、气管丙二醇组、正常对照组不同时间段获取的大鼠血2 mL,37℃水浴1 h,4 ℃ 过夜,血标本离心(223.6g,10 min),取上清液,分装在无菌小瓶中,-80℃保存备用。采用Versa Max酶标仪,检测血清IL-23、INF-γ、IL-4水平。所有流程严格按说明书进行操作。
1.4 免疫组化(SP法)染色 收集各组大鼠肺组织标本。石蜡切片,脱蜡,水化,枸橼酸缓冲液抗原修复,PBS洗涤,3%双氧水封闭,正常山羊血清封闭,滴加兔抗大鼠 NF-κβ1、NF-κβp65、ERK、JNK、p38MAPK单克隆抗体 20 μL/片,DAB显色,苏木素复染,脱水,中性树胶封片。PBS代替一抗作阴性对照,用已知阳性切片作阳性对照。采用Image-Pro Plus 6.0病理细胞图像分析系统,选取测量参数,测定阳性率和强阳性率,每间隔1个高倍视野(400倍)选取1个视野进行观察,每张切片至少观察5个高倍视野,计算其肺泡间隔阳性细胞比率(=5个高倍视野的阳性细胞数/细胞总数×100%)并计算其平均值。
1.5 统计学方法 采用SPSS 17.0统计软件,数据用xˉ±s表示,多组间用重复测量的多因素方差分析,两两比较采用SNK-q法,P<0.05表示差异有统计学意义。
2 结果
2.1 SM(1LD50)不同途径对大鼠血清炎性因子的影响 腹腔和气管SM组:血清IL-23、INF-γ水平24 h达高峰,然后逐渐下降;血清IL-4水平24 h达低峰,然后逐渐升高,72 h达高峰。5组不同时间血清炎性因子水平分别比较:(1)腹腔和气管SM组不同时间点间血清IL-23、INF-γ、IL-4水平分别比较,差异有统计学意义;(2)腹腔SM组与其他4组分别比较,差异有统计学意义;(3)腹腔SM组与气管SM组变化趋势分别比较,差异有统计学意义;IL-23、INF-γ呈递减趋势,IL-4呈递增趋势(图1 A~C)。
2.2 SM(1LD50)不同途径对大鼠肺泡间隔NF-κβ1、NF-κβp65、ERK、JNK、p38MAPK蛋白表达的影响 腹腔和气管SM组6 h肺泡间隔NF-κβ1、NF-κβp65、ERK、JNK、p38MAPK 蛋白阳性表达呈带状分布,24 h聚集成簇,48、72 h呈团簇状。丙二醇和正常对照组呈零星分布(图2)。5组不同时间肺泡间隔相关蛋白阳性表达率分别比较:(1)腹腔和气管SM组不同时间点间的NF-κβ1、NF-κβp65、ERK、JNK、p38MAPK蛋白阳性表达率分别比较,差异有统计学意义;(2)腹腔SM组与其他4组蛋白阳性表达率分别比较,差异有统计学意义;(3)腹腔SM组与气管SM组蛋白阳性表达率变化趋势分别比较,差异有统计学意义,呈递增趋势。
3 讨论
本研究发现,腹腔和气管SM组各时间段血清INF-γ、IL-23水平24 h达最高峰,然后逐渐下降;血清IL-4水平24 h最低峰,48 h后呈现升高趋势。本研究提示,在SM诱导肺损伤的急性期,促炎因子INF-γ和IL-23水平呈一过性升高,抗炎因子IL-4水平则一过性降低。可见,SM诱导大鼠血清炎性因子反应属一种生理和(或)病理代偿性反应,已达到促炎与抗炎反应新的平衡。文献报道,这种反应可诱发氧化应激和细胞凋亡,导致SM对肺组织更进一步病理学改变[7,12]。SM诱导肺损伤急性期,促炎因子升高已形成共识[13-14]。在SM肺损伤慢性期,促炎因子可出现下调现象,这可能与免疫功能下降有关[15]。本研究还证实,作为SM的稀释剂丙二醇,不能诱导大鼠血清炎性因子反应。笔者认为,炎性因子源于炎细胞释放并能启动炎性反应的重要因子,其分子水平的级联效应是肺损伤的基础。因此,炎性反应是SM肺损伤的分子机制之一,同样如何抗炎则是SM诱导急性肺损伤防治的重要措施之一[16-17]。

图1 大鼠血清IL-23、INF-γ、IL-4水平变化趋势Fig.1 The trends in serum IL-23,INF-,IL-4 levels and the positive expression ratio of proteins-related in rats with SM(1LD50)
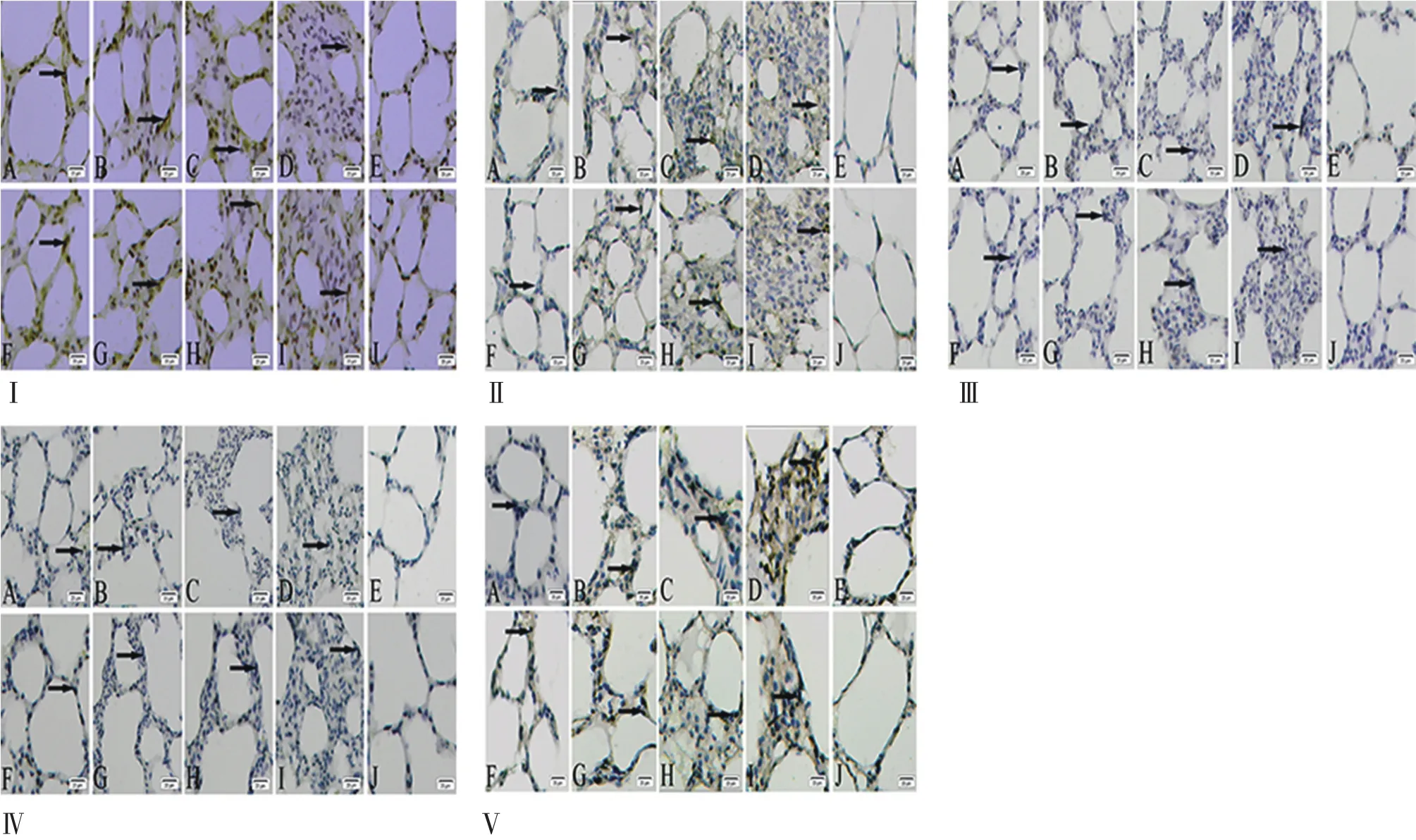
图2 大鼠肺泡间隔NF-Kβ1、NF-Kβp65、ERK、JNK、p38MAPK蛋白阳性表达(× 400)Fig.2 The positive expression of NF-Kβ1,NF-Kβp65,ERK,JNK,p38MAPK proteins in the alveolar septum of rats with SM(1LD50)
本研究还发现,腹腔SM组大鼠肺组织各时间段肺泡间隔 NF-κβ1、NF-κβp65、ERK、JNK、p38MAPK蛋白阳性表达率显著升高,提示腹腔SM组大鼠肺泡间隔炎性反应严重。这与我们前期研究的腹腔SM组大鼠肺泡间隔炎性细胞浸润(淋巴细胞和巨噬细胞)增多结果一致[18]。本研究结果说明,肺泡间隔相关炎性蛋白表达与炎性细胞浸润密切相关。肺泡间隔相关炎性蛋白表达的增加,揭示了SM诱导肺损伤炎性反应在分子水平的变化,且这些蛋白通道的激活对炎症的发展起着关键性作用[19]。在正常情况下,胞浆中NF-κβ(包括 NF-κβ1和 NF-κβp65)与其抑制蛋白结合不具有活性。当机体受到刺激时,抑制蛋白被磷酸化并迅速降解,NF-κβ释放和激活并转移到细胞核内,结合特异性DNA位点,启动相关基因转录[20]。ERK和JNK能应答多种细胞外刺激,参与调解细胞的生命过程,其信号功能失调与炎症密切相关[21]。研究发现,SM诱导急性肺损伤可增加TGF-β1和Smad蛋白表达,结果提示有潜在肺纤维化形成的可能性[22]。同时,TGF-β1则可介导ERK通道,增强特定核转录因子NF-κβ活化,有利于促进胶原的合成[23]。ERK信号通道还可激活NF-κβ信号通道,两者之间存在关联性。因此,SM诱导急性肺损伤炎性反应可能与在转录水平ERK和NF-κβ细胞内信号蛋白激活有关[16]。另外,缺氧也可迅速激活ERK、JNK、p38MAPK蛋白,通过MAPK、ERK、JNK信号通道产生炎性反应[24]。研究表明,SM可产生细胞应激,磷酸化后激活p38MAPK信号通道,使促炎因子(如 IL-8、IL-6、TNF-α、IL-1β)表达上调[25]。也有学者认为,ERK信号通道的激活,可增加MMP-2活性。而炎性因子活性依赖于MAPK信号通道,诱导MAPK/ERK信号通道活化,可激活NF-κβ和ERK蛋白转录至细胞核调节转录因子活性,产生相应的细胞效应[19,23]。本研究表明,SM诱导急性肺损伤相关炎性蛋白表达与炎性因子水平关系密切。促炎因子可增加JNK和p38MAPK的活化作用,并通过活化的MAPK信号转录通道调节基因表达水平和蛋白功能[26-27]。笔者认为,腹腔和气管途径SM(1LD50)对肺所产生的生物化学效应(炎性因子和相关炎性蛋白)的差异性,推测可能与SM对腹腔的腹膜和气管的黏膜局部屏障作用的机制和作用的面积不同导致毒素吸收入血浓度的差异有关。SM可诱导肺巨噬细胞释放促炎介质和细胞因子,刺激中性粒细胞溢出和集聚[15]。在损伤部位,中性粒细胞通过脱颗粒和髓过氧化物酶释放改变肺组织的微环境,从而启动肺损伤[28]。
综上所述,SM(1LD50)染毒,经腹腔注射大鼠血清炎性因子水平和肺泡间隔相关蛋白表达明显高于经气管灌注,提示SM诱导的肺炎性反应与染毒途径有关。不同途径SM(1LD50)诱导急性肺损伤,取决于毒物作用的靶器官和代谢的基础。SM诱导的急性肺损伤毒理学机制错综复杂,引发的细胞和分子水平的炎性反应是启动肺损伤的关键环节。建立经腹腔和气管途径SM(1LD50)诱导急性肺损伤模型,可为SM肺损伤的抗炎靶向治疗提供理论依据。
参考文献
[1]NOURANI M R,FARAJPOUR Z,NAJAFI A,et al.Trefoil factor family 1 is involved in airway remodeling of mustard lung[J].Iran J Allergy Asthma Immunol,2016,15(4):275-282.
[2]JOSEPH LB,COMPOSTO G M,HECK D E.Tissue injury and repair following cutaneous exposure of mice to sulfur mustard[J].Ann N Y Acad Sci,2016,1378(1):118-123.
[3]BENSON J M,TIBBETTS B M,WEBER W M,et al.Uptake,tissue distribution,and excretion of 14C-sulfur mustard vapor following inhalation in F344 rats and cutaneous exposure in hairless guinea pigs[J].J Toxicol Environ Health,2011,74(13):875-885.
[4]JAFARI M.Dose-and time-dependent effects of sulfur mustard on antioxidant system in liver and brain of rat[J].Toxicology,2007,231(1):30-39.
[5]VIJAYARAGHAVAN R,KULKARNI A,PANT S C,et al.Differential toxicity of sulfur mustard administered through percutaneous,subcutaneous,and oral routes[J].Toxicol Appl Pharmacol,2005,202(2):180-188.
[6]SHARMA M,VIJAYARAGHAVAN R,GANESAN K.Comparison of toxicity of selected mustard agents by percutaneous and subcutaneous routes[J].Indian J Exp Biol,2008,46(12):822-830.
[7]NOURANI M R,MAHMOODZADEH HOSSEINI H,IMANI FOOLADI A A.Cellular and molecular mechanisms of acute exposure to sulfur mustard:a systematic review[J].J Recept Signal Transduct Res,2017,37(2):200-216.
[8]RAHMANI H,JAVADI I,SHIRALI S.Respiratory complications due to sulfur mustard exposure[J].Int J Curr Res Acad Rev,2016,4(6):143-149.
[9]PANAHI Y,GHANEI M,VAHEDI E,et al.Efficacy of probiotic supplementation on quality of life and pulmonary symptoms due to sulfur mustard exposure:a randomized double-blind placebo-controlled trial[J].Drug Chem Toxicol,2017,40(1):24-29.
[10]ZHU X J,XU R,MENG X,et al.Mechanistic insights of sulfur mustard-induced acute tracheal injury in rats[J].Int J Toxicol,2014,33(5):382-392.
[11]XIAOJI Z,XIAO M,RUI X,et al.Mechanism underlying acute lung injury due to sulfur mustard exposure in rats[J].Toxicol Ind Health,2016,32(8):1345-1357.
[12]MOSAYEBZADEH M,GHAZANFARI T,DELSHAD A,et al.Evaluation of apoptosis in the lung tissue of sulfur mustard-exposed individuals[J].Iran J Allergy Asthma Immunol,2016,15(4):283-288.
[13]WEINBERGER B,MALAVIYA R,SUNIL V R,et al.Mustard vesicant-induced lung injury:Advances in therapy[J].Toxicol Appl Pharmacol,2016,305:1-11.
[14]BOSKABADY M H,AMERY S,VAHEDI N,et al.The effect of vitamin E on tracheal responsiveness and lung inflammation in sulfur mustard exposed guinea pigs[J].Inhal Toxicol,2011,23(3):157-165.
[15]ASKARI N,GHAZANFARI T,YARAEE R,et al.Association between acne and serum pro-inflammatory cytokines(il-1α,il-1β,il-1ra,il-6,il-8,il-12 and rantes)in mustard gas-exposed patients:sardasht-iran cohort study[J].Arch Iran Med,2017,20(2):86-91.
[16]KANNAN G M,KUMAR P,BHASKAR A S,et al.Prophylactic efficacy of S-2(2-aminoethylamino)ethyl phenyl sulfide(DRDE-07)against sulfur mustard induced lung toxicity in mice[J].Drug Chem Toxicol,2016,39(2):182-189.
[17]PLAHOVINSAK J L,BUCCELLATO M A,REID F M,et al.Selection of non-steroidal anti-inflammatory drug and treatment regimen for sulfur mustard-induced cutaneous lesions[J].Cutan Ocul Toxicol,2016,35(3):208-217.
[18]YU D,BEI Y Y,LI Y,et al.In vitro the differences of inflammatory and oxidative reactions due to sulfur mustard induced acute pulmonary injury underlying intraperitoneal injection and intratracheal instillation in rats[J].Int Immunopharmacol,2017,47:78-87.
[19]FENG J,ZHANG Q,MO W,et al.Salidroside pretreatment attenuates apoptosis and autophagy during hepatic ischemia-reperfusion injury by inhibiting the mitogen-activated protein kinase pathway in mice[J].Drug Des Devel Ther,2017,11:1989-2006.
[20]BEN-YEHUDA GREENWALD M,FRUŠIĆ-ZLOTKIN M,SOROKA Y,et al.A novel role of topical iodine in skin:Activation of the Nrf2 pathway[J].Free Radic Biol Med,2017,104:238-248.
[21]SUN Y,ZHANG D,MAO M,et al.Roles of p38 and JNK protein kinase pathways activated by compound cantharidin capsules containing serum on proliferation inhibition and apoptosis of human gastric cancer cell line[J].Exp Ther Med,2017,14(2):1809-1817.
[22]WEI H,YUANYUAN B,DAN Y,et al.The differences of apoptosis and pulmonary fibrosis following sulfur mustard-induced acute pulmonary injury via intraperitoneal injection and intratracheal instillation in rats[J].Int J Clin Exp Med,2017,10(12):15974-15990.
[23]GHAFFARPOUR S,GHAZANFARI T,KABUDANIAN ARDESTANI S,et al.Correlation between MMP-9 and MMP-9/TIMPs complex with pulmonary function in sulfur mustard exposed civilians:sardasht-iran cohort study[J].Arch Iran Med,2017,20(2):74-82.
[24]ZHOU Y H,HAN Q F,WANG L H,et al.High mobility group box 1 protein attenuates myocardial ischemia reperfusion injury via inhibition of the p38 mitogen-activated protein kinase signaling pathway[J].Exp Ther Med,2017,14(2):1582-1588.
[25]DILLMAN JF 3RD,MCGARY K L,SCHLAGER J J.An inhibitor of p38 MAP kinase downregulates cytokine release induced by sulfur mustard exposure in human epidermal keratinocytes[J].Toxicol In Vitro,2004,18(5):593-599.
[26]CAI X,WANG X,LI J,et al.Protective effect of glycyrrhizin on myocardial ischemia/reperfusion injury-induced oxidative stress,inducible nitric oxide synthase and inflammatory reactions through high-mobility group box 1 and mitogen-activated protein kinase expression[J].Exp Ther Med,2017,14(2):1219-1226.
[27]ZHOU S,DU X,XIE J,et al.Interleukin-6 regulates iron-related proteins through c-Jun N-terminal kinase activation in BV2 microglial cell lines[J].PLoS One,2017,12(7):e0180464.
[28]PANAHI Y,JADIDI-NIARAGH F,JAMALKANDI SA,et al.Immunology of chronic obstructive pulmonary disease and sulfur mustard induced airway injuries:implications for immunotherapeutic interventions[J].Curr Pharm Des,2016,22(20):2975-2996.
