德国美利奴羊胎儿期骨骼肌组织学结构发育特征研究
2018-05-24李雪娇刘晨曦孙亚伟杨开伦刘明军
李雪娇,刘晨曦,孙亚伟,杨开伦,刘明军
(1 新疆农业大学 动物科学学院,新疆 乌鲁木齐 830000;2 新疆畜牧科学院 生物技术研究所,新疆 乌鲁木齐 830000)
绵羊一直是畜牧业的主要畜种[1]。羊肉营养价值较高,是人们日常生活中重要的肉品来源之一[2]。随着养羊业的快速发展,人们越来越注重羊肉的品质。影响肉品质的原因很多,骨骼肌肌纤维的组织学结构特征是决定肉品质的关键因素之一[3-4]。胎儿期是决定产肉性能的关键时期,胎儿期肌纤维的数量和直径影响着骨骼肌终生的生长发育,且肌纤维组成类型和比例也在胎儿期基本形成。目前关于胎儿期骨骼肌肌纤维发育的相关研究多以猪为主[5-6],反刍动物较少。胎儿期肌纤维生长发育能力影响或决定着绵羊的产肉性能,因此弄清绵羊胎儿期骨骼肌肌纤维的组织学发育性特征,对绵羊产肉性能以及肉品质性能的提高具有重要的科学意义。
家畜肌纤维形成大致可分为2个阶段,即初级纤维和二级纤维形成阶段。目前国内对于猪骨骼肌的形成及其发育规律研究相对较为成熟,猪初级纤维大约从妊娠后32 d开始形成,初级纤维形成后不久(妊娠后35 d左右)开始形成二级纤维,第85天二级纤维开始大量形成,直到妊娠第105天左右所有的肌纤维全部形成,之后肌纤维的数量保持相对稳定,直到成年[7-9]。目前,对绵羊骨骼肌发育的研究尚比较少,有学者发现绵羊妊娠后期和出生后的肌肉生长由早期肌纤维数量增加转变为肌纤维体积增大[10],此时表现为肌纤维直径和长度增加。除了肌纤维数量,肌纤维组成类型(Ⅰ型和Ⅱ型纤维)和比例也在胎儿期基本形成,并在胎儿中后期开始发育。胎儿肌纤维的形成与发育存在品种差异性,任航行[11]比较了Texel羊和乌珠穆沁羊胎儿中后期发育模型的差异,发现骨骼肌组织生长发育差异具有时段特征。这种发育模型上的差异有可能是造成产肉性能高低不同的原因。目前对绵羊胎儿期肌纤维形成和分化的大致过程基本清楚,但对于肌纤维类型的发育模型,初级纤维和二级纤维的数量、比例变化规律,以及其与不同肌纤维类型形成的关系等还有待进一步深入研究。
德国美利奴羊是由泊力考斯和英国莱斯特公羊与原产德国的美利奴羊杂交培育而成[12],具有早熟、生长发育快、产肉多、繁殖率高以及被毛品质好等优良特点。德国美利奴羊周岁母羊平均体质量可达58.67 kg,净肉率高达36.29%[13],是一种典型的肉用羊,但其骨骼肌发育机制尚不清楚。德国美利奴羊产肉性能优良,胎儿期肌纤维的生长发育能力很有可能影响其产肉性状。鉴于目前对绵羊骨骼肌肌肉发生机制的认识尚不全面,本研究选取德国美利奴羊胎儿肌纤维发育的中后期,通过研究肌纤维直径、数量、密度和肌纤维类型等组织学结构特征,探究胎儿期骨骼肌组织学生长发育特征,以期为进一步探究绵羊胎儿骨骼肌发生机制奠定基础。
1 材料与方法
1.1 试验动物
选择年龄相近、体况良好、体质量55~60 kg的成年德国美利奴母羊(购自新疆巴州种畜场),经过埋栓同期发情处理后进行人工授精配种,通过超数排卵获得胚胎并移植到身体状况相同的受体母羊,怀孕母羊均按照国家农业行业标准(NY/T 816-2004)的肉羊饲养标准,根据母羊体质量定时、定量饲喂,其后代为试验动物即德国美利奴羊胎儿。采样时间分别为怀孕母羊妊娠的第75天(D75)、第105天(D105)和第135天(D135),每组采样个体数为3只。
1.2 主要试剂
快肌抗体(Monoclonal Anti-Myosin (Skeletal,Fast) antibody produced in mouse)和慢肌抗体(Monoclonal Anti-Myosin (Skeletal,Slow) antibody produced in mouse),购自Sigma公司;伊红染液(水溶性)和苏木素染液(Harris),购自(台资)珠海贝索生物技术有限公司;DAB染色液(链霉菌-生物素法)免疫组化试剂盒,购自福州迈新生物技术开发有限公司。
1.3 样品采集及组织切片的制作
在母羊妊娠的第75,105和135天分别进行剖腹产取出胎儿,迅速采集3只胎羊的骨骼肌组织(背最长肌),液氮冻存,记录试验动物羊号、体长、体高、体质量等。所有试验动物取材部位相同,对胎儿骨骼肌组织进行常规的石蜡包埋,组织修块(6 mm×6 mm)后置于自来水中冲洗3 h以上或过夜,用体积分数50%,70%,80%,85%和90%乙醇依次各浸泡30 min,然后用体积分数95%乙醇浸泡30 min×2,体积分数100%乙醇浸泡30 min×2,使组织块完全脱水;再将组织块放入二甲苯-无水乙醇溶液(V(二甲苯)∶V(无水乙醇)=1∶1)中浸泡20 min,二甲苯中浸泡10 min×2;经过二甲苯透明后,放入60 ℃烘箱中,二甲苯-石蜡溶液(V(二甲苯)∶V(石蜡)=1∶1)浸泡1 h,放入石蜡浸泡1 h×2,最后对组织块进行包埋[14-15]。
1.4 常规HE染色
将石蜡包埋好的样品按照6 μm厚度连续切片,每个样品制作6~8张组织切片,65 ℃烘片3 h,冷却至室温,用HE染色法[16-18]对切片进行染色。将切片于体积分数100%二甲苯中浸泡15 min,重复2次,体积分数100%乙醇-二甲苯溶液(V(体积分数100%乙醇)∶V(甲苯)=1∶1)浸泡3~5 min,体积分数100%,95%,80%,70%,50%乙醇各浸泡3 min,用新鲜配制的苏木素溶液染色8~10 min后,用自来水冲洗3~5 min,置于体积分数0.5%盐酸酒精中分色蓝化3~5 s后,自来水冲洗3~5 min,再于体积分数70%,80%,90%乙醇中各浸泡3 min,用体积分数0.5%伊红溶液染色浸泡2 min,体积分数95%乙醇浸泡3 min×2;体积分数100%乙醇浸泡3 min×2;再将切片放入体积分数100%乙醇-二甲苯溶液(V(体积分数100%乙醇)∶V(二甲苯)=1∶1)浸泡3 min,100%二甲苯浸泡5 min×2,用中性树胶封片。
1.5 肌纤维类型的鉴定
使用粘附载玻片(多聚赖氨酸载玻片)切片,厚度约5 μm,每个样品切3张组织切片,放入烘箱中加热2~3 h,冷却至室温后进行脱蜡和水化,用PBS溶液冲洗3 min,重复3次进行抗原修复。将切片浸入枸橼酸缓冲液,微波中火(98~100 ℃)加热至沸腾,冷却5 min,重复2次;用PBS溶液冲洗3 min,重复3次;加内源性过氧化物酶阻断剂孵育10 min,用PBS溶液冲洗3 min,重复3次;加非特异染色阻断剂孵育10 min,用PBS溶液冲洗3 min,重复3次;分别加快肌抗体 (M4276,Sigma)和慢肌抗体(M8421,Sigma)4 ℃孵育过夜,用PBS溶液冲洗3 min,重复3次;加生物素标记的羊抗小鼠/兔IgG聚合物孵育10 min,用PBS溶液冲洗3 min,重复3次;加链霉菌抗生物素蛋白-过氧化物酶孵育10 min,用PBS溶液冲洗3 min,重复3次;加DAB显色液孵育5 min,自来水冲洗后加苏木素体细胞染色液孵育30 s,PBS溶液冲洗反蓝,梯度乙醇脱水,二甲苯透明后用中性树胶和盖玻片封片[19-20]。
1.6 分析方法
用Olympus DP2-BSW图像采集系统取10×40倍放大的图像,每个样本取5张切片进行分析,每个样品选取不重复、不缺失的10个视野。用图像分析软件(Imgae)进行数据的测量,统计单位面积肌纤维的数量、直径和面积。肌纤维数量为每个视野面积内单根肌纤维总数量的平均值,肌纤维直径为每个视野面积内肌纤维直径的平均值,肌纤维密度值为每个视野中肌纤维数量除以视野面积所得的平均值。用图像分析软件统计视野面积内快肌和慢肌数量。所测量数据用SPSS进行统计与分析,统计结果以“平均值±标准差”表示,同时对所得试验数据进行方差分析。
2 结果与分析
2.1 德国美利奴胎羊的发育情况
德国美利奴羊D75~D135胎儿体尺性状如表1所示。由表1可以看出,在妊娠的第75~135天,德国美利奴羊胎儿各项体尺指标均在不断增加。随着怀孕母羊妊娠时间的增加,胎儿体质量增加,体长和体高增长,体尺性状均呈现上升趋势。妊娠75~105 d胎儿体质量呈近5倍增长,体长、体高呈近2倍增长,妊娠105~135 d胎儿体质量呈3.5倍增长,体长、体高的增长趋势相对缓慢。

表1 德国美利奴羊胎儿期体尺性状Table 1 German Merino sheep fetal body traits
2.2 德国美利奴羊胎儿期肌纤维组织学结构特征
采用常规HE染色法对德国美利奴羊胎儿背最长肌进行组织切片分析,结果如图1所示。由图1可以看出,德国美利奴羊胎儿背最长肌细胞核被苏木素着色为蓝紫色,细胞质、间质以及纤维类物质均被伊红着色为不同程度的红色。D75胎儿骨骼肌可见中空管状的初级肌纤维典型结构,围绕在初级肌纤维的四周,形成了数量众多的次级肌纤维,此时肌纤维仍在不断形成。D105和D135胎儿骨骼肌切片未见初级肌纤维结构,而均呈现为次级肌纤维结构。表明在妊娠105 d之前,初级肌纤维已经与次级肌纤维融合,肌纤维的形成已经完成。妊娠135 d时,视野内单根肌纤维面积明显增大,且肌间脂肪含量逐渐降低,肌纤维直径显著增粗,且排列紧密。
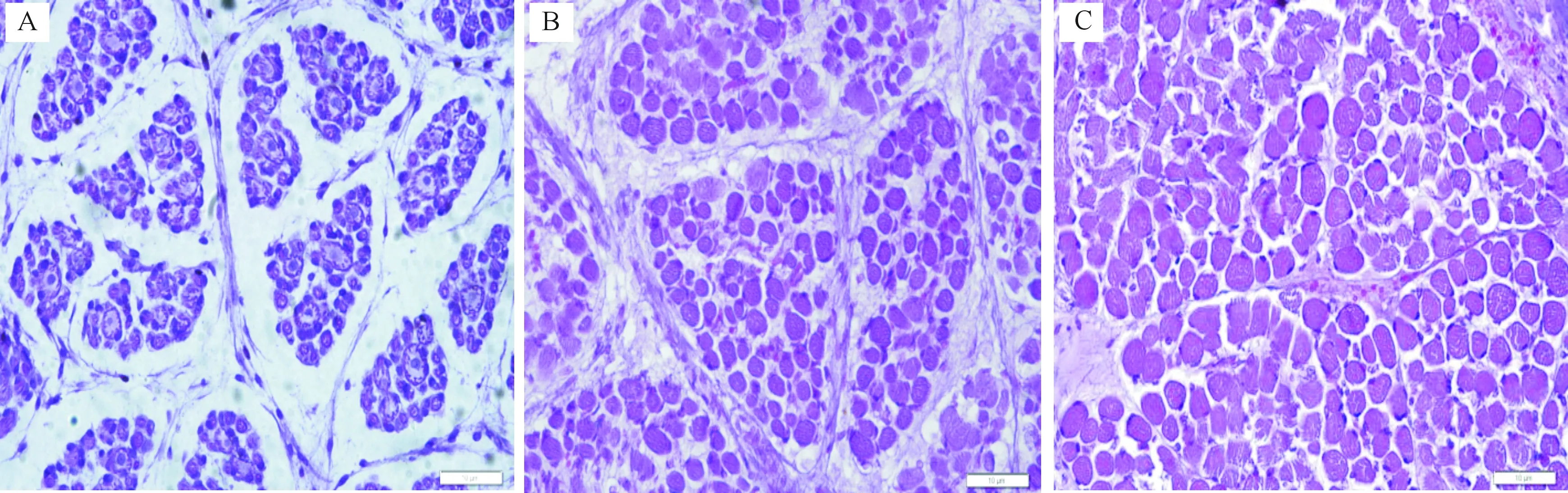
A.D75;B.D105;C.D135图1 德国美利奴羊胎儿期不同发育时期背最长肌的HE染色观察(10×40)Fig.1 German Merino sheep fetus at different developmental stages of longissimus muscle HE staining result(10×40)
单位面积肌纤维数量、直径是肌纤维组织结构最重要的2个特征。本研究针对德国美利奴羊胎儿的背最长肌组织,统计分析了单位面积肌纤维数量、直径和单位面积,结果如表2所示。由表2可以看出,D75胎儿单位面积肌纤维数量较少,为(310.23±77.15) 根;D105胎儿单位面积肌纤维数量最大,为(369.41±72.64) 根,D135胎儿单位面积肌纤维数量为(301.80±41.76) 根,低于D105胎儿。可见,从D75至D105,单位面积肌纤维数量逐渐增加,于D105时单位面积肌纤维数量达到最高,但肌纤维数量在3个时期间无统计学差异。从D75至D135肌纤维直径逐渐增大,胎儿肌纤维直径由(1.80±0.26) μm发育至(2.91±0.25) μm,单位面积肌纤维直径增粗了1.6倍,且D75至D105胎儿肌纤维直径的增长幅度较为平缓,D105至D135胎儿肌纤维直径的增长幅度显著增大。肌纤维面积随发育阶段呈现递增趋势,而肌纤维密度随发育阶段呈现先高后低的变化趋势,D105时期胎儿单位面积肌纤维密度最大,达6.82根/μm2。

表2 德国美利奴羊胎儿期单位面积肌纤维数量、直径的统计结果Table 2 The statistical results of quantity,Germany Merino sheep fetal unit area of muscle fiber diameter
注:“*”表示该时期与其他时期相比差异显著(P<0.05)。
Note: The“*”stand for the period is significant compared with other periods(P<0.05).
2.3 德国美利奴羊胎儿期肌纤维类型的变化规律
使用快肌抗体 (M4276,Sigma)和慢肌抗体(M8421,Sigma),通过DAB染色液(链霉菌-生物素法)免疫组化方法对德国美利奴羊胎儿不同发育时期背最长肌进行染色,结果如图2所示。由图2可以看出,DAB染色液会使相应抗原出现区域沉淀,使相应抗原存在处显示浅黄色、棕黄色或是褐色,苏木素体细胞染色液可将细胞核染至浅蓝色。D75胎儿单位面积快肌数量较少而慢肌数量较多,中空的初级纤维结构均为慢肌,围绕在初级纤维四周的次级纤维为快肌。D105和D135胎儿单位面积快肌数量明显增加,而慢肌数量逐渐减少。
用图像分析软件统计单位面积快、慢肌数量,结果如表3所示。由表3可以看出,单位面积德国美利奴羊D75胎儿骨骼肌褐色快肌数量较少,为(178.86±5.22) 根;D105胎儿快肌数量最多,为(323.75±6.13)根;D135胎儿快肌数量为(281.86±5.64) 根,低于D105胎儿快肌数量,总体上来看,快肌数量随胎龄增大呈先增加后减少趋势。与快肌数量的变化不同,胎儿单位面积慢肌数量随胎龄增加而逐渐减少,D75时最多,为(83.4±5.36)根, D135时慢肌数量最少,为(23.9±3.45) 根。德国美利奴羊胎儿不同发育阶段相比,骨骼肌快、慢肌数量的差异均达极显著水平(P<0.01)。从肌纤维密度来看,D105时期单位面积快肌密度最大,达5.97 根/μm2,D75时期单位面积慢肌密度最大,为1.54根/μm2。
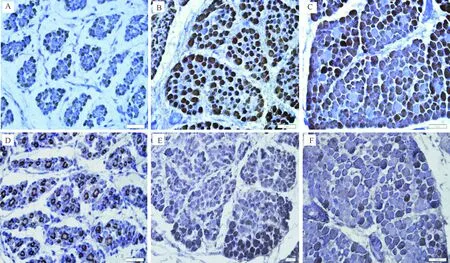
A.D75(快肌);B.D105(快肌);C.D135(快肌);D.D75(慢肌);E.D105(慢肌);F.D135(慢肌)A.D75 (Fast muscle);B.D105 (Fast muscle);C.D135 (Fast muscle);D.D75 (Slow muscle);E.D105 (Slow muscle);F.D135 (Slow muscle)图2 德国美利奴羊胎儿期不同发育时期背最长肌快慢肌免疫组化染色结果(10×40)Fig.2 German Merino sheep fetus at different developmental stages of longissimus muscle skeletal muscles immunohistochemical staining results(10×40)

胎龄Gestationalage快肌数量/根Numberoffastmuscle慢肌数量/根Numberofslowmuscle快肌密度/(根·μm-2)Fastmuscledensity慢肌密度/(根·μm-2)SlowmuscledensityD75178.86±5.22**83.4±5.36**3.301.54D105323.75±6.13**61.5±20.64**5.971.13D135281.86±5.64**23.9±3.45**5.200.44
注:“**”表示该时期与其他时期相比差异极显著(P<0.01)。
Note:The“**”stand for the period is very significant compared with other periods(P<0.01).
3 讨 论
国内外对家畜肌纤维组织学特性的研究大多以出生后为主,且相关研究最早见于肉牛。如Crouse[21]1972年首次研究了牛肉肌纤维的组织学结构特征。之后Cornforth等[22]发现,牛肉肌纤维横截面积随日龄的增加而增加,Cassens等[23]发现,肌纤维越细则肌纤维密度就越大,且肌肉横截面纹理呈天鹅绒状则表示肉品质优良。秦宁等[24]对长白山野猪和东北民猪骨骼肌组织学特性的研究发现,猪肌纤维直径与密度呈显著负相关。总的来看,目前对家畜胎儿不同发育阶段肌纤维生长发育的数据结果尚较为缺乏。
中国农业科学院任航行[11]比较了特克塞尔(Texel)和乌珠穆沁绵羊不同发育阶段胎儿骨骼肌的组织细胞学特征,发现多个与肌肉发生及生肌细胞增殖相关的基因在胎儿特定发育期的表达差异显著,并且发现Texel在D85阶段数目上有明显增加,而乌珠穆沁绵羊肌纤维数则在D105时明显增加。刘卫娟[25]研究发现,随着怀孕母羊妊娠时间的增加,胎儿体质量、体长、体高逐渐增加,肌纤维的直径呈递增趋势,相应的肌纤维密度也发生了变化。本研究结果显示,德国美利奴羊胎儿肌纤维数量在D105阶段达到峰值,骨骼肌中期发育主要以肌纤维数量的增加为主,到D105左右肌纤维数量基本恒定,而胎儿骨骼肌后期发育主要以肌纤维面积的增大为主,且发育至后期胎儿肌纤维排列紧致,肌间脂肪含量较少。
根据肌肉收缩功能的不同,可将肌纤维类型分为慢收缩肌Ⅰ型和快收缩肌Ⅱ型[23,26],Ⅱ型肌纤维又可分为快速氧化型(ⅡA型)、快速酵解型(ⅡB型)和中间型肌纤维(ⅡX型)3类[24-25]。Ⅰ型肌纤维收缩较慢且持久,其中与肌纤维收缩能力相关的ATP酶活性较低。ⅡB型肌纤维由于其ATP酶活性较高, 因此其收缩快而短[28]。ⅡX型肌纤维收缩能力和代谢特性均处于ⅡA型和ⅡB型肌纤维之间[29-30]。肌纤维类型与肉品质息息相关[31],氧化性肌纤维(Ⅰ型肌纤维)比例较高时,肉品质嫩度优良,而PSE肉和瘦肉率等与ⅡB型肌纤维含量有关[32]。因此,肌纤维类型的研究不仅具有分子学意义,而且对肉品质的改良也起着重要指导作用。本研究通过免疫组化分析,结果发现中空的初级纤维结构均为慢肌,次级纤维大多数以快肌为主。D75时胎儿次级纤维成倍围绕在初级纤维四周,发育后期胎儿骨骼肌快肌纤维数量逐渐增加,慢肌纤维数量随胎龄的增加而逐渐减少,发育至D135慢肌数量极少。肌纤维类型的变化规律表现为:快肌数量整体呈先增加后降低趋势,而慢肌数量呈逐渐下降趋势。
综上所述,本研究探究了德国美利奴羊胎儿骨骼肌组织学结构以及肌纤维类型的变化规律,确定了德国美利奴羊胎儿妊娠的第105天是肌纤维从肌增生到肌肥大的关键时间窗口,肌纤维类型早期发育主要以慢肌(Ⅰ型肌纤维)为主,后期发育主要以快肌(Ⅱ型肌纤维)为主。本研究为进一步探究绵羊胎儿骨骼肌发生机制奠定了基础,并为提高绵羊产肉量和肉品质性能研究提供了理论依据。
[参考文献]
[1] 蒋小怀.新疆养羊业生产形势分析与发展对策研究 [J].草食家畜,2014(2):1-5.
Jiang X H.Study on the production situation and development countermeasures of Xinjiang sheep industry [J].Grass-Feeding Livestock,2014(2):1-5.
[2] 赵有璋.羊生产学 [M].北京:中国农业出版社,1993.
Zhao Y Z.Production science of sheep and goat [M].Beijing:China Agriculture Press,1993.
[3] 周金星,毕亚玲,高登惠.肌肉组织学结构及其与肉品品质的关系 [J].山地农业生物学报,2004,23(5):438-441.
Zhou J X,Bi Y L,Gao D H.The relationship between structure and meat quality and muscle tissue [J].Journal of Mountain Agriculture and Biology,2004,23(5):438-441.
[4] 赵 晓,莫德林,张 悦,等.猪的骨骼肌生长发育研究进展 [J].生命科学,2011,23(1):37-44.
Zhao X,Mo D L,Zhang Y,et al.Research progress on skeletal muscle growth and development in pigs [J].Chinese Bulletin of Life Sciences,2011,23(1):37-44.
[5] 刘居鹏,单安山,彭济昌.猪肌纤维发育及其与肉质的关系 [J].中国饲料,2006(16):11-14.
Liu J P,Shan A S,Peng J C.Development of porcine muscle fiber and its relationship with meat quality [J].China Feed,2006(16):11-14.
[6] 郭云雁,王立贤,程笃学,等.猪肌纤维组织学特性研究进展 [J].中国畜牧兽医,2007,34(8):49-52.
Guo Y Y,Wang L X,Cheng D X,et al.Research progress on histological characteristics of porcine muscle fibers [J].China Animal Husbandry and Veterinary Medicine,2007,34(8):49-52.
[7] Wilson D A,Baker G J,Pijanowski G J,et al.Composition and morphologic features of the interosseous muscle in Standardbreds and Thoroughbreds [J].Am J Vet Res,1991,52(1):133-139.
[8] Ashmore C R,Addis P B,Doerr L.Development of muscle fibers in the fetal pig [J].J Anim Sci,1973,36(6):1088-1093.
[9] Wigmore P M,Stickland N C.Muscle development in large and small big fetuses [J].Journal of Anatomy,1983,40(137):235-245.
[10] Zhu M J,Ford S P,Nathanielsz P W,et al.Effect of maternal nutrient restriction in sheep on the development of fetal skeletal muscle [J].Biol Reprod,2004,71(6):1968-1973.
[11] 任航行.Texel与乌珠穆沁绵羊妊娠中、后期胎儿骨骼肌基因表达谱及组织学分析 [D].北京:中国农业科学院,2010.
Ren H X.Texel and ujumqin sheep in late pregnancy, fetal skeletal muscle profiles of gene expression and histological analysis [D].Beijing:Chinese Academy of Agricultural Sciences,2010.
[12] 陈晓涛,章焕然,陈伟德.德国美利奴羊在新疆的应用前景 [J].草食家畜,2003(1):9-10.
Chen X T,Zhang H R,Chen W D.The German Merino sheep application in Xinjiang [J].Grass-Feeding Livestock,2003(1):9-10.
[13] 蒋烈戈,李勇忠,景亚平,等.德国美利奴羊与中国美利奴羊主要生产性能比较 [J].中国草食动物科学,2013,33(6):78-79.
Jiang L G,Li Y Z,Jing Y P,et al.The German Merino sheep and Chinese Merino sheep production performance comparison [J].China Herbivores Science,2013,33(6):78-79.
[14] 陈 璐,马恒辉,金邦茎.骨骼肌组织石蜡制片技术的改进 [J].临床与实验病理学杂志,2008,24(2):233-234.
Chen L,Ma H H,Jin B J.Improvement of paraffin sectioning technique for skeletal muscle tissue [J].Chinese Journal of Clinical and Experimental Pathology,2008,24(2):233-234.
[15] 李 艳,高友晶,张 喜,等.细胞石蜡包埋切片技术的应用 [J].江汉大学学报(自然科学版),2011,39(1):72-74.
Li Y,Gao Y J,Zhang X,et al.Application of cell paraffin embedded section technique [J].Journal of Jianghan University (Natural Science Edition),2011,39(1):72-74.
[16] 王 巧.HE染色方法在临床病理诊断中的应用 [J].临床合理用药杂志,2014(32):118-119.
Wang Q.Application of HE staining method in clinical pathological diagnosis [J].Journal of Clinical Rational Drug Use,2014(32):118-119.
[17] 张 敏.HE染色在临床病理诊断中的应用 [J].齐齐哈尔医学院学报,2011,35(4):552-553.
Zhang M.Clinical application of HE staining in clinical pathological diagnosis [J].Journal of Qiqihar University of Medicine,2011,35(4):552-553.
[18] 刘增辉.病理染色技术 [M].北京:人民卫生出版社,2001:14.
Liu Z H.Pathological staining technique [M].Beijing:People Health Publishing House,2001:14.
[19] 吴秉铨,刘彦仿.免疫组化学病理诊断 [M].北京:北京科学技术出版社,2007.
Wu B Q,Liu Y F.Immunohistochemical pathological diagnosis [M].Beijing:Beijing Science and Technology Press,2007.
[20] 张卫琴.免疫组化技术在病理诊断中的应用 [J].安徽医药,2012,16(11):1700-1702.
Zhang W Q.Application of immunohistochemical technique in pathological diagnosis [J].Anhui Medical and Pharmaceutical Journal,2012,16(11):1700-1702.
[21] Crouse H R.Palatability of individual muscles from bovine leg steaks as related to chemical and histologocal traits [J].J Food Sci,1972,37:282-287.
[22] Cornforth D P,Hecker A L,Cramger D A,et al.Maturity and its relationship to muscle characteristics of cattle [J].Journal of Animal Science,1980,50:75-80.
[23] Cassens R G,Rymkiewicz J,Szeremeta J,et al.The importance of myofiber type [J].Food Microstructure,1984,3:1-7.
[24] 秦 宁,徐日福,张树敏,等.长白山野猪和东北民猪骨骼肌组织学特性比较 [J].吉林农业大学学报,2012,34(3):343-347.
Qin N,Xu R F,Zhang S M,et al.Comparison of histological characteristics of skeletal muscle between Changbai Mountain wild boar and Northeast China pig [J].Journal of Jilin Agricultural University,2012,34(3):343-347.
[25] 刘卫娟.几种肉羊肌肉组织学形状和理化性状的研究 [D].河北保定:河北农业大学,2009.
Liu W J.Several studies of the shape and physical-chemical properties of the muscle groups were studied [D].Baoding,Hebei:Agricultural University of Hebei,2009.
[26] Ausoni S,Gorza L,Schiaffino S,et al.Expression of myosin heavy chain isoforms in stimulated fast and slow rat muscles [J].The Journal of Neuroscience,1990,10:153-160.
[27] 杨飞云.猪骨骼肌肌纤维类型分布及转化的分子机理研究 [D].四川雅安:四川农业大学,2008.
Yang F Y.Study on the distribution and transformation of muscle fiber types in porcine skeletal muscle [D].Ya’an,Sichuan:Sichuan Agricultural University,2008.
[28] 高儒松,程志斌,杨正华.肌纤维类型与猪肉品质的关系 [J].中国畜牧兽医,2009,36(4):191-195.
Gao R S,Cheng Z B,Yang Z H.Relationship between muscle fiber types and pork quality [J].China Animal Husbandry and Veterinary Medicine,2009,36(4):191-195.
[29] 罗 军.肌肉纤维特性研究进展 [J].黄牛杂志,1989,5(4):36-40.
Luo J.Research progress of muscle fiber characteristics [J].Journal of Yellow Cattle Science,1989,5(4):36-40.
[30] 杨飞云,陈代文,黄金秀,等.猪背最长肌肌纤维类型的发育性变化及品种与营养影响特点 [J].畜牧兽医学报,2008,39(12):1701-1708.
Yang F Y,Chen D W,Huang J X,et al.The developmental changes of muscle fiber types in longissimus dorsi muscle of pigs and the characteristics of the variety and nutrition [J].Chinese Journal of Animal and Veterinary Sciences,2008,39(12):1701-1708.
[31] 杨晓静,赵茹茜,陈 杰,等.猪背最长肌肌纤维类型的发育性变化及其品种和性别特点 [J].中国兽医学报,2005,25(1):89-94.
Yang X J,Zhao R Q,Chen J,et al.Developmental changes of muscle fiber types and characteristics of breed and sex of longissimus dorsi muscle in pigs [J].Chinese Journal of Veterinary Science,2005,25(1):89-94.
[32] Engel W K.The essentiality of histo and cytochemical studies in the investigation of meuromuscular disease [J].Neurology,1962,12:778-784.
