芍药苷通过cAMP-PKA信号通路对心肌梗死大鼠保护作用的实验研究
2018-05-24王建发赵国安
王建发,赵国安
心肌梗死(MI)指冠状动脉闭塞,血流中断,使部分心肌因严重的持久性缺血而发生局部坏死[1]。临床主要表现为剧烈而持久的胸骨后疼痛,发热、白细胞增多、血清心肌酶活力增高及进行性心电图变化等,可导致心律失常、休克或心力衰竭,严重威胁人类健康[2]。MI的发病机理复杂多样,目前针对其治疗方法包括调整生活方式、药物控制及手术治疗等,但调整生活方式耗时且收效甚微、西药长期治疗毒副作用大及手术创伤性大等不足,严重阻碍MI患者的治疗和预后。在此背景下,中医药针对心血管疾病防治的多途径、多靶点及整体调节的治疗方针优势凸显[3,4]。本研究通过探讨芍药苷对MI大鼠的保护作用,并初步探究其中所涉及的相关分子机制,为临床MI的治疗方法提供理论参考。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 SPF级SD大鼠,64只,雌雄各半,体质量240~280 g,合格证号:SCXK-(吉)2003-0001,由吉林大学基础医学院动物试验中心提供。饲养环境:室温18~22℃、相对湿度40%~50%,标准饲料和水饲养。
1.1.2 实验药物 盐酸异丙肾上腺素注射液,CAS号:51-30-9,规格:1 mg,厂家:湖北广奥生物科技有限公司;缬沙坦胶囊,国药准字:H20040217,规格:80 mg,厂家:北京诺华制药有限公司;芍药苷,纯度≥90%,批号:20140912,厂家:宁波德康生物制品有限公司。
1.1.3 实验试剂 总RNA提取试剂盒,逆转录试剂盒、实时荧光定量PCR试剂盒均购自上海酶联生物科技有限公司;Western blot印迹全套试剂盒,购于上海西宝生物科技有限公司;肌酸激酶(CK)、乳酸脱氢酶(LDH)、超氧化物歧化酶(SOD)试剂盒均购自南京建成生物工程研究所;cAMP 、PKA、pPKA ELISA试剂盒,均购自上海纪宁实业有限公司。
1.2 实验方法
1.2.1 动物模型的建造 SD大鼠均参照文献[5,6]采用结扎冠状动脉前降支构建大鼠心肌梗死模型:①以水合氯醛腹腔注射350 mg/kg进行麻醉,麻醉满意后将大鼠以仰位固定;②对大鼠气管进行插管建立呼吸辅助通道;③手术区备皮,消毒,开胸并暴露心脏;④结扎冠状动脉前降支:撕开心包膜后,以左冠状静脉为标志,在左心耳与肺动脉圆锥之间,距主动脉根部2 mm处结扎左冠状动脉前降支。⑤关胸,清除腹腔内积血,连接缝合肋间肌,并通过挤压大鼠胸壁排出胸腔内气体,恢复胸腔负压状态,迅速闭合胸腔,缝合,消毒。⑥断开呼吸机,大鼠自主呼吸稳定后拔管,清理呼吸道,单笼喂养。结扎后左室壁苍白或变紫,并出现活动减弱,心电图ST段抬高,表明结扎成功。另取10只SD大鼠作为假手术组,不结扎,其余步骤同上。手术3 h后,腹腔注射3.5 ml/kg水合氯醛,使其全身麻醉,稳定5 min后,以Medlab生物信号采集处理系统采集大鼠心电图信号并传入电脑,记录假手术组与造模组大鼠Ⅱ导联心电图中ST段的变化。造模过程中4只大鼠因麻药过量导致造模失败。
1.2.2 动物分组及给药 将建模成功后大鼠随机分为阳性对照组(以10 mg/kg缬沙坦灌胃给药),芍药苷低、中、高剂量组(分别以25 mg/kg、50 mg/kg、100 mg/kg灌胃给药),模型组及假手术组(以等量生理盐水灌胃),1/d,连续给药4周。
1.2.3 样本采集 给药4周后,于腹主动脉采血,3500 r/min离心15 min,分离血清,存于-80℃冰箱中备用;取血结束后,以静注氯化钾处死大鼠,打开胸腔,取出心脏,心脏标本以4%甲醛固定,石蜡包埋,备用。
1.2.4 各组大鼠血清酶学变化的检测 检测血清中肌酸激酶(CK)、乳酸脱氢酶(LDH)、超氧化物歧化酶(SOD)的活力变化,实验步骤分别按照试剂盒操作说明书进行。
1.2.5 各组大鼠心肌组织形态学变化 取石蜡包埋的心肌标本,切片,每个标本取3~5张不连续的切片;常规脱蜡处理后,加苏木素染液5 min后,水洗;分别再以盐酸乙醇-氨水处理;以酸化伊红乙醇复染,自来水终止染色;以梯度酒精进行脱水处理,二甲苯透明后中性树胶封片,于显微镜下观察心肌组织的病理变化。
1.2.6 各组大鼠心肌梗死面积的测定 参照文献[7]方法,在做冠状动脉结扎点以下垂直于长轴横断片段切片,切片厚度4 μm,以Image Pro Plus 6.0专业图像分析软件计算心肌梗死面积(IS),梗死面积(%)=[(左心室梗死部位心内膜长/总心内膜周长)/2]+[(左心室梗死部位心外膜长/总心外膜长)/2]×100 %。
1.2.7 各组大鼠心肌组织中cAMP、PKA及pPKA表达检测 Western blot检测大鼠心肌组织中cAMP、PKA及pPKA蛋白表达,血管总蛋白的提取:取大鼠的心肌组织于研钵中,加入300 UI裂解液(按照说明书配制1 mmol/L的PMSF),于冰上进行研磨10 min、充分振荡并静置10 min后,在4℃以14000 r/min离心8 min,取上清即得总蛋白;以BCA法检测蛋白浓度,分别取60 μg总蛋白,以5倍量上扬缓冲液稀释后,置于95℃变性5 min,备用;Western blot检测:将变性蛋白置于120 g/L的SDS-PAGE中进行电泳,而后分别加入一抗cAMP、PKA及pPKA于4℃孵育过夜,再以辣根过氧化酶结合的山羊抗兔孵育后,采用BeyoECL Plus 发光检测。检测完毕进行免疫印迹清除,再检测β-actin,方法同上。一图像分析软件对条带进行灰度分析,以目的蛋白灰度值与内参β-actin灰度值的比值反应蛋白的相对表达水平。
1.2.8 各组大鼠心肌组织中pCREB蛋白表达检测采用免疫组化法检测大鼠心肌组织中pCREB蛋白表达情况:将石蜡切片进行脱蜡、脱水、枸橼酸缓冲液抗原修复,同时采用H2O23%漂洗,将内源性过氧化酶活性去除;接着采用triton 4%在4℃下孵育24 h、山羊血清封闭,37℃孵育20 min。甩去封闭血清后,滴加1:800的pCREB一抗、二抗,HRP、DAB显色、苏木素复染、盐酸分化3 s、碳酸锂30 s泛蓝; 逆浓度酒精脱水、封片前二甲苯透明15 min、中性树脂封片。最后采用Image-Pro Plus 6.0软件分析。
1.3 统计学方法 采用SPSS 20.0软件对本研究中数据进行统计学处理,计量资料用均数±标准差(±s)描述,两组间比较采用t检验,多组间比较采用方差分析,P<0.05表示两组差异有统计学意义。
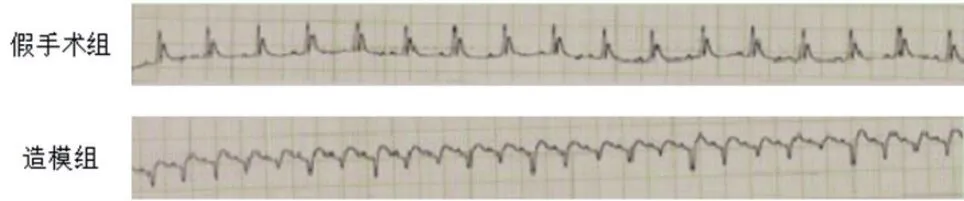
图1 假手术组与造模组心电图对比
表1 各组血清酶学指标测定(±s)
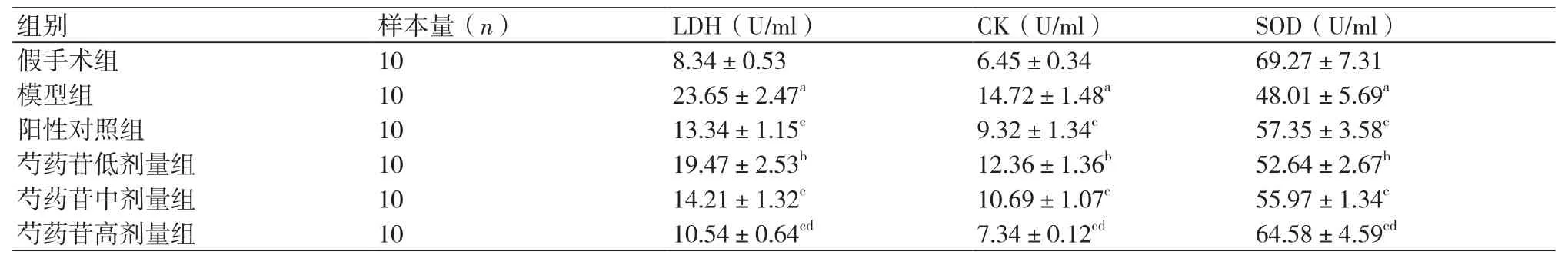
表1 各组血清酶学指标测定(±s)
注:LDH:乳酸脱氢酶;CK:肌酸激酶,SOD:超氧岐化酶;与假手术组比较,aP<0.01;与模型组比较,bP<0.05,cP<0.01;与阳性对照组比较,dP<0.05
组别 样本量(n) LDH(U/ml) CK(U/ml) SOD(U/ml)假手术组 10 8.34±0.53 6.45±0.34 69.27±7.31模型组 10 23.65±2.47a 14.72±1.48a 48.01±5.69a阳性对照组 10 13.34±1.15c 9.32±1.34c 57.35±3.58c芍药苷低剂量组 10 19.47±2.53b 12.36±1.36b 52.64±2.67b芍药苷中剂量组 10 14.21±1.32c 10.69±1.07c 55.97±1.34c芍药苷高剂量组 10 10.54±0.64cd 7.34±0.12cd 64.58±4.59cd
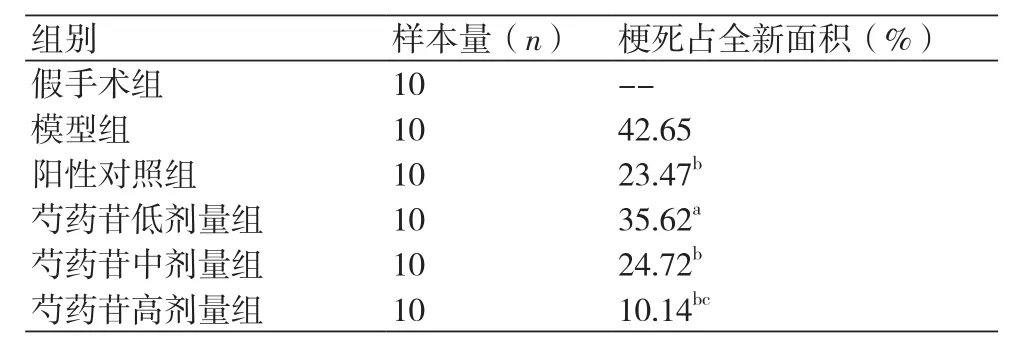
表2 各组大鼠心肌梗死面积的比较
表3 各组大鼠血浆中cAMP表达水平比较(±s)

表3 各组大鼠血浆中cAMP表达水平比较(±s)
注:与假手术组比较,aP<0.01;与模型组比较,bP<0.05,cP<0.01;与阳性对照组比较,dP<0.05
组别 样本量(n) cAMP(nmol/L)假手术组 10 35.72±4.21模型组 10 16.72±2.53a阳性对照组 10 24.67±3.38c芍药苷低剂量组 10 20.97±2.49b芍药苷中剂量组 10 26.37±4.15c芍药苷高剂量组 10 32.72±3.49cd
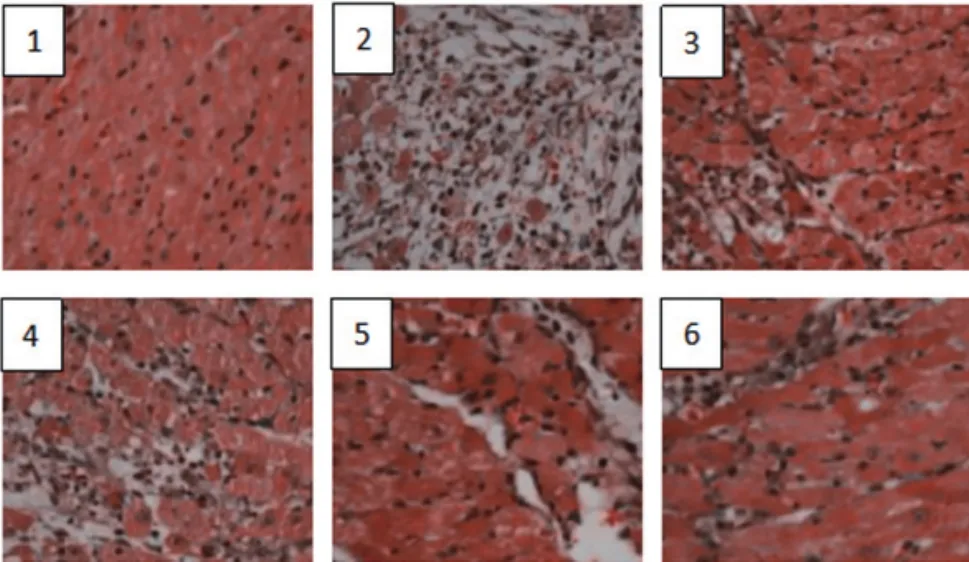
图2 各组心肌组织形态学变化(×200)
2 结果
2.1 假手术组与造模组大鼠心电图变化 假手术组心电图各导联无ST段变化,造模组心电图中导联ST段明显抬高,提示MI模型造模成功,可供后续实验(图1)。
2.2 各组大鼠血清酶学变化测定 给药4周后,各治疗组大鼠血清中CK、LDH活性均显著降低(P<0.05),SOD活性均显著升高(P<0.05);随芍药苷剂量的增加,血清中CK、LDH活性均逐渐降低,SOD活性逐渐升高,且差异均具有统计学意义(P<0.05);且芍药苷高剂量组血清CK指标接近假手术组(表1)。
2.3 各组大鼠心肌组织形态学变化测定 假手术组心肌细胞完整,细胞核基本无变化;模型组心肌损伤明显,细胞核固缩或碎裂,部分细胞核溶解,心肌细胞坏死。各给药组病例症状均有改善,且阳性对照组及芍药苷中、高剂量组改善明显(图2)。
2.4 各组MI面积的测定 给药4周后,各治疗组大鼠MI面积均明显减小;随芍药苷剂量增加,MI面积减小,差异有统计学意义(P<0.05)(表2)。
2.5 各组心肌组织中cAMP表达水平的测定 给药4周后,各治疗组大鼠心肌组织中cAMP的表达水平均显著上调;随芍药苷剂量的增加,cAMP的表达水平逐渐上调,且差异具有统计学意义(P<0.05);芍药苷高剂量组cAMP的表达水平接近假手术组(表3)。
2.6 各组心肌组织中PKA/pPKA表达水平的测定给药4周后,各组间PKA表达水平均无显著性差异(P>0.05);各治疗组大鼠心肌组织中pPKA的表达水平均显著上调;随芍药苷剂量的增加,pPKA的表达水平逐渐上调,差异具有统计学意义(P<0.05);且芍药苷高剂量组PKA的表达水平接近假手术组(表4、图3)。
2.7 各组心肌组织中pCREB蛋白表达水平的测定 给药4周后,各治疗组大鼠心肌组织中pCREB蛋白的表达水平均显著上调;随芍药苷剂量的增加,pCREB蛋白的表达水平逐渐上调,差异具有统计学意义(P<0.05);芍药苷高剂量组pCREB蛋白表达明显高于阳性对照组和模型组(P<0.05)(表5)。
表4 各组大鼠心肌组织中PKA表达水平比较(±s)
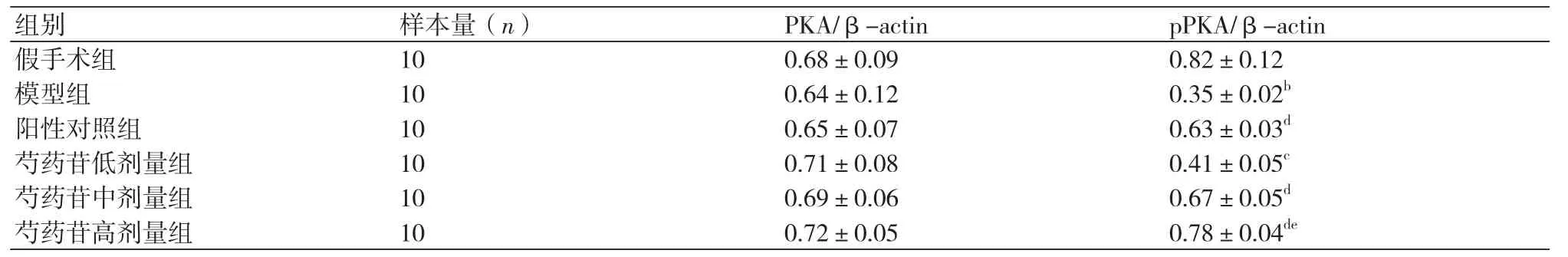
表4 各组大鼠心肌组织中PKA表达水平比较(±s)
注:与假手术组比较,aP<0.05,bP<0.01;与模型组比较,cP<0.05,dP<0.01;与阳性对照组比较,eP<0.05
组别 样本量(n) PKA/β-actin pPKA/β-actin假手术组 10 0.68±0.09 0.82±0.12模型组 10 0.64±0.12 0.35±0.02b阳性对照组 10 0.65±0.07 0.63±0.03d芍药苷低剂量组 10 0.71±0.08 0.41±0.05c芍药苷中剂量组 10 0.69±0.06 0.67±0.05d芍药苷高剂量组 10 0.72±0.05 0.78±0.04de
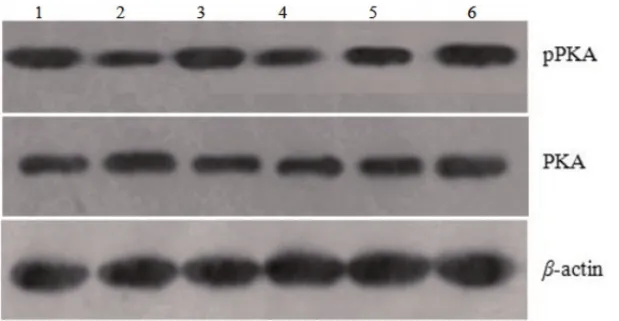
图3 各组大鼠心肌组织中PKA蛋白表达量变化

表5 各组心肌组织中pCREB蛋白表达水平
3 讨论
MI是临床内科常见的危急重症,随着现代生活节奏的加快、饮食结构的调整及人口老龄化的影响,MI的发病率呈现出逐年增高的趋势,且其居高不下的死亡率给患者及家庭带来极大威胁[8]。临床针对MI诊断主要是通过观察心电图、测定血清酶学中相关指标(如CK、LDH、SOD等)变化[9]、病理学检查及MI面积的观察等手段,故针对临床疗效的评价同样可以以这些指标的变化作为参考。
目前西医主要认为MI发病是冠状动脉硬化、血栓形成导致血管堵塞,使心肌严重缺血缺氧所致[10];中医则将其归属为“真心痛”、“胸痹”、“厥心痛”的范畴,属于本虚标实之证,本虚是指气、血、阴、阳亏虚;标实是指血瘀、痰浊、寒凝、气滞等证,其中以气虚痰瘀为主要病理机制[11,12]。对应的治疗原则亦有所差异:西药虽在治疗疾病时具有起效快速的特点,但针对MI疾病特点,所需治疗病程长、服药量大,西药无法兼顾整体且副作用大的缺点,导致其在临床MI的治疗方面逊色于中医药治疗。中医药针对MI的治疗,从病机出发,多采用益气活血祛瘀之法,且中药及其复方针对MI的治疗具有多层次、多靶点、多途径综合作用的优势,使得中药治疗MI逐渐成为临床治疗MI的首选。
芍药苷是从毛茛科植物芍药中提取出的单帖糖苷类单体成分,为芍药根中的生物活性成分,近年来国内外学者对芍药苷的心血管方面的药理作用进行了大量深入的研究,发现其对心肌缺血所致的心肌损伤具有保护作用,且疗效显著[13],但其具体作用机理仍待进一步研究。于蓓等研究表明,芍药苷可能通过稳定细胞膜、抑制心肌损伤、降低脂质的过氧化等发挥对心肌损伤的保护作用[14]。而本研究结果显示,治疗后随芍药苷剂量的增加,血清中CK、LDH活性均逐渐降低,SOD活性均逐渐升高,明显减轻心肌细胞坏死症状,MI面积显著减小(P<0.05),此结果证明芍药苷预处理对大鼠心肌缺血再灌注损伤具有一定的保护作用。另外王微等研究结果表明,通过芍药苷预处理对大鼠心肌缺血的保护机制可能与下调NF-κB的蛋白表达有关[15]。郝霁萍等研究表明,芍药苷可能通过促进PPARα的蛋白表达,进而抑制血清中TNF-α、ICAM-1的含量减轻缺血心肌的炎症反应,实现对心肌组织的保护作用[16,17]。高宇勤等研究表明,芍药苷可能通过上调AMPKα的表达水平,促进其磷酸化,进而减轻心肌损伤[18]。上述研究表明芍药苷可通过多途径、多靶点实现对损伤心肌的保护。
cAMP-PKA信号通路为最早发现的细胞内信息传递系统之一,经国内外大量研究表明,其通路的信息传递过程主要包括:外部信号通过结合细胞膜上特异性受体,激活G-蛋白及腺苷酸活化酶,进而促进三磷酸腺苷转化为cAMP,cAMP通过促进PKA将特异性的蛋白质磷酸化为pPKA,引起细胞效应[19]。pCREB是CREB蛋白的磷酸化形式,同时也是cAMP-PKA信号通路的主要下游蛋白,pCREB在正常大鼠中蛋白表达量较少,其主要位于细胞核内,核仁染色呈现棕黄色。Inserte等研究结果表明,心肌组织中cAMP水平升高,促进pPKA的激活,进而通过心肌细胞中的Ca2+通道产生对心肌细胞的保护作用[20]。韩劲松等研究表明,二氮嗪可能通过cAMP-PKA信号通路的调控机制实现对心肌细胞的保护[21]。Zhang等研究普萘洛尔对损伤心肌保护作用机制,表明通过cAMP-PKA信号通路可调控对心肌细胞的保护作用[22]。本研究通过cAMP-PKA信号通路对MI大鼠保护作用进行分析发现,心肌组织中PKA表达无显著变化(P>0.05);但cAMP及pPKA表达水平均显著上调,以上研究结果表明心肌细胞的保护作用机制可以通过调节cAMP-PKA信号通路进行实现。同时本研究结果还显示,各指标变化程度均呈剂量相关性,芍药苷高剂量组血清激酶指标及cAMP、pPKA表达水平均接近假手术组,芍药苷高剂量组pCREB蛋白表达也明显高于阳性对照组和模型组,进一步证明,高剂量芍药苷可通过调节cAMP-PKA信号通路中的cAMP、PKA及pCREB蛋白表达增加达到保护作用。
综上所述,芍药苷对心肌梗死大鼠的保护作用可能是通过调节cAMP-PKA信号通路中的cAMP及PKA的表达实现,且治疗作用具有剂量相关性。但其具体的作用机制仍有待于进一步临床验证。
参 考 文 献
[1]朱利洁,陈景瑞,龚博,等. 参麦注射液对急性心肌梗死大鼠的心肌保护作用研究[J]. 天津中医药,2015,32(6):347-51.
[2]王瑞钰,张清,沈健,等. 低蛋白血症与急性ST段抬高型心肌梗死患者冠脉病变及预后的相关性研究[J]. 重庆医科大学学报,2017,42(2):225-31.
[3]王维浩,邢之华,刘卫平,等. 益气活血保心汤对急性心肌梗死大鼠的保护作用[J]. 中国中医急症,2016,25(6):997-1000.
[4]王思颖,李绍旦,刘毅,等. 通心络对心肌梗死模型大鼠心肌损伤保护作用及机制的研究[J]. 环球中医药,2016,9(6):650-3.
[5]杨雷,毛秉豫. 芪参益气滴丸对心肌梗死大鼠心肌的保护作用[J].中国实验方剂学杂志,2012,18(5):167-71.
[6]姜丽红,陈立红. 益气活血方对实验性心肌梗死大鼠心肌梗死面积及VEGF、bFGF、Ⅷ表达量的影响[J]. 世界中西医结合杂志,2011,6(12):1067-70.
[7]Takagawa J,Zhang Y,Wong ML,et al. Myocardial infarct size measurement in the mouse chronic infarction model:comparison of area- and length-based approaches[J]. J Appl Physiol,2007,102:2104-11.
[8]苏懿,王磊,张敏州. 急性心肌梗死的流行病学研究进展[J].中西医结合心脑血管病杂志,2012,10(1):467-69.
[9]沈健,罗素新,马康华,等. 急性心肌梗死生化标志物的研究进展[J].心血管病学进展,2012,33(1):106-10.
[10]龙凤玺,戴国华,赵晨. 中医药治疗急性心肌梗死临床研究概况[J].辽宁中医药大学学报,2014,16(5):240-2.
[11]杨丹丹. 活血祛瘀法对缺血性心肌损伤作用的系统评价及实验研究[D]. 北京中医药大学,2016.
[12]杨萃. 从瘀毒理论探讨急性心肌梗死的发病机制及与炎症相关性研究[A]. 国际数字医学会、Digital Chinese Medicine.湖南中医药大学学报2016/专集:国际数字医学会数字中医药分会成立大会暨首届数字中医药学术交流会论文集[C]. 国际数字医学会、Digital Chinese Medicine:2016:2.
[13]李贻奎,洪晓华,张东. 丹皮酚和芍药苷及其不同配比对急性心肌梗死大鼠的保护作用[J]. 中药新药与临床药理,2010,21(3):254-6.
[14]于蓓,吴丹,周亚伟. 芍药苷对心肌缺血大鼠的治疗作用及其作用机制[A]. 中国药学会(Chinese Pharmaceutical Association)、天津市人民政府. 2010年中国药学大会暨第十届中国药师周论文集[C],2010:8.
[15]王微,刘畅,应达时,等. 芍药苷对大鼠心肌缺血再灌注损伤的保护作用及机制研究[J]. 中药药理与临床,2016,32(6):52-6.
[16]郝霁萍,高宇勤,贺少辉,等. 芍药苷预处理激活PPARα对在体大鼠心肌缺血再灌注损伤保护的作用研究[J]. 中国中医急症,2015,24(11):1888-90.
[17]Xiao H,Chen Z,Liao Y,et al. Positive correlation of tumor necrosis factor-alpha early expression in myocardium and ven-tricular arrhythmias in rats with acute myocardial infarction[J]. Arch Med Res,2008,39(3):285-91.
[18]高宇勤,郝霁萍,赵国平. 芍药苷预处理激活AMPKα对在体大鼠心肌缺血再灌注损伤的保护作用[J]. 海南医学,2015,26(15):2185-9.
[19]Stuenaes JT,Bolling A,Ingvaldsen A,et al. Beta adrenoceptor stimulation potentiates insulin stimulated PKB phosphorylationin rat cardiomyocytes via cAMP and PKA[J]. Br J Pharmacol,2010,160(1):116-29.
[20]Inserte J,Garcia-Dorado D,Ruiz-Meana M,et al. Ischemic preconditioning attenuates calpain-mediated degradation of structural proteins through a protein kinase A-dependent mechanism.Cardiovasc Res,2004,64(1):105-14.
[21]韩劲松,王辉山,韩宏光,等. 环磷酸腺苷信号通路在二氮嗪预处理中对离体鼠心肌的保护作用[J]. 中国胸心血管外科临床杂志,2010,17(5):390-4.
[22]Li Zhang,Chao-Qian Xu,Yuan Hong,et al. Propranolol regulates cardiac transient outward potassium channel in rat myocardium via cAMP/PKA after short-term but not after long-term ischemia[J].Naunyn-Schmied Arch Pharmacol (2010)382:63-71.
