心肌梗死大鼠心肌组织中AQP1、HIF-1α的表达变化及其与心肌水肿的关系
2018-05-24韩延辉王燕贾静静王红雷朱继红来利红李影
韩延辉,王燕,贾静静,王红雷,朱继红,来利红,李影
急性心肌梗死是由于患者冠状动脉发生急性 闭塞所致相应供血区心肌缺血坏死,是一种发病率和死亡率较高的疾病[1]。心肌水肿是缺血性心肌梗死常见的并发症,临床研究表明其对心室收缩和舒张功能造成负面影响,进一步增加心律失常、心肌坏死等不良预后的发生风险,而目前临床针对心肌梗死后心肌水肿的研究多集中于临床诊断,对发病原因及机制的研究较少[2]。水通道蛋白1(AQP1)属于水通道蛋白家族的一个亚型,在自由水分子跨膜转运中发挥重要作用,以往研究显示AQP1、AQP4与脑缺血性水肿密切相关;缺氧诱导因子-1α(HIF-1α)是缺氧条件下产生的DNA结合蛋白,其作为血管内皮生成因子(VEGF)的活化因子,在缺血性梗死组织中表达明显增加,参与血管新生的复杂病理过程[3,4]。本研究采用结扎左冠状动脉前降支法制备大鼠心肌梗死模型,观察心肌组织中AQP1、HIF-1α的表达变化,探讨其与心肌水肿的关系。
1 材料与方法
1.1 实验动物 雄性SPF级SD大鼠48只,6~8周龄,体质量(200±20)g,购自湖南省实验动物中心,均适应性喂养3 d,喂养条件适中(温度22℃、相对湿度60%、自由饮水、按量饮食)。
1.2 仪器与试剂 主要仪器包括全波长Multiskan FC 型酶标仪购自Thermo Scientific公司;Microfuge R型离心机购自Beckman公司;Mastercycler nexus PCR仪购自Eppendorf公司;7500型荧光定量检测仪购自Applied Biosystems公司;TE214S型分析天平购自Sartorius公司。主要试剂包括AQP1、HIF-1α双抗体夹心法酶联免疫实验(ELISA)检测试剂盒购自R&D Systems公司;TRIZOL® Reagent Cat购自Invitrogen公司;逆转录试剂盒Reverse Transcription Kit和荧光定量检测试剂盒SYBR®Premix Ex Taq™均购自日本Takara公司;引物合成由上海生工生物工程有限公司完成。
1.3 动物模型建立及分组 将48只SD大鼠随机分为心肌梗死组和假手术组,每组24只。腹腔注射10%水合氯醛麻醉,注射量为4 ml/kg,麻醉后进行气管插管,在胸骨左侧第3、4肋骨间开胸,然后在左心耳和肺动脉椎线连接的中点下方2 mm处对左侧冠状动脉进行结扎,以心电图显示肢体Ⅱ导联ST段持续抬高30 min以上作为梗死模型成功的标志[5]。假手术组手术方法同梗死组,但只穿线不结扎冠状动脉。
1.4 样本采集 造模完成后12、24、48、72 h分批处理各组大鼠,注射3%戊巴比妥钠(40 mg/kg)深度麻醉,取出心脏,生理盐水冲洗,根据后续实验需要进行样品保存。
1.5 心肌组织中AQP1、HIF-1α蛋白检测 采用双抗体夹心法酶联免疫实验(ELISA)检测心肌组织匀浆液中AQP1、HIF-1α蛋白的含量。取各时间点心肌组织匀浆,匀浆完成后3000 rpm离心10 min,取上清进行ELISA检测,操作严格按照试剂盒说明书进行,为减少实验误差,各样本均重复测量3次后取平均值。
1.6 Real-time PCR检测心肌组织中AQP1、HIF-1α mRNA水平 取各时间点心肌组织标本0.1 g,假手术组取相同解剖部位心肌组织,用剪刀剪碎,采用Trizol法提取组织中的总RNA,通过Reverse Transcription Kit将RNA逆转录为cDNA,并使用荧光定量试剂盒SYBR® Premix Ex Taq™对心肌组织中的AQP1、HIF-1α mRNA进行测定,检测总体系为25 μl,其中上下游引物各0.5 μl、2×SYBR® Premix 12.5 μl,cDNA模板2 μl、ddH2O 9.5 μl,PCR程序参照试剂盒中提供的两步法检测:95℃预变性30s,(95℃ 5s,60℃30s)共40个循环,溶解曲线为95℃ 15s、60℃60s、95℃ 15s。以GADPH作为内参基因,采用2-ΔΔCt法计算mRNA相对表达量,各基因扩增的上下游引物序列见表1。

表1 AQP1、HIF-1α、GADPH的引物序列
1.7 心肌组织含水量检测 在各检测时间点,取处死后的大鼠心脏,去除心脏、大血管、右心室及其他用于匀浆和提取RNA的组织样本后,在分析天平上对原始重量进行称量即为湿重,在80℃条件下干燥24 h后对左心室进行再次称量即为干重,组织含水量=(湿重-干重)/湿重×100%。
1.8 统计学分析 采用统计软件SPSS 19.0对本研究所得数据进行处理,计量资料以均数±标准差(±s)表示,组间比较采用重复测量方差分析,两两比较方差齐采用LSD法,方差非齐次时采用Dunnett’s T3法,AQP1、HIF-1α与心肌水肿的关系采用Pearson相关分析,以P<0.05为差异具有统计学意义。
2 结果
2.1 两组大鼠心肌组织AQP1、HIF-1α mRNA表达情况 心肌梗死组大鼠心肌组织中AQP1、HIF-1α mRNA水平较假手术组明显升高,组间差异有统计学意义(P均<0.05);且心肌梗死组大鼠心肌组织AQP1、HIF-1α mRNA水平随时间呈增高趋势,各时间点组间表达差异有统计学意义(P均<0.05)(表2)。
2.2 两组大鼠心肌组织中AQP1、HIF-1α蛋白表达情况 心肌梗死组大鼠心肌组织AQP1、HIF-1α的蛋白表达水平较假手术组明显升高,差异有统计学意义(P<0.05);心肌梗死组大鼠心肌组织中AQP1、HIF-1α蛋白表达水平均在72 h内呈时间梯度升高,组间差异有统计学意义(P<0.05)(表3)。
表2 两组大鼠心肌组织中AQP1、HIF-1α mRNA相对表达量比较(±s,n=6)
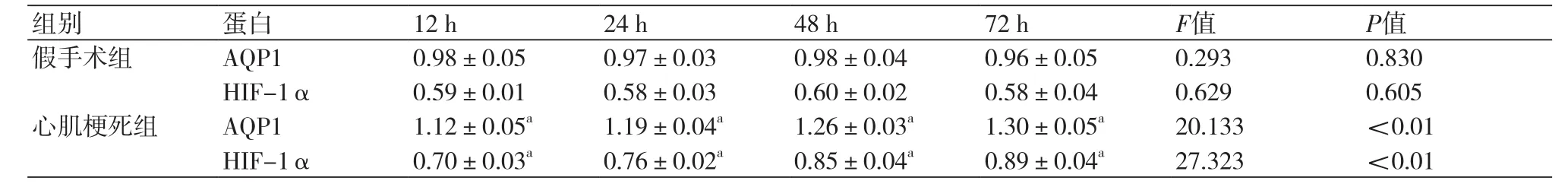
表2 两组大鼠心肌组织中AQP1、HIF-1α mRNA相对表达量比较(±s,n=6)
注:AQP1:水通道蛋白1;HIF-1α:缺氧诱导因子-1α;与假手术组比较,aP<0.05
组别 蛋白 12 h 24 h 48 h 72 h F值 P值假手术组 AQP1 0.98±0.05 0.97±0.03 0.98±0.04 0.96±0.05 0.293 0.830 HIF-1α 0.59±0.01 0.58±0.03 0.60±0.02 0.58±0.04 0.629 0.605心肌梗死组 AQP1 1.12±0.05a 1.19±0.04a 1.26±0.03a 1.30±0.05a 20.133 <0.01 HIF-1α 0.70±0.03a 0.76±0.02a 0.85±0.04a 0.89±0.04a 27.323 <0.01
2.3 两组大鼠不同时间点心肌水肿情况 心肌梗死组大鼠术后12、24、48、72 h心肌组织含水量逐渐升高,与假手术组比较也升高,差异有统计学意义(P均<0.05)(表4)。
2.4 心肌梗死大鼠心肌组织中AQP1 mRNA及蛋白水平与心肌水肿的相关性 心肌梗死大鼠心肌组织中AQP1 mRNA水平与心肌含水量呈正相关(r=0.507,P=0.010),AQP1蛋白水平与心肌含水量呈正相关(r=0.585,P=0.008)(图1~2)。
2.5 心肌梗死大鼠心肌组织中HIF-1α mRNA及蛋白水平与心肌水肿的相关性 心肌梗死大鼠心肌组织中HIF-1α mRNA水平与心肌含水量呈正相关(r=0.408,P=0.025),HIF-1α蛋白水平与心肌含水量呈正相关(r=0.486,P=0.017)(图3~4)。
表3 两组大鼠心肌组织中AQP1、HIF-1α蛋白表达水平比较(ng/ml,±s,n=6)
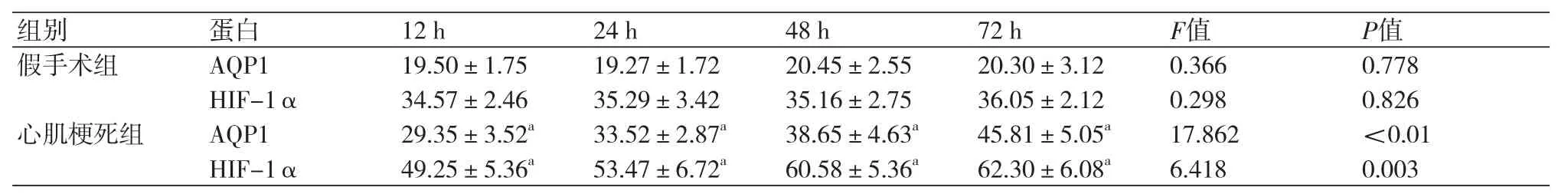
表3 两组大鼠心肌组织中AQP1、HIF-1α蛋白表达水平比较(ng/ml,±s,n=6)
注:AQP1:水通道蛋白1;HIF-1α:缺氧诱导因子-1α;与假手术组比较,aP<0.05
组别 蛋白 12 h 24 h 48 h 72 h F值 P值假手术组 AQP1 19.50±1.75 19.27±1.72 20.45±2.55 20.30±3.12 0.366 0.778 HIF-1α 34.57±2.46 35.29±3.42 35.16±2.75 36.05±2.12 0.298 0.826心肌梗死组 AQP1 29.35±3.52a 33.52±2.87a 38.65±4.63a 45.81±5.05a 17.862 <0.01 HIF-1α 49.25±5.36a 53.47±6.72a 60.58±5.36a 62.30±6.08a 6.418 0.003
表4 两组大鼠各时间点心肌组织含水量比较(%,±s,n=6)

表4 两组大鼠各时间点心肌组织含水量比较(%,±s,n=6)
注:与假手术组比较,aP<0.05
组别 12 h 24 h 48 h 72 h F值 P值假手术组 70.21±0.48 70.32±0.56 70.39±0.46 70.36±0.52 0.145 0.932心肌梗死组 73.23±0.79a 74.12±1.16a 76.23±1.57a 78.75±1.75a 19.341 <0.01
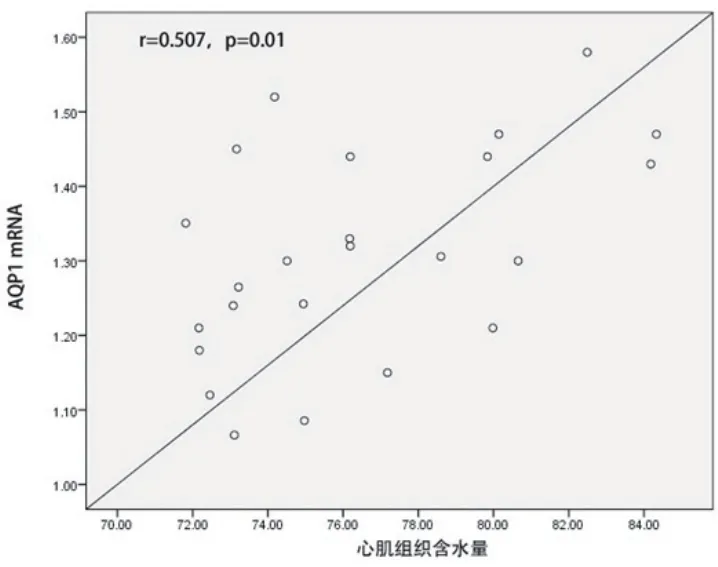
图1 心肌梗死大鼠心肌组织含水量与AQP1mRNA表达的相关性

图2 心肌梗死大鼠心肌组织含水量与AQP1蛋白表达的相关性
3 讨论
心肌水肿是急性心肌梗死后常见的病理改变,冠状动脉闭塞后心肌处于缺血缺氧环境,有氧代谢转变为无氧酵解,相关细胞因子在局部聚集,导致该区域组织间质通透性发生变化,心肌细胞外水分子向胞内移动并滞留于细胞内;同时缺氧环境会抑制心肌细胞膜上腺苷三磷酸酶的活性,导致细胞内部处于高渗状态,引发水肿[6]。缺血后心肌水肿会使左心室功能障碍甚至结构改变,降低其顺应性,是影响患者预后的主要因素之一[7]。
AQP1是广泛表达于肾脏、肺部、脑部及心脏等的水通道蛋白。生理条件下AQP1蛋白对水分子的跨膜转运影响并不明显。但相关研究显示在病理状态下细胞膜上水分子的转运多以AQP通道为主,AQP1参与调节脑水肿、肺水肿、肿瘤转归等各种病理过程的水代谢[8,9]。Yan等[10]研究表明AQP1在山羊体外循环手术后高表达,与心肌水肿程度密切相关,敲除AQP1基因后,水肿程度明显降低;李志清等[11]研究表明在大鼠烫伤早期心肌组织中AQP-1 mRNA表达量与心肌组织含水率、血清cTnI含量均呈显著正相关;闫玉梅等[12]研究显示在AQP1慢病毒载体转染羊心肌组织后,体外循环结束后48 h内AQP1 mRNA水平和蛋白水平趋势相同,且转染组水肿程度更为严重,AQP1水平与心肌水肿程度呈正相关。HIF-1α是细胞在缺氧条件下诱导产生的核蛋白。临床研究表明其主要受上游ERK/MAPK、PI3K/AKT/mTOR等通路的调节,进而促进基质金属蛋白酶、VEGF等基因的表达,参与肿瘤细胞的增殖凋亡、侵袭转移及血管生成[13]。李敏等[14]研究显示在膝骨关节炎伴骨髓水肿患者血清HIF-1α、VEGF水平明显高于非骨髓水肿组,且与患者骨髓水肿的容积积分、程度积分均呈正相关。但目前尚未有HIF-1α是否介导心肌梗死后心肌水肿病理进程的相关研究。靳春杰等[15]研究表明HIF-1α在炎症、缺血性组织及缺氧条件下均呈高表达,能够上调VEGF及炎性抑制TNF-α、IL-1β等的表达;李玲萍等[16]研究显示HIF-1α在急性心肌梗死患者中表达明显升高且与心肌损伤标志物肌酸激酶同工酶(CK-MB)、心肌肌钙蛋白I(cTnI)呈正相关。本研究对急性心肌梗死大鼠造模后不同时间点的心肌含水量进行分析,结果显示在术后12 h即表现水肿,且随着时间推移水肿程度增加,同时观察到心肌组织中AQP1和HIF-1α均呈高表达,且变化趋势与心肌水肿程度密切相关,提示,由AQP1介导的跨膜水转运,以及与HIF-1α相关的炎症等信号通路,均可能参与心肌梗死后心肌水肿。
综上所述,心肌梗死大鼠心肌组织中AQP1、HIF-1α mRNA及蛋白均表达上调,且在冠状动脉结扎后72 h内呈时间递增,且与心肌水肿严重程度呈正相关。
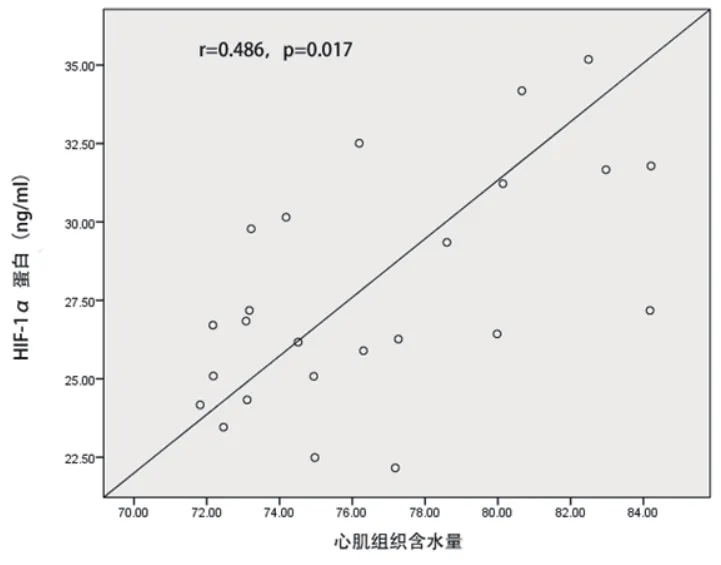
图3 心肌梗死大鼠心肌组织含水量与HIF-1α mRNA表达的相关性
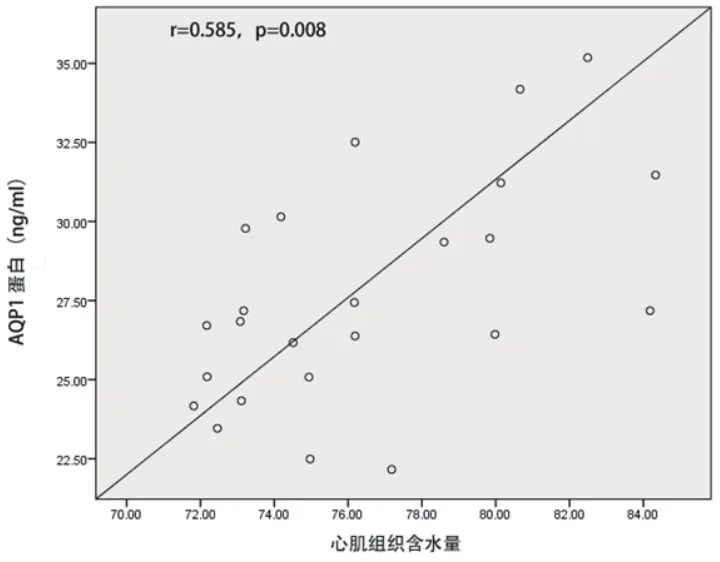
图4 心肌梗死大鼠心肌组织含水量与HIF-1α蛋白表达的相关性
参 考 文 献
[1]王娟,刘宏斌. 急性心肌梗死标记物的研究进展[J]. 中华老年心脑血管病杂志,2016,18(11):1213-6.
[2]Tahir E,Sinn MR,Radunski UK,et al. Serial native T1- and T2-mapping to quantitatively monitor resorption of myocardial edema following acute myocardial infarction[J]. Journal of Cardiovascular Magnetic Resonance,2015,17(1):1-2.
[3]Akdemir G,Kaymaz F,Gursoy-Özdemir Y,et al. The time course changes in expression of aquaporin 4 and aquaporin 1 following global cerebral ischemic edema in rat[J]. Surg Neurol Int, 2016,7(1):4.
[4]戴宇翔,王审,李晨光,等. 梗死心肌侧枝血管形成与缺氧诱导因子-1α及血管内皮生长因子A表达水平的关系及临床意义[J].中国临床医学,2015,22(3):305-9.
[5]王浩宇,陈玉成,曾智,等. Aquaporin-1蛋白在缺血心肌中表达变化及其与心肌水肿的关系[J]. 华西医学,2007,22(1):116-9.
[6]王芳,李晓娟,刘鹏飞. 心肌缺血后心肌水肿的磁共振成像研究进展[J]. 医学综述,2015,21(13):2421-3.
[7]Fernándezjiménez R,Sánchezgonzález J,Agüero J,et al.Myocardial edema after ischemia/reperfusion is not stable and follows a bimodal pattern: imaging and histological tissue characterization[J].J Am Coll Cardiol,2015,65(4):315-23.
[8]魏晓,李香营,田毅,等. AQP1在心肌缺血组织中的作用[J]. 中国热带医学,2012,12(2):243-8.
[9]吉春玲,瞿详,任亦频,等. 右美托咪定对脓毒症大鼠心肌组织水通道蛋白-1及炎症细胞因子水平的干预作用[J]. 中国中西医结合急救杂志,2014,21(4):266-9.
[10]Yan Y,Huang J,Ding F,et al. Aquaporin 1 plays an important role in myocardial edema caused by cardiopulmonary, bypass surgery in goat[J]. Int J Mol Med,2013,31(3):637-43.
[11]李志清,肖德权,王甲汉,等. 大鼠烫伤早期心肌组织水通道蛋白1表达及其与心肌水肿的关系[J]. 中华烧伤杂志,2013,29(3):245-8.
[12]闫玉梅,丁芳宝,梅举,等. AQP1慢病毒载体成功转染心肌细胞后加重体外循环后心肌细胞水肿[J]. 中华胸心血管外科杂志,2012,28(9):540-3.
[13]李继强. 缺氧诱导因子1α相关信号通路与肿瘤关系的研究进展[J]. 医学综述,2015, 21(24):4460-4.
[14]李敏,吴俊华,吴晓惠,等. 伴骨髓水肿的膝骨关节炎与血管内皮因子、缺氧诱导因子1α的相关性研究[J]. 中华临床医师杂志(电子版),2015,9(20):19-21.
[15]靳春杰,方贵龙,权伟,等. 缺氧诱导因子-1α对创伤性脑损伤大鼠炎性反应和血管生成因子表达的影响[J]. 中华创伤杂志,2016,32(9):835-42.
[16]李玲萍,刘艳,王丽月,等. 急性心肌梗死患者血清低氧诱导因子-1α的检测及临床意义分析[J]. 中国药物与临床,2016,16(8):1093-5.
